Аллергия к инсулину
В настоящее время зарегистрировано около 40 видов инсулинов. Инсулин распределяется на группы в зависимости от его происхождения. Инсулины изготавливают методами генной инженерии или из поджелудочной железы крупного рогатого скота или свиней. Инсулин, вырабатываемый поджелудочной железой свиньи, особенно близок по своим свойствам к инсулину, который вырабатывается поджелудочной железой человека. В случаях, если больные пользовались им длительно, нельзя не учитывать возможность аллергических реакций.
Таблица № 35
Клинические проявления аллергических реакций на инсулин
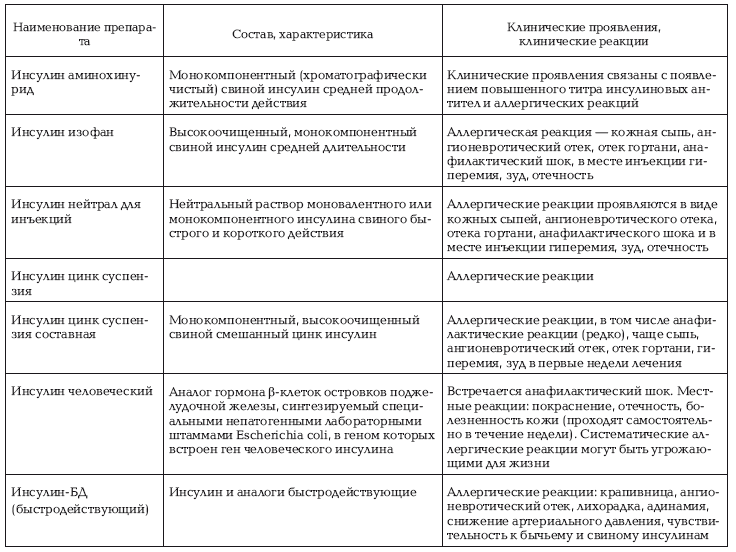
Возникновение аллергических реакций требует замены на другой инсулин и проведение десенсибилизирующей терапии. Наличие в анамнезе аллергической реакции на другие инсулины требует проведения аллергической пробы.
В связи с наличием чужеродных белковых компонентов в некоторых видах инсулинов могут возникнуть аллергические реакции. При применении монокомпонентных инсулинов они встречаются редко. Реакции могут быть общими и местными.
К общим реакциям относятся:
уртикарная сыпь;
отек ангионевротический;
бронхоспазм;
полиартралгии,
полиартрит;
расстройства пищеварения;
тромбопеническая пурпура;
увеличение лимфатических узлов.
Обычно генерализованная аллергическая реакция возникает на фоне местной реакции. В этих случаях на месте введения инсулина чаще через 7 – 14 дней от начала лечения или сразу после введения инсулина, или через 6 – 24 ч.
Местная реакция проявляются гиперемией и отечностью кожи в месте введения инсулина. Величина этого участка колеблется от 1 до 5 см и более. На месте инъекции появляется жжение, зуд, иногда с болью.
В случае кожных и прочих реакций и положительной кожной пробы на инсулин лечение может быть продолжено в стационаре под строгим врачебным контролем. В этих случаях проводится специфическая гипосенсибилизация.
Применяются различные схемы быстрой гипосенсибилизации. Одной из них является последовательное введение увеличивающихся минимально доз инсулина. В первые сутки вводится (ЕД):
1/1000;
1/500;
1/25.
На вторые сутки вводится (ЕД):
1/100;
1/50;
1/25;
1/12.
На третьи сутки вводится (ЕД):
1/5;
1/2;
1;
2.
На четвертые сутки дозу инсулина доводят до требуемой.
По другой схеме, когда жизненных показаний к инсулину нет, увеличение дозы проводят медленно и доводят до терапевтической в течение 10 дней – 2 – 3 месяцев, начиная с 1/1000 – 1/10 000 ЕД.
Если через несколько месяцев аллергические реакции возобновляются, то курс гипосенсибилизации повторяется.
Липодистрофия при сахарном диабете часто развивается в местах введения инсулина в виде исчезновения жировой ткани. Это происходит в результате нарушения липолиза и литогенеза в местах инъекций в подкожной клетчатке. В этих местах происходит рассасывание подкожного жирового слоя различного размера, от углубления до ямки размером 10 – 12 см в диаметре. В некоторых случаях появляется избыточное жироотложение с фиброзным перерождением подкожной клетчатки. Возникает липодистрофия медленно и развивается у больных в разные сроки – от 1 месяца до нескольких лет.
Для лечения применяется введение суинсулина в атрофические участки в дозе 4 – 10 ед 4 – 5 инъекций, через 2 – 4 месяца пораженные участки замещаются жировой тканью. Лучшие результаты получаются при применении монопикового инсулина. В других случаях является эффективным введение инсулина вместе в одном шприце с таким же по объему 0,5%-ным инсулином. Эту смесь подогревают до 37°C, вводят ежедневно, медленно. Восстановление дефекта подкожно-жирового слоя происходит после 3-х недель от начала лечения.
Профилактика липодистрофии заключается в использовании острых игл и достижения испарения спирта с обработанного участка кожи; при введении лекарства медленно, игла должна быть направлена строго перпендикулярно к поверхности тела и вводится на 1/2 – 3/4 толщины подкожно-жирового слоя.
Должны соблюдаться правила введения инсулина строго по назначению врача.
Таблица № 36
Этапы подготовки к процедуре
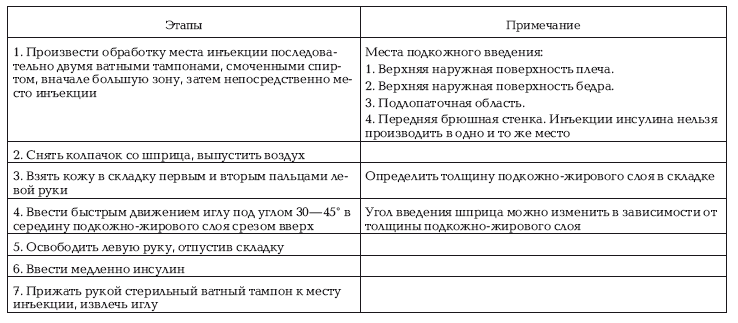
Таблица № 37
Выполнение процедуры
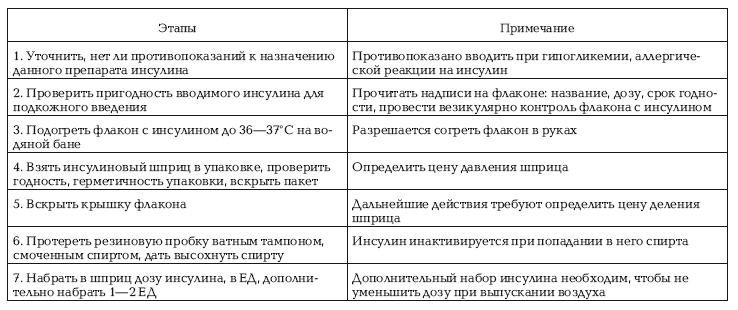
Пациент должен после введения инсулина принять пищу.
В настоящее время диабетология находится на достаточно высоком уровне, многое известно, в том числе как развивается заболевание, разработаны методики управления и контроля диабетом. В настоящее время созданы приборы, которые предназначены для самостоятельного использования пациентами в качестве средств для введения инсулина,—шприцы-ручки. Ими в течение дня делают несколько уколов. С помощью современных шприц-ручек проводится менее болезненная процедура, хотя и требующая к себе внимания.
В настоящее время найдена возможность введения инсулина с помощью специальных приборов, которые настраиваются на определенный ритм введения, когда заполняются несколько уколов на постоянное введение с помощью электронного устройства (помпы), и больной круглосуточно получает инсулин в дозировках, требующихся для жизнедеятельности организма, а скорость введения можно регулировать самостоятельно. Происходит полная имитация работы поджелудочной железы по секреции инсулина.
Преимущества помповой терапии: в быстром достижении нормогликемии; повышение безопасности лечения; минимальный риск гипогликемии.
При использовании помпы применяются инсулин короткого действия, вводимый в различных скоростных режимах.
Все это позволяет быстро достигнуть и сохранить равновесие «инсулин – глюкоза» в организме.
Положительным является освобождение пациента от многоразовых инъекций, так как инсулин вводится через катетер. Он подключается к телу в месте, определяемом пациентом. Главное для пациента – научиться грамотно его использовать, для этого ему необходимо пройти специальное обучение.
Помповая терапия применяется и в детском возрасте. При этом у детей реже возникает гипогликемия (не чаще 1 раза в 6 – 10 месяцев), уменьшается суточная доза инсулина, родители детей отмечают улучшение эмоционально-психологического состояния ребенка в связи с отменой многоразовых уколов. У детей грудного возраста местом введения иглы катетера могут быть ягодицы. Особенно эффективно применение помпы в пубертатном периоде, когда быстро нарушается баланс «инсулин – глюкоза». Помповая терапия помогает вести активный образ жизни.
В настоящее время предлагается несколько видов устройств. Они представляют собой компактные электронные устройства в герметичном корпусе, в котором располагается картридж с инсулином короткого действия. Мотор под управлением процессоров каждые 3 мин двигает поршень внутри картриджа. Из инфузионного набора, состоящего из гибкого катетера и канюли, которая находится под кожей, инсулин поступает в организм больного.
Показаниями для перевода на помповую терапию являются:
возможность получить компенсацию диабета обычной инсулиновой терапией;
частые гипогликемии, особенно бессимптомные, а также ночные;
тяжелые формы диабета с выраженным кетоацидозом;
инсулинорезистентность к инсулину;
наличие сосудистого осложнения;
замедленная усвояемость пищи;
личное желание получить лучшее качество жизни.
В связи с наиболее оптимальным контролем уровня глюкозы в крови снижается риск развития осложнений, особенно ретинопатии, нейропатии, микроальбуминурии.
Инсулиновая помпа повышает качество жизни больного, так как дает возможность:
1) постоянно подавать минимальное количество инсулина;
2) стабилизирует уровень глюкозы в крови;
3) снижает возможность развития гипогликемии;
4) в период роста адаптирует потребности в инсулине;
5) инфузионный набор заменяется 1 раз в 2 – 3 дня, вместо многократных инъекций, при ношении не ощутим;
6) не делаются инъекции по ночам;
7) дает возможность заниматься спортом.
Вариантов крепления и ношения инсулиновой помпы может быть множество: ее можно носить на поясе, в кармане брюк или рубашки, помпу можно прикрепить к пижаме, положить под подушку.
Для беременных женщин должна быть обеспечена компенсация диабета в первые 3 месяца беременности, во время нее, в период кормления грудью. Известно, что в эти периоды потребности при диабете меняются в связи с изменениями в организме беременной женщины. В первые 3 месяца беременности потребность организма в инсулине снижается. Начиная со 2-й недели беременности потребность в инсулине начинает расти и достигает максимума перед родами. В период родов она резко снижается, а после них она становится меньше, чем до беременности.
Применение инсулиновой помпы дает возможность обеспечить контроль сахарного диабета и таким образом сохранить здоровье как матери, так и будущего ребенка.
Установлено, что раннее применение инсулиновой помпы снижает частоту врожденных аномалий у новорожденных, снижает уровень кетоновых тел, предотвращаются ночные гликемии, обеспечивается здоровый сон, под контролем находится изменение аппетита, положительно сказывается на психоэмоциональном состоянии женщины отсутствие необходимости в многократных инъекциях.
Инсулиновая помпа у детей
Этот метод инсулинотерапии применяется у детей и имеет ряд преимуществ перед введением инсулина:
1) нет необходимости вводить инсулин шприцами или шприц-ручками;
2) введение инсулина покрывает минимальную потребность в инсулине;
3) гипогликемия возникает редко;
4) изменение дневной потребности в инсулине, связанное с ростом ребенка;
5) уровень глюкозы крови стабилизируется;
6) имеет место для ребенка более свободный выбор в питании;
7) ребенок может принимать активное участие во многих мероприятиях, в том числе и занятии спортом;
8) ребенку не нужно просыпаться утром или ночью, чтобы сделать дополнительную инъекцию инсулина.
Все это избавляет родителей от беспокойства. Однако родители должны знать о помповой инсулинотерапии все, что необходимо для ее применения. В 12 лет ребенок может самостоятельно проводить помповую терапию при поддерживающем контроле со стороны родителей. У детей потребность в инсулине выше, чем у взрослых. Это связано с активным ростом ребенка и высоким уровнем контринсулиновых гормонов в пубертатном периоде.
Выделяются периоды, которые связаны с изменениями потребности в инсулине в течение роста ребенка и продолжительными болезнями. В первые 2 года заболевания потребность в инсулине составляет 0,5 – 0,6 ЕД/кг массы тела. Обычно в первые месяцы заболевания регистрируется ремиссия заболевания, и потребность в инсулине снижается до минимальной – 0,1 – 0,2 ЕД/кг массы, у некоторых детей с помощью диеты удается сохранить нормогликемию.
Через 5 лет от начала заболевания потребность в инсулине повышается до 1 ЕД/кг массы тела, так как прекращается функционирование β-клеток поджелудочной железы. Потребность в инсулине значительно повышается у подростков – до 1,2 – 1,5 ЕД/кг, а иногда до 2 ЕД/кг, а последующие дозы снижаются до 1 ЕД/кг.
Для нормального функционирования при интенсифицированной инсулинотерапии инсулин вводится путем многократных инъекций более 3 – 4 раз в день, но имитация работы поджелудочной железы не получается. Только помпа обеспечивает введение инсулина подкожно малыми дозами.
В основе работы помпы лежит базисная подача инсулина. Базальная доза инсулина не зависит от приема пищи и обычно составляет 30 – 50% от общей суточной дозы. Общая базальная доза инсулина программируется в соответствии с изменениями чувствительности к инсулину.
Величина болюсной дозы инсулина зависит от съеденных с пищей углеводов, уровня глюкозы в крови, от планируемой физической активности. Решение о проведении терапии инсулином с помощью помпы принимается комиссионно – родителями, ребенком и врачами. Дети с сахарным диабетом I типа являются кандидатами для лечения с помощью помповой инсулинотерапии.
Основными показаниями для перевода на инсулиновую помпу ребенка являются:
1) тяжелая гипогликемия;
2) резкие колебания уровня глюкозы в течение дня;
3) субкомпенсация сахарного диабета;
4) макро– и микрососудистые осложнения.
К другим причинам относятся: неонатальный и грудной возраст детей, склонность к кетоацидозу, боязнь уколов, нарушение питания у подростков.
Применение инсулиновой помпы у детей обеспечивает улучшение качества жизни ребенка с диабетом. Ребенок может активно заниматься спортом, стабилизируется уровень глюкозы в крови, снижается риск развития гипогликемии, обеспечивается свобода в питании. Дети уже с 12 лет могут самостоятельно проводить терапию с помощью помпы при контроле со стороны взрослых.
В инсулиновых помпах мотором управляют микропроцессы. Этот мотор двигает поршень внутри картриджа с инсулином, который через специальный набор поступает в организм, получаемые дозы инсулина соответствуют заранее запрограммированным значениям.
Инфузионный набор связывает помпу и место введения инсулина, он состоит из канюли (иглы) и тонкой трубочки катетера, который соединяется с помпой. Канюля вводится под кожу живота и сопоставима по величине со шприц-ручкой, с помощью самоклеющегося основания она фиксируется на коже и исключает самопроизвольное выпадение из кожи. Канюля прикрепляется на живот и бедро. Для обеспечения равномерного всасывания инсулина меняется место и устанавливается новый инфузионный набор. Наборы подлежат замене каждые 3 дня.
Инсулиновая помпа дает возможность для ребенка улучшить качество жизни и адаптировать базальный инсулин к потребностям в период роста.

