Анальгезирующие средства (анальгетики)
Клинический случай. Мать годовалого мальчика обратилась в поликлинику, она заявила, что у ребенка некоторое время режутся зубы, и он кусает и повреждает язык. Ребенка осмотрели, на языке обнаружены зажившие рваные раны. Ребенка также осмотрела стоматологическая бригада, которая отметила, что прикусывание языка может быть нормальным поведением в этом возрасте.
Через 14 месяцев ребенок поступил в клинику вместе с родителями с припухлостью на левой руке. Родители сообщили, что не знают о каких-либо травмах и только что заметили опухшую руку ребенка. Никаких жалоб на боль или плача у ребенка не было. При осмотре у ребенка обнаружили перелом локтевой кости, произошедший несколько дней назад. Поскольку ребенок не проявлял никаких признаков беспокойства, родители не знали о травме и не обращались к врачу ранее. Отец ребенка сообщил семейному врачу (который общался с ними на их родном языке), что у некоторых членов семьи в их стране есть аналогичная проблема – переломы костей без болевых ощущений. Эта информация была передана педиатрической бригаде, которая соответственно провела дальнейшее расследование, включавшее генетическое тестирование, что привело к постановке диагноза. Ребенку поставили диагноз врожденной сенсорной нейропатии с ангидрозом (врожденная нечувствительность к боли с ангидрозом Свенсона). У родителей оказался кровнородственный брак, что могло стать причиной возникновения рецессивных синдромов. Через восемнадцать месяцев после постановки диагноза у пары родился второй ребенок (девочка), у которой также было диагностировано то же заболевание.
Боль – это неприятное сенсорное событие, сопровождаемое эмоциональным переживанием, которое предупреждает человека о фактическом или потенциальном повреждении тканей. Это повреждение может быть вызвано воздействием химических, механических или термических раздражителей (например, кислот, давления, уколов и высокой или низкой температуры) либо наличием патологического процесса (например, опухоли, мышечного спазма, воспаления, повреждения нервов). Действие указанных факторов трансформируется в болевой сигнал, который активирует ноцицепторы сенсорных нейронов. Хотя боль выполняет защитную функцию, предупреждая человека о наличии проблемы со здоровьем, ее чрезмерная выраженность часто приводит к дополнительным страданиям. Для купирования боли используют препараты нескольких фармакологических групп, облегчающие боль, которые объединены в группу анальгетиков.
Классификация анальгетиков
Анальгезирующие средства преимущественно центрального действия:
• опиоидные (наркотические) анальгетики – агонисты опиоидных рецепторов у опиаты – морфин, кодеин;
• опиоиды – фентанил, суфентанил, тримепиридин;
• частичные агонисты – бупренорфин;
• агонисты-антагонисты – буторфанол, налбуфин;
• неопиоидные анальгетики центрального действия – клонидин, дексмедетомидин, амитриптилин, габапентин, прегабалин, карбамазепин, ацетаминофен;
• анальгетики смешанного действия (опиоидный и неопиоидный компоненты) – трамадол;
Анальгезирующие средства преимущественно периферического действия:
• нестероидные противовоспалительные средства (сведения о них представлены в главе «Противовоспалительные средства»).
Опиоидные (наркотические) анальгетики
Опиум и его производные использовали на протяжении веков. Находки окаменелых семян опийного мака, датируемые 30 000-летним периодом, позволяют предположить, что опиум использовался еще неандертальцами. В 1799 году Фридрих Сертюрнер выделил основное действующее вещество опиума, которое он назвал морфином. Морфин и другие опиоидные препараты действуют на эндогенную опиоидергическую систему, которая не только участвует в установлении болевого порога (контроль афферентного входа) и контроле ноцицептивной информации, но также влияет на функции желудочно-кишечного тракта, эндокринной и вегетативной систем.
Морфин и кодеин являются природными опиатами, содержащимися в растении мак Papaver somniferum. Опий (смесь алкалоидов опия), морфин и кодеин вызывают схожие эффекты, но с разной силой действия. Химические изменения в структуре морфина привели к созданию полусинтетических опиоидов. Примерами таких соединений являются гидрокодон, оксикодон, бупренорфин, налорфин, налоксон, диацетилморфин (героин).
Синтетические опиоиды представляют собой химически разнообразные соединения, полностью производимые в лабораторных условиях. В эту группу входят фентанил, аналоги фентанила, метадон.
Анальгетическое действие морфина и всех опиоидов опосредуется через эндогенную опиоидергическую систему, основу которой составляют опиоидные рецепторы. Выделяют 3 вида опиоидных рецепторов: µ (мю), δ (дельта) и κ (каппа).
Таблица 13. Классификация опиоидных рецепторов
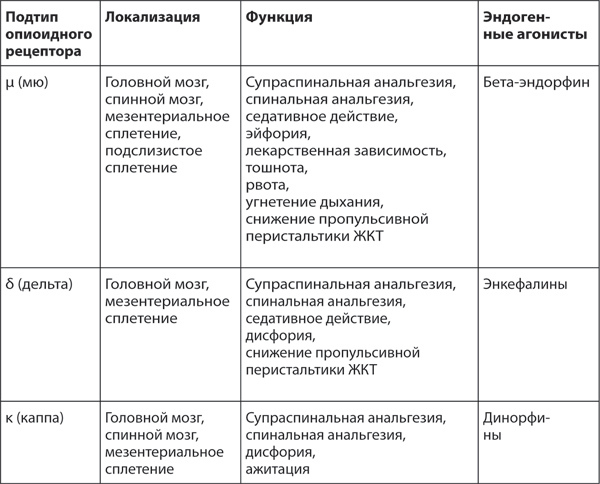
Опиоидные рецепторы являются частью опиоидергической системы организма и представляют собой состоящие из семи трансмембранных доменов структуры, связанные с белками Gi/Go. Они активируются как эндогенными опиоидными пептидами (энкефалины и эндорфины), так и экзогенно введенными природными, синтетическими или полусинтетическими опиоидами, такими как морфин и фентанил. Мю-, каппа- и дельта-опиоидные рецепторы обеспечивают анальгезию спинально и супраспинально.
В спинном мозге активация опиоидных рецепторов приводит к ингибированию в клетке посредством белка Gαi аденилатциклазы, как следствие, к уменьшению концентрации циклического аденозинмонофосфата, увеличению К+-проводимости и снижению Са2+-проводимости. В результате концентрация К+и Са2+ в нейроне снижается. Это приводит к нарушению пресинаптического высвобождения нейромедиаторов ноцицепции (глутамат, субстанция Р) из окончаний первичных афферентных волокон малого диаметра, а также постсинаптической гиперполяризации мембран ноцицептивных нейронов дорсального рога (торможению этих нейронов).
В организме существуют опиоидные механизмы, которые подавляют передачу боли на уровне спинного мозга посредством нисходящего торможения из головного мозга. Теория контроля афферентного входа боли (теория контроля афферентных ворот) была предложена Р. Мелзаком и П. Уоллом в 1965 году для описания процесса тормозной модуляции боли на уровне спинного мозга.
Согласно теории контроля афферентного входа, существует система нисходящего торможения болевых путей. Околоводопроводное серое вещество (PAG) в среднем мозге и ростральный вентромедиальный продолговатый мозг (RVM) являются двумя важными областями мозга, участвующими в нисходящей тормозной модуляции. Оба эти центра содержат высокие концентрации опиоидных рецепторов и эндогенных опиоидов, которые активируют эту систему. Нисходящие тормозные пути подходят к нейронам спинного мозга и подавляют передачу боли. На уровне спинного мозга эти пути являются моноаминергическими и используют норадреналин и серотонин в качестве нейромедиаторов.
Вопрос
Почему, когда мы ударяемся, то для облегчения боли потираем ушибленное место?
Афферентные стимулы неболевого типа (например, при потирании кожи) поступают в ЦНС по миелинизированным Aβ-волокнам, которые в спинном мозге активируют ингибирующие нейроны. Болевые стимулы поступают в спинной мозг по миелинизированным Аδ-волокнам (быстрая боль) и немиелинизированным С-волокнам (медленная боль). Эти стимулы проходят в головной мозг, не активируя ингибирующие нейроны в спинном мозге. При потирании ушибленного места мы тактильно активируем Aβ-волокна безболезненными стимулами, что приводит к возбуждению тормозных интернейронов в дорсальном роге, вызывая угнетение болевых сигналов, передаваемых через C-волокна.
Таким образом, опиоиды действуют как пресинаптически, так и постсинаптически, оказывая анальгезирующее действие. Пресинаптически опиоиды блокируют кальциевые каналы ноцицептивных афферентных нервов, ингибируя высвобождение нейротрансмиттеров, таких как вещество Р и глутамат, которые способствуют ноцицепции. Постсинаптически опиоиды открывают калиевые каналы, которые гиперполяризуют необходимые клеточные мембраны, увеличивая потенциал действия для генерации ноцицептивной передачи.
Морфин является стандартом сравнения опиоидных анальгетиков. В основном его используют для лечения сильной боли, связанной с травмой, инфарктом миокарда и при инкурабельных злокачественных новообразованиях. У пациентов с инфарктом миокарда он облегчает боль и беспокойство, а также расширяет коронарные артерии и снижает потребность миокарда в кислороде. Морфин доступен как в инъекционных, так и в пероральных формах, включая препараты длительного действия. При пероральном введении препарата требуются более высокие дозы, чем при парентеральном введении. Основным метаболитом морфина является 3-глюкуронид, который фармакологически неактивен. Также образуется значительное количество метаболита 6-глюкуронида, который более активен, чем морфин, и имеет более длительный период полувыведения. Следовательно, метаболит 6-глюкуронид вносит значительный вклад в анальгетическую эффективность морфина. Морфин выводится преимущественно с мочой в виде глюкуронидов. Небольшое количество выводится с желчью и участвует в энтерогепатической циркуляции.
Побочные эффекты морфина
Эйфория – возникновение приятных ощущений и немотивированного состояния свободы от тревог и проблем. При этом возникает чувство комфорта и устраняются чувства голода, жажды и др.
Лекарственная зависимость (психическая и физическая) развивается при повторных приемах морфина. Желание повторного приема морфина сначала связано с вызываемой морфином эйфорией. Затем развивается физическая зависимость, проявляющаяся абстинентным синдромом. Явления абстиненции возникают при отмене морфина: сначала слезотечение, насморк, потливость, «гусиная кожа», затем беспокойство, тахикардия, тремор, тошнота, рвота, диарея, сильные боли в животе, спине и др.
Угнетение дыхания связано в основном со снижением чувствительности дыхательного центра к двуокиси углерода и зависит от дозы. Дыхание становится редким и глубоким при введении даже терапевтических доз морфина. Для восстановления дыхания используют антагонисты опиоидных рецепторов – налоксон и налтрексон.
Миоз (сужение зрачков) – характерный диагностический признак приема морфина – возникает в результате возбуждения центра глазодвигательного нерва. Привыкание в отношении миоза развивается медленно.
Брадикардия возникает вследствие повышения тонуса центра блуждающих нервов.
Тошнота и рвота (усиливающиеся при движении) развиваются за счет стимуляции рецепторов пусковой (триггерной) зоны рвотного центра, расположенной на дне IV желудочка мозга. Непосредственно рвотный центр морфин угнетает.
Влияние на продукцию гормонов: повышение продукции пролактина, антидиуретического гормона (вазопрессина), гормона роста, что связано со стимуляцией центров в гипоталамусе; усиление выделения вазопрессина приводит к уменьшению диуреза; снижается секреция гонадотропных гормонов, адренокортикотропного гормона, а также тестостерона и гидрокортизона.
Снижение температуры тела ниже нормы (независимо от исходного уровня). Эффект связан с угнетением центра теплорегуляции в гипоталамусе и снижением теплопродукции.
Повышение тонуса скелетных мышц (преимущественно мышц-сгибателей и дыхательных мышц). Эффект реализуется на уровне спинного мозга.
Стимуляция выделения гистамина приводит к расширению сосудов кожи и конъюнктивы глаз, крапивнице. У больных бронхиальной астмой морфин может вызвать бронхоспазм (повышение тонуса бронхов связано с действием на опиоидные рецепторы бронхиальных мышц).
Снижение пропульсивной моторики желудка и кишечника, повышение тонуса сфинктеров кишечника, уменьшение секреции поджелудочной железы и выделения желчи (вследствие повышения тонуса сфинктера Одди и желчных протоков) нарушают продвижение содержимого по кишечнику и приводят к развитию обстипации (запора). Вследствие повышения тонуса гладких мышц желчевыводящих путей могут возникнуть спастические боли (колики).
Повышение под действием морфина тонуса мочеточников может вызвать приступ почечной колики, а повышение тонуса сфинктеров уретры – задержку мочеиспускания.
Фентанил относится к высокоэффективным синтетическим опиоидным агонистам. Фентанил и его производные, включая суфентанил, альфентанил и ремифентанил, являются наиболее мощными опиоидами.
Благодаря высокой эффективности и липофильности фентанил включен в состав трансдермального кожного пластыря длительного действия для обеспечения постоянного обезболивания у пациентов с тяжелой или хронической болью. Он также доступен для лечения тяжелой боли в виде спреев. Его применяют парентерально до и после операции, а также в качестве дополнения к общей анестезии. Фентанил вызывает меньшую тошноту, чем морфин, но часто связан с ригидностью мышц туловища при использовании в качестве дополнения к парентеральной анестезии.
Альфентанил и ремифентанил используются как часть процедур анестезии и доступны для внутривенного введения. Ремифентанил используется для краткосрочных процедур и амбулаторных операций, поскольку считается, что он обладает сверхбыстрым началом действия.
Буторфанол – агонист-антагонист опиоидных рецепторов (стимулирует κ-рецепторы и является антагонистом μ-рецепторов). Применяют для премедикации перед хирургическими операциями, во время операций и для послеоперационного обезболивания. В меньшей степени, чем морфин, угнетает дыхание, меньше вызывает риск лекарственной зависимости. Так же, как пентазоцин, буторфанол повышает давление в легочной артерии и увеличивает работу сердца, в связи с чем его не рекомендуют применять при инфаркте миокарда.
Налоксон – полный конкурентный антагонист μ-, δ- и κ-рецепторов. Наибольшее сродство налоксон имеет к μ-опиоидным рецепторам, что позволяет конкурировать с опиодами за места связывания с соответствующими рецепторами, устраняя их эффекты в организме. Собственной фармакологической активностью не обладает. Применяется для устранения действия опиоидов при передозировке и угнетении дыхания, вызванного опиоидами. Налоксон неэффективен при угнетении дыхания, вызванного неопиоидными препаратами. Продолжительность действия в зависимости от дозы составляет от 45 мин. до 4 ч.
Налтрексон является полным антагонистом опиоидных рецепторов, наиболее эффективен в отношении μ- и κ-рецепторов. Обладает большей продолжительностью действия, чем налоксон.
Трамадол – анальгетик смешанного действия. Он является агонистом мю-опиоидных рецепторов, за счет чего производит подобное морфину действие на головной и спинной мозг, а также ингибирует обратный захват серотонина и норадреналина нейронами, вследствие чего активирует ингибирующие ноцицептивные механизмы в спинном мозге. Трициклические антидепрессанты и другие ингибиторы обратного захвата моноаминов в ЦНС также обладают обезболивающим эффектом за счет этих механизмов. Таким образом, анальгетический эффект трамадола лишь частично ингибируется опиоидными антагонистами, такими как налоксон. Трамадол назначают перорально для лечения умеренной боли. При его использовании есть опасность возникновения лекарственной зависимости. Трамадол практически не вызывает угнетения сердечно-сосудистой и респираторной систем. Препарат снижает порог судорожной готовности, а риск возникновения судорог увеличивается, если трамадол применяется одновременно с антидепрессантами.

