Глава 11
“Страшная туча”
Я прекрасно сознаю, что я всего лишь человек, который бессильно борется с течением времени.
Людвиг Больцман
Пока Гиббс писал статьи, Людвиг Больцман нашел в Граце человека, с которым мог обсуждать свои идеи. В мае 1873 года он познакомился с девятнадцатилетней Генриеттой фон Айгентлер, которая готовилась стать школьной учительницей. Обладательница длинных светлых волос и голубых глаз, она была на десять лет младше Больцмана и сблизилась с ним отчасти из общего интереса к науке. За год до этого знакомства она посещала лекции по физике в Университете Граца, хотя женщины в Австрии не имели права на высшее образование. Она проучилась лишь один семестр, после чего всех женщин исключили из университета, поскольку их присутствие якобы не позволяло мужчинам сосредоточиться на деле. Не дрогнув, фон Айгентлер подала прошение министру образования и получила характеристики от благосклонно настроенных преподавателей. Такая настойчивость дала ей возможность еще один семестр посещать лекции.
Из сохранившихся писем, относящихся к раннему периоду их отношений, видно, что инициативу проявила фон Айгентлер. Когда ее мать умерла, оставив ее младшей из трех осиротевших сестер, она стала чаще писать Больцману, хотя они по-прежнему главным образом обсуждали ее учебу и его научную карьеру. Первым намеком на романтические отношения можно считать письмо, в котором фон Айгентлер попросила Больцмана прислать ей свою фотографию. Больцман выполнил ее просьбу, но и дальше ограничивался краткими ответами на ее длинные письма. В сентябре 1875 года настойчивость фон Айгентлер окупилась: Больцман отправил ей весьма формальное предложение руки и сердца, в котором выразил надежду, что жена станет ему “товарищем в общем начинании”.
Но фон Айгентлер не смогла преодолеть мизогинию XIX века. Когда пара объявила о помолвке, родственники настояли, чтобы фон Айгентлер прекратила даже неофициальные занятия наукой и вместо этого научилась готовить. Раздосадованная, в начале 1876 года она пожаловалась Больцману: “К несчастью, у меня сейчас мало времени, чтобы читать и учиться, ведь порой я даже вечером работаю на кухне у Кинцля”.
В тридцатилетием браке Больцман часто нуждался в поддержке жены, поскольку вопреки его ожиданиям его идеи снова и снова подвергались критике, что усугубляло его природную предрасположенность к депрессии и отчаянию.
Первую и самую конструктивную критику Больцману высказал его друг и наставник Иозеф Лошмидт, которому не нравилось, что второе начало термодинамики в конечном счете предсказывает Вселенной гибель в результате перехода в неизменное состояние после рассеяния всей теплоты в космосе. Если это правда, писал Лошмидт, то второе начало – это “страшная грозовая туча, где кроется причина гибели всей жизни во Вселенной”.
В качестве контраргумента для такого мрачного прогноза Лошмидт указал на очевидное противоречие в рассуждениях Больцмана.
Чтобы понять логику Лошмидта, вспомните, как теплота самопроизвольно выходит в большую комнату сквозь открытую дверцу горячей духовки. Это типичный необратимый процесс, поскольку после выключения духовка всегда остывает, пока ее температура не сравняется с температурой комнаты. Обратное никогда не происходит само по себе.
Больцман назвал это естественным следствием бесконечных столкновений частиц воздуха, каждая из которых при этом подчиняется тем же физическим законам, что и бильярдный шар. Здесь, по мнению Лошмидта, и возникает противоречие. Законы, описывающие отдельные молекулярные столкновения, обратимы. Они полностью симметричны по времени. Чтобы понять почему, представьте, как смотрите фильм, где крупным планом показывают столкновение двух бильярдных шаров. Один шар появляется слева и ударяет другой, лежащий неподвижно. Первый шар при этом останавливается, а второй укатывается вправо. Теперь представьте, что вы увидите, если фильм покажут задом наперед. Шар появится справа, ударит неподвижный шар и остановится, а неподвижный шар придет в движение и укатится влево. Невозможно понять, в каком из этих случаев время в фильме идет вперед, а в каком – назад.
Теперь примените этот принцип к примеру с рассеянием теплоты из духовки. Представьте камеру, которая крупным планом сняла всего одно из триллионов столкновений частиц воздуха у открытой дверцы. Смотря этот фильм, вы никак не сможете определить, в каком направлении в нем идет время. Однако если бы после этого план сменился и камера сняла всю комнату, то вы поняли бы, в каком направлении идет картина. Увидев, что теплота рассеивается из духовки, вы сделали бы вывод, что фильм идет вперед. Увидев, что теплота, наоборот, покидает комнату и самопроизвольно концентрируется в духовке, вы сказали бы, что фильм идет назад.
Больцман утверждал, что такой необратимый процесс, как рассеяние теплоты, представляет собой результат множества отдельных обратимых столкновений. Согласно Лошмидту, здесь возникал парадокс. Как может обратимый процесс приводить к необратимому результату? В этом нет никакого смысла. Откуда берется необратимость? Больцман был достаточно проницателен, чтобы принять конструктивную критику, и согласился, что на микроскопическом уровне отдельные молекулярные столкновения обратимы. В 1877 году он опубликовал две статьи, в которых развил свои аргументы и укрепил тезис о том, что энтропия увеличивается исключительно по статистическим причинам.
Во второй статье Больцман обратился к сложной математике, чтобы как можно полнее изложить свою точку зрения. “Изящество – удел портных и башмачников”, – сказал он, объясняя свой подход, который существенно отличался от подхода его кумира Джеймса Клерка Максвелла. В заключительной части статьи Больцман формально описал идею о том, что энтропия увеличивается исключительно по статистическим причинам, с помощью следующего равенства:
Ω = —∫∫∫∫∫∫ f (x,y,z,u,v,w) lnf (x,y,z,u,v,w) dxdydzdudvdw
В последующие годы интеллектуальные преемники Больцмана, искусно используя символы, сократили равенство до:
S = klnW
Теперь эта формула считается одним из постулатов физики и выгравирована на могиле Больцмана в Вене. Согласно этому математическому утверждению, энтропия (S) любой системы равна количеству неотличимых друг от друга конфигураций, которые эта система может принимать.
* * *
Тем временем Джозайя Уиллард Гиббс не сидел без дела в своем кабинете в Йеле. Он понял, что законы термодинамики открывают путь к более глубокому пониманию химии. В первую очередь, Гиббс подарил будущим поколениям ученых концептуальную схему для изучения химических процессов, происходящих внутри живых организмов. Эти идеи изложены в его главном сочинении, 371-страничной статье, полной математических символов, которая в очередной раз заставила редакционный совет Transactions of the Connecticut Academy of Arts and Science испытать свое умение привлекать средства. Тот факт, что Джеймс Максвелл, прочитав ранние статьи Гиббса, добавил в новое издание своей книги “Теория теплоты” целую главу с описанием термодинамических диаграмм, подтолкнул редакционный совет не терять веры в ученого.
Открытие Гиббса состояло в том, что он нашел способ показать, как два начала термодинамики выступают движущей силой всех химических реакций. Во вступительной части статьи он поместил формулировку начал, и мы последуем его примеру.
Первое начало: энергия вселенной неизменна.
Второе начало: энтропия вселенной стремится к максимуму.
Затем Гиббс показал, как все процессы изменений определяются двумя этими началами. По сути, для этого он преобразовал два начала в новый закон, который можно назвать законом Гиббса: энтропия вселенной увеличивается с помощью потока энергии.
Сначала давайте вспомним, что такое химический процесс, или реакция. Простейшее объяснение таково: химическая реакция описывает, что происходит, когда при соединении веществ друг с другом образуется новое вещество. Возьмем, к примеру, образование ржавчины на железе. Железо вступает в реакцию с кислородом и водяным паром, и получается новое вещество – ржавчина. При смешивании пищевой соды с уксусом образуются углекислый газ, вода и соль. Мыло удаляет жир в результате химической реакции, в которой компоненты соединяются в новое вещество, растворимое в воде. Приготовление пищи богато подобными примерами, как и функционирование любого живого организма. Закон Гиббса позволяет нам понять, почему происходит любая химическая реакция.
Рассмотрим такую обыденную реакцию, как горение угля в камине. В этом процессе углерод, основная составляющая угля, соединяется с присутствующим в воздухе кислородом, в результате чего образуется углекислый газ и выделяется большое количество теплоты. (Большая часть угля имеет включения, которые также вступают в реакцию с кислородом, но мы опустим это для наглядности.) Почему мы никогда не наблюдаем этот процесс в обратном порядке? Почему фильм не идет задом наперед, а углекислый газ самопроизвольно не превращается обратно в кислород и уголь? Почему нельзя передать выделившуюся в процессе горения теплоту обратно углекислому газу и разделить его на твердый углерод и кислород?
Ответ дает идея Гиббса о том, что поток энергии всегда увеличивает энтропию Вселенной. Рассмотрим, что происходит при горении угля.
Сначала у нас есть твердый углерод и газообразный кислород. Чтобы интуитивно понять энтропию ситуации, можно представить энергию более плотно упакованной в твердом углероде и диспергированной в газообразном кислороде.
После сжигания остается только газ – углекислый. Энергия, которая была сосредоточена в твердом углероде, становится более рассеянной. Из твердого вещества с низкой энтропией и газа с высокой энтропией получается один газ с высокой энтропией. В целом энтропия веществ увеличивается.
Важно отметить, что в процессе соединения углерода с кислородом выделяется теплота, которая выходит в окружающую среду, нагревая воздух вокруг камина. Затем эта теплота рассеивается по воздуху, тем самым увеличивая его энтропию.
Причина, по которой углерод сгорает, а углекислый газ никогда самопроизвольно не разлагается на углерод и кислород, заключается в том, что горение увеличивает энтропию в два этапа. Сначала оно создает углекислый газ, а затем рассеивает теплоту по воздуху вокруг камина. С учетом этого горение выступает эффективным способом увеличения энтропии Вселенной.
Пример со сжиганием угля аналогичен приведенному в главе 7 примеру с домом, в одной комнате которого тепло, пока в другой – холодно. Чтобы укрепить аналогию, представьте, что закрытую межкомнатную дверь удерживает пружина. Сначала ничего не происходит, как ничего не происходит с углем, пока он спокойно лежит в камине. Затем протянутая рука открывает дверь. Теплота начинает перемещаться. Рука исчезает, но дверь остается открытой. Небольшая часть теплового потока преобразуется в механическую работу, не позволяющую двери закрыться. Таинственная рука аналогична искре, которая нужна, чтобы разжечь уголь. Энергию, необходимую для запуска реакции, обычно называют энергией активации. Когда огонь уже разгорелся, выделяемой теплоты оказывается достаточно, чтобы процесс продолжался.
Мы не наблюдаем разложения углекислого газа по той же причине, по которой не наблюдаем самопроизвольного перемещения теплоты из холодной комнаты в теплую. Ни один из этих процессов не противоречил бы первому началу термодинамики – энергия не создавалась бы и не уничтожалась, – но они приводили бы к уменьшению энтропии Вселенной, а этого не позволяет второе начало. Все реакции, приводящие к увеличению энтропии, называются самопроизвольными. Это значит, что они продолжаются, пока не перестают получать энергию активации, необходимую для их запуска.
Другой пример самопроизвольной реакции – горение водорода в кислороде, приводящее к образованию пара, газообразной формы воды. Сначала существуют два отдельных газа, а это предполагает достаточно высокую энтропию. Энергия рассеяна в этих газах. После реакции горения остается лишь один газ – пар. Два газа становятся одним, а значит, энтропия уменьшается. Но при горении выделяется большое количество теплоты, которая рассеивается в окружающей среде, что приводит к существенному увеличению ее энтропии – и это увеличение гораздо более заметно, чем уменьшение энтропии при объединении двух газов в один. Совокупная энтропия всей системы увеличивается. Как и в случае с углекислым газом, вода никогда сама по себе не распадается на два входящих в ее состав газа, поскольку для этого энтропия должна уменьшиться.
Вода никогда не распадается на компоненты сама по себе. Закон Гиббса гласит, что энтропия Вселенной должна увеличиваться, но энтропия ее составных частей может уменьшаться. Для этого энтропия других составных частей Вселенной должна увеличивается в достаточной мере, чтобы увеличивалась и ее совокупная энтропия.
Иными словами, углекислый газ и вода могут разлагаться – растения постоянно подталкивают их к этому, – но только не “сами по себе”. Равенство Гиббса позволяет нам учесть все изменения энтропии в различных частях Вселенной, чтобы найти торговую площадку, где одна часть Вселенной платит другим за весьма желанный товар – временное локальное уменьшение энтропии. Оплата при этом проводится в конкретной и определенной валюте – энергии.
Представьте два дома, в каждом из которых по две комнаты. В первом доме вместо двери между комнатами стоит двигатель. Во втором – холодильник, который перекачивает теплоту в неправильном направлении из холодной комнаты в теплую. В первом доме перемещение теплоты из теплой комнаты в холодную обеспечивает функционирование двигателя, производя работу. Эта работа, в свою очередь, обеспечивает функционирование холодильника во втором доме.
По сути, перемещение теплоты из теплой комнаты в холодную в первом доме питает перемещение теплоты в “неправильном” направлении, из холодной комнаты в теплую, во втором доме. Увеличение энтропии в первом доме, используя работу в качестве валюты, оплачивает уменьшение энтропии во втором. Такие два дома называются “сопряженными”.
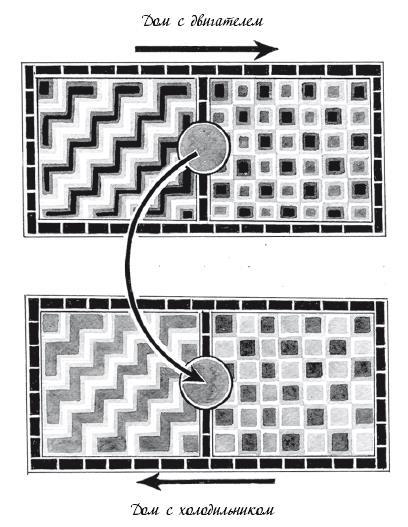
Термодинамически “сопряженные” дома
Химические реакции могут быть сопряжены, как и комнаты на схеме.
Когда водород сгорает в кислороде, рассеивается большое количество теплоты – гораздо больше, чем необходимо, чтобы компенсировать уменьшение энтропии, вызванное генерацией пара. Этот избыток “свободной” энергии можно использовать для осуществления механической работы – например, для питания автомобильного двигателя. Однако он может применяться и для запуска других химических реакций в обратном, или “несамопроизвольном”, направлении, подобно тому как тепловой поток в одном доме обращает вспять тепловой поток в другом доме. В таком контексте доступную энергию часто называют свободной энергией Гиббса, и она обеспечивает сопряжение химических реакций.
Так, в определенных обстоятельствах свободная энергия, оставшаяся после сгорания водорода и кислорода, может обеспечивать разложение углекислого газа. Первая реакция увеличивает энтропию Вселенной, а вторая – уменьшает ее. Пока совокупная энтропия увеличивается, сгорание одного вещества может приводить к разложению другого.
Способность свободной энергии Гиббса к сопряжению химических реакций друг с другом обеспечивает условия для существования жизни на земле. Самым удивительным примером служит первый этап процесса – фотосинтез, который, по сути, использует свободную энергию Гиббса для разложения воды и углекислого газа. Процесс идет следующим образом:
Шаг 1. Сбор свободной энергии солнечного света.
Солнечный свет – богатый источник свободной энергии. Молекула хлорофилла в листьях растений использует это, чтобы обеспечивать разложение воды, а иными словами – чтобы расщеплять молекулу Н2О на составляющие ее водород и кислород. Кислород выделяется в атмосферу, оставляя в листьях один водород. Изолированный водород такого типа теперь сам становится источником свободной энергии, поскольку ему необходимо снова установить связь с кислородом или подобным химическим элементом.
Этот этап, когда солнечный свет используется для расщепления воды, называется световой фазой.
Шаг 2. Использование свободной энергии в форме изолированного водорода для разложения углекислого газа.
Хитрость этого этапа состоит в том, что растения выделяют свободную энергию, хранящуюся в форме изолированного водорода, не единовременно. Вместо этого они делят ее между другими химическими соединениями, которые появились в процессе эволюции специально для хранения свободной энергии Гиббса. Самое распространенное из них – аденозинтрифосфат, или АТФ. Представьте АТФ в форме крошечной молекулярной пружины, которая сжимается, получая свободную энергию. При необходимости эту порцию энергии можно высвободить, осуществив химическую реакцию, эквивалентную разжиманию пружины в АТФ.
Используя свободную энергию Гиббса, хранящуюся в АТФ, растения расщепляют углекислый газ. В серии скоординированных химических реакций свободная энергия высвобождается из молекулы АТФ и идет на расщепление атмосферного углекислого газа на углерод и кислород, после чего происходит их перекомпоновка в молекулы, называемые углеводами. Это называется “связыванием” углерода и имеет две основные цели. Во-первых, углеводы снабжают растения такими строительными материалами, как целлюлоза, которая формирует структуру растения. Во-вторых, при производстве углеводов используется не вся энергия, хранящаяся в АТФ. Неиспользованная энергия, по сути, перемещается в молекулы углеводов. Они также представляют собой химические пружины. Это значит, что сами углеводы становятся временными хранилищами свободной энергии, которую затем можно использовать для обеспечения роста и всех остальных химических реакций, необходимых растению для поддержания жизни.
Второй этап фотосинтеза, когда свободная энергия, хранящаяся в изолированном водороде, используется для связывания углерода, называется темновой фазой.
Все это обеспечивает условия для жизни таких животных, как человек. С точки зрения свободной энергии Гиббса, мы – растения, функционирующие в обратном порядке. Потребляя в пищу растения и других животных, питающихся растениями, мы поглощаем такие химические соединения, как углеводы, которые растения создают и преобразуют в богатые хранилища свободной энергии Гиббса. Переворачивая темновую фазу фотосинтеза задом наперед, клетки животных высвобождают свободную энергию из углеводов и создают собственные молекулы АТФ, которые питают многочисленные химические процессы, происходящие в клетках животных, и позволяют им жить. В конце концов углерод, который растения получили из атмосферного углекислого газа, воссоединяется с кислородом и снова выдыхается в форме углекислого газа.
Итак, растения используют свободную энергию Гиббса, получаемую из солнечного света, чтобы преобразовывать воду и углекислый газ в углеводы, содержащие часть свободной энергии солнца, и при этом высвобождают кислород. Животные получают доступ к свободной энергии Гиббса, заключенной в углеводах, чтобы жить, и тем самым снова соединяют углерод из углеводов с атмосферным кислородом, в результате чего выделяются углекислый газ и вода. Сегодня ученые объяснили все до единого переносы свободной энергии Гиббса во всех химических процессах, происходящих в растениях, животных и мире. В них наблюдается прекрасная симметрия. Растения поглощают 2870 кДж свободной солнечной энергии, чтобы выработать 180 г глюкозы (типичного углевода). Животное, которое съедает 180 г глюкозы, выделяет ровно 2870 кДж свободной энергии, в конечном счете выдыхая углекислый газ.
Таков знаменитый цикл жизни. Углекислый газ, выдыхаемый животными, поглощается растениями, которые производят пищу и кислород, и так далее. Чтобы цикл продолжался, ему нужен постоянный приток свободной энергии Гиббса. Очень важно, что на каждом этапе цикла небольшое количество свободной энергии теряется в форме теплоты. Это значит, что на каждом этапе энтропия Вселенной увеличивается. Цикл жизни – каким бы великолепным и удивительным он ни был – связывает солнечный свет с клоакой. В целом жизнь служит эффективным способом увеличения энтропии Вселенной.
Сам Гиббс не изучал роль свободной энергии в биологии. Однако за пятьдесят лет, прошедших с публикации его статьи, загадки фотосинтеза и происходящего в животных обратного процесса, называемого клеточным дыханием, были раскрыты. Узнав из трудов Гиббса и его последователей, что переносы свободной энергии выступают движущей силой жизни, биохимики получили руководящий принцип для анализа чертовски сложных тонкостей клеточной химии.
Идеи Гиббса также оказались весьма значимыми для длительной дискуссии о витализме – теории, гласящей, что живые организмы и неживые предметы подчиняются разным физическим законам. Труды Германа Гельмгольца и других ученых серьезно ослабили поддержку витализма, но работа Гиббса нанесла теории сокрушительный удар. Концепция свободной энергии показала, что каждый химический процесс в каждой клетке каждого живого существа подчиняется законам физики. Никакой нужды в сверхъестественном или духовном не было. В лучах солнца содержалось достаточно энергии, чтобы питать прекрасные хитросплетения жизни на земле.
* * *
На протяжении нескольких лет после публикации главной работы Гиббса в 1878 году научное сообщество постепенно принимало его идеи. Он воздержался от предположений о строении вещества и молекул – и потому не спровоцировал споры. К несчастью, о Больцмане такого не скажешь. В последние десятилетия XIX века его научные воззрения втянули его в конфликт, который повредил его и без того хрупкой психике. Работа Гиббса невольно сыграла в этом свою роль.
Истоки спора лежали в философии феноменализма, которая укоренилась в немецкоязычном мире. Ее главным поборником был Эрнст Мах, профессор истории и философии естественных наук в Венском университете.
В молодости Мах был талантливым физиком-экспериментатором и сделал первые фотографии ударных волн, создаваемых телами, движущимися быстрее скорости звука, в связи с чем скорость звука теперь приравнивается к одному маху. К 1890-м годам он увлекся феноменализмом. Если не вдаваться в детали, феноменализм утверждает, что реальны лишь вещи, которые поддаются непосредственному чувственному восприятию. Приписывая физическую реальность тому, что подтверждается лишь косвенными свидетельствами, ученые, напротив, отступают от принципов науки. По мнению Маха, проблема работы Больцмана заключалась в том, что автор исходил из реальности молекул и атомов. Учитывая, что ни атомы, ни молекулы не поддаются чувственному восприятию, феноменалисты полагали, что говорить об их существовании нельзя. Это, в свою очередь, значило, что вся доктрина статистической механики, сформулированная Больцманом, вызывала сомнения. Предложенное им вероятностное объяснение увеличения энтропии ничего не стоило, если задействованные в нем объекты, а именно атомы и молекулы, не поддавались непосредственному наблюдению.
В то время к феноменализму склонялись многие ученые немецкоязычного мира, включая молодого Альберта Эйнштейна. В последующие годы он вспоминал, как идеи Маха натолкнули его на мысль, что пространство и время не имеют смысла в отсутствие линеек и часов для их измерения, а это, в свою очередь, послужило вдохновением для создания теорий относительности. Но Больцману пришлось заплатить высокую цену. Он оказался втянутым в утомительные споры о существовании атомов и молекул, которые, как он утверждал, пребывали в постоянном беспорядочном движении.
Применение феноменализма к термодинамике также предполагало обсуждение вопроса лишь с позиций наблюдаемых и измеряемых явлений – тепловых потоков, давления, объемов, температур и т. д. Это учение получило название “энергетизм”. Его сторонники полагали, что, хотя понятия атомов и молекул допускали некоторые математические фантазии, это все-таки не делало их реальными. И здесь ученые обращались к работе Джозайи Уилларда Гиббса.
Дело в том, что идеи Больцмана ставили условием существование молекул и атомов, в то время как Гиббс не делал подобных допущений. Вместо этого Гиббс исчерпывающе и точно описывал термодинамику исключительно на основе двух ее общепринятых начал. Столь чистый подход привлекал сторонников энергетизма. Один из них, молодой немецкий химик Вильгельм Оствальд, даже перевел статью Гиббса на немецкий. Для науки это было прекрасно, ведь Оствальд помог привлечь внимание европейцев к работе Гиббса, но для Больцмана – не так хорошо, поскольку сторонники энергетизма нашли аргументы в пользу того, что термодинамика не нуждается в гипотезе о существовании молекул и атомов.
Среди критиков Больцмана был молодой Макс Планк, преподававший физику в Мюнхене. Он родился в городе Киль на балтийском побережье Германии в 1858 году и получил докторскую степень за анализ второго начала термодинамики. Как и Мах и Оствальд, он осуждал настойчивую веру Больцмана в существование молекул и атомов, поведением которых объясняется второе начало. В 1882 году он прямо заявил, что Больцман ошибается, написав: “Второе начало механической теории теплоты несовместимо с предположением о конечном числе атомов. <…> Ряд текущих наблюдений, как я полагаю, свидетельствует, что от атомной теории в конце концов придется отказаться, хотя она и делает большие успехи”.
Битва Больцмана со сторонниками энергетизма шла на страницах журналов и на научных конференциях. Свидетели вспоминали утомительные дебаты Больцмана и Оствальда, в которых каждый упорно стоял на своем. Однажды после лекции, прочитанной Больцманом в престижной Императорской академии наук в Вене, Мах поднялся и заявил: “Я не верю в существование атомов!”
Слова Маха, как впоследствии признался Больцман, “не выходили у [него] из головы”. К тому времени он посвятил более двадцати лет жизни размышлениям о научных следствиях атомно-молекулярного строения Вселенной. Он готов был поклясться своей карьерой, что молекулы и атомы существуют. Но его карьера приближалась к концу, а новое поколение ученых от него отдалялось. В письме редактору научного журнала, написанном в 1890-х годах, он отметил: “Не знаю, не случится ли так, что вскоре я один буду противостоять текущему направлению немецкой науки”.
Ситуация усугублялась тем, что отход от его идей был обоснован не математическими аргументами и не физическими фактами, а философскими суждениями, которые казались Больцману совершенно бессмысленными. “Не следует ли сравнить непреодолимое желание философствовать с вызываемой мигренями рвотой?” – спрашивал он в письме итальянскому философу Францу Брентано.
Здоровье Больцмана также пошатнулось. Страдая от сильнейшей близорукости, он с трудом продолжал лабораторную работу, и друзья заметили, что радость жизни у него прерывалась периодами молчаливого уединения, которые продолжались дольше обычного. Когда в 1889 году случилась трагедия и его старший сын скоропостижно скончался от аппендицита, Больцман стал винить себя за то, что не заметил симптомов раньше. Университетская жизнь тоже осложнилась. Национализм был на подъеме, и австрийские студенты, казалось, никак не могли определиться, поддерживать им Германию или нет, а Больцману эти дебаты казались не только утомительными, но и обескураживающими. Периодически споры перерастали в пьяные дебоши. В последующие годы, описывая это, Больцман говорил, что в те дни свиньи, у которых хвосты закручивались влево, дрались со свиньями, у которых хвосты закручивались вправо.
Хуже того, придираться к работе Больцмана стали даже ученые, которые не считали себя преданными сторонниками феноменологии и энергетизма. Так, когда в 1896 году с критикой выступил математик Эрнст Цермело, Больцман начал ответную статью следующим образом: “Работа Цермело показывает, что мои статьи были поняты неправильно; тем не менее мне доставляет удовлетворение ее появление, поскольку она, по-видимому, является первым свидетельством того, что эти статьи вообще обратили на себя какое-то внимание в Германии”.
Тем не менее Больцман не лишился способности к оригинальному мышлению. В его ответе на критику Цермело содержалось множество любопытных идей, и самой яркой из них стало первое сделанное на основе одних лишь научных выкладок утверждение, что Вселенная, вероятно, должна была быть создана в какой-то определенный момент – момент творения.

