Глава 10
Подсчет способов
Математика – это язык.
Джозайя Уиллард Гиббс
Стаккато первых аккордов “Героической” симфонии Бетховена напоминало артиллерийский обстрел – казалось, они рикошетом отлетают от стен зала Венской филармонии. Было лето 1866 года, и среди зрителей сидел 22-летний Людвиг Больцман. Ниже среднего ростом, бородатый, в очках, с копной кудрявых темных волос, он был аспирантом на кафедре физики Венского университета. Одаренный с детства пианист, Больцман видел, как Бетховен схватил западную классическую музыку за шкирку и потащил в совершенно новом направлении. Но тогда он еще не знал, что в последующие четыре десятилетия своей карьеры, напоминающие “Героическую” симфонию множеством перемен тональности и темпа, он сделает то же самое для физики.
Одновременно другой человек с другого континента, Джозайя Уиллард Гиббс, начнет не менее важное изучение загадок термодинамики, которое растянется на всю его жизнь. В 1866 году, пока Больцман поглощал венскую культуру и писал диссертацию, 27-летний Гиббс на пароходе пересекал Атлантику, двигаясь на восток из Америки в Европу, чтобы начать трехлетнее путешествие по крупным европейским городам. Это была первая и единственная поездка Гиббса за пределы родной Новой Англии. Посещая в Европе лекции по естествознанию и математике, он изучал всевозможные методики, необходимые для последующей работы по исследованию энергии и энтропии.
Хотя научные интересы Гиббса и Больцмана пересекались, во всех остальных отношениях они были полной противоположностью друг друга. Худой Гиббс вел замкнутую жизнь аскета, а полный Больцман был общителен, пылок и подвержен перепадам настроения, из-за которых на смену его радостному возбуждению нередко приходило отчаяние. Если жизнь австрийца характеризует “Героическая” симфония Бетховена, то жизнь американца скорее напоминает одно из сдержанных музыкальных размышлений Эрика Сати. Хотя оба ученых отталкивались от начал термодинамики, они шли в разных направлениях. Больцман смотрел внутрь, пытаясь понять, почему эти начала верны, а Гиббс выглядывал наружу, надеясь установить их следствия.
* * *
Людвиг Больцман родился в Вене 20 февраля 1844 года. В тот год эта дата выпала на Жирный вторник, в который по христианскому календарю традиционно отмечается последний праздник перед началом Великого поста. В последующие годы Больцман шутил, что именно поэтому он счастлив в одну секунду и подавлен – в другую. Отец Больцмана был налоговым инспектором, который официально именовался “региональным финансовым комиссаром” Габсбургской монархии, а мать – дочерью состоятельного купца из Зальцбурга. Людвиг хорошо учился и часто показывал лучшие результаты в классе, проявлял интерес к природе и талант к музыке. Он собирал бабочек и жуков и брал уроки игры на фортепиано у великого композитора Антона Брукнера, который в те годы работал органистом в соборе. Хотя у Людвига, как выразился будущий коллега, были “короткие пальцы и пухлые руки”, это не мешало развитию его фортепианной техники.
Однако в XIX веке богатство не спасало от болезней. В 1859 году, когда Больцману было 15 лет, его отец умер от туберкулеза, и не прошло и года, как жертвой той же болезни стал его младший брат Альберт. Некоторое время семья жила на государственную пенсию отца и наследство матери, но вскоре деньги закончились. В результате Больцман стал единственным кормильцем матери и сестры. Карьера университетского ученого соответствовала его талантам и могла обеспечить финансовую стабильность, но была ли у него надежда найти подходящее место в середине XIX века в Австрии?
Промышленная революция пришла в Австрию позже, чем в Пруссию и другие немецкоязычные государства севера, и Габсбурги не сразу осознали, какую важную роль играет наука в современном государстве. Родись Больцман на двадцать лет раньше, и ему не нашлось бы работы физиком во всей Австрии. К счастью для него, в 1850 году правительство согласилось финансировать Физический институт при Венском университете. В нем числилось всего два-три преподавателя и менее двадцати студентов, которые в основном проходили подготовку, чтобы стать учителями средней школы. Институт занимал небольшое и не приспособленное для него помещение в венском районе Эрдберг, который находится там, где Дунай делит город на две части.
Впрочем, недостаток помещений и материалов Венский физический институт восполнял наличием преподавателей с обостренным чувством локтя и страстью к научным изысканиям. Многие годы спустя Больцман будет вспоминать это время как самый счастливый период своей научной карьеры.
Старейшиной небольшого коллектива ученых в Вене считался преподаватель Иозеф Лошмидт, который был на 23 года старше Больцмана. Он взял под крыло молодого Больцмана, рано лишившегося отца, и между ними возникла крепкая дружба, основанная на общей страсти к науке, искусству, поэзии и музыке. Вместе они посещали театры и концертные залы Вены и присутствовали при исполнении “Героической” симфонии Бетховена в 1866 году. Они размывали границу между искусством и наукой, обсуждая Гомера и росписи
Сикстинской капеллы на кафедре физики и говоря о свойствах кристаллов серы в очереди в оперу. Судя по более поздним записям Больцмана и скорости, с которой он набирал вес, во время этих вылазок они также потребляли огромное количество пищи, пива и вина. (Жена Больцмана, Генриетта, называла мужа “мой дорогой толстячок”.)
Восхищаясь статьями Рудольфа Клаузиуса и Джеймса Клерка Максвелла по кинетической теории, Лошмидт применил их идеи, чтобы определить диаметр одной частицы воздуха. Полученная цифра – 0,000001 мм – стала первой подобной оценкой и примерно в три раза превосходит современную оценку диаметра молекул кислорода и азота, из которых состоит воздух. Важно, что Лошмидт познакомил с кинетической теорией Больцмана, который пришел от нее в восторг и особенно был очарован работой Максвелла. Если Бетховен был героем Больцмана в сфере искусства, то Максвелл стал его героем в сфере науки – труды шотландца вызывали у него почти такие же чувства, что и музыка немца. Он писал о статьях Максвелла по кинетической теории:
Хаос формул нарастает. Вдруг звучат четыре слова: “Пусть N = 5”. Злой демон V исчезает, прямо как в музыке, когда разрушительный бас вдруг стихает и то, что представлялось неодолимым, оказывается поверженным словно по волшебству.
Завершение того, что Максвелл начал, введя законы вероятности в физику, определит карьеру Больцмана. Стремление с помощью статистики объяснить второе начало термодинамики и показать, почему энтропия Вселенной всегда возрастает, станет его навязчивой идеей, белым китом для живущего в нем Ахава.
Но все это было впереди. После получения докторской степени в Венском университете главной заботой Больцмана стали деньги. Он некоторое время работал ассистентом заведующего кафедрой Иозефа Стефана, но его зарплаты не хватало, чтобы обеспечивать семью. К счастью, Стефан, который был прекрасно знаком с научным талантом Больцмана, написал ему великолепное рекомендательное письмо. Оно помогло Больцману получить должность профессора математической физики в Граце, втором по величине городе Австрии, расположенном примерно в 200 километрах к юго-западу от Вены. В сентябре 1869 года 25-летний Больцман с семьей переехал на новое место.
Еще со Средних веков Грац напоминал плавильный котел, где встречались германские, итальянские и славянские народы. Престижный городской университет был основан в 1585 году, но физику в нем начали преподавать только с 1850 года. Новая кафедра уступала даже венской и занимала бывшую резиденцию священника, переделанную в лабораторию, и небольшой лекционный зал. Поскольку лаборатория не отапливалась, заведующий кафедрой, профессор Тёплер, который ранее преподавал в Риге, стоящей на Балтийском море, одолжил Больцману теплую шубу, чтобы ученый мог работать и зимой. В таких стесненных обстоятельствах, часто страдая от холода, Больцман начал дело своей жизни, задавшись целью раскрыть тайны теплоты.
Первой значимой работой Больцмана стала статья, опубликованная в 1872 году в ведущем научном журнале Австрии. Она называлась “Дальнейшие исследования теплового равновесия между молекулами газа” и была длинной, однообразной, но смелой. Ее главный аргумент состоял в том, что второй закон термодинамики, гласящий, что энтропия Вселенной всегда возрастает, был прямым следствием кинетической теории.
Чтобы понять, как Больцман объединил две этих идеи, представьте духовку на большой кухне. Когда духовка нагреется, отключите питание и откройте дверцу. Как показали Клаузиус и Томсон, теплота всегда перемещается из горячей зоны в холодную, поэтому температура воздуха в духовке будет снижаться, пока не станет такой же, как в кухне. Но почему? Именно этот вопрос поставил перед собой Больцман. Сначала вспомните, что в момент отключения питания воздух в духовке значительно теплее воздуха за ее пределами, поскольку молекулы воздуха внутри в среднем движутся гораздо быстрее, чем снаружи. Теперь представьте, что происходит у открытой дверцы духовки, где горячий воздух встречается с холодным. Там быстрые частицы из духовки случайным образом время от времени сталкиваются с медленными частицами с кухни. Больцман полагал, что в этих столкновениях и кроется разгадка второго начала термодинамики.
Но чтобы понять, как происходят триллионы таких столкновений, нужно было обратиться к сложнейшей математике. Друг и наставник Больцмана Иозеф Лошмидт продемонстрировал, что отдельные частицы воздуха очень малы: в одном кубическом сантиметре воздуха содержится около 10 миллионов триллионов частиц. Точно вычислить, что происходит при столкновении каждой из них с другими, казалось бы, невозможно.
Больцман предложил оригинальный и блестящий подход к решению этой задачи. Он знал, что быстрая частица обладает большей энергией движения, или кинетической энергией, чем медленная. Здесь кинетическую энергию движущегося тела можно считать мерой усилия, необходимого для того, чтобы сдвинуть это тело с места. Или – эквивалентно – мерой “тормозного усилия”, необходимого для остановки тела. Чем быстрее и тяжелее тело, тем большее усилие требуется в обоих случаях, а следовательно, тем выше кинетическая энергия этого тела.
Концепция кинетической энергии весьма полезна при анализе столкновений. Представьте, например, как движущийся биток приближается к бильярдному шару, лежащему на столе. Часть кинетической энергии битка теряется в форме теплоты трения, когда биток катится по столу, часть преобразуется в звук столкновения с пребывающим в покое шаром, а часть передается этому шару, который приходит в движение. Передав часть своей кинетической энергии шару, с которым он столкнулся, биток движется все медленнее, пока не останавливается. Больцман представил частицы газа в виде идеальных бильярдных шаров, при столкновении которых кинетическая энергия не преобразуется ни в звук, ни в теплоту трения, а только передается от частицы, обладающей большей энергией, к частице, обладающей меньшей энергией.
Воздух в комнате состоит из бесконечного количества частиц, которые обмениваются кинетической энергией. Так представлял происходящее Больцман. Чтобы упростить свой анализ, он применил математическую хитрость. Он разделил количество кинетической энергии, которую переносит одна частица, на целочисленные единицы. Таким образом, у него получилось, что частица может двигаться с 1, или 6, или 35 единицами кинетической энергии, но никогда не движется с 2,3, или 5,78, или другим нецелым числом единиц.
Это упростило расчеты Больцмана и обеспечило реалистичное описание молекулярного переноса энергии. Кроме того, эта техника дала способ визуализации поведения молекул. Чтобы понять почему, представьте, что вместо большого количества молекул воздуха, движущихся с разным количеством единиц энергии, перед вами толпа толкающихся людей, в карманах у которых лежит разное число монет. Каждый человек в толпе идет в случайном направлении, но успевает сделать лишь один-два шага, а затем сталкивается с другим человеком. В такой аналогии быстрой молекуле с большим числом единиц энергии соответствует человек с большим количеством монет, а медленной – человек с небольшим количеством монет. Следовательно, горячую духовку в прохладной комнате можно представить как небольшую группу богачей, которые столпились в углу просторного зала, полного гораздо более бедных людей.
Если продолжить аналогию, то эквивалентом температуры каждой из двух групп будет среднее состояние ее членов. В каждой группе есть люди богаче и беднее среднего, подобно тому как в газах двух разных температур есть частицы, которые движутся быстрее и медленнее среднего. Быстрой молекуле, которая сталкивается с медленной и теряет часть энергии, соответствует богач, налетающий на бедняка и передающий ему часть своих монет, в результате чего богач становится беднее, а бедняк – богаче. Держа в уме эти правила, следите за деньгами.
Сначала беднее становятся лишь богачи, стоящие на краю своей группы, потому что им проще всего налететь на окружающих их бедняков. Благодаря тем же столкновениям бедняки на краю своей группы становятся немного богаче. Столкновений происходит слишком много, и уследить за всеми невозможно, но при этом можно предсказать, как распределение монет в толпе изменится со временем.
Рано или поздно передача денег, которая сначала происходит главным образом на границе между богачами и бедняками, охватит большее пространство. Стоящие дальше от края группы богачи тоже начнут терять деньги, поскольку их соседи на границе станут не такими богатыми, как раньше. Подобным образом бедняки с границы быстро потеряют нажитое, сталкиваясь с соседями из “бедной глубинки”. Вскоре все деньги, которые были сосредоточены в руках богачей, разделят между собой бедняки.
Чтобы закрепить результаты мысленного эксперимента, уменьшите количество участвующих в процессе людей. Пусть в комнате будет 12 человек. У группы из шести человек слева в кармане лежит по одной монете, в то время как у группы из шести человек справа нет ничего. Сделайте пример еще проще: пусть каждый человек может владеть лишь одной монетой в любой заданный момент времени. Монеты случайным образом перемещаются по комнате, когда люди обмениваются ими друг с другом или передают их соседям, которые не имеют монет.
Как монеты будут распределены в итоге?
Для ответа на этот вопрос посчитайте количество способов распределения монет, которые не отличаются друг от друга. В нашем примере все распределения с шестью монетами слева и нулем монет справа выглядят одинаково, потому что монеты идентичны. Что насчет распределений, в которых слева находится пять монет, а справа – одна? Они не идентичны, но похожи друг на друга. Подобным образом друг друга напоминают все распределения, в которых слева находится четыре монеты, а справа – две. И так далее.
Теперь спросите, сколько существует способов распределения шести монет между стоящими слева людьми? Их довольно много. Первый человек может держать любую из шести монет, второй – любую из пяти и так далее. Получается, что общее число способов распределения всех монет слева составляет 6 × 5 × 4 × 3 × 2 × 1, что равняется 720.
Сколько существует способов распределения пяти монет слева и одной справа? Число существенно больше: 4320.
А четырех слева и двух справа? 10 800.
Трех слева и трех справа? 14 400. Способов добиться равного распределения больше, чем любого другого.
Двух слева и четырех справа? 10 800.
Одной слева и пяти справа? 4320.
Нуля слева и шести справа? 720.
Даже при небольшом количестве монет равномерных распределений – например, с четырьмя монетами слева и двумя справа, тремя слева и тремя справа, а также двумя слева и четырьмя справа – больше, чем неравномерных. Если взглянуть на комнату после тысячи случайных обменов монетами, шанс увидеть три монеты в левой части комнаты и три – в правой составит 31 %. Шанс того, что все монеты окажутся слева, напротив, составляет всего 1,5 %. Если в исходной системе все монеты находятся слева, со временем деньги, как правило, распределяются по всей комнате.
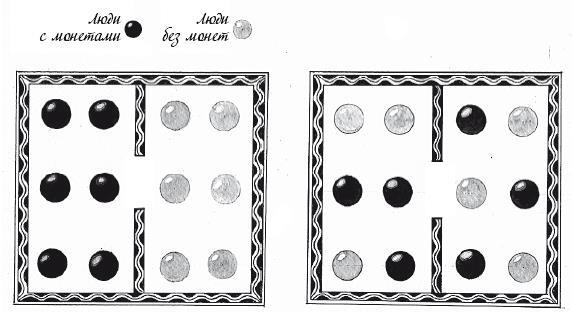
Распределение слева в 20 раз менее вероятно, чем распределение справа, где в каждой части комнаты находится одинаковое количество монет
Когда числа больше, этот эффект становится более выраженным. Пусть в комнате находится 100 человек и 50 монет, которые могут перемещаться между ними. Количество равномерных и почти равномерных распределений монет превосходит количество неравномерных распределений в 70 миллиардов раз.
Обратите внимание, что само по себе каждое распределение – хоть равномерное, хоть неравномерное – весьма маловероятно. Однако, поскольку многие триллионы равномерных распределений неотличимы друг от друга, монеты почти наверняка оказываются в одном из них.

При большем количестве монет неравномерных распределений, таких как слева, гораздо меньше, чем равномерных, таких как справа
Больцман применил такую же логику к рассеянию теплоты. Единственное отличие в том, что в этом случае не люди обмениваются монетами, а молекулы переносят кинетическую энергию.
По сути, Больцман показал, что неотличимых друг от друга способов распределения малых количеств энергетических единиц по кухне гораздо больше, чем способов концентрации больших количеств энергетических единиц у малого числа молекул. Любая система, которая в исходном состоянии содержит распределение необычного или редкого типа, – например, комната, где большая часть теплоты сконцентрирована в духовке, – в конце концов приходит к более типичному распределению, то есть к рассеянию теплоты.
Иными словами, теплота всегда рассеивается из горячей зоны, поскольку после некоторого периода случайных столкновений вероятность такого результата становится неимоверно более высокой.
Энтропия, по логике Больцмана, есть не что иное, как количество неотличимых друг от друга способов расстановки составных частей системы. Говоря, что энтропия конкретной системы возрастает, мы имеем в виду, что распределения внутри этой системы, или конфигурации системы, становятся все более вероятными. Второе начало термодинамики верно по той же причине, по которой при тасовании колоды карт, распределенных по мастям, порядок карт нарушается. Неотличимых друг от друга способов сложить колоду беспорядочным образом гораздо больше, чем способов оставить ее в порядке, поэтому при тасовании карты перемешиваются.
Определение энтропии через “количество распределений” объясняет не только рассеяние теплоты. Оно помогает понять многие необратимые процессы в природе. Например, воздух выходит из незавязанного воздушного шарика, но никогда не заходит обратно, потому что способов распределения частиц воздуха по комнате гораздо больше, чем способов их концентрации внутри шарика. Подобным образом нет способа размешать молоко в чашке с чаем так, чтобы жидкости отделились друг от друга, вместо того чтобы смешаться, поскольку у частиц молока существует гораздо больше способов распределиться в чае, чем оставаться сконцентрированными в одном месте. Аналогично, если уронить яйцо, то оно разобьется и разольется, но если собрать разбитое яйцо и уронить его снова, то оно не сформируется обратно. И снова дело в том, что у разлетевшихся частиц яйца есть гораздо больше способов оставаться в беспорядке, чем снова сложиться в форме неразбитого, целого яйца.
Следовательно, энтропия со временем увеличивается, поскольку вероятность ее уменьшения очень мала. Фактически – и это поразительный аспект логики Больцмана, – лишь наблюдая за увеличением энтропии, мы понимаем, в каком направлении идет время. Мы отличаем будущее от прошлого, потому что в будущем общая энтропия становится больше. Таким образом, пытаясь постичь теплоту с атомистической точки зрения, Больцман узнал, что именно лежит в основе открытия стрелы времени, сделанного Уильямом Томсоном. Представьте, что в фильме показывают, как теплота на кухне перемещается обратно в духовку или как молоко в чашке отделяется от чая. Увидев это, вы понимаете, что фильм идет в обратном направлении. Стрела времени отражает неотвратимый переход от статистически маловероятных упорядоченных распределений к более вероятным беспорядочным. Здесь есть тонкий момент: если в фильме показывают, как теплота перемещается обратно в духовку, в нем не показывают ничего невероятного, но показывают нечто крайне маловероятное. Вероятность этого настолько мала, что мы сразу понимаем: здесь что-то не так.
Статья Больцмана 1872 года не лишена недостатков, но все равно считается важной научной вехой и первой серьезной попыткой объяснить второе начало термодинамики на молекулярном уровне. Впрочем, в свое время она не оказала особого влияния. Отчасти это объяснялось тем, что круг австрийских профессиональных физиков был довольно узок и никто из них не был в состоянии прокомментировать сложные математические выкладки Больцмана. В этом отношении Германия сулила больше надежд. Когда в 1872 году Больцман посетил Берлин, профессор физики городского университета Герман Гельмгольц проявил интерес к его идеям. Однако из этого ничего не вышло: Больцман привык к неформальной австрийской академической культуре, где профессора и студенты были на короткой ноге, и не мог свободно говорить с Гельмгольцем, который воплощал в себе более формальную, иерархическую природу прусского общества. “К нему не подступиться”, – писал Больцман об именитом физике в письме матери. Прусские университеты были престижнее австрийских, но общительному Больцману они казались неприветливыми и бюрократическими структурами. Уже не в первый раз у него возникли трудности с продвижением своих идей.
* * *
В 1872 году, пока Больцман размышлял о нелестной реакции на свою статью, Джозайя Уиллард Гиббс, вернувшийся в родной Йель, был поглощен работой. Гиббс не высказывал никаких предположений о структуре вещества. Его стратегия заключалась в том, чтобы переключить внимание с молекулярных основ законов термодинамики на их следствия.
Гиббс происходил из семьи интеллектуалов. Его отец, которого также звали Джозайя Уиллард, занимал пост профессора духовной литературы в Йеле и был выдающимся лингвистом. Убежденный аболиционист, Гиббс-старший сыграл важную роль в освобождении порабощенных африканцев, которые подняли восстание на борту испанского корабля “Амистад”. Его подход к этому вопросу предопределил подход его сына к науке. Летом 1839 года 53 невольника из Менделенда (на территории современной Сьерра-Леоне) взбунтовались через несколько дней после выхода корабля из Гаваны. Они захватили контроль над судном и потребовали, чтобы штурман отвез их обратно в Африку. Штурман, однако, обманул африканцев и привел “Амистад” в Северную Америку. Там ВМС США конфисковали судно, а африканцев отправили в город Нью-Лондон в штате Коннектикут. Перед американской системой правосудия встал вопрос: кем считать невольников с “Амистада” – собственностью их испанских владельцев или свободными людьми, которые взбунтовались, стараясь себя защитить?
Американские аболиционисты, для которых дело “Амистада” стало очень громким, столкнулись с проблемой, поскольку представители народности менде не владели ни единым языком, понятным обитателям Новой Англии. Так как они не имели возможности изложить свою версию событий, выстроить их защиту на суде было практически невозможно. Гиббс-старший вознамерился решить эту проблему. Он навестил менде в коннектикутской тюрьме и, встретившись с ними, показал сначала один палец, потом второй, а затем по одному все остальные пальцы на руках. Менде поняли, чего он хочет, и сосчитали от одного до десяти на своем языке. Затем Гиббс отправился в нью-йоркский порт, где стал ходить от корабля к кораблю, повторяя слова, которые узнал у менде. В конце концов он нашел среди матросов освобожденного раба, который работал на британском бриге, понимал числительные на языке менде и говорил по-английски. Благодаря универсальной природе чисел Гиббс нашел переводчика, необходимого невольникам в Коннектикуте. Их судебная битва за свободу началась, и, хотя процесс занял более двух лет, Верховный суд США постановил, что менде незаконно удерживались в рабстве и перевозились на корабле, а потому подняли бунт с целью самозащиты. Суд велел освободить их, и 35 выживших вернулись в Африку.
Хотя в то время Гиббсу-младшему было всего два года, он вырос с пониманием, что математика служит универсальным языком. Впоследствии он использовал этот язык, чтобы распространить влияние и значимость начал термодинамики далеко за пределы истоков науки.
Как и многие его предшественники, Гиббс решил изучать термодинамику, поскольку не мог не обратить внимания на преобразующую силу паровых технологий. К середине XIX века Америка пережила бум железнодорожного строительства. Американская гражданская война, бушевавшая в 1863 году, когда Гиббс искал тему для своей диссертации, стала первым в истории конфликтом, в котором железные дороги играли главную роль в военной логистике, обеспечивая передвижение и снабжение войск. Итоговая победа Севера, как и победа Великобритании над Францией в Наполеоновских войнах, отчасти объяснялась более высоким уровнем развития паровых технологий. Гиббс написал диссертацию “О форме зубцов колес для зубчатой передачи”. После этого он подал заявку на патент на тормоз для железнодорожных вагонов.
Но прикладная наука не стала делом жизни Гиббса. В 1861 году его отец, Гиббс-старший, умер и оставил детям солидное состояние, включая ценные бумаги трех железнодорожных компаний Среднего Запада. Это наследство позволило Гиббсу и двум его сестрам отправиться в трехлетнее путешествие по Европе. Гиббс использовал поездку, чтобы раздвинуть свои научные горизонты. Хотя официально Гиббс не числился ни в одном европейском университете, он посещал лекции на разные темы – от абстрактной аналитической теории чисел до физики света, звука и тепла. В Гейдельберге он присутствовал на занятиях Германа Гельмгольца, который сформулировал закон сохранения энергии.
Вернувшись в Америку, Гиббс занял неоплачиваемую должность профессора математической физики в Йеле. Университет не давал ему жалованье, но Гиббс, к счастью, в нем не нуждался. Имея комфортный дом и богатое отцовское наследство, Джозайя Уиллард Гиббс готов был приступить к работе, которая увлекла его на десять лет.
* * *
Отцы термодинамики – Карно, Джоуль, Томсон и Клаузиус – считали, что их область науки занимается установлением взаимосвязи между теплотой и работой. Гиббс вывел термодинамику из столь узких рамок. Он показал, что все происходящее в материальном мире, от плавления твердых тел и кипения жидкостей до механизма химических реакций, подчиняется законам этой науки.
Но сначала научные амбиции Гиббса были весьма скромны. Он задался целью сделать недавно открытые законы более простыми для понимания. Его особенно тревожила концепция энтропии. Сам он понимал определение Томсона и Клаузиуса, которое гласило, что это мера рассеяния теплоты в любом веществе, но понимал ли его еще хоть кто-нибудь? “Понятие энтропии <…> несомненно, покажется многим надуманным и, возможно, даже оттолкнет начинающих”, – рассуждал он.
В первых двух научных статьях, опубликованных в 1873 году, Гиббс попытался решить эту проблему простым и логичным образом. Он нарисовал карты. Подобно тому, как географические карты позволяют нам мгновенно составить представление о рельефе, предложенные Гиббсом термодинамические карты показывают, как меняются свойства вещества при нагревании и охлаждении, растяжении и сжатии. Они демонстрируют начала термодинамики в действии в материальном мире.
Например, нагрейте воду в ковше на плите, измеряя ее температуру. Вы находитесь на уровне моря, а исходная температура воды составляет 20 °C. Она монотонно увеличивается по мере поступления теплоты в воду.
Затем начинается кипение. В ковше оказывается смесь воды и пара. Вы делаете важное наблюдение: температура перестала расти. Она остается на отметке 100 °C. Теплота от плиты продолжает передаваться ковшу, но это приводит к формированию пара, а не к дальнейшему нагреванию воды.
Когда вся вода превращается в пар, температура снова начинает повышаться.
Теперь представьте, что вы проводите аналогичный эксперимент в Ла-Ринконаде (Перу) – самом высокогорном городе в мире. Высота над уровнем моря там составляет 5100 метров, а атмосферное давление примерно вдвое ниже, чем на уровне моря. Вы заметите два отличия от эксперимента в первом месте: вода закипает при гораздо более низкой температуре, равной 83 °C, и дольше пребывает в форме водопаровой смеси. Дарвин обратил на это внимание, когда останавливался с ночевкой в Андах. Хотя картошка варилась всю ночь, к утру она была недостаточно мягкой для употребления в пищу.
Далее представьте, что происходит внутри скороварки. Крышка герметично закрывает кастрюлю, а потому при кипении воды направленное вниз давление пара на воду возрастает до двух атмосфер. Температура кипения воды повышается до 121 °C, но вода меньше времени пребывает в форме водопаровой смеси.
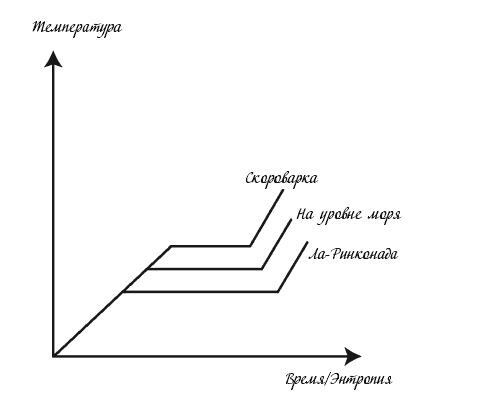
Как меняется температура воды при нагревании
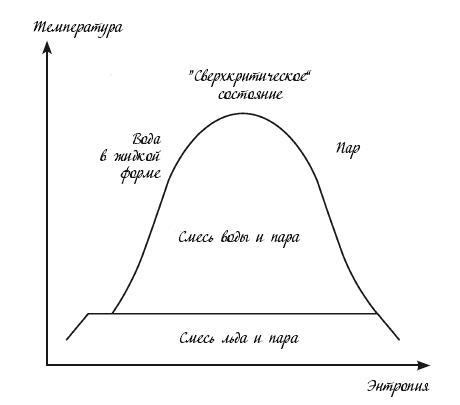
Термодинамическая карта воды и ее состояний
На соседней странице три этих эксперимента представлены на графике (горизонтальные линии соответствуют кипению воды и наличию водопаровой смеси в ковше).
Вспомните, что энтропия – это мера рассеяния теплоты в любом теле (в нашем примере – в воде в ковше).
Таким образом, ось времени в этом случае также представляет энтропию воды и пара. Теплота от горящего газа непрерывно поступает в воду и рассеивается в ней.
На втором графике показано, что увеличение энтропии может проявляться двумя способами: либо в форме повышения температуры, либо в форме преобразования воды в пар. В последнем случае увеличение энтропии проявляется в повышении доли воды, пребывающей в парообразном состоянии.
Повторяя эти измерения при разном давлении, мы получаем первую термодинамическую карту, которая показывает, как вода, лед и пар реагируют на нагревание и охлаждение в широком диапазоне условий. Слева от купола – значения температуры и давления, при которых вода пребывает в жидкой форме. Внутри купола – значения температуры и давления, при которых вода пребывает в форме водопаровой смеси. Справа – значения температуры и давления, при которых вода пребывает только в форме пара. Под куполом давление и температура так низки, что вода пребывает в форме смеси льда и пара. Над куполом давление и температура так высоки, что вода пребывает не в жидком и не в парообразном, а в так называемом сверхкритическом состоянии.
Переоценить важность этих диаграмм невозможно. Например, они широко применяются инженерами, которые проектируют электростанции, вырабатывающие большую часть мирового электричества. На многих из них установлены современные паровые двигатели, в которых теплота от угля, ядерных реакций, геотермальных источников и солнечного света используется для создания горячего пара высокого давления. В отличие от паровых машин XIX века, в двигателях пар не толкает поршень. Вместо этого он нагнетается на лопасти турбины, раскручивая их и питая электрогенераторы. Когда пар выполнил работу по раскручиванию турбины, он конденсируется обратно в воду, после чего процесс повторяется. Главное здесь – эффективность: нужно преобразовывать как можно больше доступной теплоты в электроэнергию. Благодаря Сади Карно инженеры знают, что легче всего добиться желаемого результата, сделав пар как можно более горячим. Но при этом они должны поддерживать структурную целостность компонентов электростанции.
Именно здесь неоценимую роль играют термодинамические диаграммы. Так, они сообщают инженерам, сколько именно тепловой энергии на электростанции поглощается водой при преобразовании в пар, какое давление оказывает этот пар и до какой температуры он разогревается. Диаграммы помогают инженерам определить оптимальную температуру для конденсации пара, выходящего из турбин. Это позволяет им максимизировать эффективность электростанции без ущерба безопасности ее работы.
Вы включаете свет, смотрите телевизор, жарите курицу в электрической духовке – и все это возможно во многом благодаря термодинамической диаграмме.
Но работа Гиббса не ограничивается генерацией энергии. Его графический подход с использованием диаграмм привлек внимание ученых и инженеров к так называемым фазовым переходам — преобразованию вещества, скажем, из жидкой формы в твердую или газообразную и наоборот. Термодинамическая диаграмма показывает, что фазовые переходы происходят при постоянной температуре, при которой энтропия вещества существенным образом меняется. Иными словами, как ни парадоксально, во время таких переходов вещества могут поглощать теплоту, не становясь теплее, и выделять теплоту, не становясь холоднее. Мы отметили, что вода кипит при постоянной температуре в 100 °C. Подобным образом при охлаждении пар, температура которого составляет, скажем, 120 °C, начинает конденсироваться обратно в воду, когда его температура снижается до 100 °C. При этом температура остается неизменной, пока в воду не превращается весь пар. Только после этого температура снова начинает снижаться. Поняв принципы фазового перехода, люди научились творить холод.
Археологические источники свидетельствуют, что наши предки овладели огнем около миллиона лет назад. Делать лед было гораздо сложнее, и охлаждение стало не слишком впечатляющей, но незаменимой технологией современной эпохи. Охлаждение – самое несомненно термодинамическое из всех изобретений человека. Оно также сильнее всех противоречит универсальной тенденции к увеличению энтропии. При работе холодильника теплота идет из холодной зоны внутри в теплую зону снаружи, то есть в направлении, противоположном тому, в котором она движется самопроизвольно. Цель при этом состоит в том, чтобы создать пространство, где будет замедлено неумолимое увеличение энтропии. Хотя, по сути, холодильник – это охлаждающий контейнер, охлаждение служит более важной цели, которая заключается в том, чтобы замедлить процессы гниения и разложения, служащие примерами увеличения энтропии. Следовательно, холодильник можно считать устройством, внутри которого время замедляется.
Сложно переоценить его важность для человеческого прогресса и благосостояния. Значительно увеличив время безопасного хранения и транспортировки продуктов, холодильник привел к самому значительному улучшению человеческого питания с тех пор, как наши доисторические предки открыли, что термическая обработка пищи убивает бактерии. Теперь мы питаемся более безопасной и здоровой пищей, чем когда-либо ранее, а кроме того, охлаждение играет важнейшую роль в широком распространении вакцин, которые спасают миллионы людей от преждевременной смерти и болезней. Паровой двигатель часто называют изобретением, которое стало катализатором Промышленной революции, но холодильник не сильно уступает ему по значимости.
Консервирующие свойства холода были известно давно, но лишь в начале XIX века “заготовка льда” превратилась в международный бизнес. Фредерик Тюдор, бостонский “Ледяной король”, по завершении Войны за независимость стал одним из первых американских миллионеров, поставляя лед из Новой Англии на Карибские острова, в Европу и даже в Индию. На пике развития отрасли в американской торговле льдом работало около 90 тысяч человек. Норвегия экспортировала миллион тонн льда ежегодно, добывая его в системе искусственных озер.
Но можно ли производить лед? Многие совершали такие попытки, надеясь использовать тот факт, что жидкости при испарении оказывают охлаждающий эффект. В конце концов, именно поэтому мы потеем. В 1750-е годы многие, включая Бенджамина Франклина, обратили внимание, что если при комнатной температуре испаряется диэтиловый эфир, который использовался в качестве растворителя, то окружающая среда охлаждается сильнее, чем если в тех же условиях испаряется вода.
Лишь век спустя появились машины, в которых этот эффект стал применяться в промышленном масштабе. Одна, сконструированная в Австралии эмигрантом из Шотландии Джеймсом Харрисоном, который явно изнывал от жары на новом месте жительства, производила в день по несколько тонн льда. Такие устройства, ставшие предками современных холодильников, с помощью энергии пара прокачивали жидкость по спирали трубок, охватывающих резервуар с водой, которая превращалась в лед по мере испарения идущего по трубкам эфира.
Первые холодильники приобретали пивоварни, которые тем самым оставляли очередной след в истории физики. Брожение лагера проходит при температуре около 0 °C, а доступность искусственного льда позволяла варить такое пиво даже жарким летом. В 1870-е годы, когда Джозайя Уиллард Гиббс писал статьи по термодинамике, первые корабли, оснащенные механическими холодильниками, или рефрижераторные суда, стали перевозить замороженное мясо и птицу через Атлантику. В похоронных бюро системы искусственного охлаждения стали использовать для замедления разложения трупов.
Как и прежде, когда появились паровые машины, пионеры охлаждения не уделяли особого внимания физике, лежавшей в основе работы их изобретений. Но впоследствии – опять же как с паром – ситуация изменилась. Физика и техника объединились, когда за дело взялся немецкий ученый, инженер и предприниматель Карл Линде. Рожденный в Баварии в 1842 году, он изучал инженерное дело в Швейцарском федеральном технологическом институте, где среди его преподавателей был один из отцов-основателей термодинамики Рудольф Клаузиус. Затем Линде переехал в Мюнхен, где стал профессором на кафедре машиностроения в Высшей технической школе. (У него учился Рудольф Дизель.)
Линде направил свой талант и знание термодинамики на изучение принципов охлаждения. К 1875 Г°ДУ он использовал термодинамические диаграммы вроде тех, что предложил Гиббс, чтобы повышать эффективность холодильников. Теоретически эти диаграммы показывают поведение любого вещества при нагревании и охлаждении, и Линде с большим успехом экспериментировал с такими химическими соединениями, как аммиак. В 1879 году он оставил преподавание и основал в Висбадене “Компанию Линде по производству холодильных машин”. Его машины были гораздо лучше, чем машины конкурентов, и за десять лет он продал 12 ооо аппаратов в родной Германии и около 750 – в Америке, в основном обеспечивая пивоваров. В 1892 году владельцы дублинской пивоварни “Гиннесс” поинтересовались, может ли Линде поставить им жидкий углекислый газ, чтобы сделать пивную пену плотнее. Это подтолкнуло Линде изучить сжижение воздуха, и он преуспел в этом, достигнув температуры ниже -140 °C. Это, в свою очередь, позволило в промышленных масштабах производить чистый кислород и азот. Массовая электрификация домов в начале XX века сделала домашние холодильники реальностью.
Холодильники, особенно домашние, эксплуатируют физику фазовых переходов. В качестве хладагентов в них используются летучие вещества, которые кипят на низкой температуре около 4 °C. За внутренней стенкой холодильника находится сеть трубок, называемая испарителем. Внутри нее хладагент испаряется, забирая теплоту из устройства при постоянной температуре 4 °C. Но если учесть, что теплота никогда самопроизвольно не движется из холодной зоны в горячую, то как в таком случае заставить новый газ-хладагент, температура которого составляет всего 4 °C, испускать теплоту в окружающую среду, где обычно гораздо теплее – как правило, на 20 °C?
Для этого хладагент пропускают через устройство, называемое компрессором, которое представляет собой противоположность цилиндру паровой машины. В цилиндре теплота преобразуется в работу при расширении газа. В компрессоре работа преобразуется в теплоту при сжатии газа. Когда таким образом накапливается достаточно теплоты, чтобы температура пара хладагента оказалась гарантированно выше температуры комнаты, теплота запускается в конденсатор – сеть трубок на задней стенке холодильника. Там пар испускает в окружающую среду теплоту, которая была внутри холодильника, а также теплоту, созданную в компрессоре. Поднесите руку к задней части холодильника – и вы ощутите эту совокупную теплоту.
Когда конденсатор испускает теплоту, в нем происходит очередной фазовый переход: хладагент превращается обратно в жидкость. Но его температура довольно высока и равняется температуре в комнате. Чтобы процесс охлаждения продолжался, температура хладагента должна снова снизиться до 4 °C, прежде чем он сможет вернуться в испаритель. Для этого жидкий хладагент проходит сквозь крошечный клапан, называемый терморегулирующим вентилем. Когда хладагент подается сквозь этот вентиль, его давление и температура падают, после чего он готов для возвращения в испаритель.
Благодаря компрессору холодильник подчиняется второму началу термодинамики. Теплота выходит из холодильника, уменьшая энтропию внутри устройства. Но в качестве компенсации общее количество теплоты, выходящее из конденсатора, увеличивает энтропию комнаты. Таким образом, мы платим за небольшое пространство уменьшенной энтропии у нас на кухне повышением скорости, с которой увеличивается энтропия Вселенной.
* * *
В 1873 году Гиббс не догадывался, к каким эпохальным сдвигам приведут его статьи. Скромный и непритязательный, он отправил свою работу в малоизвестный журнал Transactions of the Connecticut Academy of Arts and Science (“Труды Академии искусств и наук Коннектикута”), который не читали за пределами Йеля. Более того, поскольку статьи Гиббса были длиннее стандартных публикаций в Transactions и содержали математические формулы, стоимость их верстки превышала бюджет журнала. Чтобы покрыть расходы, редакционный совет обращался за пожертвованиями к другим преподавателям и местным бизнесменам. Один из членов совета, Э. Э. Веррил, впоследствии вспоминал, что на заседаниях велись долгие споры о значимости работ Гиббса, хотя никто в совете не понимал их сути. “И все же мы все верили, что написанное Гиббсом обладает истинной ценностью в его области науки. В связи с этим мы изыскивали средства и публиковали каждую статью в первоначальном виде”.

