Книга: Пять литров красного. Что необходимо знать о крови, ее болезнях и лечении
Назад: Глава 28 Арсенал природы и моноклональные антитела
Дальше: Глава 30 Зачем нужны клинические исследования?
Глава 29
Вирусы-аптекари, или Лекарства на заказ
Завершить раздел про лечение онкогематологических заболеваний я хочу рассказом о передовых методах терапии. Возможно, за ними будущее фармацевтики, но об этом нам еще предстоит узнать, и надеюсь, что совсем скоро.
Передовая терапия (от англ. аdvanced therapy) – это самые последние и инновационные методы лечения, основанные на достижениях клеточных и генных технологий. Препараты для передовой терапии отличаются от малых молекул и биопрепаратов тем, что представляют собой живые клетки или генетические конструкции, что дает возможность воздействовать на процессы в организме с небывалой ранее эффективностью. Это открывает возможности излечивать болезни, перед которыми традиционная фармацевтика оказалась бессильна. Передовая терапия включает в себя два основных способа – генная и клеточная терапии.
Сегодня генная терапия применяется в основном для лечения редких генетических врожденных заболеваний: бета-талассемии, серповидно-клеточной анемии; ведутся разработки по лечению меланомы,.
Принцип генной терапии состоит во введении генетического материала в клетки с целью лечения определенного заболевания. Для этого чаще всего используют вирусы; некоторые из них в природе способны внедрять свои гены в геном зараженных животных, что впервые было обнаружено еще в начале XX века.
В генной терапии такая инвазия используется для исправления дефектов в генах, которые могут быть врожденными (генеративные мутации при наследственных заболеваниях) или приобретенными (соматические мутации в опухолевых клетках). Специально модифицированный вирус (вектор) вводится в организм больного человека, где, проникая в клетки, внедряет здоровый генетический материал, нормализуя состояние белков, то есть превращая их из больных в здоровые, тем самым уменьшая или сводя на нет последствия болезни.
Самой распространенной и изученной методикой считается технология редактирования генов CRISPR/Cas9, за которую ее разработчики Дженнифер Даудна (род. 1964) и Эмманюэль Шарпантье (род. 1968) получили Нобелевскую премию в 2020 году.
CRISPR/Cas9 – это изначально сформированный эволюцией «бактериальный иммунитет» – встроенная в бактерию система защиты от опасных для нее бактериофагов. Память о них хранится в участке генома бактерии, названном CRISPR, состоящем из повторяющихся участков и так называемых спейсеров, идентичных фрагментам ДНК когда-то атаковывавших бактерию фагов. При транскрипции CRISPR образуется длинная молекула РНК, которая разрезается на короткие РНК-гиды, содержащие спейсеры и часть повторяющегося участка. РНК-гид связывается с белком Cas9, и, когда фаг попадает в бактериальную клетку, этот комплекс связывается со «знакомыми» ему частями ДНК фага и разрезает обе цепи ДНК, что приводит к гибели вируса.
Если упростить, то это такие ножницы, которые позволяют не только удалять ненужные гены, но и вставлять на их место другие. Для этого нужно «запрограммировать» CRISPR/Cas9, чтобы она удаляла те гены, которые мы хотим, а также добавить ферменты, восстанавливающие ДНК.
Исследователи научились использовать этот созданный природой хитроумный механизм для исключительно точного редактирования генома – вплоть до возможности вырезания всего одного нуклеотида. Очевидно, что такой метод имеет бóльшую разрешающую способность, чем ныне используемые методы генной терапии, и его внедрение в медицинскую практику несет в себе огромный терапевтический потенциал в лечении самых разных заболеваний: наследственных, онкологических, вирусных, в частности ВИЧ/СПИД.
Уже сегодня эта технология применяется для лечения множества заболеваний – от ВИЧ-инфекции до врожденной слепоты и некоторых онкологических заболеваний. А недавно терапию на основе CRISPR/Cas9 признали эффективной при гемофилии А.
Другой перспективной методикой генной терапии считается CAR-T-клеточная терапия.
Для лечения некоторых онкогематологических заболеваний уже сегодня успешно применяют терапию генно-модифицированными Т-клетками с химерными рецепторами антигена (chimeric antigen receptor T-cell, CAR-T). Преимущества этого лечения связаны с использованием и усилением естественного биологического механизма защиты организма от периодически появляющихся злокачественных клеток (иммунного противоопухолевого ответа).
Суть этого метода заключается в том, что в крови человека присутствуют T-лимфоциты – клетки иммунной системы, способные идентифицировать и уничтожать другие клетки. Каждый T-лимфоцит имеет на своей поверхности рецепторы, способные связываться с антигенами на поверхности чужеродных или аномальных клеток (в том числе опухолевых). Процесс лечения выглядит следующим образом:
1. У пациента берут кровь из вены и выделяют из нее T-лимфоциты.
2. При помощи вирусов внедряют в эти клетки гены, кодирующие так называемые химерные рецепторы вместо обычных. Химерными такие рецепторы называют в честь все той же Химеры. Точно так же рецепторы модифицированных Т-лимфоцитов состоят из разных фрагментов. Эта доработка позволяет T-лимфоцитам лучше «нацеливаться» на опухолевые клетки, способствует улучшению активации и деления, а также повышает выживаемость модифицированных T-лимфоцитов.
3. Количество модифицированных T-лимфоцитов наращивается до терапевтической дозы.
4. T-лимфоциты с химерными рецепторами вводят обратно в организм пациентов. Там они запускают сильную иммунную реакцию: находят и уничтожают опухолевые бласты, содержащие на своей поверхности целевой антиген, например CD19.
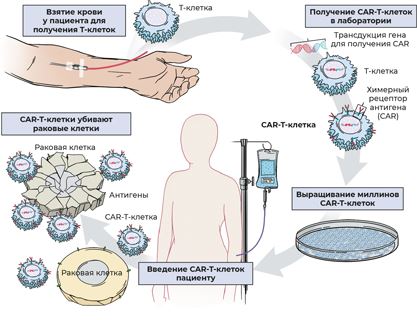
Рис. 29. Схематическое изображение процесса создания CAR-T-клеток
К 2020 году были одобрены к применению два препарата, работающие по принципу CAR-T-клеточной терапии: тисагенлеклейсел (торговая марка Kymriah) от Novartis для лечения острого лимфобластного лейкоза и диффузной B-крупноклеточной лимфомы и аксикабтаген силолейсел (торговая марка Yescarta) от Gilead. Разумеется, это не лекарства, сходящие с серийного конвейера и хранящиеся на складе, в данном случае фармацевтические компании продают курс лечения персонализированным препаратом, цикл изготовления которого в случае тисагенлеклейсела занимает 22 дня.
Такие высокотехнологичные препараты открывают поистине огромные возможности, в то же время пока эти методы имеют и свои недостатки, основные из которых – различные побочные эффекты, приводящие иногда даже к летальному исходу. Еще один значимый минус – заоблачная стоимость такого лечения. Например, Zolgensma от спинальной мышечной атрофии сейчас самое дорогое лекарство в мире стоимостью $2,1 миллиона. К этому списку стоит добавить недостаточный период наблюдений за последствиями использования генной терапии, приводящий к неуверенности в долговременности ее эффекта, а также опасения по поводу отдаленных негативных последствий применения таких лекарств.
Несмотря на это, генная терапия все больше входит в клиническую практику, и чем дальше – тем больше. Эксперты FDA прогнозируют, что уже к середине 2020-х годов это ведомство будет одобрять в год от 10 до 20 препаратов генной и клеточной терапий, что, очевидно, позволит закрыть многие неудовлетворенные потребности и даст надежду людям с ранее неизлечимыми заболеваниями.
У этих новых и прогрессивных методов есть потенциал, чтобы помочь при самых разных болезнях, но практически генная терапия уже проявила себя в лечении онкологических и моногенных наследственных заболеваний. И здесь кроется один из самых сложных и пока не принятых вызовов: очень часто мы просто не знаем, какие именно гены и каким образом влияют на развитие тех или иных болезней, а потому и направлено такое лечение сейчас главным образом на заболевания, генетические дефекты при которых уже локализованы исследователями, например на гемофилию, бета-талассемию и серповидноклеточную анемию.
Генотерапевтические подходы находятся в самом начале пути, новые методы лечения, основанные на внедрении функциональных генов (или даже на полноценном редактировании генома), способны кардинально изменить существующие терапевтические стратегии и обеспечить эффективную помощь при многих ныне безнадежных заболеваниях.
Надеюсь, мне удалось вас убедить, что открытие принципиально нового вида лечения в гематологии и онкологии всегда высоко оценивалось научным миром; именно поэтому онкология находится на переднем краю науки, и изучать ее очень интересно, ведь новые открытия в ней происходят чуть ли не каждый день.
Лекарственная терапия в гематологии не ограничивается приведенными группами препаратов и названий, я описал лишь самые часто упоминаемые и эффективные. На самом деле их гораздо больше, например ингибиторы протеасом, ингибиторы деацетилаз, интерфероны, даже мышьяк (в виде триоксида мышьяка, известного алхимикам как «белый мышьяк») до сих пор используется как химиопрепарат.
Назад: Глава 28 Арсенал природы и моноклональные антитела
Дальше: Глава 30 Зачем нужны клинические исследования?

