Книга: Пять литров красного. Что необходимо знать о крови, ее болезнях и лечении
Назад: Глава 7 Беседа и осмотр
Дальше: Глава 9 Как оценить функцию костного мозга? Биопсия: что это такое и для чего ее выполняют?
Глава 8
Клинический анализ крови: как «счесть жемчужины в море полуденном»?
После общения и осмотра пациента врач-гематолог обязательно заглянет в результаты анализа крови или назначит его, если он не был выполнен ранее. В арсенале современного гематолога анализы крови играют важную роль, ведь зачастую причиной обращения становятся именно случайно обнаруженные изменения. Я ежедневно оцениваю от 20 до 30 анализов крови. Для диагностики особенно важны свежие данные, а для отслеживания результатов лечения или для понимания истории развития болезни могут пригодиться более ранние.
Есть пациенты, которые бережно хранят все свои анализы, собирая многотомную историю болезни. Иногда такая «отчетность» выглядит очень солидно, чувствуется рука профессионала. Например, у меня был пациент-бухгалтер, который предоставил результаты анализов за последние 20 лет в виде таблицы Excel. Как правило, такие детальные отчеты нам не нужны, потому что организм человека – система постоянно меняющаяся. Что было, то сплыло, наша задача – работать с тем, что происходит сейчас.
Базовые и самые часто используемые тесты – клинический и биохимический анализы крови. Это относительно простые и быстрые, но очень информативные исследования, на основе которых врач ставит предварительный диагноз и принимает решение о дальнейших обследованиях или, возможно, сразу назначает лечение.
Вероятно, вы слышали другие названия клинического анализа крови: общий анализ крови, общеклинический анализ крови – и сокращения ОАК, КАК. Все это синонимы. Сейчас этот анализ включает в себя определение количества:
 лейкоцитов;
лейкоцитов; эритроцитов (гемоглобина);
эритроцитов (гемоглобина); тромбоцитов.
тромбоцитов.Также в рамках анализа определяется гематокрит – это отношение объема всех форменных элементов крови (то есть клеток крови) к общему объему крови. Так как 98 % всех клеток по объему – эритроциты, то, по сути, это объемная доля эритроцитов в крови. Такие показатели определяются на автоматическом анализаторе в венозной или капиллярной крови, и они являются наиболее важными. Отклонения от нормы по любому из этих пунктов могут стать сигналом тревоги.
Анализы крови сдаются не только для постановки диагноза, но и ради отслеживания прогресса в лечении или контроля работы костного мозга на фоне какой-нибудь агрессивной терапии, которая может ему повредить.
Что нормально, а что нет?
Я работаю гематологом уже более 10 лет и вот к какому выводу пришел: на сегодняшний день во всем мире не существует общепринятых норм клинического анализа крови.
Я постараюсь объяснить, почему это происходит.
Для начала определимся, что такое норма в биологии и медицине.
Норма – нахождение в диапазоне допустимых значений для здоровых людей с доверительной вероятностью 95 % (стандартное требование к надежности статистических обобщений). Почему мы оперируем понятием вероятности? Мы не можем измерить уровень гемоглобина у всех здоровых людей (они составляют то, что в статистике называется генеральной совокупностью) и, проводя измерения для какой-то ограниченной группы (выборки), должны распространить наши результаты на всех, для чего при обработке результатов с использованием методов математической статистики определяем доверительный интервал, исходя из разброса показателей, размера выборки и доверительной вероятности. Принято считать, что нормальным уровнем гемоглобина для мужчин будет значение между 120 и 160 г/л (это 95 %-ный доверительный интервал). Однако не всегда небольшое отклонение от нормы надо рассматривать как показатель болезни, существует вероятность 5 %, что у здорового человека показатель окажется за пределами этого диапазона.
Вспоминаю по этому поводу одну историю. Однажды ко мне на прием пришел пациент и с порога заявил, что его не устраивают порядки в нашей поликлинике: консультации он ждал две недели, в регистратуре ему отказали в постановке на диспансерный учет, а в очереди он прождал лишних 7 минут и 46 секунд. На излете последних слов я настроился на тяжелый разговор. Я поздоровался и спросил, что послужило причиной обращения к гематологу, и он достал из двухтомного сборника своей истории болезни свежий клинический анализ крови.
– Вот, полюбуйтесь! – Голос его звучал расстроенно.
Я внимательно изучил результаты анализа.
– Не вижу никакой патологии.
– Ну как же вы не видите?! А там «писити» понижен на две десятых!
Я еще раз посмотрел на результаты – и там действительно напротив параметра «PCT» стояла жирная красная стрелка, направленная вниз. Облегченно вздохнув, я улыбнулся про себя. Дело в том, что так называемый «писити», или PCT – plateletcrit, или тромбокрит, – это параметр, который считается на автоматическом анализаторе и отображает объемную долю тромбоцитов в цельной крови (в процентах). На него в общем-то сейчас не особо обращают внимание. Мы в основном ориентируемся на реальное количество тромбоцитов в единице объема (в «штуках» на литр). Их в норме должно быть от 150×109/л до 400×109/л. И с этим показателем у пациента все было в порядке. Поэтому оставшиеся 20 минут приема я потратил на объяснение состава крови пациенту, и он ушел счастливым, уяснив, что ему не надо наблюдаться у гематолога.
Кроме того, в разных лабораториях нормы иногда могут незначительно отличаться. Это, как правило, связано с технологическими особенностями изготовления реактивов и со страной, где вы сдаете анализ. Поэтому смотреть нужно не на нормы, опубликованные в интернете, а именно на цифры, указанные в бланке, который вы получите после диагностики. Кстати, любые попытки самодиагностики по интернету – верный путь к панике и развитию ипохондрии. Не верите – послушайте песню «Never google your symptoms» в исполнении шведского врача Хенрика Видегрена ().
Возвращаясь же к результатам анализов, надо помнить и о том, что существуют разные единицы измерения. Прежде чем сравнивать несколько анализов, сделанных в разных лабораториях, смотрите на величины, в которых выражены результаты. Например, гемоглобин иногда измеряют в г/л, а иногда в г/дл, при этом 14 г/дл будет соответствовать 140 г/л. В такой ситуации все просто – надо одно значение просто умножить на 10, но в большинстве случаев переводить из одних единиц в другие несколько сложнее.
И наконец, существует разница при оценке венозной и капиллярной крови,.
Также не следует забывать, что каждый живой организм уникален, поэтому нельзя рассчитывать на то, что показатели крови у всех нас будут совпадать даже при отсутствии болезней. Например, сильно меняется качество крови и отчасти работа костного мозга у спортсменов, которые занимаются бодибилдингом. Их трудно не заметить или с кем-то перепутать: если такой пациент приходит на прием, можно сразу предсказать, какие отклонения в показателях у него будут наблюдаться, – и это будет его норма. Во-первых, бодибилдеры применяют много фармакологических препаратов, в том числе эритропоэтин, благодаря которому у них будет повышенный уровень эритроцитов и гемоглобина. Во-вторых, так как они насилуют себя адскими физическими нагрузками, у них будет повышен уровень лейкоцитов – для этого отклонения есть специальное название: «миогенный лейкоцитоз», то есть избыточное количество лейкоцитов, спровоцированное ростом мышц. Когда человек качается, возникают микротравмы мышц (это необходимое условие их роста). Организм думает, что это что-то нездоровое, и начинает вырабатывать лейкоциты. Плюс к этому, если человек придет сдавать анализы непосредственно после зала, то у него будет повышен гематокрит – клеток крови будет много, а плазмы мало, потому что во время нагрузок организм теряет жидкость, а значит, кровь сгущается. Итого: лейкоцитоз, повышенный уровень гемоглобина и высокий гематокрит – и если все это сочетается с грудой мышц, которые просвечивают под футболкой, то врач признает это за норму, не требующую лечения. Тогда как у человека с другим телосложением это может быть показателем болезни.
Отклонения от обычных показателей связаны не только со спортом. Есть множество других факторов, которые влияют на состав крови, например:
 Пол человека – содержание эритроцитов, гемоглобина и гематокрит выше у мужчин.
Пол человека – содержание эритроцитов, гемоглобина и гематокрит выше у мужчин. Возраст – результаты анализа крови у детей существенно отличаются от показателей взрослых. При старении снижается уровень гемоглобина и содержание эритроцитов, увеличивается средний объем эритроцита.
Возраст – результаты анализа крови у детей существенно отличаются от показателей взрослых. При старении снижается уровень гемоглобина и содержание эритроцитов, увеличивается средний объем эритроцита. Раса – у негроидов количество лейкоцитов и нейтрофилов ниже, чем у европеоидов.
Раса – у негроидов количество лейкоцитов и нейтрофилов ниже, чем у европеоидов. Место жительства – содержание эритроцитов, гемоглобина и гематокрит выше у лиц, постоянно проживающих в высокогорных областях (на высоте более 2500 м над уровнем моря).
Место жительства – содержание эритроцитов, гемоглобина и гематокрит выше у лиц, постоянно проживающих в высокогорных областях (на высоте более 2500 м над уровнем моря). Время суток и года – например, утром у нас в крови выше содержание гемоглобина, а во второй половине дня – больше лейкоцитов, нейтрофилов и тромбоцитов, поэтому исследования целесообразно производить в одно и то же время. Что касается времен года, то содержание гемоглобина, эритроцитов и гематокрит ниже летом.
Время суток и года – например, утром у нас в крови выше содержание гемоглобина, а во второй половине дня – больше лейкоцитов, нейтрофилов и тромбоцитов, поэтому исследования целесообразно производить в одно и то же время. Что касается времен года, то содержание гемоглобина, эритроцитов и гематокрит ниже летом. Беременность – во время нее количество лейкоцитов, нейтрофилов и моноцитов повышается, а содержание тромбоцитов, эритроцитов, гемоглобина и гематокрит снижаются, причем степень изменения зависит от срока беременности.
Беременность – во время нее количество лейкоцитов, нейтрофилов и моноцитов повышается, а содержание тромбоцитов, эритроцитов, гемоглобина и гематокрит снижаются, причем степень изменения зависит от срока беременности. Физическая нагрузка и прием пищи приводят к лейкоцитозу – повышенному количеству лейкоцитов.
Физическая нагрузка и прием пищи приводят к лейкоцитозу – повышенному количеству лейкоцитов. Курение и прием алкоголя. У хронических курильщиков большинство параметров повышено. А прием алкоголя, напротив, может приводить к дефициту клеток крови – особенно тромбоцитов.
Курение и прием алкоголя. У хронических курильщиков большинство параметров повышено. А прием алкоголя, напротив, может приводить к дефициту клеток крови – особенно тромбоцитов. Медикаменты, лечебные и диагностические процедуры могут вызывать различные изменения гематологических показателей. Например, глюкокортикостероиды вызывают рост количества нейтрофилов, а обычная таблетка «от головы» – нестероидный противовоспалительный препарат – может повлечь за собой дефицит лейкоцитов.
Медикаменты, лечебные и диагностические процедуры могут вызывать различные изменения гематологических показателей. Например, глюкокортикостероиды вызывают рост количества нейтрофилов, а обычная таблетка «от головы» – нестероидный противовоспалительный препарат – может повлечь за собой дефицит лейкоцитов.Приведу ориентировочные показатели общеклинического анализа крови у взрослых людей.
Таблица 1
Общеклинический анализ крови у взрослых 18–45 лет
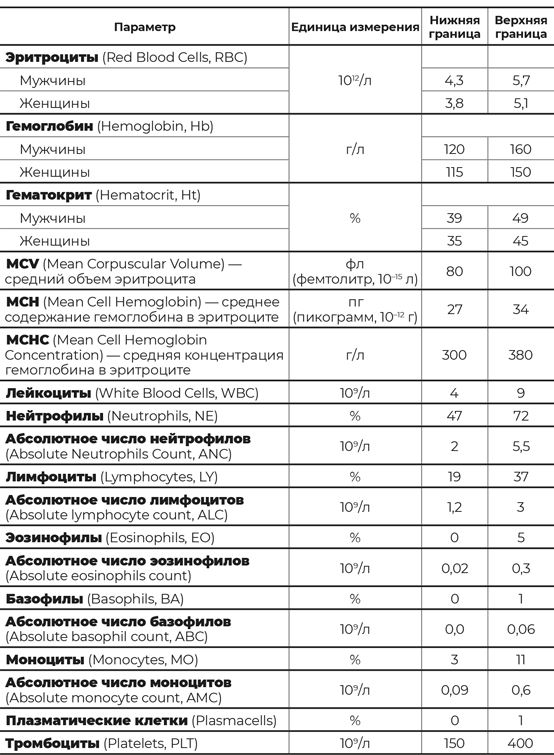
Обращаю ваше внимание на то, что нормы приведены для взрослых людей, потому что у детей нормы значительно отличаются и лечением детей с заболеваниями крови занимаются детские гематологи.
Помимо количественных показателей, крайне важна морфология клетки, то есть ее внутренняя архитектура: как расположено внутри ядро, как выглядит цитоплазма, какие в ней есть гранулы. Изменение обычной формы клеток и их размеров также указывает на наличие определенных патологических процессов в организме.
И еще для точной диагностики изменений часто проводят анализ лейкоцитарной формулы. Как мы помним, в группу лейкоцитов входит большое количество разных клеток – эозинофилы, базофилы, моноциты и другие, и их соотношение при болезнях может меняться.
Как открыли форменные элементы крови
Прежде чем затронуть тему клинического анализа крови, все же необходимо провести краткий экскурс в историю открытий и исследования форменных элементов крови. Этим открытиям предшествовало изобретение оптических микроскопов в середине XVII века. Первый оптический микроскоп, состоявший из нескольких линз, был сконструирован в 1619 году нидерландским изобретателем Корнелиусом Дреббелем (1572‒1633), а на его основе в 1624 году Галилео Галилей (1564‒1642) создал свой микроскоп, увеличивавший всего в девять раз. Широкую известность получил микроскоп английского естествоиспытателя Роберта Гука (1635‒1703) с 30-кратным увеличением. Используя подобные несовершенные микроскопы, нидерландский естествоиспытатель Ян Сваммердам (1637‒1680) обнаружил в 1658 году «красные шарики» в крови лягушки. Надо отметить, что диаметр лягушачьих эритроцитов в три раза больше диаметра человеческих. Человеческие эритроциты первым в 1666 году наблюдал итальянский анатом Марчелло Мальпиги (1628‒1694), но ограничился кратким упоминанием. В 1674 году нидерландский натуралист Антони ван Левенгук (1632‒1723) создал микроскоп, в котором использовалась всего одна линза, но очень высокого качества, что позволяло добиться увеличения в 275 раз. Исследовав образец своей собственной крови, он обнаружил там красные тельца, которые подробно описал и назвал глобулами (шариками), так же, как Сваммердам и Мальпиги, ошибочно считая их сферическими. Лишь век спустя английский хирург Уильям Хьюсон (1739‒1774) (кстати, впервые выделивший из крови фибрин) продемонстрировал, что эритроциты представляют собой диски, а не шарики.
Впрочем, роль эритроцитов в жизнедеятельности организма еще долго оставалась загадкой. Лишь в 1839 году немецкий химик Фридрих Хюнефельд (1799‒1882) обнаружил в крови обыкновенного дождевого червя кристаллизующееся вещество, которое он назвал кристаллами крови. В вышедшей в 1840 году книге «Химизм в организации животных» (Chemismus in der thierischen Organisation) он высказал предположение, что красные кровяные тельца поглощают кислород и что кристаллы крови – это железосодержащий белок. Роль эритроцитов в транспорте кислорода окончательно удалось установить в 1864 году немецкому химику Феликсу Хоппе-Зейлеру (1825‒1895), открывшему обратимую оксигенацию (насыщение кислородом) гемоглобина; кстати, авторство термина «гемоглобин» принадлежит как раз ему.
В отличие от эритроцитов обнаружить в крови лейкоциты оказалось сложнее, ведь эти бесцветные тельца близки по размеру к эритроцитам, а концентрация их в крови на три порядка ниже концентрации эритроцитов, притом что пробы крови для микроскопии обычно разводили водой.
Первыми описали лейкоциты французские врачи Жозеф Льето (1703‒1780) и Жан-Батист Сенак (1693‒1770) в 1749 году (независимо друг от друга) и уже упоминавшийся нами Уильям Хьюсон в 1773 году, но эти исследования прошли незамеченными, и повторно лейкоциты открыли в 1843 году независимо друг от друга французский врач Габриэль Андраль (1797‒1876) и британский медик Уильям Аддисон (1802‒1881).
Следующий прорыв в изучении лейкоцитов произошел в 1879 году, когда Пауль Эрлих придумал метод окраски мазков крови и дифференциального подсчета клеток крови. Он выделил три типа незернистых (лимфоциты, мононуклеары, переходные формы) и пять типов зернистых (нейтрофилы, эозинофилы, мелкозернистые базофилы, грубозернистые базофилы, бета-амфиофильнозернистые клетки) лейкоцитов. Морфологию белых кровяных телец подробно исследовал немецкий гематолог Йозеф Арнет (1873‒1955), выделивший до 80 морфологических типов лейкоцитов, за что навлек на себя упреки клиницистов в излишнем теоретизировании.
В общем-то критика в адрес Арнета была справедлива, ведь, поднаторев в области морфологии лейкоцитов, исследователи вплоть до 1960-х годов не особо продвинулись в понимании роли, например, лимфоцитов. Лишь в 1961 году австралийский исследователь Жак Миллер (род. 1931) открыл роль тимуса в обучении лимфоцитов-киллеров («тимус-зависимых клеток»), и примерно тогда же у куриц обнаружили, что их орган, так называемая фабрициева сумка (лат. Bursa fabricii), вырабатывает лимфоциты, генерирующие антитела (о них мы дальше поговорим подробнее). У человека подобного органа нет, но аналогичные человеческие лимфоциты для простоты называли «бурсозависимыми клетками». В 1969 году британский иммунолог Айвен Ройт (род. 1927) для еще большей простоты обозвал их T-лимфоцитами и B-лимфоцитами.
Как и в случае с эритроцитами и лейкоцитами, открытие тромбоцитов представляет собой запутанную историю. Впервые их описал в 1842 году французский врач Альфред Донне (1801‒1878), а в 1865 году его открытие повторил немецкий анатом Макс Шульце (1825‒1874), но другие ученые сочли их в силу малых размеров либо остатками разрушающихся эритроцитов или лейкоцитов (тут они в каком-то смысле были правы: как мы уже говорили выше, это «осколки» мегакариоцитов), либо родоначальниками эритроцитов. В 1881 году итальянский биолог Джулио Бидзодзеро (1846‒1901) открыл тромбоциты у амфибий и назвал их маленькими бляшками и кровяными пластинками. Связь кровяных пластинок с тромбозом, обнаруженная Бидзодзеро в ходе экспериментов на животных, привела к признанию тромбоцитов отдельным форменным элементом крови. В русской медицинской литературе в отношении тромбоцитов долгое время употреблялся термин «бляшки Биццоцеро» (так писали его фамилию раньше).
Исследование форменных элементов крови было связано с установлением того факта, что при различных заболеваниях количество и морфологические признаки клеток крови изменяются. Это обстоятельство и предопределяет то, что кровь является самым широко исследуемым первичным биоматериалом в лабораторной диагностике.
Как проводился анализ крови в прошлом веке
Для анализа крови, конечно же, надо было сдать кровь. Обычно брали так называемую капиллярную кровь из мякоти безымянного пальца, предварительно протерев кожу ваткой со спиртом и уколов его скарификатором-копьем (приятного в этом было мало). Это требовало определенных навыков: в зависимости от толщины кожи нужна разная глубина прокола. Первую каплю крови вытирали сухим ватным шариком и приставляли к ранке по очереди капилляр Панченкова и несколько пипеток, из которых набранную кровь выдували в подготовленные пробирки. И в довершение всего каплю крови наносили на сухое предметное стекло, а затем шлифовальным стеклом размазывали тонким равномерным слоем для приготовления мазка. Забор крови из вены, не имевший таких ограничений по объему пробы и не вносивший искажения в состав анализируемой крови, как при заборе из пальца, был более сложным делом и назначался реже.
Для определения скорости оседания эритроцитов (СОЭ) кровь из капилляра Панченкова выдували в пробирку (или часовое стекло), частично заполненную 5 %-ным раствором цитрата натрия, затем образующуюся смесь набирали вновь в капилляр, который закрепляли в штативе. Смесь крови и цитрата при стоянии разделяется на плазму и эритроциты. СОЭ (измеряемая в миллиметрах) определяли через час после начала исследования по величине столбика плазмы над осевшими эритроцитами. Сама по себе СОЭ – неспецифический лабораторный показатель, отклонение которого от нормы лишь сигнализирует о патологических процессах.
Для определения гемоглобина использовался гемометр Сали, представлявший собой штатив с тремя гнездами. В крайних гнездах находились ампулы со стандартным раствором с известным содержанием гемоглобина. В среднем гнезде находилась градуированная пробирка, куда пипеткой вносились раствор соляной кислоты и кровь, в результате смешивания которых из гемоглобина образуется гемин, придающий раствору бурый цвет. Содержимое пробирки разводили, прибавляя по каплям дистиллированную воду и перемешивая стеклянной палочкой, пока его цвет не сравняется с цветом стандартного раствора боковых ампул гемометра. Ошибка при определении содержания гемоглобина этим методом могла составлять ±30 %.
Для исследований образцов крови под микроскопом использовали пробирки с разными растворами для разведения: для эритроцитов – с физиологическим раствором (0,9 %-ный раствор поваренной соли); для лейкоцитов – с 3–5 %-ным раствором уксусной кислоты, где эритроциты лизировались (растворялись) и можно было без помех подсчитать все виды лейкоцитов; для тромбоцитов – с 1 %-ным раствором оксалата аммония, тоже вызывающим лизис эритроцитов.
Подсчет клеток под микроскопом проводился с использованием счетных камер. Счетную камеру для подсчета клеток в заданном микрообъеме жидкости и представляющую собой толстое предметное стекло с микроскопической сеткой и прямоугольным углублением (камерой) для жидкости предложил в 1874 году французский анатом Луи-Шарль Малассе (1842‒1909). Наблюдая за несколькими квадратами сетки и зная их площадь и глубину камеры, можно подсчитать количество клеток в определенном объеме жидкости, то есть их концентрацию. В отечественной лабораторной практике использовалась (и до сих пор используется) камера с усовершенствованной сеткой, созданная и предложенная к использованию в 1914 году профессором Казанского университета Николаем Константиновичем Горяевым (1875‒1943), в честь которого это устройство так и называется – камера Горяева, хотя правильнее его называть камерой Бюркера с сеткой Горяева.
Устройство представляет собой толстое предметное стекло с плоской площадкой в центре, углубленной на 0,1 мм. На дне площадки нанесены две сетки, разграниченные поперечной канавкой. Сбоку от сеток расположены стеклянные площадки, к которым притирается шлифованное покровное стекло. После притирания покровного стекла образуется камера, закрытая сверху и с двух боковых сторон, а с двух других сторон остаются щели (капиллярные пространства), через которые камеру и заполняют суспензией. Сетка состоит из 225 больших квадратов, из которых 100 – пустые, 25 разделены каждый на 16 малых квадратов и 100 разделены полосами (самостоятельного значения эти полосы, образующиеся при гравировке малых квадратов, не имеют). Эритроциты считали в пяти расположенных по диагонали сетки квадратах, разделенных на малые, то есть в 80 малых квадратах, а в 100 больших квадратах сетки, не разделенных на малые квадраты и полосы, – лейкоциты, поскольку их на три порядка меньше, чем эритроцитов. Исходя из количества подсчитанных клеток, микрообъема каждого квадрата, степени разведения крови по специальным формулам определяли число клеток в единице объема.
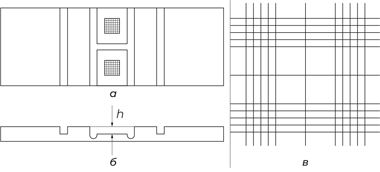
Рис. 7. Счетная камера Горяева (а – вид сверху; б – вид сбоку; в – деление камеры на квадраты; h – глубина камеры)
Метод подсчета тромбоцитов в камере Горяева с применением фазово-контрастного микроскопа является хоть и самым точным, но очень трудоемким, так что часто подсчет тромбоцитов вели в окрашенных мазках крови. В них же измеряли и диаметр эритроцитов, хотя мазки крови в основном брались для исследования лейкоцитарной формулы, то есть процентного состава лейкоцитов каждого вида. Для подобной процедуры требуется окраска мазков.
Окрашивание крови
Перед тем как поместить стекло под микроскоп, мазки крови окрашиваются специальным красителем. Сам метод окрашивания клеток крови, как уже отмечалось, предложил Пауль Эрлих. На эту мысль его натолкнула прочитанная им книга про отравление свинцом, где отмечалась способность этого токсичного элемента накапливаться в определенных тканях. Эрлиха настолько увлекла тема окрашивания биологических тканей, что его научный руководитель представил своего студента светилу бактериологической науки Роберту Коху (1843‒1910), причем следующим образом: «Это маленький Эрлих. Он очень хорошо окрашивает, но никогда не сдаст экзамен». Экзамены Эрлих все же сдал и даже защитил докторскую диссертацию, посвященную окрашиванию биологических структур недавно открытыми синтетическими красителями. Предложенный Эрлихом в 1877 году метод основывался на использовании двух красителей – фуксина и метиленового синего, проявляющих соответственно кислотные и основные свойства. Попытки Эрлиха окрасить клетки крови морских свинок сначала были безуспешными, но как-то раз он отлучился, а подкрашенная капля успела высохнуть, и под микроскопом Эрлих увидел окрашенные клетки; так выяснилось, что следует подкрашивать высохшую кровь. В 1888 году патологоанатом Одесской городской больницы Чеслав Иванович Хенцинский (1851‒1916) предложил использовать для окраски малярийного плазмодия смесь эозина (еще один кислотный краситель) и метиленового синего. Однако такое окрашивание не выявляло ядро плазмодия, и в 1890 году врач Дмитрий Леонидович Романовский (1861‒1921), работавший в петербургском Николаевском военном госпитале, начал экспериментировать с этой смесью и обнаружил, что если применять длительно хранившийся в растворе метиленовый синий, то составной краситель дает полихромную (многоцветную) окраску клеток. Он высказал предположение, что это объясняется наличием какого-то третьего вещества, но, не будучи химиком, ограничился простой догадкой. Вещество, названное азуром, образующееся при окислении метиленового синего, выделил немецкий химик Густав Гимза в 1902 году и наладил серийное производство реактива (эозин-азур-метиленовый синий) под названием «Giemsasche Lözung für die Romanowsky Färbung» («Раствор Гимзы для окраски по Романовскому»), так что метод получил название «Окрашивание по Романовскому‒Гимзе».

Рис. 8. Окрашенный мазок крови
Составной краситель, как я уже говорил, состоит из нескольких химических соединений – щелочной (основные, или базовые, красители) и кислой (кислотные красители) реакции, под воздействием которых составляющие клеток крови (кислотной или основной природы) по-разному окрашиваются. Таким образом становится легче определить их морфологию – строение и форму.
Окрашивание применяется в основном, чтобы выявить разные виды лейкоцитов. Эритроциты и тромбоциты имеют характерное строение, и оценить их морфологию довольно легко. А вот разные виды лейкоцитов достаточно сходны между собой: только когда мы их окрашиваем, они начинают выглядеть по-разному.
Например, гранулы внутри эозинофилов окрашиваются в оранжево-розовый цвет. Они являются структурами основной (щелочной) природы и получили название в честь кислотного красителя, который их так окрашивает, – эозина. А он, в свою очередь, носит имя древнегреческой богини утренней зари Эос.
Гранулы базофилов, напротив, окрашиваются в интенсивный сине-фиолетовый цвет. Они представляют собой структуры кислой природы, поэтому окрашиваются базовыми красителями, отсюда и название.
Ядра лейкоцитов красятся в фиолетово-красный цвет, и некоторые виды лейкоцитов получили свои названия из-за разной формы под микроскопом, например палочкоядерные и сегментоядерные.
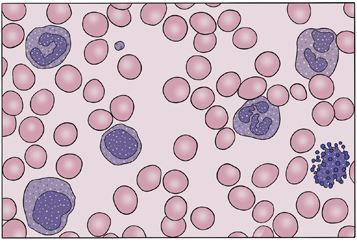
Рис. 9. Мазок крови под микроскопом
Осторожно сдвигая окрашенный мазок в поле зрения микроскопа, врач считал клетки каждого вида (отличающиеся по форме ядра, цвету цитоплазмы и гранул) и их общее количество. Насчитав в совокупности 100, он получал требуемое процентное соотношение каждого вида клеток. Для облегчения подсчета использовались счетчики лейкоцитарной формулы с отдельными клавишами для каждого вида клеток. Если обнаруживались какие-либо отклонения от нормы, обязательно просматривали еще 100 лейкоцитов.
И да, после этих процедур все использовавшиеся при конкретном анализе скарификаторы, пробирки, капилляры, пипетки промывались, заворачивались в крафт-бумагу и стерилизовались при температуре 180 ºС в сухожаровом шкафу.
Современные процедуры клинического анализа крови
В соответствии с Национальным стандартом России по обеспечению качества лабораторных исследований сейчас клинический анализ крови проводится из венозной крови, за исключением особых клинических ситуаций вроде забора крови у малышей. Да и при заборе капиллярной крови скарификаторы-копья (уже одноразовые) уступили место одноразовым автоматическим ланцетам с узкой режущей частью (иглой), имеющим разную глубину прокола и не вызывающим болезненных ощущений. Для различения ланцетов с разными размерами игл и глубиной прокола они окрашены в разный цвет. До момента прокола игла (или лезвие) скрыта в корпусе и после забора анализа убирается обратно и блокируется, не допуская повторного использования ланцета. Капилляры Панченкова на сегодняшний день в ряде регионов вообще под запретом, так что забор крови в пробирку осуществляется либо одноразовым капилляром end-to-end, либо самотеком. СОЭ определяется с помощью пробирок Вестергрен; впрочем, суть метода и используемый реактив (цитрат натрия) остались теми же самыми.
А вот для определения гемоглобина применяется уже не метод Сали с применением соляной кислоты, а трансформирующий реагент – смесь ацетонциангидрина, калия железосинеродистого и гидрокарбоната натрия. При реакции гемоглобина с ним образуется гемиглобинцианид, причем интенсивность окраски содержимого пробирки, измеряемая уже не на глазок, а спектрофотометрами или фотоэлектроколориметрами, пропорциональна количеству гемоглобина.
Для забора крови из вены в наши дни используются устройства, которые называются вакутайнеры (или вакутейнеры). Название Vacutainer является зарегистрированной торговой маркой фирмы Becton Dickinson and Company (США). Вакутайнер состоит из стерильной одноразовой иглы и пластиковой пробирки (непосредственно вакутайнера). Пробирки (опять же применяется цветовая маркировка) содержат внутри дозированный объем вакуума для разного объема проб крови, разделительный гель (разделяет сыворотку и сгусток после центрифугирования) и различные антикоагулянты (тогда пробирки силиконизируют, то есть наносят на них силиконовое покрытие для избежания контактной активации свертывания крови) или же, наоборот, активаторы свертывания. В таких пробирках удобно хранить длительное время и транспортировать образцы крови, что позволяет обеспечить централизацию лабораторных исследований.
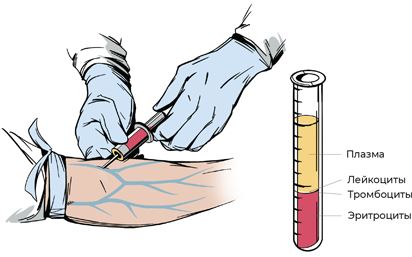
Рис. 10. Получение крови из вены с помощью вакутайнера
В середине XX века на смену ручному анализу клеток крови пришел автоматический метод. Технику автоматизированного подсчета клеток разработали в 1947 году братья Джозеф и Уоллес Культеры. Созданная ими компания Coulter Corporation была приобретена в 1997 году фирмой Beckman Instruments, сменившей свое название на Beckman Coulter, на сегодняшний день она является одним из ведущих игроков на рынке клинической диагностики.
Принцип работы счетчика основан на кондуктометрическом (или апертурно-импедансном) методе. Каждая клетка крови, плавающая в емкости с раствором электролита, увлекаемая потоком, проходит через отверстие очень маленького диаметра (апертуру) в погруженной в емкость трубке, из которой жидкость отсасывается насосом. Внутри и снаружи трубки расположены два электрода, так что, когда при прохождении клетки через апертуру вытесняется определенный объем электролита, это приводит к возрастанию сопротивления (импеданса) и изменению тока, протекающего в электролите, пропорционально размеру клетки.
Если в апертуре одновременно находятся две или более клетки, это приведет к ошибке подсчета, поэтому проба крови разводится до такой концентрации, при которой в апертуре датчика всегда будет не больше одной клетки. Анализируя количество и амплитуду импульсов, можно определить число и объем частиц, прошедших через апертуру. А измерив количество жидкости, пропускаемой через апертуру, можно вычислить концентрацию частиц в пробе.
Понятно, что небольшие по размеру тромбоциты легко выделить по амплитуде импульсов, но определение количества лейкоцитов, близких по размеру к эритроцитам, возможно только после лизиса (растворения) эритроцитов, поэтому при подсчете лейкоцитов в разведенную суспензию крови добавляют лизирующий раствор. Различение популяций лейкоцитов при кондуктометрическом методе невозможно из-за близости их размеров, однако можно подобрать такой состав растворителя, при котором различные формы лейкоцитов в разной степени меняются в размерах, что позволяет провести их подсчет.
До нас, к сожалению, прогресс в этой области дошел с опозданием: судя по книге Адама Хиггинботама «Чернобыль. История катастрофы» (автор ссылается там на врача Анжелику Барабанову), даже в московской спецбольнице № 6 могущественного Минсредмаша (атомного ведомства) в 1986 году не было автоматических счетчиков клеток крови и клиницисты вели подсчет вручную, так что каждый анализ занимал полчаса вместо 20 секунд. Все же подобное сопоставление верно скорее для массовых лабораторных исследований, да и упомянутые полчаса, вероятнее всего, отсчитывались от момента забора крови (для набившего руку специалиста сам подсчет занимал не более пяти минут) – даже сейчас в экстренных случаях и в единичных анализах предпочитают не запускать имеющиеся счетчики, а провести подсчет вручную.
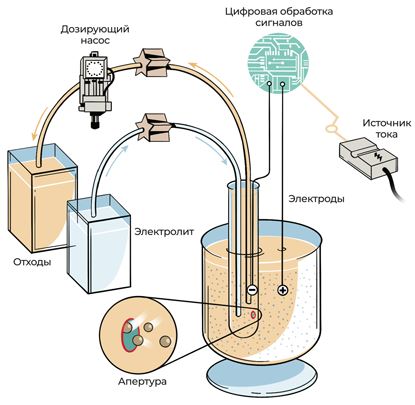
Рис. 11. Принцип метода кондуктометрии
На сегодняшний день технология автоматического гематологического анализа претерпела значительные изменения. Появились и новые принципы измерений, помимо кондуктометрического, в частности метод лазерного светорассеивания, когда по интенсивности рассеивания клетками поляризованного лазерного луча под разным углом оценивается не только размер клеток, но и их структура, форма ядра, клеточная зернистость.
Первые счетчики, которые относят сейчас к I классу, определяли 8‒9 параметров: количество эритроцитов, тромбоцитов, лейкоцитов, гемаглобин, гематокрит и некоторые другие.
Сегодня применяются уже аппараты так называемого III класса, определяющие до сотни различных параметров, позволяя проводить не только дифференцировку лейкоцитов по пяти основным популяциям (нейтрофилы, эозинофилы, базофилы, моноциты и лимфоциты), но и подсчет и анализ ретикулоцитов, некоторых субпопуляций лимфоцитов. Они, как правило, комплектуются блоком для автоматического приготовления и окраски мазков из заданных образцов крови.
Врач-лаборант, работающий с гематологическим анализатором, оценивая результаты, принимает решение – надо ли их перепроверять под микроскопом. Зачем же, спрашивается, это делать?
При всех достоинствах автоматических анализаторов исследование специалистом образца крови под микроскопом до сих пор остается самым надежным методом диагностики. При выявлении анализатором патологической морфологии клеток проба отправляется на перепроверку под микроскопом. Дело в том, что современные анализаторы, несмотря на все свои неоспоримые плюсы, иногда ошибаются в подсчете подвидов клеток. И касается это, как правило, лейкоцитов: эритроциты и тромбоциты поддаются подсчету легко.
Кстати, лейкоциты могут вводить в заблуждение не только автоматику, но и докторов в лаборатории обычной городской поликлиники или больницы. Если у врача нет большого опыта – постоянного потока гематологических пациентов, как у нас в поликлинике, он может ошибиться в идентификации тех или иных подвидов лейкоцитов.
Например, в нашу поликлинику часто обращаются напуганные пациенты, у которых обнаружены какие-то виды бластов – миелобласты или лимфобласты, то есть молодые клетки, которые в норме должны быть в костном мозге, а не в сосудистом русле. На основе такого анализа можно заподозрить, скажем, острый лейкоз – серьезное онкологическое заболевание. Мы всегда в таком случае проводим повторный анализ у себя в лаборатории. И наши врачи, работающие в гематологии по 20 лет, находят в анализе миелоциты, которые ошибочно были приняты за бласты. Мы с радостью успокаиваем таких пациентов, что их анализы в норме, – и с чистой совестью отправляем домой.
Предполагается, что использование обучающихся нейронных сетей расширит сферу применения автоматического гематологического анализа. На сегодняшний день технологиям машинного зрения, способным распознавать клетки все более и более точно, подобно человеку, нарабатывающему опыт, уже посвящено множество научных работ. Обучение искусственного интеллекта происходит на больших массивах данных по принципу человеческого; например, ему показывают, как выглядят различные бласты. Он запоминает, систематизирует, учится максимально точно их определять – и если выявляет нездоровую клетку, то обращает на это внимание врача: «Посмотрите, мне кажется, тут что-то не то!» Как только такие технологии получат массовое распространение, они освободят врачей от рутинных процессов. Впрочем, не стоит слепо верить в технологии, сулящие революционный прорыв, как показывает история биотехнологического стартапа Theranos. Обещания его основательницы Элизабет Холмс создать устройство для проведения множества анализов при помощи лишь одной капли крови на поверку оказались блефом.
Итак, мы разобрались, как сейчас забирают кровь и проводится ее анализ, и поняли, что не стоит бежать к врачу при незначительных изменениях в анализах крови, даже когда на бланке, выданном в лаборатории, напротив того или иного параметра стоит ярко-красная стрелка, направленная вверх или вниз.
Когда точно надо к гематологу?
В этом разделе я приведу наиболее значимые количественные изменения состава крови, при обнаружении которых стоит обратиться к гематологу, даже если нет других жалоб.
Названия этих количественных отклонений формируются очень просто: если есть дефицит тех или иных клеток, то добавляется аффикс «-пения» – в переводе с древнегреческого «бедность». Получается: тромбоцитопения – дефицит тромбоцитов, нейтропения – дефицит нейтрофилов и т. д. Единственное исключение в данном случае – «анемия», дефицит гемоглобина. Название этой болезни образовано из приставки «ан-» – отсутствие и «гема» – кровь. Букву «г» для красоты звучания выкинули, и получилось слово, обозначающее «малокровие».
Термин же, характеризующий увеличение тех или иных клеток, складывается из их названия и окончания «-оз»: например, тромбоцитоз – переизбыток тромбоцитов, лейкоцитоз – слишком много лейкоцитов и т. д.
Почему лейкоцитоз и моноцитоз носят звания «абсолютных»? Потому что количественные изменения в лейкоцитарной формуле оцениваются в абсолютных значениях (грубо говоря, в «штуках»). И врачи в основном ориентируются на них. Разбалансировка в процентном содержании клеток лейкоцитарного ряда может быть следствием большого количества причин, и она не всегда патологична.
Таблица 2
Снижение показателей в анализе крови
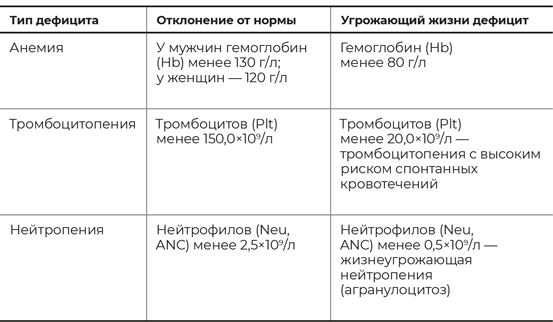
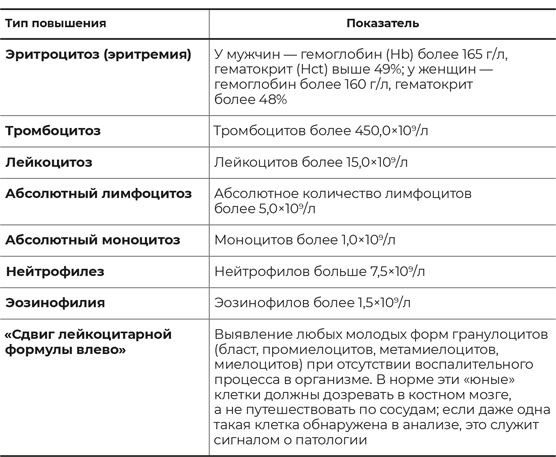
Таблица 3
Повышение некоторых параметров в клиническом анализе крови
Более подробно об отклонениях, описанных в таблице, и о том, чем они опасны для здоровья (а иногда и для жизни в целом), мы поговорим в соответствующих главах.
Пока же давайте разберем, какие факторы могут повлиять на качество анализа крови и как правильно подготовиться к сдаче анализа, чтобы он был наиболее точным и информативным для врача.
Как подготовиться к сдаче анализа крови? Обязательно ли делать это натощак?
Далеко не все анализы сдаются натощак, то есть не менее чем через 4–8 часов после последнего приема пищи. Если проводится исследование, например, на наличие инфекций или на группу крови, то еда никак не повлияет на результаты.
Перед общим анализом крови голодать тоже необязательно, но лучше не есть хотя бы за два часа. Это связано с тем, что после еды в крови увеличивается количество лейкоцитов и перекус может исказить результаты.
А вот биохимический анализ и исследование уровня гормонов в крови проводятся строго на голодный желудок, так как еда влияет на уровень глюкозы и запускает в организме другие биохимические процессы. Жирная и острая еда, обильные приемы пищи накануне могут привести к искажению других показателей. Поэтому будет лучше, если за сутки до запланированного обследования вы постараетесь есть только легкую пищу и не перегружать желудок.
Однако прием пищи не единственный фактор, который может повлиять на результаты. Большую роль играет эмоциональное и физическое состояние человека. Для того чтобы получить точные результаты, перед сдачей анализов крови лучше хорошо выспаться, не волноваться и исключить не только утренние пробежки и спортзал, но и длительные пешие прогулки. Кроме того, на результаты могут повлиять курение и прием медикаментов.
Правда ли, что большинство анализов нужно сдавать с утра?
Острой необходимости в этом нет. Даже если анализы необходимо сдать натощак, воздержаться от пищи на несколько часов можно и днем. Однако нужно ограничивать не только еду, но еще и эмоциональные и физические нагрузки. Для большинства людей соблюсти все эти ограничения проще утром, чем в другое время суток.
Не стоит забывать, что в течение дня у человека могут меняться показатели гормонов и биохимии крови. И для того чтобы, скажем, точно отследить динамику лечения, сдавать эти анализы лучше в одно и то же время.
Как алкоголь и курение влияют на результаты анализа?
Алкоголь изменяет содержание в крови многих веществ, поэтому после его употребления результаты анализов будут некорректными. К примеру, из-за алкоголя снижается гемоглобин и количество эритроцитов, повышается холестерин и уровень нейтральных жиров.
На основе таких анализов врач может заподозрить серьезные заболевания – от подагры и сахарного диабета до внутреннего кровотечения и сердечной недостаточности, тогда как на самом деле у пациента просто легкое похмелье.
В крови также меняется концентрация микро– и макроэлементов, по-другому работают щитовидная железа и надпочечники, что влияет на уровень гормонов. Для того чтобы избежать искажений, от алкоголя лучше отказаться как минимум за двое суток до исследования.
Курение влияет на показатели не так сильно, но все же стоит воздержаться от сигарет и девайсов для курения в течение пары часов перед сдачей крови, особенно если речь идет об анализах на гормоны и биохимию.
В каких случаях кровь берут из пальца, а в каких – из вены?
Для клинического анализа кровь можно взять как из пальца, так и из вены. Взятие крови из пальца проходит менее болезненно, тогда как взятие из вены не только доставляет дискомфорт, но иногда и пугает пациента. Вероятно, вы слышали истории о том, как человек упал в обморок, увидев, как кровь вытекает из вены в вакутайнер. Но полученный образец «из пальца» состоит из капиллярной крови и межтканевой жидкости – она разбавляет кровь, поэтому такой анализ дает менее точные результаты. Так что я рекомендую все же потерпеть пугающую процедуру: вы всегда можете отвернуться, отвлечься или заранее попросить медсестру о помощи (в процедурных кабинетах всегда есть нашатырь, чтобы взбодрить пациента).
Для всех остальных анализов, включая гормоны и биохимию, кровь берут только из вены. Взятие из пальца практикуют в крайних случаях – у маленьких детей либо у людей с низким давлением или поврежденными венами, например после курса химиотерапии.
Важно ли, из какой руки берется кровь – из левой или правой?
На результаты исследования это никак не влияет. Чаще всего у правшей кровь берут из левой руки, а у левшей – из правой. Но только для того, чтобы дискомфорт после процедуры не мешал привычной активности.
Как подготовить ребенка к процедуре взятия крови?
Прежде всего, не стоит обманывать ребенка по поводу того, куда вы идете. Можно подготовить его к процедуре, например поиграв дома в доктора – пусть ребенок «возьмет кровь» у игрушек, а потом сам успокоит их после укола. Стоит предупредить, что ощущения будут неприятными, и перед анализом не стыдить и не ругать ребенка за страх и слезы.
Как правило, в частных лабораториях детям после взятия крови выдают символические «медали». Если вы сдаете анализ в обычной поликлинике, можно самостоятельно придумать вознаграждение для ребенка за смелость. Например, моя мама подсовывала стоматологу в карман жвачку и просила выдать ее после процедуры. Вы не представляете, сколько счастья обеспечивал мне этот подарок, и каждый следующий раз я шел к зубному без страха.
Почему анализ может не получиться – по вине лаборатории или пациента?
Возможны оба варианта. Если пациент не соблюдал правила подготовки к анализу – выпивал накануне, принимал медикаменты перед взятием крови, пришел в лабораторию сразу после спортзала или сильного стресса, то результаты могут оказаться некорректными.
Помните, мы говорили про спортивные нагрузки и миогенный лейкоцитоз: человек, который хорошо позанимался в зале, обеспечивает себе микротравмы мышц, в ответ на что организм начинает вырабатывать лейкоциты – и это является нормой. Если врач не знает, что вы сдали анализы после занятий спортом, он увидит повышенное содержание лейкоцитов в крови и, вероятнее всего, заподозрит наличие воспалительного процесса в организме. А это значит, надо провести дополнительные исследования, чтобы найти очаг воспаления, – таким образом, спортсмен рискует ввязаться в продолжительное обследование всего организма, тогда как для этого объективно нет повода.
Кроме того, плотный прием пищи прямо перед анализом увеличивает количество хиломикронов – веществ, которые делают кровь мутной и затрудняют исследование.
Конечно же, многое зависит и от лаборатории. Нарушение правил взятия, хранения или транспортировки крови почти неизбежно искажает результаты.
И пожалуйста, помните, что только врач может учесть все факторы и корректно расшифровать результаты. У меня был такой пример в практике: ко мне обратилась женщина – давно знакомая пациентка, которую я лечил от онкологического заболевания крови. В свое время мы успешно справились с болезнью, и вдруг через два года она приходит с подозрительным анализом: наблюдается сгущение крови, повышен гематокрит. В чем дело?
Я буквально пытал ее – детально расспрашивал, что она делала, где была, как себя чувствовала. Оказалось, что она соблюдала Рамадан, то есть ничего не ела и не пила с восхода до заката. Такие строгие ограничения плюс жаркое лето – в результате в организме возник дефицит жидкости и кровь сгустилась. Я ее попросил по возможности пить в течение дня. Через неделю она пересдала анализы, и показатели вернулись в норму – хотя, судя по первоначальным результатам, были все основания для постановки серьезного диагноза.
Можно ли назначить себе анализ самостоятельно?
Я считаю, что было бы хорошо, если бы все взяли за правило сдавать два базовых анализа: клинический анализ крови и минимальный набор биохимических маркеров (уровень глюкозы, холестерин) хотя бы раз в год. Есть ряд заболеваний, которые можно выявить заблаговременно по результатам простых исследований крови – и вовремя принять меры. Например, повышение уровня глюкозы протекает бессимптомно, но со временем может приводить к сахарному диабету; повышенный уровень холестерина тоже никак не сообщает о себе – а потом «внезапно» начинает повышаться систолическое давление. В группу риска по этим заболеваниям входят люди старше 40, и для них такая диспансеризация, я считаю, необходима.
Главное – при выявлении тех или иных отклонений не впадать в панику. Как говорилось выше, результаты анализа зависят от огромного количества факторов. Если у вас нет никаких жалоб на здоровье, при выявлении каких-либо изменений в анализах для подтверждения лучше повторно их сдать с разницей 5‒7 дней.
Другие виды исследований лучше делать только по назначению врача.
Назад: Глава 7 Беседа и осмотр
Дальше: Глава 9 Как оценить функцию костного мозга? Биопсия: что это такое и для чего ее выполняют?

