Глава 8
Трансмиссивные (кровяные) инфекции
Флеботомная лихорадка
Син.: москитная лихорадка, лихорадка паппатачи, бухарская лихорадка
Флеботомная лихорадка (phlebotomus febris) – острая арбовирусная эндемическая болезнь, протекающая с кратковременной высокой лихорадкой, головной и мышечными болями, конъюнктивитом и светобоязнью.
Исторические сведения. Впервые болезнь была описана в 1799 г. У.Барнетгом на о. Мальта («средиземноморская лихорадка»). В 1886 г. А. Пик выделил болезнь в самостоятельную нозологическую форму, а ее связь с москитами была доказана в 1909 г. Р.Дерром, К.Францем, С.Тауссигом, которые предложили название Febris papatasii и установили вирусную природу заболевания. В России первые случаи заболевания были описаны В.Д.Шредером (1913), Е.И.Марциновским (1917), Н.И.Латышевым (1923) и др. Возбудитель был выделен в 1944 г. А.Сэйбином (сицилийский и неаполитанский вирусы). Ш.Д.Мошковский (1936), П.А.Петрищева и А.Я.Алымов (1939) установили трансовариальную передачу вируса у москитов.
Этиология. Возбудители – вирусы рода phlebovirus, семейства bunyaviridae относятся к экологической группе Arboviruses, имеют спиральный тип симметрии, размеры 90—110 нм, содержат однонитчатую РНК.
Различают сицилийский (типовой), неаполитанский и другие вирусы, вызывающие флеботомную лихорадку.
Вирусы погибают при температуре 56°С, при –70°С сохраняются до 1 года, а при высушивании – многие годы. Культивируются на среде VERО, вызывают летальную инфекцию у новорожденных мышей.
Эпидемиология. Флеботомная лихорадка – эндемический трансмиссивный вироз, склонный к эпидемическому распространению. Источники возбудителей – больной человек в период вирусемии и инфицированные самки москитов Рh. papatassii, способные к трансовариальной передаче вирусов. Москиты становятся заразными спустя 6—8 дней после кровососания на больном человеке. Механизм заражения – трансмиссивный, но возможно и парентеральное заражение через плохо обработанные инструменты.
Эпидемический сезон флеботомной лихорадки совпадает с лётом москитов, продолжается с мая по октябрь и в субтропических и тропических регионах нередко имеет двухволновой характер.
Заболеваемость обычно эндемическая, однако среди неиммунных лиц возможны эпидемические вспышки. Восприимчивость всеобщая, у местных жителей эндемических очагов после инфицирования в детском возрасте формируется гомологичный иммунитет, повторные заболевания редки.
Ареал болезни совпадает с ареалом москитов и включает страны, расположенные в пределах 20—45° с.ш. В нашей стране очаги инфекции были ликвидированы в 40-е годы, но спорадические случаи болезни изредка регистрируются.
Патогенез и патологоанатомическая картина. На месте укуса москита часто возникает болезненная воспалительная реакция кожи в виде зудящих папул, окруженных зоной гиперемии.
После репликации инокулированного вируса в клетках системы макрофагов развивается вирусемия, определяющая начальные проявления болезни. Вирус флеботомной лихорадки фиксируется в клеткахЦНС, вегетативных симпатических ганглиях, вызывая нарушение функции и церебральную гипертензию. Фиксация вируса в костном мозге приводит к лейкопении с относительным лимфомоноцитозом. Изменения внутренних органов не изучены.
Клиническая картина. Инкубационный период продолжается 3—7 дней. Болезнь развивается внезапно: появляется озноб, в течение первых суток температура тела достигает 39—40 °С и остается повышенной от 2 до 5 сут. Больные жалуются на интенсивную головную боль, артралгии, распространенные миалгии, особенно в икроножных и поясничных мышцах. Характерны боли в глазных яблоках и надбровной области. Возможно появление повторной рвоты, у детей – судорог.
При осмотре больных определяются одутловатость и гиперемия лица, шеи и верхних отделов груди, напоминающая солнечную эритему. Характерны конъюнктивит, фотофобия. Патогномоничными симптомами считаются симптом Тауссига (резкая болезненность при надавливании на глазные яблоки, при их движении или при попытке приподнять веки) и симптом Пика (ограниченная инъекция сосудов на склерах в наружном или реже внутреннем углу глаза в виде треугольника, обращенного вершиной к зрачку).
Часто наблюдаются гиперемия зева, отечность небного язычка, нередко с точечными геморрагиями. Возможен herpes labialis. На открытых участках кожи могут быть папулы на месте укуса москитов, исчезающие через 4—5 дней. У ряда больных на 2—3-й день болезни может появляться мелкопятнистая или кореподобная сыпь, исчезающая после нормализации температуры тела.
В течение первых суток болезни выявляется тахикардия, сменяющаяся в дальнейшем брадикардией. Артериальное давление обычно понижено. Язык может быть сухим и покрытым белым налетом. Размеры печени и селезенки не изменяются.
Характерны неврологические проявления: интенсивная головная боль, бессонница, головокружение, гиперестезия, вегетативная лабильность, иногда – менингеальный синдром; при тяжелом течении может развиваться бред, возможна утрата сознания.
В гемограмме отмечается лейкопения с относительным лимфомоноцитозом, анэозинофилия, нейтропения с преобладанием юных форм. СОЭ не изменяется. В анализе мочи выявляется альбуминурия.
При спинномозговой пункции выявляются повышение внутричерепного давления, небольшое увеличение содержания белка и положительные пробы Панди и Нонне —Апельта.
На 3—4-й день болезни температура обычно критически снижается, что сопровождается повышенной потливостью, улучшением состояния больных, уменьшением миалгий и головной боли.
Период реконвалесценции продолжается 2—3 нед и характеризуется выраженной астенией, часто психической депрессией, невралгиями и потливостью. Иногда возможно кратковременное повышение температуры и сохранение церебральной гипертензии и вегетативной лабильности.
Осложнения. Наблюдаются крайне редко, обычно они обусловлены присоединением ассоциированной инфекции.
Прогноз. Благоприятный, летальные исходы крайне редки.
Диагностика. Основана на результатах анализа комплекса эпидемиологических и клинико-лабораторных данных. Верификация достигается выделением вируса из крови в лихорадочный период и с помощью серологических реакций (РТГА, РСК, РН) с 5—6-го дня болезни.
Дифференциальная диагностика. Проводится с острыми респираторными заболеваниями, малярией, клещевым боррелиозом, риккетсиозами, лептоспирозом.
Лечение. Больные подлежат госпитализации. Им проводят дезинтоксикационную и симптоматическую терапию. В случаях церебральной гипертензии применяют диуретики.
Реконвалесценты выписываются после 14—21-го дня болезни (7—10-й день апирексии).
Профилактика. Осуществляется путем уничтожения москитов и защиты от их нападения, созданием активного иммунитета с помощью формолвакцины (по эпидемиологическим показаниям).
Сходные остролихорадочные заболевания могут наблюдаться при инфекции вирусами иссык-кульской лихорадки и лихорадки долины Сырдарьи, при этом часто определяется полиморфная пятнисто-розеолезная сыпь на туловище и конечностях.
Геморрагические лихорадки
Геморрагические лихорадки (febres haemorrhagica) – группа острых вирусных зоонозных болезней с разнообразными механизмами передачи возбудителей, характеризующихся развитием универсального капилляротоксикоза и геморрагического синдрома на фоне острого лихорадочного состояния и протекающих с явлениями общей интоксикации.
В настоящее время у человека описано 13 геморрагических лихорадок, большая часть из которых являются эндемическими для тропических регионов. В России описаны конго-крымская геморрагическая лихорадка, омская геморрагическая лихорадка и геморрагическая лихорадка с почечным синдромом.
Возбудители геморрагических лихорадок относятся к экологической группе арбовирусов (семейства тогавирусов и буньявирусов), аренавирусам и филовирусам.
Геморрагические лихорадки – природно-очаговые инфекции. Основными резервуарами возбудителей являются животные – приматы, грызуны, крупный и мелкий рогатый скот, клещи и др., в организме которых обычно развивается латентная инфекция с длительным персистированием вирусов, что обеспечивает интенсивное заражение окружающей среды в энзоотических очагах. В отдельных случаях инфекция может приобретать антропонозный характер.
Механизмы заражения геморрагическими лихорадками разнообразны: трансмиссивный – при арбовирусных геморрагических лихорадках; аэрогенный, алиментарный и контактный – при аренавирусных геморрагических лихорадках, возможна парентеральная передача некоторых возбудителей геморрагических лихорадок.
Восприимчивость к геморрагическим лихорадкам высокая, контингентами высокого риска заражения являются лица, имеющие тесный профессиональный контакт с животными или объектами дикой природы (лесорубы, геологи, сельскохозяйственные рабочие, работники вивариев и т.д.). Наиболее тяжелые формы болезни наблюдаются у людей, впервые посещающих очаги инфекции. У местных жителей часто наблюдаются легкие и субклинические формы геморрагических лихорадок. Летальность при геморрагических лихорадках колеблется от 1 —5 до 50-70 %.
Геморрагическая лихорадка с почечным синдромом
Геморрагическая лихорадка с почечным синдромом (ГЛПС) – острая вирусная природно-очаговая болезнь, протекающая с высокой лихорадкой, выраженной общей интоксикацией, геморрагическим синдромом и своеобразным поражением почек в виде нефрозонефрита.
Исторические сведения. Под различными названиями (маньчжурский гастрит, геморрагический нефрозонефрит, лихорадка Сонго и др.) болезнь регистрировалась в районах Дальнего Востока с 1913 г.
В 1938—1940 гг. в комплексных исследованиях вирусологов, эпидемиологов и клиницистов была установлена вирусная природа болезни, изучены основные закономерности эпидемиологии и особенности ее клинического течения. В 50-х годах ГЛПС была выявлена в Ярославской, Калининской (Тверской), Тульской, Ленинградской,
Московской областях, на Урале, в Поволжье. Сходные заболевания были описаны в Скандинавии, Маньчжурии, Корее. В 1976 г. американские исследователи Г.Ли и П.Ли выделили вирус от грызунов Apodemus agrarius в Корее, в 1978 г. ими был выделен вирус от больного человека.
С 1982 г. по решению Научной группы ВОЗ различные варианты болезни объединены общим названием «геморрагическая лихорадка с почечным синдромом».
Этиология. Возбудители ГЛПС – вирусы рода hantaan (Нantaan pymela, seoul и др.), семейства bunyaviridae – относятся к сферическим РНК-содсржащим вирусам диаметром 85—110 нм.
Эпидемиология. ГЛПС – природно-очаговый вироз. Резервуаром вирусов на территории России являются 16 видов грызунов и 4 вида насекомоядных животных, у которых наблюдаются латентные формы инфекции, реже возникают энзоотии с гибелью животных. Вирус выделяется во внешнюю среду преимущественно с мочой грызунов, реже с их фекалиями или слюной. Среди животных наблюдается трансмиссивная передача вируса гамазовыми клещами, блохами.
От грызунов к человеку в естественных или лабораторных условиях вирус передается воздушно-пылевым, алиментарным и контактным путями. Случаи заражения ГЛПС от больного человека неизвестны.
Заболеваемость носит спорадический характер, возможны и групповые вспышки. Природные очаги расположены в определенных ландшафтно-географических зонах: прибрежных районах, полесье, влажных лесных массивах с густой травой, что способствует сохранению грызунов. Заболеваемость имеет четкую сезонность: наибольшее число случаев болезни регистрируется с мая по октябрь – декабрь с максимальным подъемом в июне – сентябре, что обусловлено нарастанием численности грызунов, частыми посещениями леса, выездами на рыбалку, сельскохозяйственными работами и т.п., а также в ноябре – декабре, что связано с миграцией грызунов в жилые помещения.
Болеют чаще всего сельские жители в возрасте 16—50 лет, преимущественно мужчины (лесозаготовители, охотники, полеводы и др.). Заболеваемость городских жителей связана с пребыванием их в загородной зоне (посещение леса, отдых в лагерях отдыха и санаториях, расположенных вблизи леса), работой в вивариях.
Иммунитет после перенесенной болезни довольно стойкий. Повторные заболевания наблюдаются редко.
Патогенез и патологоанатомическая картина. После внедрения в организм человека через повреждению кожу и слизистые оболочки и репликации в клетках системы макрофагов вирус поступает в кровь. Развивается фаза вирусемии, которая обусловливает начало болезни с развитием общетоксических симптомов.
Оказывая вазотропное действие, вирус повреждает стенки кровеносных капилляров как непосредственно, так и в результате повышения активности гиалуронидазы с деполяризацией основного вещества сосудистой стенки, а также вследствие высвобождения гистамина и гистаминоподобных веществ, активизации калликреин-кининового комплекса, повышающих сосудистую проницаемость.
Большая роль в генезе капилляротоксикоза отводится иммунным комплексам. Наблюдается поражение вегетативных центров, регулирующих микроциркуляцию.
В результате повреждения сосудистой стенки развивается плазморея, уменьшается объем циркулирующей крови, повышается ее вязкость, что приводит к расстройству микроциркуляции и способствует возникновению микротромбов. Повышение капиллярной проницаемости в сочетании с синдромом диссеминированного внутрисосудистого свертывания крови обусловливает развитие геморрагического синдрома, проявляющегося геморрагической сыпью и кровотечениями.
Наибольшие изменения развиваются в почках. Воздействие вируса на сосуды почек и микроциркуляторные расстройства вызывают серозно-геморрагический отек, который вдавливает канальцы и собирательные трубочки и способствует развитию десквамативного нефроза. Снижается клубочковая фильтрация, нарушается канальцевая реабсорбция, что приводит к олигоанурии, массивной протеинурии, азотемии и нарушениям баланса электролитов и ацидотическим сдвигам кислотно-основного состояния.
Массивная десквамация эпителия и отложение фибрина в канальцах обусловливают развитие обструктивного сегментарного гидронефроза. Возникновению почечных повреждений способствуют аутоантитела, появляющиеся в ответ на образование клеточных белков, приобретающих свойства аутоантигенов, циркулирующие и фиксированные на базальной мембране иммунные комплексы.
При патологоанатомическом исследовании во внутренних органах выявляют дистрофические изменения, серозно-геморрагический отек, кровоизлияния. Наиболее выраженные изменения обнаруживают в почках. Последние увеличены в объеме, дряблы, капсула их легко снимается, под ней кровоизлияния. Корковое вещество бледное, выбухает над поверхностью разреза, мозговой слой багрово-красный с множественными кровоизлияниями в пирамидках и лоханках, имеются очаги некроза. При микроскопическом исследовании мочевые канальцы расширены, просвет их заполнен цилиндрами, собирательные трубочки нередко сдавлены. Капсулы клубочков расширены, в отдельных клубочках имеются дистрофические и некробиотические изменения. В очагах кровоизлияний канальцы и собирательные трубочки грубо деструктивно изменены, просвет их отсутствует из-за сдавления или заполнен цилиндрами. Эпителий перерожден и десквамирован. Выявляются также широко распространенные дистрофические изменения клеток многих органов, желез внутренней секреции (надпочечники, гипофиз) и вегетативных ганглиев.
В результате иммунных реакций (повышение титра антител, классов IgМ и IgG, изменения активности лимфоцитов) и саногенных процессов патологические изменения в почках регрессируют. Это сопровождается полиурией вследствие снижения реабсорбционной способности канальцев и уменьшением азотемии с постепенным восстановлением почечной функции в течение 1 года – 4 лет.
Клиническая картина. Основными симптомами ГЛПС являются высокая лихорадка, гиперемия и одутловатость лица, возникновение с 3—4-го дня болезни геморрагического синдрома и нарушения функции почек в виде олигурии, массивной протеинурии и азотемии с последующей полиурией. Болезнь характеризуется циклическим течением и многообразием клинических вариантов от абортивных лихорадочных форм до тяжелых форм с массивным геморрагическим синдромом и стойкой острой почечной недостаточностью.
Инкубационный период ГЛПС 4—49 дней, но чаще составляет 2—3 нед. В течении болезни выделяют 4 периода: 1) лихорадочный (1—4-й день болезни); 2) олигурический (4—12-й день); 3) полиурический (с 8—12-го по 20—24-й день); 4) реконвалесценции.
Лихорадочный период, или начальная фаза инфекции, характеризуется острым повышением температуры, появлением мучительных головной и мышечных болей, жажды, сухости во рту. Температура повышается до 38,5—40 °С и удерживается несколько дней на высоких цифрах, после чего снижается до нормы (короткий лизис или замедленный кризис). Продолжительность лихорадочного периода в среднем 5—6 дней. После снижения температура спустя несколько дней может повышаться вновь до субфебрильных цифр – «двугорбая» кривая.
Мучительная головная боль с первых дней болезни сосредоточена в области лба, висков. Нередко больные жалуются на нарушение зрения, появление «сетки» перед глазами. При осмотре закономерно отмечают одутловатость и гиперемию лица, инъекцию сосудов склер и конъюнктив, гиперемию зева.
Со 2—3-го дня болезни на слизистой оболочке мягкого неба возникают геморрагическая энантема, а с 3—4-го дня – петехиальная сыпь в подмышечных впадинах; на груди, в области ключиц, иногда на шее, лице. Сыпь может быть в виде полос, напоминающих «удар хлыста». Наряду с этим появляются крупные кровоизлияния в кожу, склеры, в места инъекций. Впоследствии возможны носовые, маточные, желудочные кровотечения, которые могут быть причиной смертельных исходов. У части больных легкими формами болезни геморрагические проявления отсутствуют, но симптомы «жгута» и «щипка», указывающие на повышенную ломкость капилляров, всегда положительны.
Пульс в начале болезни соответствует температуре, затем развивается выраженная брадикардия. Границы сердца нормальные, тоны приглушены. Артериальное давление в большинстве случаев понижено. При тяжелом течении болезни наблюдается развитие инфекционно-токсического шока. Нередко выявляются признаки бронхита, бронхопневмонии.
При пальпации живота определяют болезненность, чаще в подреберьях, а у некоторых больных – напряжение брюшной стенки. Боли в области живота в дальнейшем могут быть интенсивными, что вызывает необходимость дифференциации от хирургических заболеваний брюшной полости. Печень обычно увеличена, селезенка – реже. Поколачивание по пояснице болезненно. Стул задержан, но возможны поносы с появлением в испражнениях слизи и крови.
В гемограмме в этом периоде болезни – нормоцитоз или лейкопения с нейтрофильным сдвигом влево, тромбоцитопения, увеличение СОЭ. В общем анализе мочи – лейкоциты и эритроциты, небольшая протеинурия.
С 3—4-го дня болезни на фоне высокой температуры начинается олигурический период. Состояние больных заметно ухудшается. Возникают сильные боли в поясничной области, часто заставляющие больного принимать вынужденное положение в постели. Отмечается нарастание головной боли, возникает повторная рвота, приводящая к обезвоживанию организма. Значительно усиливаются проявления геморрагического синдрома: кровоизлияния в склеры, носовые и желудочно-кишечные кровотечения, кровохарканье.
Количество мочи уменьшается до 300—500 мл в сутки, в тяжелых случаях возникает анурия.
Отмечаются брадикардия, гипотензия, цианоз, учащенное дыхание. Пальпация области почек болезненна (осмотр должен проводиться осторожно ввиду возможного разрыва почечной капсулы при грубой пальпации). С 6—7-го дня болезни температура тела литически и реже критически снижается, однако состояние больных ухудшается. Характерны бледность кожи в сочетании с цианозом губ и конечностей, резкая слабость. Сохраняются или нарастают признаки геморрагического синдрома, прогрессирует азотемия, возможны проявления уремии, артериальная гипертензия, отек легких, в тяжелых случаях развивается кома. Периферические отеки образуются редко.
В гемограмме закономерно выявляют нейтрофильный лейкоцитоз (до 10—30 * 10^9 /л крови), плазмоцитоз (до 10—20 %), тромбоцитопению, увеличение СОЭ до 40—60 мм/ч, а при кровотечениях – признаки анемии. Характерны повышение уровня остаточного азота, мочевины, креатинина, гиперкалиемии и признаки метаболического ацидоза.
В общем анализе мочи отмечается массивная протеинурия (до 20—110 г/л), интенсивность которой изменяется в течение суток, гипоизостенурия (относительная плотность мочи 1,002—1,006), гематурия и цилиндрурия; нередко обнаруживаются цилиндры, включающие клетки канальцевого эпителия.
С 9—13-го дня болезни наступает полиурический период. Состояние больных заметно улучшается: прекращаются тошнота, рвота, появляется аппетит, диурез увеличивается до 5—8 л, характерна никтурия. Больные испытывают слабость, жажду, их беспокоят одышка, сердцебиение даже при небольшой физической нагрузке. Боли в пояснице уменьшаются, но слабые, ноющие боли могут сохраняться в течение нескольких недель. Характерна длительная гипоизостенурия.
В период реконвалесценции полиурия уменьшается, функции организма постепенно восстанавливаются.
Выделяют легкие, средней тяжести и тяжелые формы заболевания. К легкой форме относят те случаи, когда лихорадка невысокая, геморрагические проявления выражены слабо, олигурия кратковременна, отсутствует уремия. При форме средней тяжести последовательно развиваются все стадии болезни без угрожающих жизни массивных кровотечений и анурии, диурез составляет 300—900 мл, содержание остаточного азота не превышает 0,4—0,8 г/л. При тяжелой форме наблюдается резко выраженная лихорадочная реакция, возможны инфекционно-токсический шок, геморрагический синдром с кровотечениями и обширными кровоизлияниями во внутренние органы, острая надпочечниковая недостаточность, нарушение мозгового кровообращения. Отмечаются анурия, прогрессирующая азотемия (остаточный азот более 0,9 г/л). Возможен смертельный исход вследствие шока, азотемической комы, эклампсии или разрыва почечной капсулы. Известны формы ГЛПС, протекающие с синдромом энцефалита.
Осложнения. К числу специфических осложнений относят инфекционно-токсический шок, отек легких, уремическую кому, эклампсию, разрыв почки, кровоизлияния в мозг, надпочечники, сердечную мышцу (клиническая картина инфаркта миокарда), поджелудочную железу, массивные кровотечения. Возможны также пневмонии, абсцессы, флегмоны, паротит, перитонит.
Прогноз. Летальность при ГЛПС на Дальнем Востоке достигает в последние годы 6—8 %, в Европейской части России – 1—3,5 %, но и возможна до 10 %.
Диагностика. Распознавание ГЛПС основано на выявлении характерных клинических признаков. Из эпидемиологических данных следует учитывать контакт с объектами внешней среды, инфицированными выделениями грызунов.
Важное диагностическое значение имеют изменения гемограммы в виде лейкопении с последующим нейтрофильным гиперлейкоцитозом, тромбоцитопения, повышение СОЭ. Существенным диагностическим признаком является массивная и альтернирующая протеинурия, стойкая гипоизостенурия. Диагноз подтверждается с помощью МФА, РИА и ИФА с антигеном вирусов Hantaan в криостатных срезах легких грызунов (рыжих полевок Apodemus agrarius) и антител к нему в НРИФ.
Дифференциальная диагностика. Проводится с гриппом, брюшным и сырным тифами, лептоспирозом, энцефалитами, острым пиелонефритом, хирургическими заболеваниями брюшной полости (острый аппендицит, холецистит, панкреатит, прободная язва желудка) и др.
Лечение. Больные ГЛПС подлежат обязательной госпитализации в инфекционный стационар с соблюдением требований максимально щадящей транспортировки. Терапевтические мероприятия проводятся с учетом периода и формы тяжести болезни при постоянном контроле за основными биохимическими показателями. Больной должен соблюдать постельный режим в остром периоде болезни и до начала реконвалесценции. Назначается легкоусвояемая пища без ограничений поваренной соли (стол № 4 по Певзнеру).
В начальном периоде в комплекс лечебных средств включают изотонические растворы глюкозы и хлорида натрия, аскорбиновую кислоту, рутин, антигистаминные средства, анальгетики, дезагреганты. Имеется положительный опыт применения противовирусных препаратов (рибамидил).
На фоне олигурии и азотемии ограничивают прием мясных и рыбных блюд, а также продуктов, содержащих калий. Количество выпиваемой и вводимой больному жидкости не должно превышать суточный объем выделяемой мочи и рвотных масс более чем на 1000 мл, а при высокой температуре – на 2500 мл.
Лечение больных тяжелыми формамиГЛПС с выраженной почечной недостаточностью и азотемией или инфекционно-токсическим шоком проводят в отделениях интенсивной терапии с применением комплекса противошоковых мероприятий, назначением больших доз глюкокортикоидов, антибиотиков широкого спектра действия, методов ультрафильтрации крови, гемодиализа, а при массивных кровотечениях – гемотрансфузий.
Больных выписывают из стационара после клинического выздоровления и нормализации лабораторных показателей, но не ранее 3—4 нед от начала болезни при средней тяжести и тяжелых формах заболевания. Переболевшие подлежат диспансерному наблюдению в течение 1 года с ежеквартальным контролем общего анализа мочи, артериального давления, осмотром нефролога, окулиста.
Профилактика. Профилактические мероприятия направлены на уничтожение источников инфекции – мышевидных грызунов, а также на прерывание путей ее передачи от грызунов человеку.
Геморрагическая конго-крымская лихорадка
Син.: капилляротоксикоз острый инфекционный, лихорадка геморрагическая, конго-крымская лихорадка
Геморрагическая конго-крымская лихорадка— вирусная природно-очаговая болезнь, возбудитель которой передается через укусы иксодовых клещей; характеризуется тяжелой интоксикацией и резко выраженным геморрагическим синдромом.
Исторические сведения. Болезнь впервые описана М.П.Чумаковым и соавт. в 1944—1945 гг. в Крыму и позднее в республиках Средней Азии. В 1956—1969 гг. очаги сходных заболеваний выявлены в Болгарии, Югославии, Венгрии, Восточной и Западной Африке, в Пакистане и Индии. Заболевание распространено в Крыму, Донецкой, Астраханской, Ростовской и Херсонской областях, Краснодарском и Ставропольском краях, в Казахстане, Узбекистане, Туркмении и Азербайджане.
Этиология. Возбудитель – вирус рода nairovirus, семейства Вunyaviridае.
Эпидемиология. Конго-крымская геморрагическая лихорадка —природно-очаговый вироз. Резервуар вирусов – дикие (зайцы, африканские ежи и др.) и домашние (коровы, овцы, козы) животные, клещи более 20 видов из 8 родов с трансовариальной передачей возбудителей.
Механизм заражения – обычно трансмиссивный через укус инфицированного клеща Нуaloma plumbeum (в Крыму), Нуaloma anatolicum (в Средней Азии, Африке) и мокрецов – Culicoideus. Возможно аэрогенное заражение (в лабораторных условиях) и при контакте с кровью больных людей (внутрибольничное заражение).
В эндемичных районах заболеваемость имеет сезонный характер и повышается в период сельскохозяйственных работ (в нашей стране в июне – августе), нередко приобретая профессиональный характер. У неиммунных лиц заболевание протекает тяжело с высокой летальностью. После болезни сохраняется стойкий иммунитет.
Патогенез и патологоанатомическая картина. Патологическим реакциям при крымской геморрагической лихорадке свойственно циклическое течение. После внедрения вируса и его репликации в элементах системы макрофагов развивается фаза вирусемии, определяющая возникновение общетоксического синдрома. Последующая фаза гематогенной диссеминации приводит к развитию универсального капилляротоксикоза, синдрома внутрисосудистого свертывания крови и различных повреждений (мостовидные некрозы в печени, дистрофические изменения в миокарде, почках и надпочечниках), что клинически проявляется массивными геморрагиями и признаками органной патологии.
Клиническая картина. Инкубационный период продолжается 2—14 дней (в среднем 3—5 дней). Заболевание может протекать в стертой, легкой, средней тяжести и тяжелой формах. Помимо инкубационного, выделяют 3 периода болезни: начальный, разгара, или геморрагическую фазу, и исходов.
Начальный период продолжается 3—6 дней и характеризуется внезапно появляющимся ознобом, быстрым повышением температуры тела до 39—40°С, распространенными миалгиями и артралгиями, сильной головной болью, нередко болями в животе и поясничной области. У ряда больных определяется положительный симптом Пастернацкого. Частыми симптомами являются сухость во рту, головокружение и многократная рвота.
Больные обычно возбуждены,их лицо, слизистые оболочки, шея и верхние отделы груди гиперемированы, губы сухие, нередко отмечается герпетическая сыпь. Характерна артериальная гипотензия, пульс часто соответствует температуре тела или несколько замедлен. Гематологические изменения в этот период проявляются лейкопенией с нейтрофильным сдвигом влево, тромбоцитопенией, повышением СОЭ.
Период разгара болезни продолжается 2—6 дней, часто развивается после кратковременного, в течение 1—2 дней, снижения температуры тела. В этой фазе болезни выявляется выраженный геморрагический синдром в виде петехиальной сыпи на боковых участках туловища, в области крупных складок и конечностей. При тяжелых формах болезни наблюдаются пурпура, экхимозы, возможны кровотечения из десен, носа, желудка, матки, кишечника, легких.
Больные находятся в подавленном состоянии, бледны; у них отмечаются акроцианоз, тахикардия и артериальная гипотензия; возможен бред. В 10—25 % случаев наблюдаются менингеальные симптомы, возбуждение, судороги с последующим развитием комы. Печень обычно увеличена, у некоторых больных выявляются признаки гепатаргии. Часто развиваются олигурия, микрогематурия, гипоизостенурия, азотемия. Иногда бывают осложнения в виде пневмоний, отека легких, тромбофлебита, острой почечной недостаточности, шока. Продолжительность лихорадки 4—8 дней.
Период реконвалесценции длительный, до 1—2 мес, характеризуется астеническим симптомокомплексом. У некоторых больных работоспособность восстанавливается в течение последующих 1—2 лет.
В эндемичных районах нередко наблюдаются абортивные формы болезни без выраженного геморрагического синдрома.
При лабораторных исследованиях, помимо характерных гематологических сдвигов, выявляются повышение показателей гематокрита, остаточного азота, активности аминотрансфераз, признаки метаболического ацидоза. Значительная тромбоцитопения и высокие показатели гематокрита могут свидетельствовать о неблагоприятном прогнозе.
Прогноз. Серьезный, летальность может достигать 40 %.
Диагностика. Распознавание болезни основывается на выявлении типичных признаков болезни: острого начала болезни с высокой лихорадкой, гиперемии лица, быстрого нарастания геморрагических проявлений, сосудистой недостаточности, нефропатии и гепатопатии у больных, относящихся к категории высокого риска (животноводы, охотники, геологи и др.).
Специфическая диагностика включает выделение вируса из крови в период вирусемии, использование серологических тестов: НРИФ, РТНГА, РСК.
Дифференциальная диагностика. Проводится с менингококковой инфекцией, гриппом, лептоспирозом, сыпным тифом, тромбоцитопенической пурпурой и болезнью Шенлейна —Геноха, у жителей тропических стран —с желтой лихорадкой и другими геморрагическими лихорадками.
Лечение. Осуществляется в соответствии с общими принципами терапии больных геморрагическими лихорадками. Получен положительный эффект от применения иммунной сыворотки по 60—100 мл (предложена М.П.Чумаковым в 1944 г.) или гипериммунного иммуноглобулина.
Профилактика. При госпитализации больных должна предусматриваться профилактика внутрибольничного заражения, в том числе парентеральным путем. В очагах болезни проводят комплекс дератизационных и дезинфекционных мероприятий. По показаниям необходимы вакцинация, введение иммуноглобулина.
Геморрагическая омская лихорадка
Исторические сведения. Геморрагическая омская лихорадка впервые описана в 1945—1948 гг. в ходе эпидемической вспышки в Омской и Новосибирской областях. С 1958 г. в связи с депрессией переносчика регистрация случаев болезни наблюдается редко.
Этиология. Возбудитель – вирус омской лихорадки рода Flavivirus, семейства Togaviridae.
Эпидемиология. Омская геморрагическая лихорадка – природно-очаговьгй вироз. Резервуар вирусов – ондатры, водяные крысы и другие грызуны. Переносчики – клещи Dermacentor pictus, возможно, другие клещи этого рода, гамазовые клещи и блохи.
Заражение человека происходит при контакте с инфицированными ондатрами, через укусы клещей, воздушно-пылевым путем в лабораторных условиях.
Наибольшая частота заболеваний обычно наблюдается в летние месяцы в период активности клещей.
Патогенез и патологоанатомическая картина. Изучены недостаточно. В результате вирусемии и гематогенной диссеминации вирусов развиваются характерный капилляротоксикоз, поражение центральной и вегетативной нервной системы, эндокринной системы (надпочечники). В ходе болезни формируется стойкий иммунитет.
Клиническая картина. Инкубационный период составляет 3—10 дней. Начальный период болезни протекает остро, с высокой лихорадкой, потрясающими ознобами, головной болью и миалгиями. Отмечаются разлитая гиперемия лица и шеи, яркая инъекция сосудов склер и конъюнктивы. С первых дней болезни можно выявить петехиальные элементы на слизистой оболочке полости рта, в зеве и на конъюнктивах.
В отличие от крымской геморрагической лихорадки геморрагическая экзантема при омской лихорадке отмечается непостоянно (у 20—25 % больных), реже наблюдается массивное кровотечение из желудочно-кишечного тракта и других органов.
В период разгара болезни возможно развитие менингоэнцефалита. У 30 % больных выявляют атипичную пневмонию или бронхит; часто обнаруживается гепатомегалия. У некоторых больных можно отметить преходящую протеинурию.
Лихорадочный период составляет 4—12 дней, в последних случаях лихорадка часто бывает двухволновой.
В гемограмме – лейкопения с нейтрофильным сдвигом влево, тромбоцитопения, отсутствие эозинофилов. В период второй температурной волны возможен нейтрофильный лейкоцитоз.
Прогноз. Заболевание характеризуется благоприятным течением и относительно невысокой летальностью (0,5—3 %).
Диагностика и лечение. Аналогичны таковым при крымской-конго геморрагической лихорадке.
Желтая лихорадка
Желтая лихорадка (febres flava) – острая вирусная природно-очаговая болезнь с трансмиссивной передачей возбудителя через укус комаров, характеризующаяся внезапным началом, высокой двухфазной лихорадкой, геморрагическим синдромом, желтухой и гепаторенальной недостаточностью. Болезнь распространена в тропических регионах Америки и Африки.
Желтая лихорадка относится к болезням, предусмотренным Международными медико-санитарными правилами, подлежит регистрации в ВОЗ.
Исторические сведения. Желтая лихорадка известна в Америке и Африке с 1647 г. В прошлом инфекция нередко принимала характер тяжелых эпидемий с высокой летальностью. Вирусная природа и передача вируса комарами Aedes aegypti установлена К.Финлеем и Комиссией У.Рида в 1901 г. на Кубе. Искоренение этого вида комаров обеспечило исчезновение городских очагов инфекции на Американском континенте. Вирус желтой лихорадки был выделен в 1927 г. в Африке.
Этиология. Возбудитель – вирус желтой лихорадки (flavivirus febricis) – относится к роду flavivirus, семейству Тоgaviridae.
Эпидемиология. Выделяют два эпидемиологических вида очагов желтой лихорадки – природные, или джунглевые, и антропоургические, или городские.
Резервуаром вирусов в случае джунглевой формы являются обезьяны мармозеты, возможно, грызуны, сумчатые, ежи и другие животные.
Переносчиком вирусов в природных очагах желтой лихорадки являются комары Aedes simpsoni, А. аfricanus в Африке и Наеmagogus sperazzini и др. в Южной Америке. Заражение человека в природных очагах происходит через укус инфицированного комара А. simpsoni или Наеmagogus, способного передавать вирус через 9—12 дней после заражающего кровососания.
Источником инфекции в городских очагах желтой лихорадки является больной человек в периоде вирусемии. Переносчиками вирусов в городских очагах являются комары Aedes aegypti.
Заболеваемость в джунглевых очагах обычно спорадическая и связана с пребыванием или хозяйственной деятельностью человека в тропических лесах. Городская форма протекает в виде эпидемий.
В настоящее время регистрируются спорадическая заболеваемость и локальные групповые вспышки в зоне тропических лесов в Африке (Заир, Конго, Судан, Сомали, Кения и др.), Южной и Центральной Америке.
Патогенез и патологоанатомическая картина. Инокулированный вирус желтой лихорадки гематогенно достигает клеток системы макрофагов, реплицируется в них в течение 3—6, реже 9—10 дней, затем вновь проникает в кровь, обусловливая вирусемию и клиническую манифестацию инфекционного процесса. Гематогенная диссеминация вируса обеспечивает его внедрение в клетки печени, почек, селезенки, костного мозга и других органов, где развиваются выраженные дистрофические, некробиотические и воспалительные изменения. Наиболее характерны возникновение очагов колликвационного и коагуляционного некрозов в мезолобулярных отделах печеночной дольки, формирование телец Каунсилмена, развитие жировой и белковой дистрофии гепатоцитов. В результате указанных повреждений развиваются синдромы цитолиза с повышением активности АлАТ и преобладанием активности АсАТ, холестаза с выраженной гипербилирубинемией.
Наряду с поражением печени для желтой лихорадки характерно развитие мутного набухания и жировой дистрофии в эпителии канальцев почек, возникновение участков некроза, обусловливающих прогрессирование острой почечной недостаточности.
При патологоанатомическом исследовании обращают на себя внимание багрово-цианотичная окраска кожных покровов, распространенная желтуха и геморрагии в коже и на слизистых оболочках. Размеры печени, селезенки и почек увеличены, в них выявляются признаки жировой дистрофии. В слизистой оболочке желудка и кишечника определяются множественные эрозии и геморрагии. Помимо изменений в печени, закономерно обнаруживают дистрофические изменения в почках, миокарде. Часто выявляются геморрагии в периваскулярных пространствах головного мозга; поражается и сердечно-сосудистая система.
При благоприятном течении болезни формируется стойкий иммунитет.
Клиническая картина. В течении болезни выделяют 5 периодов. Инкубационный период длится 3—6 дней, реже удлиняется до 9—10 дней.
Начальный период (фаза гиперемии) протекает в течение 3—4 дней и характеризуется внезапным повышением температуры тела до 39—41 °С, выраженным ознобом, интенсивной головной болью и разлитыми миалгиями. Как правило, больные жалуются на сильные боли в поясничной области, у них отмечаются тошнота и многократная рвота. С первых дней болезни у большинства больных наблюдаются резко выраженная гиперемия и одутловатость лица, шеи и верхних отделов груди. Сосуды склер и конъюнктивы ярко гиперемированы («кроличьи глаза»), отмечаются фотофобия, слезотечение. Часто можно наблюдать прострацию, бред, психомоторное возбуждение. Пульс обычно учащен, в последующие дни развиваются брадикардия и гипотензия. Сохранение тахикардии может свидетельствовать о неблагоприятном течении болезни. У многих увеличена и болезненна печень, а в конце начальной фазы можно заметить иктеричность склер и кожи, наличие петехий или экхимозов.
Фаза гиперемии сменяется кратковременной (от нескольких часов до 1—1,5 сут) ремиссией с некоторым субъективным улучшением. В ряде случаев в дальнейшем наступает выздоровление, однако чаще следует период венозных стазов.
Состояние больного в этот период заметно ухудшается. Вновь до более высокого уровня повышается температура, нарастает желтуха. Кожные покровы бледные, в тяжелых случаях цианотичные. На коже туловища и конечностей появляется распространенная геморрагическая сыпь в виде петехий, пурпуры, экхимозов. Наблюдаются значительная кровоточивость десен, многократная рвота с кровью, мелена, носовые и маточные кровотечения. При тяжелом течении болезни развивается шок. Пульс обычно редкий, слабого наполнения, артериальное давление неуклонно снижается; развиваются олигурия или анурия, сопровождающиеся азотемией. Нередко наблюдается токсический энцефалит.
Смерть больных наступает в результате шока, печеночной и почечной недостаточности на 7—9-й день болезни.
Продолжительность описанных периодов инфекции составляет в среднем 8—9 дней, после чего заболевание переходит в фазу реконвалесценции с медленной регрессией патологических изменений.
Среди местных жителей эндемичных районов желтая лихорадка может протекать в легкой или абортивной форме без желтухи и геморрагического синдрома, что затрудняет своевременное выявление больных.
При лабораторных исследованиях в начальной фазе болезни обычно отмечаются лейкопения со сдвигом лейкоцитарной формулы влево до промиелоцитов, тромбоцитопения, а в период разгара – лейкоцитоз и еще более выраженная тромбоцитопения, повышение показателей гематокрита, гиперкалиемия, азотемия; в моче – эритроциты, белок, цилиндры.
Выявляются гипербилирубинемия и повышение активности аминотрансфераз, преимущественно АсАТ.
Прогноз, В настоящее время летальность от желтой лихорадки приближается к 5 %.
Диагностика. Распознавание болезни основано на выявлении характерного клинического симптомокомплекса у лиц, относящихся к категории высокого риска заражения (невакцинированные люди, посещавшие джунглевые очаги желтой лихорадки на протяжении 1 нед до начала болезни).
Диагноз желтой лихорадки подтверждается выделением из крови больного вируса (в начальном периоде болезни) или антител к нему (РСК, НРИФ, РТПГА) в более поздние периоды болезни.
Дифференциальная диагностика. Проводят с другими видами геморрагических лихорадок, вирусным гепатитом, малярией.
Лечение. Больных желтой лихорадкой госпитализируют в стационары, защищенные от проникновения комаров; проводят профилактику парентерального заражения.
Терапевтические мероприятия включают комплекс противошоковых и дезинтоксикационных средств, коррекцию гемостаза. В случаях прогрессирования печеночно-почечной недостаточности с выраженной азотемией проводят гемодиализ или перитонеальный диализ.
Профилактика. Специфическую профилактику в очагах инфекции осуществляют живой аттенуированной вакциной 17 Д и реже – вакциной «Дакар». Вакцина 17 Д вводится подкожно в разведении 1:10 по 0,5 мл. Иммунитет развивается через 7—10 дней и сохраняется в течение б лет. Проведение прививок регистрируется в международных сертификатах. Непривитые лица из эндемичных районов подвергаются карантину в течение 9 дней.
Энцефалиты вирусные
Энцефалит клещевой весенне-летний
Син.: клещевой энцефалит, таежный энцефалит, русский дальневосточный энцефалит, весенне-летний менингоэнцефалит, клещевой энцефаломиелит и др.
Энцефалит клещевой (encephalitis acarina) – вирусная природно-очаговая трансмиссивная болезнь с преимущественным поражением ЦНС.
Переносчиками вирусов являются иксодовые клещи. Известны три нозогеографических варианта болезни – восточный, западный и двухволновый (двухволновая молочная лихорадка), различающиеся по ряду клинико-эпидемиологических параметров.
Исторические сведения. Тяжелые заболевания, сопровождающиеся поражением ЦНС и приводившие к высокой летальности, стали отмечаться, начиная с 1932 г., в ряде районов таежной зоны Дальнего Востока. В 1935 г. А.Г. Панов установил клиническую самостоятельность болезни, отнес ее к энцефалиту В. Комплексные экспедиции Наркомздрава СССР, руководимые Л.А.Зильбером, Е.Н.Павловским, А.А.Смородинцевым, И.И.Рогозиным в 1937—1941 гг., выявили 29 штаммов возбудителей энцефалита, установили роль иксодовых клещей как переносчиков вирусов, изучили в общих чертах эпидемиологические особенности инфекции, ее клинические проявления, патоморфологию, разработали методы специфической профилактики и лечения болезни. В 1951—1954гг. А.А.Смородинцевым, М.П.Чумаковым и др. в западных районах СССР была описана своеобразная нозогеографическая форма клещевого энцефалита – двухволновая молочная лихорадка (Самостоятельность двухволновой молочной лихорадки, установленная А.А.Смородинцевым в 1951—1955 гг., в настоящее время многими исследователями подвергается сомнению).
Этиология. Возбудитель клещевого энцефалита относится к комплексу вирусов клещевого энцефалита роду Flavivirus, семейству Тоgaviridае, экологической группы Arboviruses. Вирусы имеют вид круглых частиц размером 25—40 им, содержат РНК, окруженную белковой оболочкой. Введение в эксперименте вирусной РНК животным вызывает у них болезнь, аналогичную вызываемой полным вирусом. Различают восточные («персулькатные») и западные («рицинусные») антигенные варианты вирусов, вызывающих различные нозогеографические формы клещевого энцефалита.
Вирус культивируется на куриных эмбрионах и клеточных культурах различного происхождения.
Из лабораторных животных наиболее чувствительны к вирусу белые мыши, сосунки хлопковых крыс, хомяки, обезьяны, из домашних животных – овцы, козы, поросята и лошади.
Вирус клещевого энцефалита обладает различной степенью устойчивости к факторам внешней среды: при нагревании до 60°С он погибает через 10 мин, а при кипячении – через 2 мин. Вирус быстро разрушается при ультрафиолетовом облучении, воздействии лизола и хлорсодержащих препаратов.
Антигенные свойства вирусов клещевого энцефалита отличаются от свойств других арбовирусов, что используется для серологической идентификации клещевого энцефалита.
Эпидемиология. Клещевой энцефалит – трансмиссивная природно-очаговая инфекция.
Основными резервуарами и переносчиками возбудителей являются иксодовые клещи Ixodes persulcatus, преобладающие в восточных районах России, и Ixodes ricinus, обитающий преимущественно в западных районах России и ряде европейских стран, а также некоторые другие виды иксодовых и гамазовых клещей. Спустя 5—6 дней после кровососания на инфицированном животном вирус проникает во все органы клеща, концентрируясь в половом аппарате, кишечнике, слюнных железах, сохраняется в течение всей жизни членистоногого (2—4 года), что определяет механизм заражения животных и человека и трансовариальную и трансфазовую передачу вируса у клещей. В различных очагах болезни инфицированность клещей достигает 1—3 %, а в отдельные годы – 15—20 %.
Дополнительными резервуарами вирусов клещевого энцефалита являются около 130 видов грызунов и других диких млекопитающих – «прокормителей» клещей: ежи, кроты, белки, бурундуки, полевки, белозубки и т.д., а также некоторые птицы: рябчики, поползни, зяблики, дрозды и др.
Человек наиболее часто заражается клещевым энцефалитом трансмиссивным путем через укус вирусофорного клеща; вероятность заражения возрастает с увеличением длительности кровососания. Раздавливание клещей в процессе их удаления и занесение вирусов на слизистые оболочки глаза или на поврежденные участки также могут привести к заражению в естественных и лабораторных условиях. Существует алиментарный путь заражения человека клещевым энцефалитом при употреблении в пищу сырого козьего или коровьего молока.
Зона обитания основных резервуаров вирусов определяет границы очагов инфекции.
Выделяют три типа очагов болезни: I тип – природные очаги в условиях дикой природы; II тип – переходные очаги с измененным составом компонентов биоценоза как результат хозяйственной деятельности человека; III тип – антропоургические (вторичные) очаги на территориях вблизи населенных пунктов, где прокормителями клещей, кроме грызунов, становятся и домашние животные. В зависимости от биотических и абиотических факторов выделяют 7 групп очаговых регионов. Очаги клещевого энцефалита известны в таежной зоне Дальнего Востока, в лесных районах Сибири, Урала, Восточного Казахстана, европейской части России, в Чехии, Словакии, Болгарии, Австрии, Венфии, Польше, Швеции, Финляндии.
Заболеваемость клещевым энцефалитом имеет сезонный характер, достигая максимума в мае – июне. Второй, менее выраженный подъем заболеваемости наблюдается в конце лета – начале осени, что обусловлено численностью и активностью клещей в природе.
Патогенез и патологоанатомическая картина. Входными воротами инфекции при трансмиссивном заражении служит кожа, а при алиментарном – слизистая оболочка пищеварительного тракта.
После репликации в области входных ворот вирус гематогенно и лимфогенно диссеминирует в лимфатические узлы, внутренние органы и достигает ЦНС, где оказывает прямое действие на нервные клетки и индуцирует мезенхимально-воспалительную реакцию, усиливающую патогенный эффект вируса. При алиментарном заражении вначале наблюдается висцеральная фаза с вирусемией и репликацией вируса во внутренних органах, а в дальнейшем возникает вторичная вирусемия с поражением ЦНС (двухволновой менингоэнцефалит). В ряде случаев процесс принимает хроническое прогредиентное течение с профессированием морфологических повреждений.
В патологический процесс вовлекается серое вещество головного и спинного мозга, в особенности двигательные нейроны спинного и ствола головного мозга. Наблюдается поражение нервной ткани в среднем мозге, таламической и гипоталамической областях, в коре головного мозга и мозжечка. В корешках периферических нервов развивается картина интерстициального неврита. Закономерно происходит поражение мягких оболочек мозга.
При вскрытии часто обнаруживаются отечность мозговых оболочек и вещества мозга, расширение и полнокровие сосудов, геморрагии, признаки нарушения ликворо– и гемодинамики. Уже в ранней, предпаралитической фазе болезни отмечаются пролиферация микроглии, феномен нейрофагии. Наиболее выраженные некробиотические процессы развиваются в передних рогах шейного отдела спинного мозга, в ядрах черепных нервов и ретикулярной субстанции.
Обычно отмечается полнокровие внутренних органов, нередки кровоизлияния в серозные оболочки, слизистую оболочку желудка, дыхательных путей, кишечника.
При остром течении процесса наблюдается медленная репарация повреждений и формируется стойкий иммунитет. Нарушения иммунного статуса определяют неуклонно прогрессирующее течение болезни со стойкими необратимыми парезами и параличами.
Клиническая картина. Инкубационный период продолжается 3—21 день, в среднем 10—14 дней.
В течении болезни различают начальную фазу, протекающую с преобладанием общетоксического синдрома, фазу неврологических расстройств, характеризующуюся различными вариантами поражения центральной и периферической нервной системы, и фазу исходов (выздоровление с постепенным восстановлением или сохранением остаточных неврологических нарушений, формирование прогредиентных хронических вариантов или гибель больных).
В зависимости от глубины и выраженности неврологических расстройств выделяют лихорадочную, менингеальную, менингоэнцефалитическую, менингоэнцефалополиомиелитическую и полирадикулоневритическую формы болезни. Лихорадочная и менингеальная формы являются основными при западных вариантах клещевого энцефалита, паралитические формы преобладают при восточном варианте болезни.
По степени тяжести клинической картины болезни выделяются следующие типы клещевого энцефалита: 1) заболевание с абортивным течением (или легкая форма болезни), лихорадкой в течение 3—5 дней, преходящими признаками серозного менингита и выздоровлением в течение 3—5 нед;
2) заболевания средней тяжести, протекающие с менингеальными и общемозговыми симптомами, имеющими доброкачественную динамику с выздоровлением в течение 1,5—2 мес;
3) тяжелые формы с высокой летальностью, затяжным и неполным выздоровлением, стойкими резидуальными признаками в виде парезов, параличей, мышечной атрофии. Известны молниеносные формы болезни, заканчивающиеся летально в первые сутки заболевания еще до развития характерной клинической картины, а также хронические и рецидивирующие формы клещевого энцефаломиелита.
В 8—15 % случаев болезни наблюдается непродолжительный продром: головная боль, слабость, утомляемость, нарушение сна, корешковые боли, чувство онемения в коже лица или туловища, психические нарушения.
Болезнь, как правило, развивается остро, внезапно. Возникает высокая лихорадка с подъемом температуры до 39—40,5 °С продолжительностью 3—12 дней, отмечаются жар, ознобы, мучительная головная боль, ломящие боли в конечностях, поясничной области, тошнота, повторная рвота, общая гиперестезия, фотофобия, боль в глазных яблоках.
Обычно с 3—4-го дня, а иногда и в первые часы болезни наблюдаются признаки очагового поражения ЦНС: парестезии, парезы конечностей, диплопия, эпилептиформные судороги. Сознание в первые дни болезни сохранено, но больные заторможены, безучастны к окружающему, сонливы. Изредка наблюдаются оглушенность, бред, возможны сопор и кома.
В остром периоде лицо больных гиперемировано, инъецированы сосуды склер и конъюнктивы, отмечается гиперемия кожи шеи и груди. Характерны брадикардия, приглушенность сердечных тонов, артериальная гипотензия. Выявляются электрокардиографические признаки нарушения проводимости, стойкие, но обратимые признаки дистрофии миокарда. Тяжелая миокардиодистрофия может обусловить развитие у больных картины острой сердечной недостаточности, ведущей к смертельному исходу болезни.
Часто отмечаются гиперемия слизистой оболочки верхних дыхательных путей, учащение дыхания, одышка. Нередко выявляются ранние и поздние пневмонии; последние, протекающие на фоне нарушения центральной регуляции дыхания и кровообращения, прогностически неблагоприятны.
Характерны изменения пищеварительной системы в виде обложенности языка, при этом часто бывают тремор языка, вздутие живота и задержки стула. В случаях алиментарного заражения часто отмечается гепатолиенальный синдром.
В остром периоде наблюдаются нейтрофильный лейкоцитоз (до 10,0—20,0 * 10^9 /л), увеличение СОЭ, гипогликемия, транзиторная протеинурия.
Лихорадочная форма клещевого энцефалита характеризуется доброкачественным течением и ограничивается развитием общетоксического синдрома.
Менингеальная форма протекает доброкачественно с развитием общетоксического синдрома и признаков серозного менингита. Характерно возникновение высокой лихорадки, сильной головной боли в теменно-затылочной области, усиливающейся при движении, повторной рвоты на высоте головной боли, фотофобии, гиперакузии и гиперестезии кожи, неравномерности сухожильных рефлексов. С первых дней болезни выявляются оболочечные симптомы: ригидность мышц затылка, симптомы Кернига, Брудзинского и др., сохраняющиеся в течение 2—3 нед. У некоторых больных могут наблюдаться преходящие энцефалитические симптомы.
При исследовании цереброспинальной жидкости – повышение ее давления до 200—400 мм вод.ст., лимфоцитарный умеренный плеоцитоз, незначительное повышение уровня белка, глюкозы и хлоридов.
Менингоэнцефалитическая форма болезни характеризуется развитием диффузного или очагового поражения головного мозга.
При диффузном клещевом менингоэнцефалите, кроме общетоксических и менингеальных симптомов, рано выявляется нарушение сознания больных от легкой заторможенности до глубокого сопора и комы. При благоприятном прогнозе сознание проясняется через 10—12 дней, но сохраняется сонливость. У части больных в остром лихорадочном периоде наблюдаются бред, галлюциноз, психомоторное возбуждение с утратой ориентации во времени и обстановке. В первые дни болезни отмечаются двигательные расстройства в виде парциальных или генерализованных единичных или многократных эпилептиформных припадков, что обычно ухудшает прогноз. Часто наблюдаются фибриллярные подергивания мышц лица и конечностей, тремор рук, угнетение глубоких рефлексов, снижение мышечного тонуса.
При очаговом менингоэнцефалите клинические проявления определяются зоной поражения ЦНС. Поражение белого вещества одного из полушарий головного мозга влечет возникновение спастических парезов правых или левых конечностей и парезов лицевого и подъязычного нервов с той же стороны. При локализации процесса в левом полушарии возникает также расстройство речи.
Поражение белого вещества в стволовом отделе мозга приводит к развитию пареза черепных нервов на стороне очага воспаления и пареза конечностей на противоположной стороне тела (альтернирующий синдром). В периоде реконвалесценции двигательные нарушения восстанавливаются в течение 2—3 мес.
Наряду с симптомами выпадения двигательных функций могут наблюдаться гиперкинезы в виде клонических судорог конечностей или части тела. В отдельных случаях стойкие миоклонические гиперкинезы в сочетании с эпилептиформными припадками входят в синдром кожевниковской эпилепсии. Возможны приступы джексоновской эпилепсии. Корковая и стволовая локализация поражения приводят к тикообразным и хореиформным подергиваниям мышц.
Характерным признаком клещевого энцефалита является сочетанное пражение черепных нервов, обусловленное повреждением серого вещества головного мозга. Черепные нервы вовлекаются в патологический процесс с различной частотой.
Наблюдается поражение глазодвигательных нервов и симпатической иннервации глаза, приводящие к птозу, косоглазию и диплопии. Нередко отмечается парез лицевого нерва, реже страдают зрительный, слуховой и вестибулярный нервы.
Распространение процесса на область ядер IX, X, XII пар черепных нервов, столь характерное для клещевого энцефалита, приводит к возникновению ранних бульбарных симптомов: парезу мягкого неба, гнусавости голоса, смазанности речи, афонии, нарушению глотания, повышению саливации с заполнением слизью дыхательных путей, тахикардии, диспноэ. Частота бульбарных расстройств достигает 25 %.
Менингоэнцефалополиомиелитическая форма болезни характеризуется наряду с общетоксическим и менингеальным синдромами возникновением признаков диффузного энцефалита, очагового энцефалита и поражения серого вещества спинного мозга. Последние относятся к типичным клиническим признакам болезни, возникают уже в первые дни заболевания и спустя 3—4 дня становятся наиболее выраженными.
У больных развиваются ранние вялые парезы мышц шеи, туловища, конечностей, симметрично поражающие мускулатуру шеи, плечевого пояса, верхних конечностей, иногда межреберную мускулатуру и диафрагму. Двигательные нарушения нижних конечностей выявляются редко и выражены незначительно, но известны и параличи восходящего типа, начинающиеся с нижних конечностей и затем распространяющиеся на туловище и верхние конечности. В период исходов болезни наряду с парезами наблюдается резко выраженная атрофия мышц, особенно дельтовидных, трапециевидных, двуглавых, трехглавых и грудных. При этом голова не удерживается в вертикальном положении, пассивно свисает, движения верхних конечностей почти полностью утрачиваются. Мышечная атрофия наблюдается и в случаях реконвалесценции с исчезновением парезов.
Полирадикулоневритическая форма клещевого энцефалита, наблюдаемая у 2—4 % больных, проявляется наряду с общетоксическими и менингеальными симптомами признаками поражения корешков и периферических нервов. Характерны парестезии в виде «ползания мурашек», покалывания в коже различных участков, боли по ходу нервных стволов, положительные симптомы «натяжения» (Лассега и др.), расстройство чувствительности в дистальных отделах конечностей по типу «перчаток» и «носков».
Двухволновой менингоэнцефалит (двухволновая молочная лихорадка), регистрируемый в европейских очагах клещевого энцефалита, характеризуется развитием двухфазной температурной реакции, продолжительностью каждая 2—15 дней с интервалом 1—2 нед, преобладанием общетоксического синдрома в ходе первой температурной волны и развитием менингеальных и общемозговых признаков при повторном повышении температуры тела с быстрой положительной динамикой и выздоровлением без остаточных явлений.
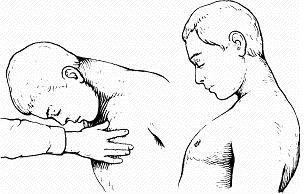
Рис. Остаточные явления после перенесенного клещевого энцефалита (паралич шейных мышц).
Диагностика. Клиническая диагностика клещевого энцефалита основывается на комплексе эпидемиологических и клинико-лабораторных данных, выявляющих характерные синдромы болезни.
Специфическая диагностика болезни проводится с помощью вирусологических и серологических методов. Вирусологический метод предполагает выделение вируса из крови и цереброспинальной жидкости больного (в первые 5—7 дней болезни) или головного мозга умерших людей – путем внутримозгового заражения новорожденных белых мышей исследуемым материалом, а также с использованием культуры клеток и последующей идентификацией вируса с помощью метода флюоресцирующих антител (МФА).
Наряду с вирусологическими широко применяют серологические методы верификации диагноза с использованием РСК, РДПА, РПГА, ИФА, РН в парных сыворотках крови больных, взятых с интервалом 2—3 нед.
Дифференциальная диагностика. Проводится с менингитами и энцефалитами иного генеза, полиомиелитом, сосудистыми поражениями головного мозга, комами различного генеза, опухолями ЦНС, абсцессами головного мозга.
Лечение. Комплексная терапия клещевого энцефалита включает специфические, патогенетические и симптоматические средства. Для специфической терапии применяют противоэнцефалитный донорский иммуноглобулин, вводимый внутримышечно ежедневно по 3—12 мл в течение 3 дней. При тяжелой форме болезни препарат вводят 2 раза в сутки в дозе 6-12 мл с интервалом 12 ч, в последующие дни – 1 раз в день. При появлении второй волны лихорадки требуется повторное введение препарата.
Одновременно проводят дезинтоксикационную, дегидратационную терапию, при тяжелом течении болезни – противошоковую, назначают кортикостероиды, осуществляют борьбу с дыхательной недостаточностью. При судорожном синдроме применяют 25 % раствор сульфата магния, реланиум, натрия оксибутират, барбитураты и другие седативные средства. В периоде стихания острых проявлений болезни назначают витамины группы В, прозерин, дибазол, антигистаминные препараты. Выписка больных производится через 2—3 нед: после нормализации температуры, при отсутствии неврологических расстройств. Реконвалесценты подлежат диспансеризации.
Профилактика. В очагах клещевого энцефалита применяют комплекс мероприятий по защите населения от нападения клещей (противоклещевые комбинезоны, репелленты – диметил– и дибутилфталаты), проводят взаимоосмотры с удалением и уничтожением обнаруженных клещей. После удаления присосавшихся клещей применяют специфический донорский иммуноглобулин (взрослым по 3 мл внутримышечно). Не рекомендуется использовать в пищу некипяченое молоко.
Специфическая профилактика проводится по эпидемическим показаниям за 1—1,5 мес до сезона активности клещей. Тканевую инактивированную или живую аттенуированную вакцины вводят по 1 мл под кожу трехкратно с интервалами от 3 мес до 1 года с последующей ежегодной ревакцинацией по 1 мл вакцины.
Энцефалит японский
Син.: комариный энцефалит, осенний энцефалит, энцефалит В
Энцефалит японский (encephalitis japonica) – острая вирусная трансмиссивная природно-очаговая болезнь, протекающая с развитием тяжелого менингоэнцефалита и общетоксического синдрома, отличается высокой летальностью.
Исторические сведения. Эпидемические вспышки болезни с летальностью до 60 % описывались в Японии с 1871 г. В 1924—1925 гг. Футаки, а также Р.Канеко и И.Аоки выделили заболевание в самостоятельную нозоформу. В 1933—1936 гг. Хаиаши выделил вирус и установил его передачу при укусе комара.
В России японский энцефалит описан А.А.Смородинцевым, А.К.Шубладзе, П.А.Петрищевой и М.Б.Кролем в 1938 г. в Южном Приморье.
Этиология. Возбудитель японского энцефалита – вирус рода Flavivirus, семейства Togaviridae, экологической группы Arboviruses является РНК-содержащим вирусом размером 15—50 нм, относится к термолабильным вирусам: инактивируется при нагревании до 56 °С через 30 мин, при кипячении – через 2 мин, но в лиофилизированном состоянии сохраняется неограниченно долго. По антигенным свойствам близок к вирусам энцефалита Сан-Луи и Западного Нила.
К вирусу чувствительны обезьяны, белые мыши, хомяки, полевки, некоторые домашние животные и птицы.
Эпидемиология. Японский энцефалит – трансмиссивная природно-очаговая инфекция. Резервуаром вирусов являются дикие и домашние млекопитающие и птицы.
Механизм заражения – трансмиссивный, через укус комаров. Основными переносчиками являются комары Culex tritaeniarhynhus, С.рipiens, С. bitaeniarhunchus, Аеdes japonicus, Аеdes togoi у которых предполагается трансовариальная передача вирусов.
Различают природные и антропургические очаги инфекции. В природных очагах (луговых, морских, прибрежных и лесных) резервуаром вирусов служат дикие животные (грызуны, птицы), возможно иксодовые, гамазовые и краснотелковые клещи.
В антропургических (сельских и городских) очагах в эпидемическую цепь включаются домашние животные (свиньи, овцы, коровы, лошади, домашняя птица и др.) и человек.
Японскому энцефалиту свойственна четкая сезонность с повышением заболеваемости в августе – сентябре, продолжительность вспышек не превышает 40—50 дней. Вспышкам болезни предшествуют жаркая погода и обилие осадков, с образованием большого числа временных водоемов – мест выплода комаров.
Восприимчивость к болезни высокая во всех возрастных группах, в сельских очагах болеют преимущественно мужчины, работающие вблизи заболоченных водоемов.
В эндемичных районах часто выявляются латентные формы инфекции с формированием стойкого иммунитета.
Природные и антропургические очаги болезни выявлены в Приморском крае и на Дальнем Востоке, в Японии, Восточном и Среднем Китае, Индии, Корее, Вьетнаме, на Филиппинах и некоторых других территориях Юго-Восточной Азии.
Патогенез и патологоанатомическая картина. Из места инокуляции вирусы гематогенно диссеминируют по всем системам и органам человека, вызывая поражение эндотелия микрососудов с развитием серозно-геморрагического интерстициального отека и геморрагии в миокарде, почках, печени, желудочно-кишечном тракте и других органах.
Вследствие нейротропности вируса, а также в результате иммунопатологических реакций, наиболее глубокие морфофункциональные изменения развиваются в ЦНС. Характерны формирование периваскулярных инфильтратов, появление отека и геморрагии в сером и белом веществе головного мозга и мозговых оболочках, возникновение циркуляторных расстройств и некротических очагов преимущественно в области базальных ядер, зрительных бугров, лобных долей, мозжечка. Менее значительные изменения возникают в спинном мозге.
При циклическом течении инфекционного процесса постепенно развиваются саногенные и репаративные реакции, формируется стойкий иммунитет.
Клиническая картина. Инкубационный период продолжается 4—21 день, в среднем 8—14 дней. Различают периоды болезни: начальный, разгара и реконвалесценции.
Начальный период, продолжительностью 3—4 дня, развивается остро, обычно без продромальных симптомов: наблюдается внезапный подъем температуры до 39—40°С, даже до 41°С, и на этом уровне она остается 6—10 дней. Кроме температурной реакции, к первичным признакам заболевания относятся озноб, головная боль, особенно в области лба, боли в пояснице, животе, конечностях, тошнота, рвота. Лицо, склеры и верхние отделы грудной клетки гиперемированы. Отмечается повышенная потливость.
Вследствие нарушения функции гипоталамической области учащается пульс до 120—140 уд/мин, повышается артериальное давление, периферические капилляры резко сужаются.
Часто отмечается болезненность мышц и нервных стволов, определяются ригидность мышц затылка, повышение мышечного тонуса, нарушение функции глазодвигательных мышц. Сухожильные рефлексы повышены. При тяжелом течении болезни может наступить смерть больного.
В разгар болезни, с 3—4-го дня заболевания, возникают и прогрессируют симптомы очагового поражения головного мозга, нарастают признаки менингеального синдрома, отмечается угнетение сознания вплоть до комы, часто бывают психические расстройства: делириозный статус, галлюциноз, бред.
Повышение мышечного тонуса экстрапирамидного и пирамидного характера является причиной вынужденного положения больного в постели: на спине или на боку с запрокинутой головой, согнутыми руками и ногами. Мышечная гипертония распространяется на жевательные и затылочные мышцы. При глубоком поражении пирамидной системы могут возникать спастические гемипарезы, монопарезы и параличи.
Характерны хореиформные гиперкинезы мышц лица, верхних конечностей; при тяжелом течении болезни могут развиваться клонические или тонические судороги, наблюдаются эпилептиформные припадки. У некоторой части больных отмечено возникновение стереотипии, состоящей в многократном повторении одного и того же движения, и каталепсии.
Изменения в двигательной сфере, возникающие в остром периоде болезни, нестойкие; они исчезают по мере улучшения состояния больного. Часто наблюдаются центральные парезы лицевого нерва с асимметрией носогубных складок.
В остром периоде во всех случаях заболевания отмечаются гиперемия диска зрительного нерва, реже кровоизлияние и отек. Нарушается свето– и цветоощущение, сужается поле зрения.
Возможно развитие бронхита и лобарных пневмоний. В гемограмме – нейтрофильный лейкоцитоз (до 15,0—20,0 * 10^9 /л), лимфопения, анэозинофилия, повышение СОЭ до 20—30 мм/ч.
Цереброспинальная жидкость прозрачна, давление ее повышено незначительно, увеличено содержание белка, характерен умеренный лимфоцитарный плеоцитоз.
В период реконвалесценции, продолжительностью 4—7 нед, температура обычно нормальная или субфебрильная. Сохраняются некоторые остаточные симптомы органического поражения головного мозга (гемипарез, нарушения координации движений, мышечная слабость, психические нарушения и др.). Встречаются также поздние осложнения: пневмонии, пиелоциститы, пролежни.
Наряду с тяжелыми наблюдаются и легкие формы японского энцефалита, протекающие без стойкой неврологической симптоматики.
Прогноз. Японский энцефалит – тяжелое заболевание, летальность 25—80 %. Смерть наступает чаще всего в первые 7 дней при коматозном состоянии, бульбарных явлениях, судорожных приступах.
У реконвалесцентов часто выявляются остаточные явления: психические нарушения в виде астенических состояний, снижения интеллекта, психозов, парезы, параличи, гиперкинезы.
Диагностика. Распознавание японского энцефалита основано на совокупности клинических, эпидемиологических и лабораторных данных. Необходимо учитывать острое начало заболевания, раннее появление психических расстройств, богатство симптомов диффузного поражения нервной системы у больных из очагов инфекции в сезон передачи вирусов.
Диагноз подтверждают путем выделения вируса из крови или цереброспинальной жидкости больных и головного мозга погибших (с использованием лабораторных животных или клеточных культур НеLа и др.), а также с помощью серологических тестов – РСК, РТГА, РИ, НРИФ и др.
Дифференциальная диагностика. Проводится с серозными менингитами, клещевым и другими энцефалитами.
Лечение. Больным проводят специфическую и патогенетическую терапию. Специфическую терапию осуществляют в лихорадочный период с помощью иммуноглобулина по 3—6 мл три раза в день ежедневно или сыворотки реконвалесцентов по 20—30 мл, а также гипериммунной лошадиной сыворотки по 15—20 мл внутримышечно или внутривенно в первые 5—7 дней болезни.
Патогенетическая терапия включает дезинтоксикационные и диуретические средства, кортикостероиды, седативные и противосудорожные средства. При нарушении дыхания, сердечно-сосудистой деятельности и коматозном состоянии проводят реанимационные мероприятия.
Реконвалесценты подлежат длительной диспансеризации с участием невропатолога и психиатра.
Профилактика. В очагах японского энцефалита проводят комплекс противокомариных мероприятий, осуществляют меры по защите от нападения комаров и созданию активного иммунитета у населения.
Иммунизацию проводят по эпидемическим показаниям населению эндемических очагов с помощью формолвакцины. Для экстренной пассивной профилактики применяют однократно 10 мл гипериммунной лошадиной сыворотки или 6 мл иммуноглобулина.
Риккетсиозы
Риккетсиозы— группа острых трансмиссивных болезней человека, вызываемых риккетсиями. Протекают с развитием выраженной интоксикации и генерализованного васкулита, поражениями ЦНС, внутренних органов и характерными высыпаниями на коже.
Возбудители – риккетсии (названные в честь американского исследователя Г.Т.Риккетса, погибшего при изучении сыпного тифа), относятся к семейству Rickettsiасеае, включающему три рода: Rickettsia, Pochalimea, Сохiella.
Различают антропонозные риккетсиозы, возбудители которых циркулируют между человеком и его специфическими эктопаразитами – вшами (эпидемический сыпной тиф, волынская лихорадка), и зоонозные, возбудители которых циркулируют между домашними (в антропургических очагах) или дикими (в природных очагах) животными и кровососущими членистоногими, способными заражать риккетсиями и человека. В связи с трансовариальной передачей риккетсии у акариформных и иксодовых клещей последние являются не только переносчиками, но и стойкими резервуарами инфекции в природных условиях.
Выделяют 6 групп риккетсиозов, из них описаны у человека 5 групп: I – группа сыпного тифа: эпидемический сыпной тиф, эндемический (блошиный) сыпной тиф; II – группа клещевых пятнистых лихорадок: пятнистая лихорадка Скалистых гор, марсельская лихорадка (с нозогеографическими вариантами: южноафриканский и восточноафриканский риккетсиозы), совероазиатский клещевой риккетсиоз, североавстралийский сыпной тиф, осповидный (везикулезный) риккетсиоз; III – группа цуцугамуши: цуцугамуши; IV – группа Ку-лихорадки: Ку-лихорадка; V – группа пароксизмальных риккетсиозов: волынская (траншейная) лихорадка, пароксизмальный риккетсиоз.
Тиф сыпной эпидемический и болезнь Брилла
Син.: тиф сыпной вшиный, тиф европейский сыпной; болезнь Брилла – повторный, рецидивный, спорадический сыпной тиф
Тиф сыпной эпидемический (Турhus exanthematicus) – острый антропонозный риккетсиоз, характеризующийся развитием генерализованного пантромбоваскулита и проявляющийся тяжелой общей интоксикацией, менингоэнцефалитом, розеолезно-петехиальной сыпью, гепатоспленомегалией. Нередко возникают отдаленные доброкачественно протекающие рецидивы инфекции – болезнь Брилла.
Исторические сведения. Сыпной тиф был известен еще античным врачам, но первое достоверное описание его принадлежит Дж.Фракасторо. В самостоятельную нозологическую форму болезнь выделена А.Логвиновским, Я.Шировским, Я.Говоровым и подробно описана В.Герхардом в Америке, В.Гризингером в Германии, С.П.Боткиным в России.
Инфекционная природа болезни была доказана О.О.Мочутковским в опыте самозаражения кровью сыпнотифозного больного в 1876 г. В том же году Д.В.Попов описал характерные гранулемы в головном мозге погибшего от сыпного тифа (узелки Попова).
В 1909 г. Г.Т.Риккетс, Р.Уилдер в крови больного мексиканским сыпным тифом и в 1913 г. С.Провачек в крови больного сыпным тифом в Сербии обнаружили микроорганизмы, названные бразильским исследователем Э. да Роша Лима в 1916 г. Rickettsia prowazekii в честь умерших от сыпного тифа ученых.
Передачу возбудителей вшами предполагали Г.Н.Минх (1871) и Н.Ф.Гамалея (1908) и доказали в эксперименте Ш.Николь и др. (1909).
Американский исследователь Н.Е.Брилл в 1910 г. описал спорадический сыпной тиф, который Г.Цинссер и М.Костанеда в 1933 г. объяснили рецидивом эпидемического сыпного тифа. В нашей стране эту форму изучали К.Н.Токаревич, Г.С.Мосинг, П.Ф.Здродовский, К.М.Лобан и др.
Опустошительные эпидемии сыпного тифа являлись постоянными спутниками социальных потрясений, что получило отражение в названиях болезни (военный, голодный, тюремный, вшиный и т.д.). Особой жестокостью отличались эпидемии сыпного тифа в периоды войн.
Под влиянием социально-экономических преобразований в настоящее время в большинстве стран регистрируются лишь случаи болезни Брилла.
Этиология. Возбудитель – rickettsia prowazekii – мелкий [(0,2-0,3) х (0,2-1,0) мкм] неподвижный, не образующий спор и капсул плеоморфный микроорганизм; грамотрицательный, окрашивается по Романовскому – Гимзе, методом П.Ф.Здродовского и серебрением по Морозову. Обладает гемолизинами и эндотоксинами, имеет соматический термостабильный антиген, сходный с таковым у R. mooseri, и термолабильный видоспецифический антиген, отличающийся от антигенов R. mooseri и других риккетсий. В организме человека паразитирует в цитоплазме эндотелиальных и мезотелиальных клеток. Культивируется в легких мышей, на куриных эмбрионах и тканевых культурах.
Риккетсий Провачека чувствительны к нагреванию и действию дезинфицирующих веществ в обычных концентрациях, но устойчивы к действию низкой температуры и высушиванию, длительно сохраняются в высушенных фекалиях вшей. R. prowazekii высокочувствительны к антибиотикам (тетрациклины, левомицетин, эритромицин, рифампицин).
Эпидемиология. Тиф сыпной эпидемический – антропонозный трансмиссивный риккетсиоз, склонный к эпидемическому распространению.
Источник инфекции и резервуар возбудителей инфекции – больной эпидемическим сыпным тифом или болезнью Брилла, в период риккетсиемии в течение последних 1—2 дней инкубационного периода, 16—17 дней лихорадочного периода и 1—2 дней (до 7—8 дней) апирексии, т.е. на протяжении 3 нед.
Ведущий механизм заражения – трансмиссивный. Переносчики риккетсий – вши, в основном платяные (Реdiculus humanus corporis), реже головные (Реdiculus humanus caputis), которые выделяют риккетсии с фекалиями спустя 4—5 дней после инфицирующего кровососания и на протяжении всей жизни (14—17 дней).
Человек заражается риккетсиями при втирании инфицированных экскрементов насекомого в поврежденную расчесами кожу или при раздавливании на коже инфицированных вшей, изредка заражение происходит при попадании инфицированного материала в конъюнктиву глаза или в дыхательные пути (в лабораторных условиях).
Восприимчивость человека к сыпнотифозной инфекции очень высокая во всех возрастных группах. Характерно сезонное повышение заболеваемости в зимне-весенний период из-за возрастающей в это время скученности людей, снижения сопротивляемости организма вследствие недостатка витаминов и создания оптимальных температурных условий для развития вшей между одеждой и поверхностью тела.
Болезнь Брилла наблюдается преимущественно у лиц старших возрастных групп, перенесших в прошлом манифестную или субклиническую форму сыпнотифозной инфекции, не имеет сезонных колебаний заболеваемости. При наличии педикулеза такой больной становится потенциальным источником эпидемической вспышки сыпного тифа.
В настоящее время эпидемический сыпной тиф постоянно регистрируется в ряде стран Африки и Латинской Америки. В России, европейских и североамериканских странах регистрируются случаи болезни Брилла.
Патогенез и патологоанатомическая картина. Механизм развития сыпного тифа может быть представлен в виде 5 последовательных фаз: I – внедрение риккетсий в организм и размножение их в эндотелиальных клетках сосудов; II – разрушение клеток эндотелия и поступление риккетсий в кровь – риккетсиемия и токсемия (начало клинических проявлений болезни); III – функциональные нарушения сосудистого аппарата во всех органах и системах в виде вазодилатации, паралитической гиперемии с замедлением тока крови; IV – деструктивно-пролиферативные изменения капилляров с образованием тромбов и специфических гранулем; V – активация защитных сил организма и специфическая иммунологическая перестройка организма, определяющие элиминацию возбудителя и выздоровление.
Специфические сыпнотифозные изменения сосудов – универсальный острый инфекционный васкулит – складывается из трех компонентов: тромбообразования, деструкции сосудистой стенки и клеточной пролиферации, которые лежат в основе различных типов изменений: бородавчатого эндоваскулита с развитием пристеночного тромба и ограниченными деструктивными изменениями; деструктивного тромбоваскулита с обширными деструктивными изменениями и образованием обтурирующих тромбов; деструктивно-пролиферативного тромбоваскулита, характеризующегося очаговой пролиферацией полиморфно-ядерных клеток и макрофагов по ходу сосудов с развитием околососудистых сыпнотифозных гранулем в виде муфт (узелков Попова – Давыдовского). Сосудистые повреждения наблюдаются во всех органах и тканях, но наиболее выражены в головном мозге. По И.В.Давыдовскому, любая форма сыпного тифа – это острый менингоэнцефалит с преимущественным поражением серого вещества, особенно промежуточного, среднего и продолговатого мозга в области олив, ядер черепных нервов и ядер гипоталамуса, где вокруг поврежденных участков сосудов образуются специфические гранулемы, развиваются отек и набухание ткани мозга, кровоизлияния.
Сосудистые расстройства (гиперемия, стаз, тромбоз, деструкция эндотелия) лежат в основе возникновения розеолезно-петехиальной сыпи на коже и кровоизлияний в слизистые оболочки.
Распространенный панваскулит, сочетающийся с постоянной вазодилатацией, вызванной эндотоксинами риккетсий, и гиперкоагуляцией крови, обусловливает выраженные микроциркуляторные расстройства и дистрофические изменения в различных тканях. Часто возникают миокардит, дегенеративные изменения в предсердно-желудочковом (Ашоффа – Тавары) узле и предсердно-желудочковом (Гиса) пучке. Характерны дистрофические процессы в шейных и грудных симпатических ганглиях. Отмечаются отек и кровоизлияния в надпочечниках, дистрофические изменения в печени и почках.
С первого дня болезни и до 5—6-го дня периода апирексии во внутренних органах обнаруживаются риккетсии.
В ходе инфекционного процесса у больных сыпным тифом появляются в нарастающих титрах антитела к риккетсиям и их токсинам (вначале иммуноглобулины класса М, а позднее иммуноглобулины класса G), развиваются саногенные реакции, формируется иммунитет. Получило признание мнение о развитии при сыпном тифе нестерильного иммунитета (премуниции, по Сержану), обеспечивающего длительное (многолетнее) сохранение возбудителя в латентном состоянии в элементах системы мононуклеарных фагоцитов (например, в лимфатических узлах). Активизация дремлющей инфекции приводит к развитию рецидива – болезни Брилла, при этом с первых дней болезни в сыворотке крови превалируют противориккетсиозные антитела, относящиеся к IgG. Элиминация риккетсии приводит к быстрой утрате иммунитета.
Клиническая картина. Эпидемический сыпной тиф – циклическая инфекционная болезнь, в течении которой выделяют периоды инкубации (продолжительностью 6—25 дней, в среднем 12—14 дней), начальный (до появления сыпи, продолжительностью 4—5 дней), разгара (от момента появления сыпи до нормализации температуры, продолжительностью от 4—5 до 8—10 дней) и реконвалесценции (продолжительностью 2—3 нед).
Болезнь может протекать в стертой, легкой, средней тяжести (превалирующей) и тяжелой формах (10—15 % больных). Известно субклиническое течение сыпнотифозной инфекции. Типичный симптомокомплекс обычно выявляется при форме средней тяжести.
Тиф сыпной эпидемический развивается остро и лишь изредка удается выявить кратковременный (от 6 ч до 2 дней) продромальный период.
Начальный период болезни продолжительностью 3—4 дня характеризуется быстрым повышением температуры тела, которая в течение 1—2 (реже 3—4) дней достигает максимального уровня (39—40 °С), и другими признаками интоксикации: упорной головной болью, иногда головокружением, тошнотой, слабостью, бессонницей, слуховой, зрительной, тактильной гиперестезией; отмечаются некоторое беспокойство и эйфория больных.
Характерен внешний вид больного – одутловатое гиперемированное лицо (иногда и шея), блестящие глаза, инъецированные склеры («кроличьи глаза», «красные глаза на красном лице»), сухие яркие губы, горячая сухая кожа. На 2—3-й день болезни у основания небного язычка выявляется энантема в виде точечных кровоизлияний (симптом Розенберга – Винокурова – Лендорфа). С 3—4-го дня заболевания (чаще при тяжелых формах) на переходной складке конъюнктивы можно увидеть энантему в виде багрово-фиолетовых пятнышек (симптом Киари – Авцына). Обычно наблюдаются тахикардия, артериальная гипотензия, иногда – приглушение тонов сердца. У большинства больных с 3—4-го дня болезни отмечается спленомегалия. Диурез может несколько понижаться.
В конце 3—4-го дня болезни температура тела больных обычно понижается на 1—2 °С (так называемые врезы на температурной кривой). На следующий день температура вновь повышается, сопровождаясь усилением признаков интоксикации, поражения ЦНС и появлением характерной экзантемы, что свидетельствует о развитии разгара болезни. Период разгара характеризуется полным развертыванием клинических проявлений сыпного тифа и продолжается в среднем 8—10 дней. Лихорадка с 4—5-го дня устанавливается на определенном высоком уровне (39—40 °С), принимает характер febris continua (при тяжелом течении) или реже febris remittans, часто с «врезами» на температурной кривой на 8—9-й и 12—13-й дни болезни. Степень повышения температуры и продолжительность лихорадки являются одним из критериев оценки тяжести и прогноза заболевания. С 4—6-го дня болезни к признакам поражения симпатической нервной системы присоединяются симптомы поражения продолговатого и головного мозга – острого менингоэнцефалита. Больные жалуются на нестерпимую головную боль, головокружение, часто тошноту, бессонницу. Развиваются выраженная гиперакузия, фотофобия, тактильная гиперестезия. Рано выявляются бульбарные расстройства – девиация языка, дизартрия, симптом Говорова – Годелье (невозможность высунуть язык далее передних нижних зубов и его толчкообразные движения), сглаженность носогубной складки и др.
Как правило, больные эйфоричны, беспокойны, иногда раздражительны, грубы. Нередко, особенно при тяжелом течении сыпного тифа, с 7—8-го дня заболевания развивается status typhosus: больные дезориентированы во времени и пространстве, вскакивают с постели, стремятся спастись бегством, речь их торопливая, смазанная, бессвязная. Отмечаются яркие зрительные, реже слуховые галлюцинации устрашающего характера, заставляющие больных сопротивляться осмотру, совершать агрессивные и суицидные попытки. Продолжительность делириозного синдрома в зависимости от тяжести течения болезни колеблется от 2—3 до 7—8 дней.
Наряду с психическими расстройствами нередко отмечаются менингеальные симптомы: ригидность затылочных мышц, симптомы Кернига, Брудзинского и др. При исследовании цереброспинальной жидкости выявляются признаки серозного менингита.
Яркий и патогномоничный симптом периода разгара сыпного тифа – экзантема, появляющаяся на 4—5-й день болезни. Сыпь отличается розеолезным или розеолезно-петехиальным характером, обилием и полиморфизмом элементов, одновременностью их появления. Розеолы мелкие, плоские, не выступающие над поверхностью кожи, с фестончатыми краями, исчезают при надавливании, разнообразны по величине. На 5—6-й день болезни, а иногда и с первого дня высыпания в центре розеол появляются вторичные петехии. Могут обнаруживаться и первичные петехии. Полиморфизм и обилие элементов сыпи позволили клиницистам сравнить кожу сыпнотифозных больных со звездным небом. Обычно сыпь появляется на коже груди, боковых поверхностей туловища, спины, затем распространяется на сгибательные поверхности конечностей. В тяжелых случаях сыпь рано принимает геморрагический характер, возникают новые элементы («подсыпание»), которые крайне редко распространяются на лицо, ладонные и подошвенные поверхности. В легких случаях заболевания петехиальные элементы могут отсутствовать, но они выявляются при наложении жгута.
Элементы сыпи сохраняются в течение 7—9 дней, затем розеолы исчезают бесследно, а на месте петехии наблюдается легкая пигментация.
У 8—15 % больных сыпной тиф может протекать без характерной сыпи, но и в этих случаях можно выявить синдром повышенной хрупкости сосудов (симптомы «щипка», «жгута», Румпеля – Лееде – Кончаловского и др.).
В период разгара болезни усиливаются расстройства сердечно-сосудистой деятельности в виде прогрессирующей тахикардии, выраженной артериальной гипотензии, возможно развитие шока. Границы сердца смещены влево, тоны глухие. На электрокардиограмме обычно регистрируются снижение вольтажа, двухфазность и изоэлектричность зубца Т, депрессия интервала S – Т.
У больных сыпным тифом закономерно выявляется спленомегалия, а со второй недели и гепатомегалия. Язык становится сухим, часто покрывается темно-коричневым налетом (фулигинозный язык). Нередко отмечается поражение мочевыделительной системы: наблюдаются боли в поясничной области (олигурия, альбуминурия и цилиндрурия). В тяжелых случаях болезни нарушение иннервации мышц и сфинктеров мочевого пузыря вызывает парадоксальную ишурию.
В гемограмме больных в этот период болезни обычно – умеренный нейтрофильный лейкоцитоз и увеличение количества моноцитов, появление плазматических клеток Тюрка (до 8—10 %), повышение СОЭ.
В конце периода разгара сыпного тифа лихорадка часто принимает ремиттирующий характер и с 12—14-го дня болезни критически или кризолитически снижается до нормального уровня. Общая продолжительность лихорадочного периода составляет 2—21 день, в среднем 12—16 дней.
Период реконвалесценции сыпного тифа характеризуется обратным развитием симптомов интоксикации и признаков поражения нервной системы, угасанием сыпи, нормализацией размеров печени и селезенки. В период выздоровления у большей части больных сохраняются слабость, шум в ушах, артериальная гипотензия, астенический синдром. Критическое снижение температуры тела нередко сопровождается коллапсом, особенно у больных с предшествующими поражениями сердечно-сосудистой системы.
В редких случаях описываются кратковременные рецидивы болезни в течение первых 2 нед апирексии.
Клинические проявления эпидемического сыпного тифа могут заметно варьировать в зависимости от тяжести болезни.
Возможно развитие тяжелых форм, протекающих с выраженной гиперпирексией (41—42 °С), со значительным геморрагическим синдромом или с превалированием симптомов менингоэнцефалита.
Встречаются молниеносные формы сыпного тифа, приводящие к смерти больных на 2—5-й день заболевания.
Наряду с тяжелыми наблюдаются стертые, амбулаторные варианты, протекающие с кратковременной лихорадкой, часто без сыпи или с атипичными высыпаниями; такие формы обычно выявляются при сероэпидемиологическом обследовании. Часто у детей сыпной тиф протекает в более легкой форме.
Течение сыпного тифа может отягощаться рядом осложнений. В период разгара болезни, чаще у лиц с поражениями сердечно-сосудистой системы, возможно развитие острой сердечной или сосудистой недостаточности, которые являются одной из причин летальных исходов сыпного тифа. Вследствие сосудистых повреждений у ряда больных образуются пролежни, развиваются гангрена дистальных отделов конечностей, тромбозы, тромбоэмболии и тромбофлебиты.
Бактериальная ассоциация обусловливает возникновение пневмонии, гнойного отита, паротита, стоматита, флегмоны подкожной клетчатки.
Клинические проявления болезни Брилла имеют те же закономерности, что и эпидемический сыпной тиф, однако отличаются от последнего меньшей интенсивностью симптомов, преобладанием среди больных людей старшего возраста. Начальный период (продолжительностью 3—4 дня) сопровождается умеренно выраженной интоксикацией в виде головной боли, нарушения сна, повышения температуры до 38—39 °С. Энантема наблюдается редко (в 20 % случаев).
Период разгара болезни Брилла обычно не превышает 5—7 дней и характеризуется умеренной гипертермией в пределах 38—39 °С ремиттирующего или, реже, постоянного типа.
Признаки поражения ЦНС, как правило, выражены умеренно и соответствуют легким и средней тяжести формам эпидемического сыпного тифа. У больных отмечаются головная боль, которая иногда может быть значительной, бессонница, некоторая возбужденность и повышенная говорливость. Гиперестезия не выражена. Сознание обычно не нарушено, у части больных отмечаются кошмарные сновидения.
Симптомы поражения продолговатого мозга ограничиваются симптомом Говорова – Годелье. Менингеальные симптомы выявляются редко.
Экзантема наблюдается у 60—96 % больных болезнью Брилла, превалируют розеолезно-петехиальные элементы сыпи, количество которых обычно невелико.
Признаки поражения сердечно-сосудистой системы наблюдаются при болезни Брилла довольно часто, что, очевидно, связано с преобладанием среди больных лиц пожилого и преклонного возраста с различными заболеваниями и физиологическими изменениями сердечно-сосудистого аппарата. Увеличение печени и селезенки выявляется непостоянно.
Осложнения болезни Брилла наблюдаются сравнительно редко, в основном в виде тромбозов и тромбофлебитов поверхностных вен, пневмонии. Общая продолжительность лихорадочного периода при болезни Брилла составляет в среднем 9—11 дней (с колебаниями 7—13 дней). Период реконвалесценции обычно протекает гладко.
Прогноз. Благоприятный, в случаях осложненного течения сыпного тифа может быть серьезным. В прошлом летальность достигала 5—15 % и более.
Диагностика. При сыпном тифе чрезвычайно важное значение имеет раннее выявление больных в первые 4 дня заболевания (так называемый закон 4-го дня), так как начиная с 4-го дня после инфицирующего кровососания вошь становится заразной, стремится покинуть тело больного (очевидно, ввиду лихорадки) и паразитировать на здоровом человеке, заражая его риккетсиями.
Ранняя диагностика эпидемического сыпного тифа основывается на комплексе клинических и эпидемиологических данных.
Специфическая диагностика сыпного тифа предполагает выделение из крови больного чистой культуры риккетсий Провачека или обнаружение антител к ним.
Культивирование риккетсий ввиду технических сложностей практического значения не имеет, в связи с чем для лабораторной диагностики сыпного тифа используют преимущественно сероиммунологические методы (РСК, РНГА, РАР, МФА, кожно-аллергическая проба). В связи с тем что у некоторых больных бывает положительной лишь одна из серологических проб, необходимо параллельно изучать ряд серологических тестов, обычно РСК и РНГА.
Диагностические титры РСК (1,160 и более) обнаруживаются с 6—7-го дня болезни, достигая максимального значения (1:640—1:1280) на 12—20-й день болезни. У реконвалесцентов сыпного тифа комплементсвязывающие антитела сохраняются в течение многих лет, что делает РСК пригодной для ретроспективной диагностики болезни (в титре 1:10).
Наибольшую ценность для серодиагностики сыпного тифа имеет РНГА, позволяющая выявить не только суммарный титр антител, но и принадлежность их к классам иммуноглобулинов. При сыпном тифе с 5—7-го дня болезни выявляются антитела, принадлежащие к классу IgМ в диагностическом титре 1:1000 и более. Максимальный титр антител определяется с 15—20-го дня болезни (1:12 800 и более), при этом с 3—4-й недели болезни в сыворотке крови преобладают антитела класса IgG.
При болезни Брилла с первых дней заболевания выявляются антитела, принадлежащие классу IgG, в более высоких титрах (РСК 1:10 240 и более, РНГА 1:64 000 и более).
Кожная аллергическая проба используется для определения иммунологической структуры населения в очагах сыпного тифа.
Дифференциальная диагностика. В начальном периоде сыпной тиф и болезнь Брилла следует дифференцировать от гриппа, пневмоний, менингококковой инфекции, геморрагических лихорадок; в период разгара – от брюшного тифа и паратифов, эпидемического возвратного тифа, ряда других риккетсиозов, инфекционного мононуклеоза, орнитоза, кори, сифилиса, сепсиса, лекарственной болезни, трихинеллеза, флеботомной лихорадки, различных эритем.
Лечение. При эпидемическом сыпном тифе и болезни Брила применяют этиотропные, патогенетические и симптоматические средства.
Этиотропное лечение осуществляют с помощью антибиотиков тетрациклинового ряда или левомицетина. Тетрациклин назначают перорально в суточной дозе для взрослого 1,2—1,6 г в четыре приема с интервалом 6 ч на протяжении всего периода лихорадки и 2 дней апирексии. Левомицетин назначают взрослым в суточной дозе 2 г. При тяжелом течении болезни антибиотики вводят парентерально.
Патогенетическая терапия предусматривает введение по показаниям дезинтоксикационных препаратов, диуретиков, сосудистых аналептиков, сердечных гликозидов, жаропонижающих средств и анальгетиков.При тяжелом течении болезни проводится интенсивная терапия, включающая глюкокортикостероиды.
При развитии делирия применяют бромиды, барбитураты, аминазин, седуксен, галоперидол или оксибутират натрия.
С целью профилактики тромбозов и тромбоэмболических осложнений показано назначение антикоагулянтов (гепарин в раннем периоде, позднее фенилин, пелентан и др.).
Обязателен туалет полости рта и кожи для предупреждения стоматита, паротита, пролежней. До 5—6-го дня апирексии показан постельный режим, с 6—7-го дня нормальной температуры больным можно ходить, выписка производится не ранее 12-го дня апирексии при отсутствии осложнений болезни.
Профилактика. Больные сыпным тифом подлежат обязательней госпитализации. Показана провизорная госпитализация больных с неустановленным диагнозом при лихорадке свыше 5 дней. В очаге инфекции проводятся следующие мероприятия: лица, соприкасавшиеся с больным, проходят санитарную обработку; белье, одежда, постельные принадлежности больных и контактировавших лиц подлежат камерной дезинфекции. Дезинфекция и дезинсекция в очаге осуществляются 3—5 % раствором лизола.
При эпидемическом сыпном тифе наблюдение в очаге (измерение температуры тела, осмотры) устанавливается на 71 день, при болезни Брилла – на 25 дней со времени госпитализации больного.
По эпидемиологическим показаниям может производиться активная иммунизация угрожаемых контингентов с помощью сухой химической сыпнотифозной вакцины, которая вводится однократно в дозе 0,5 мл.
Назад: Дифтерия
Дальше: Тиф возвратный эпидемический

