4. ВИНОВАТА МОЛОДОСТЬ: СТАРЕНИЕ КАК ПОБОЧНЫЙ ЭФФЕКТ
С тех времен, когда мне было совсем немного лет, я помню в основном слоганы, с помощью которых отец пытался призывать меня к порядку. Чаще всего в доме звучало решительное "хорошенького понемножку" — слоган, который должен был воспитать во мне чувство меры, но чаще просто означал, что очередная порция радостей подошла к концу. Был еще девиз "ждать, поститься и размышлять" — судя по всему, парафраз из романа-притчи "Сиддхартха" Германа Гессе. Через пару десятков лет я внезапно осознала, что все это было не более чем педагогическим приемом, а сам отец этих правил никогда не придерживался. Размышляет он, конечно, за пятерых, а вот с терпением, постом и чувством меры у него явно не сложилось. И тем забавнее, что сейчас, когда мне столько же лет, сколько и ему тогда, я собираюсь в последней главе своей книги продвигать ровно те же идеи, что и он: ждать, поститься, размышлять и знать меру.
Теория запрограммированного старения не находит сегодня широкой поддержки в научном сообществе, но из нее выросло гораздо более элегантное объяснение процессов, которые происходят в организме с течением времени. Что, если программа действительно существует, но в ней записаны не старость и смерть, а молодость и развитие? И в какой-то момент, когда сил у организма уже недостаточно, а расти дальше некуда, эта программа не выключается, а продолжает крутиться, заставляя его работать на полную катушку, как будто молодость длится вечно. Но ресурсы ограничены, а износ неизбежен, и возникает старость — побочный эффект, неприятное следствие программы вечной молодости. В таком случае лучшее, что мы можем ей противопоставить, — терпение, ожидание, смирение и замедление развития.
Все лучшее — детям
Современная эволюционная теория старения довольно далеко ушла от того, что предлагал Август Вейсман полтора века назад. В 1930 году Рональд Фишер, создавая свою теорию эволюционной генетики, заметил, что сила действия естественного отбора зависит от плодовитости, поэтому со временем он должен ослабевать по мере того, как организм теряет возможность размножаться. За эту идею позже ухватился Питер Медавар, больше известный как иммунолог и лауреат Нобелевской премии за открытие механизмов отторжения трансплантата. Медавар сформулировал теорию накопления мутаций: старение, с его точки зрения, вызвано накоплением губительных мутаций, которые не отсеивает естественный отбор, поскольку проявляются они только после определенного возраста.
Если теория Медавара верна и действие естественного отбора слабеет с возрастом, то гены, которые работают в молодых клетках, должны быть консервативны. Это значит, что их последовательности не должны в среднем сильно различаться у разных людей, а вот в последовательностях других генов, которые в старости активны, разброс должен быть гораздо выше. Недавно ученые сравнили такие наборы "генов молодости" и "генов старости" и обнаружили, что разброс в последовательностях действительно различается, особенно в генах, связанных с апоптозом (гибелью клеток) и воспалением. Правда, это касается в основном генов, которые активны в мозге, печени и легких, в мышцах же, почках и коже разницы между двумя группами генов не нашли. Возможно, это означает, что некоторые органы более критичны для процессов старения, чем другие.
Следующий шаг сделал биолог Джордж Уильямс: он предположил, что эти "вредные" мутации накапливаются неслучайно. Напротив, они могут быть полезны на ранних этапах жизни организма и поэтому закрепляются в популяции. Это явление Уильямс назвал антагонистической плейотропией. Плейотропия — это множественность функций какого- либо гена или белка. А антагонизм, то есть противоположность действий, здесь разнесен во времени: тот ген, а точнее, та мутация в гене, которая увеличивает жизнеспособность организма в молодости, в старости, наоборот, ухудшает его состояние.
Со времен Уильямса ученые нашли печать естественного отбора на множестве генов человека. Антагонистической плейотропией обладает, например, ген p53, кодирующий белок, который вызывает остановку деления, старение и апоптоз. Носители "ослабленного" варианта р53 чаще болеют раком, но дольше живут, если с этой болезнью справились. Носители "усиленного" варианта страдают онкологическими болезнями реже, зато живут меньше. То есть ген р53 приобрел мутацию, которая мешает организму жить долго, поскольку слишком активный белок выводит из строя одну клетку за другой. Но эта мутация поддерживается естественным отбором, поскольку в молодости, пока клеток много, эта особенность р53 организму не вредит, а только помогает справиться с раком.
Похожая история, судя по всему, произошла с геном АРОЕ. О нем мы тоже уже говорили — в главе, посвященной возрастным заболеваниям. Вариант АРОЕ ε4 считается одним из главных генетических факторов риска для болезни Альцгеймера, и против него даже разрабатывается генная терапия. В то же время он может быть связан с повышенной плодовитостью: у его носительниц повышена концентрация прогестерона (гормона беременности) в крови по сравнению с носительницами других вариантов этого гена. По некоторым данным, АРОЕ ε4 связан также с умственными способностями, а еще с устойчивостью к инфекциями: его носители лучше переносят заражение вирусами гепатита В и С, а дети из бразильских трущоб с АРОЕ ε4 реже страдают диареей. Все эти проявления укладываются в теорию антагонистической плейотропии: поскольку большинство потенциальных эффектов АРОЕ ε4 проявляется на ранних этапах жизни, его разрушительное действие на нервную систему пожилых людей ускользает из зоны внимания естественного отбора.
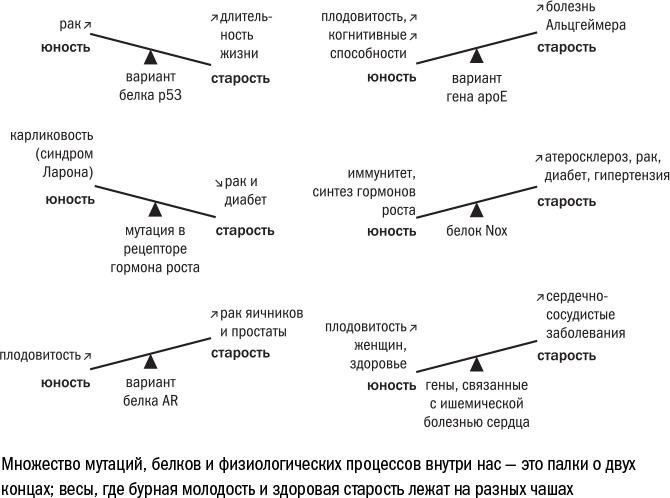
Чаще всего губительные мутации "покупают" себе место в геноме, повышая шансы молодых особей на размножение. Но если посмотреть шире, то можно заметить, что самые разные процессы, которые приводят к изнашиванию организма и старению клеток, могут быть в чем-то благоприятны для организма. Любая жизненно важная биохимическая реакция в клетке, будь то клеточное дыхание или синтез белков, порождает токсичные продукты обмена и по сути своей служит примером антагонистической плейотропии. В молодости важно дышать и получать много энергии, а результаты действия свободных радикалов проявятся когда-нибудь потом.
Практически любой процесс, который нам кажется патологическим, может принести пользу для организма. Метилирование ДНК и потеря доступа к генетической информации важны для развития: дети, которые рождаются с повышенным эпигенетическим возрастом, лучше растут и набирают вес, чем их более "молодые" с точки зрения метилирования сверстники. Перемещение ретротранспозонов по ДНК, с одной стороны, вызывает мутации, а с другой — способствует развитию нервных клеток (об этом говорилось в главе "Молекулы: мусорная катастрофа"). Воспаление полезно для борьбы с инфекцией и уборки мусора, но в стареющем организме превращается в оружие борьбы с самим собой.
Геронтолог из Ливерпуля Жуан де Магальяеш назвал этот феномен "близоруким часовщиком". Это, безусловно, отсылка к "слепому часовщику" — метафоре, которую придумал Ричард Докинз для естественного отбора, чтобы показать, что этот принцип позволяет вслепую собрать точный и совершенный объект, живой организм. Но с точки зрения геронтологов отбор не столько слеп, сколько недальновиден: отбирая то, что приносит пользу здесь и сейчас, он "не задумывается" о последствиях, и за его поспешные решения нам всем предстоит расплачиваться в старости.
Такая точка зрения может казаться пессимистичной, но только на первый взгляд. Ведь если старение вызвано накоплением конкретных вредоносных мутаций, то что мешает назвать его генетической болезнью и относиться к нему соответственно? Можно представить себе, что мы сейчас находимся еще на этапе изучения этой болезни и пока только собираем информацию о генах, которым свойственна антагонистическая плейотропия. А потом, вероятно, научимся их чинить и заменять на более благоприятные для долгой жизни варианты. Правда, исправлять такие гены придется не в начале жизни, а в середине, но это и к лучшему: методы генной терапии у взрослых сейчас вызывают гораздо меньше вопросов — как с точки зрения этики, так и по части методологии, — чем редактирование генов у эмбрионов.
Хорошего — понемножку
Если теория антагонистической плейотропии верна, то это значит, что в старом организме протекают те же процессы, что и в молодом. В таком случае старение можно рассматривать как непосредственное и излишнее продолжение развития. Поэтому американский геронтолог Михаил Благосклонный предложил считать деградацию организма результатом не программы старения, а программы молодости, или квази-программы. Этот подход позволяет объяснить два, казалось бы, противоречивых факта: старение вытекает из одних и тех же процессов, но в каждом организме проходит по-своему. Именно потому, что развитие запрограммировано жестко, а старение лишь намечено общими контурами, первое проходит у всех примерно одинаково, а второе, напротив, крайне гетерогенно. М. Благосклонный сравнивает старение с хождением вслепую: "…чем дольше вы блуждаете с закрытыми глазами, тем сильнее отклоняетесь от намеченной траектории".
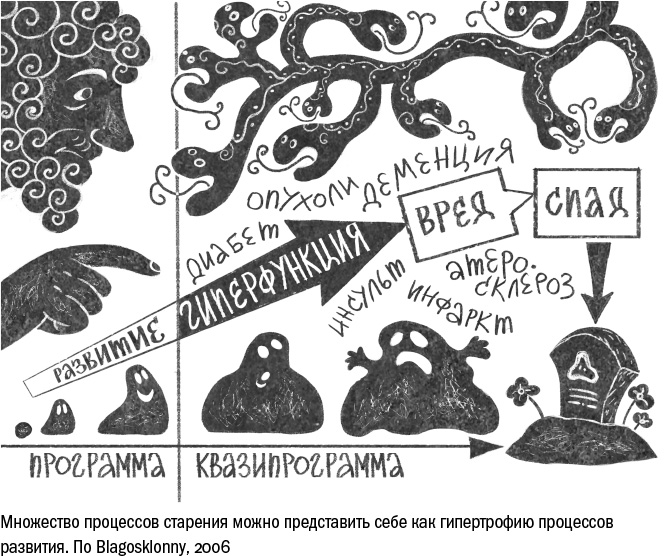
Старость, по Благосклонному, предстает в виде гиперфункции, гипертрофированного проявления программы развития. Каждое нарушение, которое возникает с возрастом, можно объяснить через преувеличенное, избыточное или ненужное продолжение какого-либо процесса развития. Например, старческая гипертония — это итог непрерывного повышения давления. Человек появляется на свет с низким артериальным давлением, и это оправдано его небольшим размером — сердцу не нужно сильно прокачивать кровь, чтобы она дошла до кончиков пальцев. По мере того как ребенок растет, а тело его становится длиннее, мышечные волокна в стенках сосудов постепенно сжимаются, уменьшая просвет сосуда и увеличивая давление. Так оно достигает значений, характерных для взрослого здорового человека. Но, будучи один раз запущена, программа не выключается, — и давление продолжает расти, пока не превращается в гипертонию, типичное возрастное состояние.
То же происходит и со зрением: пока ребенок маленький, ему важно рассматривать близко расположенные объекты, и минимальное фокусное расстояние — то, на котором он различает предмет, — у него всего несколько сантиметров. С возрастом для человека становятся важны и более далекие объекты, поэтому хрусталик (линза, которая преломляет свет в глазу) растет и становится жестче и минимальное фокусное расстояние достигает 16 см в 40 лет, а к 60 может дойти до 100 см. Так развивается дальнозоркость, которую часто можно встретить у пожилых людей.
Подобные механизмы можно найти в составе самых разных возрастных болезней. Чрезмерное свертывание крови вызывает тромбоз, избыточное воспаление — аутоиммунные реакции, неумеренное накопление жирных кислот — ожирение. Все это Благосклонный считает следствием того, что у программы развития нет естественного выключателя. Чем быстрее растет организм, тем лучше для размножения, и так ли важно, что будет потом? Поэтому нет никакого повода обзаводиться системой сдержек, и если маховик раскручен, организму уже не под силу его остановить.
В отличие от теории квазипрограммы, которая напрямую продолжает идею антагонистической плейотропии, теория гиперфункции пока не нашла большой поддержки в научном сообществе. Геронтолог из Гарварда Вадим Гладышев, например, считает, что гиперфункция плохо стыкуется с накоплением молекулярных повреждений. Если старение вызвано чрезмерной активностью клеток, то как быть с системой внутриклеточного ремонта, которая, наоборот, с возрастом работает все хуже?
К тому же если главная причина старения — в гиперфункции, а молекулярный мусор не так важен для продолжительности жизни, то системы, которые этот мусор производят, должны ускользать из-под контроля естественного отбора. В таком случае они должны производить все больше и больше мусора (потому что ломать гораздо дешевле, чем чинить) — пока поломок не станет так много, что они начнут сокращать жизнь наравне с гиперфункцией органов. Это тот же аргумент про бочку с вытекающей водой и короткой дощечкой, с которого я начала разговор о причинах старения: ни одна не может быть главной, все системы защиты от старости работают одинаково плохо.
У М. Благосклонного и на это находятся свои аргументы. Ни один человек, говорит он, не умирает от накопления в клетках молекулярного мусора. А также от укорочения теломер, истощения клеточных запасов или износа тканей. Люди умирают от инфарктов, инсультов и опухолей — катастрофических событий внутри тела, когда те или иные органы перестают работать. А эти события, в свою очередь, напрямую вызваны гиперфункцией физиологических процессов: повышенным давлением, разрушением костей, ожирением и десятками других. Молекулярный мусор и поломки, безусловно, накапливаются в клетках и между ними, но не успевают привести организм к смерти, катастрофа случается раньше.
Главный рубильник
Старение клеток, согласно теории М. Благосклонного, тоже вызвано гиперфункцией, а точнее — гиперстимуляцией. Все начинается с того, что на клетку действует какой-то стрессовый фактор: повреждение ДНК, радиация, окислительный стресс, работа онкогенов и так далее. В клетке активируются белки р21 и р16 и приостанавливают деление клетки, давая ей возможность побыть в покое и разобраться с происходящим.
В этот момент клетка еще способна вернуться к полноценной жизни: она временно перестала делиться, но сможет продолжить, как только справится со стрессом. Однако если даже в покое она все еще получает сигнал к размножению, то продолжает расти и производить токсичные продукты обмена, на которые снова реагируют р21 и р16 — и окончательно останавливают деление клетки, она становится сенесцентной. Так гиперстимуляция клетки, то есть гиперфункция программы роста, приводит к старению. В некотором смысле клетка повторяет судьбу организма в целом: чем быстрее она растет и размножается, тем меньше она живет. И наоборот: чем медленнее ее обмен веществ и чем дольше цикл деления, тем выше шанс не состариться.
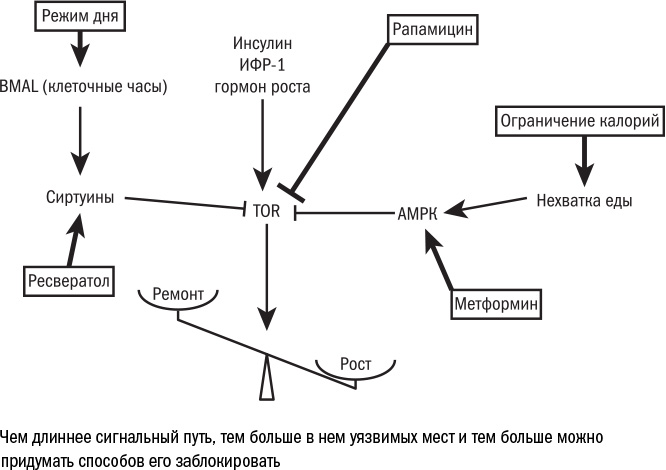
Глубинный механизм роста, тот самый главный рубильник, который включает квазипрограмму старения на клеточном уровне, давно известен: его имя TOR. Сходство с богом Тором здесь случайно, название белка — это аббревиатура: Target Of Rapamycin, то есть "мишень действия рапамицина" — лекарства, о котором нам еще предстоит поговорить. В клетках млекопитающих TOR входит в состав двух комплексов с другими белками — mTORc1 и mTORc2, — но для простоты мы их будем называть общим именем mTOR. Оба комплекса напрямую отвечают за рост и развитие клеток: стимулируют работу генов и производство белков, усиливают обмен веществ, заставляют клетку расти и запасать энергию, но в то же время подавляют аутофагию (самопереваривание) и репарацию (ремонт ДНК). Мутации в mTOR приводят к остановке роста, и такие организмы нежизнеспособны.
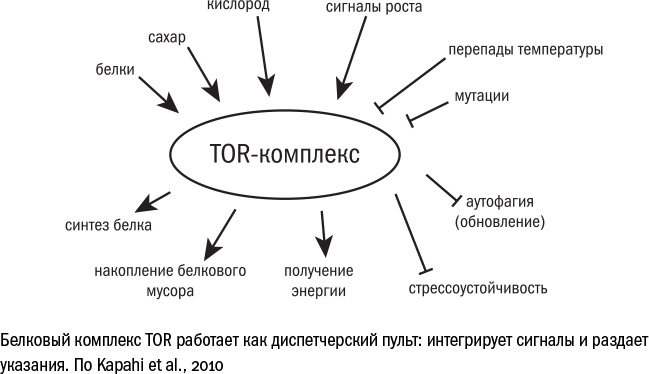
Комплекс mTOR служит в некотором роде центром принятия клеточных решений. К нему стекается информация о сигналах извне и состоянии клетки изнутри, и, взвешивая все за и против, он либо стимулирует рост, либо тормозит его. Основные два его информанта — это факторы роста (снаружи) и питательные вещества (изнутри). Первых обычно недостаточно, чтобы запустить работу mTOR, вторые же справляются, но не в полной мере. И только совместное действие внешних и внутренних стимулов раскручивает маховик mTOR на максимальную мощность.
В первую очередь mTOR реагирует на присутствие в клетке аминокислот: если их достаточно, значит, есть из чего построить белки и mTOR активен, если мало, то он "молчит". Кроме того, работа mTOR зависит от количества АТФ (энергетической "валюты" клетки): если АТФ недостаточно, действие mTOR ослабевает. Есть и другие условия, которые заставляют mTOR усмирить свой пыл: это гипоксия (дефицит кислорода), поломки в ДНК, отравление токсинами, перепады температуры и прочие стрессовые факторы. А судьба клетки зависит от суммы этих факторов: если, несмотря на стресс (который тормозит mTOR), в ней все равно много энергии, а снаружи — факторов роста (которые активируют mTOR), главный рубильник остается активен, подстегивает синтез белков, тормозит репарацию и приближает старение.
Три провокатора
За таинственными "факторами роста", которые поддерживают mTOR и заставляют клетки работать на износ, скрывается троица, с которой мы уже встречались в разговоре о гормонах: гормон роста, инсулиноподобный фактор роста — 1 (ИФР-1) и собственно инсулин. Гормон роста сдвигает клеточный обмен веществ в сторону анаболизма: синтеза белков и расщепления углеводных запасов. Под его действием клетки печени выделяют ИФР-1, который доносит тот же сигнал до остальных клеток организма. Инсулин тоже подстегивает клетки синтезировать белки, но одновременно с тем и запасать энергию. В этом смысле инсулин и гормон роста оказывают противоположное действие и подавляют работу друг друга.
Все эти три вещества активируют в клетках mTOR. Поэтому им тоже свойственна антагонистическая плейотропия: несмотря на их явную роль в росте организма, они в то же время ускоряют старение клеток. И наоборот, дефекты в этой системе то и дело оказываются людям на пользу. Например, многие долгожители оказались обладателями мутации в рецепторе к ИФР-1. И нередко их клетки оказываются устойчивыми к действию инсулина — то есть у них мало рецепторов к нему и они плохо на него откликаются. Это состояние может привести к сахарному диабету II типа: отсутствие рецепторов мешает клеткам поглощать глюкозу, и она накапливается в крови. Однако, если человек не страдает ожирением и не переедает, этот эффект может проявляться не так сильно; и преимущества от инсулинорезистентности ("молодости" клеток) у долгожителей, судя по всему, перевешивают возможные неудобства.
О неоднозначных эффектах гормона роста мы уже говорили в связи с гормональной "терапией старения": несмотря на то что идея компенсировать пожилым людям исчезающий гормон роста остается популярной, у этой процедуры немало побочных эффектов. На некотором этапе жизни организму выгоднее обойтись без гормона роста — например, потому что он блокирует репарацию ДНК в клетках, не говоря уж об остальных эффектах гиперстимуляции. А повышенные уровни гормона роста в крови — как при гигантизме — связаны с повышенным риском ранней смертности, сердечно-сосудистых болезней, рака и диабета.
Еще более показателен здесь обратный пример — хронический недостаток гормона роста. Карликовые мыши, у которых нарушено производство этого гормона в гипофизе, живут на 38% дольше контрольных, в чем обогнали все остальные виды мутантных мышей. Среди людей таким "модельным объектом" стали люди с синдромом Ларона — одним из видов карликовости, который вызван мутацией в гене рецептора к гормону роста (фактически клетки становятся менее чувствительны к нему).
Синдром Ларона встречается по всему миру, что указывает на его древнее происхождение и, вероятно, определенные преимущества, которые он дает своим носителям. Их жизнь нельзя назвать здоровой: у многих пациентов с синдромом Ларона развиваются неврологические отклонения и почти все они страдают ожирением. Работы, в которых описано их здоровье, во многом расходятся: одни отмечают, что носители синдрома отличаются повышенными умственными способностями и устойчивостью к диабету, другие — наоборот, находят у них психологические расстройства и склонность к диабету. Тем не менее все авторы отмечают, что эти пациенты живут не меньше здоровых людей (до 80–90 лет), невзирая на замедленное половое созревание (или благодаря ему?), а также надежно защищены от рака. Это неудивительно, если учесть, что во многих известных видах опухолей белки ИФР гиперактивны, а высокие люди (с повышенным уровнем гормона роста) в среднем страдают от онкологических болезней чаще, чем низкие. В этом смысле носители синдрома Ларона похожи на летучих мышей: у тех есть похожая мутация в гене рецептора гормона роста, они развиваются медленно, невзирая на интенсивный обмен веществ, и тоже практически не болеют раком.

Голод и боль
Через посредство инсулина и mTOR жизнь организма могут сокращать или удлинять и другие факторы, которые, казалось бы, не имеют прямого отношения к гиперстимуляции клеток. Это, например, боль. Многие животные воспринимают ее через молекулу-рецептор TRPV1. Он реагирует на перепады температуры и химические вещества, а "любимый" его стимул — капсаицин, жгучая субстанция из перца чили. Болевые волокна, раззадоренные капсаицином, передают сигнал дальше: они выделяют нейропептид CGRP, который, среди прочего, действует на поджелудочную железу и блокирует выделение инсулина. Логика здесь такая: если организму больно, это признак воспаления и опасности. В такой ситуации не нужно заставлять клетки расти и запасать энергию, поэтому выделять инсулин ни к чему. В умеренных дозах этот механизм, безусловно, полезен: и у людей капсаицин снижает потребление пищи, но усиливает энергозатраты, противодействуя ожирению. Поэтому, по некоторым данным, любители острой пищи живут дольше, чем те, кто ее избегает: капсаицин на 13% снижает риск смерти от естественных причин.
Тем не менее активная стимуляция болевых волокон может привести к диабету — чем меньше инсулина, тем больше глюкозы в крови. И у пожилых животных так, по всей видимости, и происходит: CGRP в их организме производится больше. Поэтому мыши, лишенные гена TRPV1, живут дольше обычного, отличаются здоровым обменом веществ и реже, чем в среднем, болеют раком. Возможно, по этому же пути пошел и голый землекоп: его нейроны не вырабатывают CGRP совсем. Он не реагирует на капсаицин, едкие кислоты и ожоги (хотя может воспринимать некоторые другие болевые стимулы, например уколы). Возможно, нечувствительность к боли стала одним из средств защиты голых землекопов от большинства возрастных болезней.
Другие виды чувствительности тоже могут вмешиваться в работу системы "инсулин — ИФР — TOR" — например, обоняние. Запах еды означает, что скоро она поступит в организм, и предусмотрительные животные выделяют инсулин заранее. Этот эффект настолько силен, что на червей и мух, которым предлагают нюхать еду, не действует диета, призванная снизить уровень инсулина в крови. Поэтому полное удаление обонятельных рецепторов или луковиц может оказаться полезным и даже продлевать жизнь, по крайней мере беспозвоночным животным. Правда, на людей эта закономерность не всегда распространяется: потеря обоняния у нас нередко связана с плохим прогнозом выживаемости. Пока неясно, что здесь причина, а что — следствие: возможно, проявляются нейродегенеративные заболевания на ранних стадиях. Тем не менее не стоит считать особо удачливыми и здоровыми людей, которые перестают различать запахи.
Наконец, регулировать долголетие особи может и ее половой партнер. В предыдущей главе я уже приводила пример самцов бурой сумчатой мыши, у которых феромоны самки запускают "программу быстрой смерти". У человека, скажем сразу, прямые взаимосвязи между общением с противоположным полом и продолжительностью жизни неизвестны, если не учитывать, конечно, корреляцию между одиночеством и смертностью у пожилых людей. А вот у других представителей животного мира разворачивается настоящая война полов.
Самцы дрозофилы, например, стремятся выбрать себе наиболее плодовитую самку и определяют это по количеству летучих феромонов, производство которых контролирует TOR. Таким образом, феромоны служат отражением общей интенсивности обмена веществ в организме самки.
После спаривания ситуация меняется. Самцу невыгодно оставлять самку в живых — тогда она сможет принести потомство от кого-нибудь другого. Поэтому, например, у червей в составе семенной жидкости, кроме сперматозоидов, есть белки, которые стимулируют работу TOR. Так самец заставляет самку не только как следует выносить потомство, но и погибнуть от износа организма вскоре после откладывания яиц. Но и самки не остаются в долгу: попадая в тело самца, феромоны заставляют его тратить энергию и истощать жировые запасы и, как следствие, сокращают жизнь — вероятно, тоже не без участия инсулина и TOR. Можно представить себе, что и в организме самцов бурой сумчатой мыши, которые гибнут после спаривания, творится нечто подобное.
Вот почему важен режим
Есть и еще одна нить, которая связывает сигнальный путь TOR с долголетием — биологические ритмы, наш внутриклеточный аналог дня и ночи. Вопреки распространенным представлениям, суточные ритмы не ограничиваются регуляцией сна и бодрствования, а влияют на бóльшую часть клеточной жизни. В течение дня ритмично колеблется работа примерно половины генов в клетках млекопитающих. Это помогает клетке адекватно реагировать на изменение внешних условий: днем, например, ее подстерегают коварные ультрафиолетовые лучи (особенно если это клетка кожи), значит, время заниматься ремонтом ДНК. А ночью снижается поступление еды — значит, можно приглушить процессы пищеварения.
Координация клеточных часов происходит на двух уровнях: в головном мозге, под действием световых сигналов извне, и в каждой клетке по отдельности. При этом без первого, общеорганизменного, процесса в принципе можно обойтись: биоритмы можно поддерживать и у слепых людей, и у тех, кто оказался в условиях полярного дня или ночи. Внутриклеточные часы гораздо важнее. Они образованы двумя группами генов: активаторами (CLOCK, BMAL1) и репрессорами (PER, CRY). И те и другие кодируют белки, которые работают факторами транскрипции, то есть влияют на активность других генов.
Внутриклеточный часовой механизм устроен так: днем активны гены CLOCK и BMAL1, соответствующие им белки запускают работу множества "дневных" генов, которые связаны с активным обменом веществ (по крайней мере, у человека, у ночных животных бывает по-другому). Кроме того, они "включают" гены PER и CRY. Белки PER и CRY постепенно накапливаются в клетке, а когда их становится достаточно много — блокируют работу BMAL1 и CLOCK. Наступает клеточная ночь: перестают работать "дневные" гены, на смену им приходят "ночные". Но белки PER и CRY понемногу разрушаются, и количество их падает. Как только их становится достаточно мало, они не могут больше блокировать работу CLOCK и BMAL1 — и в клетке снова включается дневной режим.
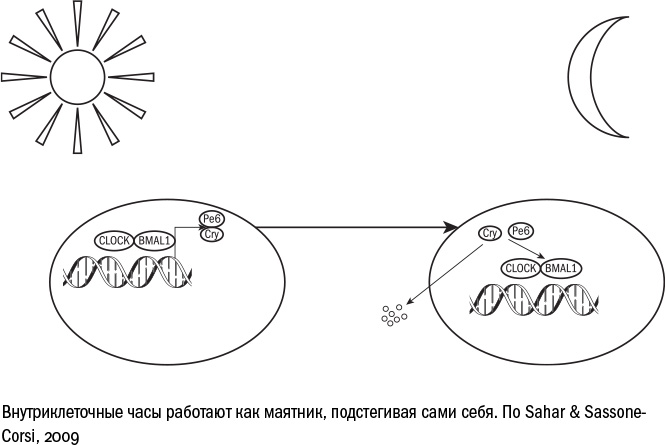
Внутриклеточные часы по всему организму нужно время от времени сверять, чтобы они продолжали идти в такт. За это отвечает гормон мелатонин, который производится в головном мозге. Важную роль играет и ежедневная активность человека. Если в организм поступает пища — значит, настал день. Если сигналы для роста и обмена веществ притихли — время спать. И здесь, конечно, на сцене снова оказывается TOR: почувствовав присутствие еды, он отдаляет наступление клеточного дня: зачем заканчивать эти сутки, если еды еще достаточно?
Несложно представить себе, что произойдет, если клетки в организме перестанут работать синхронно. Допустим, наступила ночь и во всех органах царствует белок PER, а гены CLOCK и BMAL1 молчат. Но вдруг в организм из холодильника поступает бутерброд. Клетки кишечника чувствуют еду, в них просыпается mTOR и замедляет наступление дня. К утру оказывается, что в некоторых клетках давно уже "светло" и им нужна еда, а в других еще ночь и они не готовы переваривать еду, равно как и выполнять другие физиологические функции, например выделять гормоны. Возможно, поэтому сбой биоритмов связывают с самыми разными заболеваниями — от ожирения и сердечно-сосудистых болезней до рака. Эти опасности могут подстерегать не только любителей есть по ночам, но также людей, работающих в ночную смену или много путешествующих. Есть даже подозрение, что из-за электрификации полярных регионов выросла заболеваемость раком у жителей Арктики.
Поэтому неудивительно, что разрушение внутриклеточного ритма существенно сокращает жизнь модельным объектам: черви, лишенные PER (и клеточной ночи вместе с ним), теряют способность сопротивляться стрессу, а мыши с выключенным BMAL1 стареют быстрее своих сородичей. На людях такие однозначные результаты получить невозможно, однако, вероятно, это повод уделять больше внимания своим биоритмам: не стимулировать клетки лишний раз, не будить TOR и не устраивать клеткам день посреди ночи.
Дедовский метод
Коль скоро mTOR оказался перекрестком для большинства сигнальных путей клетки и истоком множества клеточных бед, можно предположить, что его торможение способно, наоборот, продлить человеческую жизнь. И если не принимать во внимание радикальные методы вроде удаления болевых волокон или разрушение гена гормона роста, то остается ровно один простой способ это проверить: меньше есть.
Первые данные о том, как ограничение в еде влияет на продолжительность жизни, появились из бытовых наблюдений. После Первой мировой войны правительственный советник по продовольствию в Дании подсчитал, что смертность в Копенгагене сократилась на 34% — и связал это с тем, что жители столицы были вынуждены меньше есть из-за прекращения торговли с США и Великобританией.
Похожая история развернулась в Норвегии уже во время Второй мировой войны: страна была оккупирована, еды стало не хватать и количество смертей от сердечно-сосудистых заболеваний упало на 30% по сравнению с довоенным временем.
Третий эксперимент невольно поставили над собой жители Окинавы: до середины прошлого столетия средняя продолжительность жизни на острове была выше, чем в среднем по Японии, а долгожители встречались в четыре-пять раз чаще, чем в других цивилизованных странах. Исследователи связывают это с тем, что традиционный рацион окинавцев — овощи, фрукты, рыба, соя и рис — содержит меньше калорий, чем рацион жителей других регионов Японии. Правда, в 1960-е годы на остров проникли американцы и привезли с собой культуру фастфуда. И уже сейчас рожденным на Окинаве людям не приходится рассчитывать на особое долголетие.
Однако ни одна из этих историй не соответствует критериям научного эксперимента, поэтому сложно считать их доказательством того, что ограничение калорий влияет на продолжительность жизни. Строго говоря, на людях это до сих пор не доказано. Тем не менее уже есть множество результатов, полученных на животных. Первый из них появился в 1939 году. Это была работа на крысах, которых ограничивали в еде на 300–1000 дней. Оказалось, что недокормленные животные не только растут медленнее своих сверстников, но и живут дольше.
С тех пор эти эксперименты воспроизводили множество раз на самых разных организмах: дрожжах, червях, мухах, рыбках и мышах, и везде эффект оказывался схожим. Были, впрочем, и такие эксперименты, в которых ограничение калорий на животных не действовало. Вероятно, все дело в генетической разнородности объектов: в зависимости от набора генетических вариантов и характерных мутаций организмы могут по-разному реагировать на одно и то же воздействие. Но в большинстве случаев ограниченные в еде существа все-таки жили дольше тех, кто ел вволю.
Наиболее близкими к человеку из модельных объектов стали макаки-резусы: с ними работали исследователи в университете Висконсина и в Национальном институте старения. Продление жизни достоверно обнаружили только в одном из двух исследований, но улучшение здоровья у обезьян отметили обе группы ученых.
Так или иначе, сегодня ограничение калорий (calorie restriction) считается самым эффективным негенетическим методом продления жизни (по крайней мере, у животных). Оно стало золотым стандартом "омоложения": если появляется, например, новый маркер биологического возраста, то он должен отражать не только старение организма со временем, но и "омоложение" в результате голодания. Если ученые обнаруживают новый способ отдалить старение животного, его удобно сравнить с ограничением калорий — оказывается ли он эффективнее, чем "стандарт"?
Продление жизни под действием ограничения калорий хорошо вписывается в самые разные теории старения. В отсутствие энергии клетка накапливает меньше побочных продуктов обмена и медленнее изнашивается (аргумент из области теории ущерба и накопления молекулярного мусора). В то же время дефицит еды вызывает в клетке легкий окислительный стресс — и действует как горметин, запуская работу антиоксидантов и систем репарации (подкрепляя свободнорадикальную теорию старения). Если в клетке есть какая-то программа старения, то голодание ее отменяет, поскольку замедляет и размножение. Наконец, в отсутствие еды не работают гиперстимуляторы клетки — инсулин, инсулиноподобный фактор роста и TOR. Поэтому клетка включает аутофагию — переваривание белков и органелл, — чтобы добыть себе строительные материалы, и сдвигает баланс "размножение — поддержание" в сторону последнего, то есть репарации ДНК и ремонта других клеточных макромолекул.
У ограничения калорий есть и другие полезные эффекты. Например, при голодании снижаются концентрации гормона роста, инсулина и ИФР в плазме крови и возрастает количество стресс-гормонов надпочечников. Вместе эти события приглушают воспаление в организме, что может быть полезно для лечения разных болезней вне зависимости от продления жизни. Кроме того, голодание оставляет клетки без глюкозы, что сильнее всего бьет по раковым и сенесцентным клеткам. И те и другие питаются в основном глюкозой, расходуя ее быстро и неэффективно. В отсутствие глюкозы стареющие клетки перестают выделять провоспалительные белки, а раковые клетки гибнут. Именно поэтому голодание иногда назначают после операций и при лечении опухолей.
Прежде чем удариться в подробное описание "молодящей диеты", я хотела бы еще раз отметить, что доказательств ее пользы для продления жизни у людей — как и для любой другой терапии "против старения" — до сих пор нет. Все эксперименты, на которые опираются современные ученые, либо произошли случайно, то есть не были подробно спланированы, либо еще не закончились. К первой группе, помимо истории с голодающими датчанами и норвежцами, относится Миннесотский эксперимент, о котором я рассказывала еще в первой части книги. В нем изучали состояние людей в условиях, приближенных к военному времени, и почти в два раза ограничили испытуемых в еде (они потребляли около 1800 килокалорий в день, а тратили порядка 3000). Через некоторое время у них развились проблемы со здоровьем и психикой, и эксперимент пришлось прекратить.
Другой пример — эксперимент "Биосфера 2", в ходе которого испытуемые провели два года в замкнутой экосистеме. По замыслу авторов эксперимента, им должно было вдоволь хватить еды (2500 килокалорий в день), но из-за проблем с урожаем первые полгода они ели всего по 1784 килокалории в день, а оставшиеся полтора года — по 2000. Их состояние здоровья (количество жира, давление, состав крови, концентрация гормонов) улучшилось к моменту окончания эксперимента, однако, как и в случае с Миннесотским экспериментом, для них нет контрольной группы, и их не с кем сравнить.
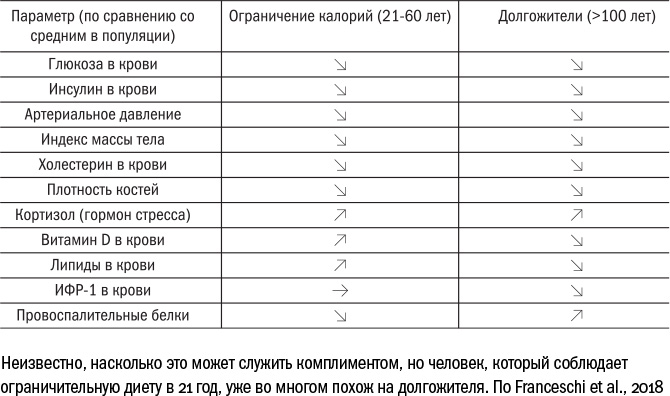
Единственное испытание, которое сейчас снабжает ученых тщательно выверенными данными, — американский проект CALERIE (Comprehensive Assessment of Long-term Effects of Reducing Intake of Energy — полная оценка долгосрочных эффектов от снижения потребления энергии). Это исследование идет всего несколько лет, а его участники — молодые люди в возрасте от 21 до 51 года, поэтому делать выводы о продлении жизни, безусловно, слишком рано. Однако руководители проекта уже отметили, что побочных эффектов от голодания практически не возникает. У испытуемых не снижается количество ИФР в крови, зато слабее работает щитовидная железа — верный союзник гормона роста. При этом по разным физиологическим параметрам — обмену веществ, массе тела, давлению крови и так далее — люди, которых ограничивают в калориях, напоминают долгожителей. Серьезные отличия можно заметить только в силе воспаления, которое повышено у пожилых людей и подавлено у молодых. Неизвестно, кому больше чести делает это сравнение, однако оно служит аргументом в пользу того, что исследования движутся в верном направлении.
Несостоявшийся рецепт
Несмотря на то что ограничение калорий считают самым эффективным способом продления жизни из тех, что доступны каждому, в научном сообществе нет до сих пор согласия по поводу того, как именно стоит себя ограничивать в еде. Поэтому единого рецепта "диеты для долголетия" все еще не существует, и я могу здесь рассказать только об общих принципах, на которых она строится, и разных ее вариантах, среди которых ученым еще предстоит выбрать лучший.
Первый вопрос, который закономерно возникает, когда речь заходит об ограничении в питании: насколько меньше калорий нужно получать? В классических экспериментах с животными точкой отсчета было питание ad libitum, то есть до насыщения. Контрольные мыши или крысы имели возможность есть столько, сколько хотели, а исследователи замеряли это количество и принимали его за норму потребления. Потом опытная группа получала сбалансированную еду, но в меньших количествах, чем контрольная. Обычно в таких работах под ограничением калорий понимают сокращение на 15–25% от нормы.
К людям же такой подход применить сложно. У каждого из нас свой режим питания, представление о норме и потребности. Кто-то начнет переедать, дорвавшись до неограниченного количества пищи, а кто-то всегда ест умеренно. Поэтому у людей необходимое количество калорий рассчитывают исходя из ежедневных энергозатрат: насыщение — это состояние, когда человек получает столько же энергии, сколько тратит.
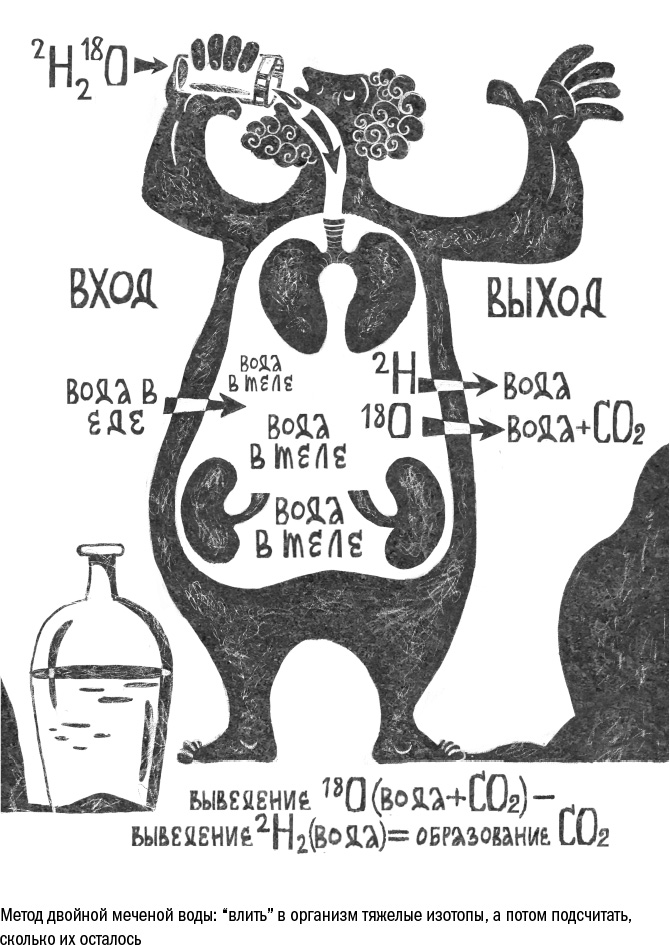
Есть несколько способов измерить энергозатраты. Самый простой — подсчитать количество выдыхаемого углекислого газа. В организме человека он образуется только в результате клеточного дыхания, поэтому по его количеству можно вычислить, сколько калорий (в составе глюкозы, белков и жиров) человек в среднем сжигает за день. Однако измерить объем углекислого газа непросто: чтобы собрать его весь, понадобится герметичная комната, откуда воздух не будет уходить наружу.
В экспериментах с людьми — например, в проекте CALERIE — используют более удобный метод с участием двойной меченой воды. Это вода, в состав которой входят тяжелые изотопы кислорода и водорода, то есть атомы с лишним нейтроном в ядре. Для здоровья она совершенно безвредна. Испытуемым дают выпить меченую воду, а затем подсчитывают количество тяжелых изотопов кислорода и водорода в моче. Дело в том, что водород может выйти из организма только с мочой (и совсем немного — с потом), а кислород — с мочой и углекислым газом. Поэтому разница в числе тяжелых изотопов водорода и кислорода равна количеству "улетевшего" углекислого газа, которое можно потом пересчитать на сожженные калории. Таким способом определяют базовые энергозатраты для каждого человека в отдельности, а потом из них вычитают нужные проценты, например в проекте CALERIE это было 20–25%.
На первый взгляд может показаться, что организм не может долго жить в таком режиме. Ведь если он каждый день получает на 20% меньше энергии, чем тратит, то ему должно не хватать энергии на жизнь. Хитрость здесь в том, что когда организму не хватает ресурсов, он может расходовать запасы более экономно и эффективно. Количество килокалорий, которые мы тратим на базовый обмен веществ, работу иммунитета, физическую активность и прочие статьи расходов, может изменяться в зависимости от того, сколько всего килокалорий поступает в организм. Всегда находится что-то, на чем можно сэкономить — например, перестать использовать расточительный гликолиз и перейти на кислородное дыхание. Ограничение калорий заставляет клетки экономить, не приводя к истощению, — если, конечно, это не радикальные версии голодания, как в Миннесотском эксперименте, где дефицит калорий доходил до 50%.
Следующий вопрос, который еще предстоит решить: что именно нужно есть, а что стоит ограничить. В классических экспериментах состав еды оставался неизменным — животные и люди ели то же, что и всегда, просто в меньших количествах. Более того, в статьях эту диету обычно именуют calorie restriction without malnutrition, дословно "ограничение калорий без недоедания" — таким образом, исследователи подчеркивают, что ограничения не должны приводить к истощению и нехватке питательных веществ. Поэтому словосочетание "(лечебное) голодание", которое часто используют в качестве синонима для "ограничения калорий" — не лучший вариант перевода английского термина.
Если уж что и ограничивать, так это потребление белков — основных источников сигнала для mTOR. Причем в экспериментах на мышах было установлено, что достаточно ограничить поступление в организм только одной аминокислоты, чтобы получить заметный эффект. Клаудио Франчески предлагает обойтись без триптофана, а большинство других исследователей ограничивают своих подопытных животных в метионине. В составе белков метионина очень мало, это одна из самых редких аминокислот, и она же самая важная — с нее начинается построение любых белковых молекул. В отсутствие метионина клетка не может производить новые белки, а вместе с ними и побочные продукты обмена веществ и тратит меньше энергии. Животные, которым не хватает метионина в пище, живут дольше, а их клетки стареют медленнее, в них усиливается работа антиоксидантов и улучшается работа митохондрий. Но поскольку человек обычно ест белки целиком, не разбирая их на отдельные аминокислоты, то избирательно ограничить метионин мы едва ли сможем. Остается только есть поменьше белковой пищи в целом.
Углеводы при ближайшем рассмотрении тоже оказываются не самой полезной пищей. Ведь именно в ответ на глюкозу в крови поджелудочная железа выделяет инсулин, а клетки запускают гликолиз. Поэтому другой вариант диеты заключается в том, чтобы исключить из еды практически все углеводы, оставив в основном жиры и немного белков. При этом в организме происходит следующее: оставшись без глюкозы, печень начинает производить ее заново. Для этого приходится обратить вспять те химические реакции, с помощью которых глюкозу обычно расщепляют. Однако до настоящей глюкозы дело не доходит, и образуются промежуточные соединения — кетоновые тела. Это короткоцепочечные жирные кислоты, которые то и дело разваливаются до ацетона — самого известного кетона, и в крови повышается концентрация кетонов. Именно поэтому диету с ограничением углеводов и преобладанием жиров называют кетогенной, а от людей, которые ее придерживаются, может пахнуть ацетоном.
Клетки других органов ловят кетоновые тела из крови и уже из них добывают энергию. Таким образом, клетки не получают глюкозы и не запускают работу mTOR. В то же время короткоцепочечные жирные кислоты подавляют воспаление и блокируют активность ферментов, которые отвечают за возрастную переупаковку ДНК. Мы с этими короткими кислотами уже встречались, когда говорили о микробах, — у долгожителей и здоровых людей по сравнению с больными чаще встречаются именно те бактерии, которые эти кислоты производят. Кетогенная диета тоже увеличивает их концентрацию в крови. Вероятно, поэтому она успешно продлевает жизнь модельным пожилым мышам, а еще поддерживает их когнитивные функции.
Мода на кетогенную диету давно уже захватила Кремниевую долину, однако насколько она безопасна, до сих пор неизвестно. Можно, конечно, назначить углеводы и белки главными врагами, но как тогда быть с жирами? Пока неясно, не повышает ли кетогенная диета у человека риск атеросклероза и ожирения тканей, как это было замечено у мышей. Проблема в том, что все клинические испытания, которые с ней проводят, нацелены на лечение конкретных болезней. Известно, например, что кетогенная диета помогает при некоторых видах эпилепсии (ровно так она и набрала популярность) и может быть полезна для борьбы с ожирением и раком (в сочетании, конечно, с противоопухолевой терапией). Но что происходит со здоровыми людьми, которые ее придерживаются, и сколько времени это может протекать без последствий, пока никто не выяснил.
Наконец, третий пункт, который необходимо прописать в диете — когда нужно есть? Ограничивать калории можно самыми разными способами: можно есть постоянно только низкокалорийную пищу, а можно просто время от времени голодать, так чтобы усредненное потребление калорий оставалось ниже нормы. Существует несколько методик и такого интервального или периодического голодания: можно воздерживаться от еды по 16 часов каждый день, или через день, или 2 дня через 5 и так далее.
Все эти виды голодания работают по меньшей мере на животных — то есть продлевают жизнь мышам (а крысам — даже до 83%) или улучшают их здоровье. У интервального голодания есть и некоторые плюсы в сравнении с перманентным ограничением калорий: например, оно позволяет избежать потери веса, которая хороша при ожирении, но может стать проблемой в старости. Кроме того, интервальное голодание связано с биологическими ритмами человека. Мы уже говорили о том, что поступление еды в "нерабочее" время подстегивает работу mTOR. Поэтому, возможно, полезно есть только в светлое время суток, не нарушая естественный цикл, — в этом смысле может сработать вариант "есть в течение 10–11 часов в сутки". А идеальный вариант, судя по всему, был бы синтезом двух основных: есть в течение лишь нескольких часов в сутки и при этом ограничивать калории. По крайней мере, в недавнем эксперименте на мышах такое совмещение методов дало лучший результат, чем каждый в отдельности.
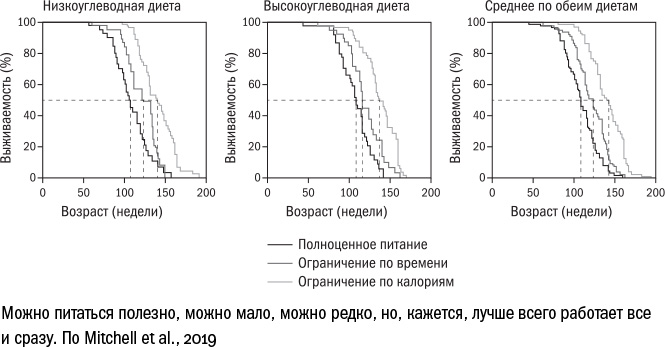
Тем не менее врачи до сих пор не рекомендуют практиковать какие-либо варианты голодания самостоятельно. Мы все еще не знаем, какие могут возникнуть побочные эффекты. Только недавно появились первые результаты клинических испытаний на здоровых людях, которые показали, что после полугода питания по схеме "12 часов через 36", никаких проблем со здоровьем не возникает. При этом у некоторых испытуемых ограничение калорий доходило до 48% (в среднем — 37%) от оптимума. Это напоминает Миннесотский "голодный" эксперимент, который закончился для участников серьезными неприятностями, вплоть до психических расстройств, однако в новом исследовании ничего подобного не произошло. Можно предположить, что то, каким образом и в какой степени можно голодать, не вредя здоровью, в значительной степени зависит от образа жизни и исходного здоровья человека — отсюда и предостережения врачей.
Таблетки от еды
Ограничение калорий — самый простой и понятный, пусть и не до конца подтвержденный на людях, способ остановить квазипрограмму старения и износ клеток. Но не все люди готовы на такие жертвы, а кому-то голодание и вовсе противопоказано, потому что может подавлять иммунитет и снижать плотность костей, повышая риск переломов. Хорошо бы найти какой-нибудь способ ограничивать в еде не человека целиком, а отдельные его клетки. Иными словами, была бы очень кстати какая-нибудь "голодная таблетка" (по-научному — калоримиметик, имитатор ограничения калорий), которую можно принять после еды и сделать вид, что не ел. Как ни удивительно, такая таблетка действительно существует. Причем, когда ее обнаружили, оказалось, что этот препарат в медицине известен уже несколько десятков лет. Имя ему — рапамицин.
Рапамицин открыли в начале 70-х годов прошлого века, когда изучали образцы почвы с острова Пасхи. Вместе с почвой в образец попали местные бактерии, которые в лаборатории стали выделять антибиотик — его и назвали рапамицином (рапа — в честь местного названия острова, Рапануи). Сначала рапамицин использовали по назначению — для борьбы с бактериальными и грибковыми инфекциями, но в процессе оказалось, что он не очень эффективен против паразитов, зато неплохо подавляет иммунную систему пациентов. И пришлось его переквалифицировать в иммуносупрессор: рапамицин стали использовать и используют до сих пор при пересадках органов, например почек, чтобы предотвратить иммунную агрессию организма против незнакомой ткани. Попутно выяснилось, что жизнедеятельность раковых клеток этот препарат тоже подавляет, и его стали применять в онкологии. И уже после этого ученые нашли белок, против которого работает рапамицин, и так и назвали его — "мишень рапамицина", target of rapamycin, сокращенно TOR.
Рапамицин блокирует mTOR напрямую, в обход всех сигнальных путей. Поэтому под его действием и опухоли растут медленнее, и иммунные клетки не работают, и обычные клетки приостанавливают свою энергетическую гонку и не торопятся стареть, и даже эпигенетический возраст у них не растет. В тестовых экспериментах на мышах рапамицин действительно продлил их жизнь, за что авторы проекта получили одну из премий "Мафусаилова мышь". Тут бы и начать его использовать на людях, но есть одна проблема — побочные эффекты. Рапамицин не зря раньше применяли как иммуносупрессор: подавляя обмен веществ в клетках, он мешает им выполнять и полезные для организма функции. Список возможных осложнений выглядит внушительно, начинаясь с тошноты и поноса и заканчиваясь гиперхолестеринемией, диабетом, гипертонией и даже развитием опухолей, которые ускользают из-под рапамицинового надзора. Несмотря на то что сейчас в онкологии используют не сам рапамицин, а его менее токсичные аналоги (их называют рапалогами), их применение все равно не проходит для организма бесследно.
Тем не менее аналоги рапамицина недавно начали тестировать как "лекарство от старости". Авторы проекта, конечно, не позиционируют это как окончательную цель. Как и у большей части исследований в области геронтологии, у их проекта есть небольшая и достижимая формальная цель — профилактика сезонной простуды. Дело в том, что в небольших дозах рапамицин действует как горметин, то есть вызывает небольшой стресс в клетках, который усиливает антистрессовый ответ, и после этого организм легче справляется с атакой патогенов. Аналоги рапамицина проверили в небольших концентрациях на пожилых людях, у которых за год приема препарата не возникло серьезных побочных эффектов, зато болели они реже, чем их сверстники. Таким образом, первый тест-драйв лекарство прошло успешно.
Параллельно с рапамицином идут поиски и других калоримиметиков. Коль скоро мы представляем себе, как устроен сигнальный каскад mTOR и кто его запускает, то могли бы, наверно, вмешаться в процесс на других стадиях. Возможно, это вмешательство окажется менее токсичным, чем рапамицин, а может, даже более эффективным. И поскольку в основе каскада mTOR лежит обмен веществ, в том числе глюкозы, то логично искать калоримиметики среди препаратов, которые влияют на уровень глюкозы в крови. Так геронтологи наткнулись на метформин.
Этот препарат давно уже используют против диабета, поскольку он угнетает синтез глюкозы в печени. При этом организм сам себя не подкармливает глюкозой даже в моменты голода, и клетки становятся более чувствительны к инсулину — готовы забрать сахар из крови по первому сигналу. Но в какой-то момент выяснилось, что диабетики, которых лечили метформином, во время терапии рискуют умереть на 17% меньше здоровых людей, а иногда даже дольше живут. Это не означает, конечно, что метформин сам по себе может продлевать жизнь — для этого нужно разбираться в том, что происходит с диабетиками после такого лечения. Тем не менее этот результат говорит о том, что метформин может влиять на скорость старения организма.
Разбираясь в механизмах действия метформина, исследователи обнаружили, что он запускает фермент АМРК, который реагирует на уровень глюкозы в клетке и тормозит mTOR, если глюкозы мало. В то же время метформин тормозит работу митохондрий, усиливает работу антиоксидантов и снижает воспаление, а еще блокирует рост опухолевых клеток. В итоге, например, мыши, которых кормили метформином, прожили на треть дольше контрольных. У метформина, впрочем, есть и побочные эффекты, например ожирение и риск гипогликемии. Поэтому врачи не рекомендуют принимать его без показаний — как и все остальные потенциальные "средства от старости".
Однако геронтологи не теряют надежды на то, что в малых концентрациях метформин все-таки может оказаться полезен — и сейчас готовится к запуску первое его клиническое испытание на здоровых людях, TAME (targeting aging with metformin, дословно "борьба со старением с помощью метформина"). Показательно, что деньги на это исследование авторы проекта собирают через краудфандинг — США все еще не готовы финансировать поиски лекарства от старости.
Каскад mTOR можно блокировать и на другой стадии — не до, а после активации mTOR. Так, судя по всему, работает ресвератрол — еще одно перспективное лекарство от старения. Он активирует сиртуины — белки, которые регулируют упаковку ДНК в ядре. Какой бы сигнал ни приходил от mTOR, сиртуины не дают переупаковывать ДНК — и эпигенетический возраст клетки не растет. Гены, которым положено работать, остаются развернутыми, а те участки, которым положено молчать — например, несущие на себе ретротранспозоны, — не раскручиваются. А вслед за сиртуинами запускаются и другие клеточные процессы, например аутофагия — переваривание испорченных органелл и неправильно свернутых белков. Кроме того, ресвератрол, как и многие вещества растительного происхождения (а он содержится, например, в кожуре винограда и орехах), обладает множеством биологических функций и в том числе может работать как антиоксидант. Впрочем, эффективность ресвератрола пока под вопросом: он продлевает жизнь далеко не всем мышам и в клинических испытаниях тоже пока никак себя не проявил, хотя и считается самой распространенной и безопасной биодобавкой против старения.
И пусть мы пока не знаем, какое из этих средств — ресвератрол, рапамицин, метформин или какой-то другой калоримиметик — поможет людям справиться с возрастными болезнями, сам факт, что есть множество способов подействовать на один и тот же механизм, позволяет надеяться, что мы на правильном пути. Так или иначе, все они работают по принципу "тише едешь — дальше будешь" и мешают комплексу mTOR гиперстимулировать клетки. Фактически они вмешиваются в программу развития и тормозят рост организма, делая его молодость — хотя бы на клеточном уровне — не такой бурной, как она могла бы быть. Из этого следует, что применять эти гипотетические методы борьбы со старением нужно с осторожностью и только после того, как рост организма закончится, а размножение совершится. Понятно, что ограничение калорий или тем более небезопасный рапамицин невозможно советовать ребенку или беременной женщине. А вот после того, как необходимость в активном развитии отпадает, имеет смысл притормозить излишнюю активность клеток и "программу молодости" в виде mTOR и инсулина — и тогда диета или калоримиметики могут быть полезны. Именно поэтому папины слова о том, что нужно ждать и поститься, были мне совершенно непонятны 25 лет назад, а сейчас приобретают новый неожиданный смысл.

