3. ВИНОВАТЫ ГЕНЫ: СТАРЕНИЕ КАК ПРОГРАММА
Как-то со школьниками в лагере мы ставили пьесу про призраков, которые терроризировали английское аристократическое семейство. Нам тогда казалось, что мы невероятно разошлись — в спектакле были и родовые проклятия, и безумные танцы, и любовные интриги, — но когда потом я стала расспрашивать зрителей об их впечатлениях, то с удивлением обнаружила, что больше всего им запомнились не пляски призраков, а часы. У нас действительно посреди сцены стояли большие самодельные часы, стрелки которых сначала показывали традиционный файф-о-клок, потом медленно ползли к полуночи, а потом внезапно начинали творить невесть что: идти в обратном направлении или бешено вращаться. Оказалось, что зрителей сильнее всего заинтересовало, кто сидел в часах. Разгадка была проста: в часах сидела бабушка-призрак, которая должна была отыграть свою короткую роль только ближе к концу действия, но заработала себе аплодисменты еще до выхода на сцену.
Среди теорий старения есть и такие, которые предполагают, что у процесса изнашивания организма есть начальник или план, по которому оно происходит. Иными словами, сторонники этих теорий убеждены, что без демонической бабушки внутри часов, стрелки нашего старения не сдвинутся с места. Я собирательно называю их теориями запрограммированного старения.
На первый взгляд они могут показаться самыми зловещими из всех, поскольку подразумевают, что в угасании и смерти организма кто-то напрямую заинтересован. Но при ближайшем рассмотрении они оказываются самыми оптимистичными: ведь если во всех наших бедах виновата одна-единственная программа, то ее можно выключить, и старение выключится вместе с ней. Проблема только в том, что мы все еще не знаем, существует ли она на самом деле.
Логика смерти
Идею о том, что смерть может быть результатом работы некой программы, привнес в научную дискуссию в 1882 году немецкий зоолог, эмбриолог и эволюционный биолог Август Вейсман. Он рассудил, что смерть могла бы быть полезна, с одной стороны, чтобы избавлять популяцию от больных и слабых особей, освобождая место для более сильных, а с другой стороны, чтобы ускорять смену поколений. Так начала свою жизнь эволюционная теория старения.
Геронтологи до сих пор ее развивают, находя все новые и новые плюсы для организмов в программе старения и смерти. Эти плюсы могут выглядеть, например, так. Каждому виду в отдельности выгодно эволюционировать быстро. При этом многие черты, которые дают преимущество отдельным особям, развиваются долго и стоят дорого — это, в частности, интеллект и иммунитет. Несмотря на то что частично они определяются генами, основную роль в обоих случаях играет жизненный опыт. А поскольку опыт копится со временем, долго живущие особи будут всегда иметь преимущество перед молодыми и поколения начнут сменяться медленнее. Единственный способ этого избежать — включить программу старения, которая компенсирует преимущество долгожителей изнашиванием их тел.
Еще один плюс программы старения, возможно, заключается в том, что она помогает организму распределять энергию в изменчивых условиях. Программа работает только тогда, когда ресурсов много, и у животного есть возможность размножаться и быстро уступать место новому поколению. В условиях дефицита энергии программа выключается: если ресурсов для размножения недостаточно, значит, и уступать место в популяции некому. Таким образом, теория запрограммированного старения вобрала в себя теорию "тела на выброс": чем лучше условия жизни, тем больше возможностей для размножения, тем больше энергии отбирают половые клетки и тем меньше ее достается "соме", то есть остальному телу, которое постепенно деградирует.
О том, как такая программа могла бы реализоваться, пишут далеко не все приверженцы этой теории. Но сам факт ни у кого из них не вызывает сомнений, и программу смерти они считают логичным продолжением программы развития организма. Здесь, правда, стоит вспомнить, что развитие у всех происходит одним и тем же путем, за редкими исключениями, а вот стареют люди по-разному, становясь все более гетерогенными по всем параметрам. Но сторонники программы старения готовы защищать свою точку зрения с помощью цифр: хоть половое развитие и запрограммировано, говорят они, но относительный разброс по времени начала менструаций у девочек — 8–13%. Прекращение менструаций — один из первых признаков старости, и здесь разброс по времени похож — 7–11%. И для времени смерти различия не намного выше — 16–21%. Так может быть, старение не так уж и гетерогенно и укладывается в одну программу?
Непосредственно механизм запрограммированного старения предложил в 1997 году Владимир Скулачев, специалист в области клеточного дыхания и один из создателей биоэнергетики, научной дисциплины, которая занимается обменом энергии в клетке. Скулачев обратил внимание на то, что у одноклеточных организмов — в частности, дрожжей — тоже встречается запрограммированная смерть, а механизмы ее схожи с апоптозом, клеточным самоубийством в организме млекопитающих. В обоих процессах участвуют белок р53, а также антиоксиданты и шапероны (белки — упаковщики белков). Поэтому Скулачев предложил считать гибель одноклеточных дрожжей и гибель отдельных клеток в многоклеточных организмах единым явлением и назвал его феноптозом.
Когда феноптоз не работает, клетка может справиться с поломками и свободными радикалами и остаться в живых. Когда феноптоз запущен, механизмы ремонта выключаются и начинают накапливаться те самые повреждения, которые приводят в конечном счете к старению или апоптозу клеток, а затем и к смерти организма. В этой теории находится место и онкологическим заболеваниям. Как только механизмы ремонта повреждений ослабевают, клетки перерождаются в опухолевые и убивают организм даже в отсутствие апоптоза. Поэтому Скулачев считает старение и рак следствиями одной программы и называет рак быстрым феноптозом, а старение — медленным, постепенным.
Программа старения и смерти, по Скулачеву, — это проявление альтруизма. Слабые организмы уступают место своим сильным собратьям, которые несут более выигрышные в данных условиях мутации. Эту логику можно применить не только к одноклеточным организмам, но и к крупным животным. Скулачев приводит в пример тихоокеанского лосося, который умирает сразу после того, как размножился, и тем самым, вероятно, освобождает место для развития своих потомков, а своим телом подкармливает беспозвоночных, которые тоже впоследствии станут пищей для следующего поколения.
Чтобы доказать, что программа старения действительно существует, необходимо привести примеры обратного — то есть случаи, в которых она не работает и старость не наступает. Если принять теорию феноптоза, то таких примеров должно быть немало: ведь механизмы клеточного ремонта очень разнообразны, и заставить их работать бесперебойно можно множеством способов. Первым в списке примеров у Скулачева значится, конечно, голый землекоп, чьи клетки гораздо более устойчивы к апоптозу, чем клетки других грызунов или человека, вероятно, благодаря поддержке длинных нитей гиалуроновой кислоты в межклеточном веществе. Вторыми следуют летучие мыши, которые, судя по всему, "сломали программу" ближе к корню и постоянно производят антиоксиданты. Что характерно, ни землекопы, ни летучие мыши, ни другие животные, которых относят к пренебрежимо стареющим, практически не болеют раком — и это подтверждает идею Скулачева о том, что рак и старение — явления одного рода.
Наконец, если программа существует, то ее можно выключить искусственно. Например, самцы австралийской бурой сумчатой мыши, как и лососи, погибают вскоре после спаривания. Оказалось, что для того, чтобы вызвать у них скорую смерть, достаточно феромонов самки, а если кастрировать или изолировать самцов, то можно продлить им жизнь до уровня самок. Того же эффекта можно достичь и посредством манипуляций с генами: выключения одного-единственного гена бывает достаточно, чтобы продлить жизнь дрозофилы или нематоды C. elegans в 4–10 раз. С позвоночными, правда, такого эффекта достичь не удается — даже мыши, на которых уже перепробовали все, пока дольше четырех лет не живут.
Гадание на генах
Что же касается людей, то у них признаков программы старения еще меньше, чем у экспериментальных животных. Мы не умираем после размножения в одночасье, нет среди нас и долгоживущих "мутантов". Тем не менее сторонники теории запрограммированного старения не теряют надежды и продолжают поиски программы в наших генах.
С людьми в этом смысле все куда сложнее, чем с животными. Нельзя просто взять человека, отключить у него какой-нибудь ген и посмотреть, будет он жить дольше или нет. Нельзя скрещивать людей избирательно, чтобы получить у их детей интересующую ученых комбинацию генов. Поэтому приходится рассчитывать на то, что на земном шаре естественным путем уже скопилось достаточно разных генетических комбинаций, чтобы найти среди них какую-нибудь закономерность.
Основной метод, который для этого используют сейчас, — это полногеномный поиск ассоциаций (genome-wide association studies, GWAS). Ученые собирают последовательность геномов разных людей, а затем ищут связь между продолжительностью их жизни и отличиями в последовательности отдельных генов. Иными словами, пытаются построить модель, которая позволила бы предсказать срок жизни человека на основе тех вариантов генов, которые он несет в своих клетках.

Для этого нужна большая выборка — в тысячи, а лучше сотни тысяч людей. За ней ученые обычно обращаются в биобанки — это базы данных, которые составлены по результатам многолетних исследований. Обычно такие исследования преследуют совсем другую цель — например, соотнести образ жизни с риском развития болезней, — но заодно собирают у участников множество анализов, включая генетические. Поэтому в каждом банке можно найти информацию не только о продолжительности жизни людей и их генотипе, но и о множестве деталей их биографии. Но поскольку действительно больших банков не так много и собирают их в основном в развитых странах, то результаты, которые ученые с их помощью получают, несколько перекошены — например, мы уже немало знаем о генах, которые связаны с долгой жизнью у британцев и исландцев, а вот у народов Азии и Африки закономерности могут оказаться совсем другими.
Тем не менее таких исследований уже было немало, и на их основе можно сделать два важных вывода. Первый — оптимистичный: долголетие определенно наследуется. Это, конечно же, не новость: давно известно, что существуют целые семьи долгожителей — в тех же "голубых зонах". Теперь этому есть и официальные подтверждения: у потомков долгожителей, например, на 62% ниже риск смерти от всех причин, чем у контрольной группы того же года рождения, на 71% ниже риск смерти от опухолей и на 85% — от болезней сердца.
Но есть и пессимистичный вывод: единого "гена долголетия" или даже группы таких генов, судя по всему, не существует. Даже оставив в стороне случаи смерти от внешних причин и случайных заболеваний вроде эпидемий, мы не можем утверждать, что продолжительность жизни определяется только генами. Не можем мы и сказать, что долголетие напрямую от них зависит — если только речь не идет о мутациях, которые достоверно сокращают жизнь, вроде прогерии.
Поэтому сейчас принято говорить не о зависимостях, а о корреляциях, то есть статистических связях долголетия с теми или иными вариантами генов. И когда мы видим сообщение о том, что вариант номер 25 гена А коррелирует с долгой жизнью, не стоит радоваться раньше времени. Из этого факта, например, не следует, что если человек исправит ген А в своих клетках на нужный вариант (а это рано или поздно станет возможным), то обязательно проживет дольше, чем мог бы со своим исходным вариантом гена. Корреляция — это не причинно-следственная связь, а некоторая статистическая закономерность, которую еще предстоит объяснить. Например, может оказаться, что вариант номер 25 гена А распространен у потомков какой-нибудь знатной семьи, которые традиционно богаты и следят за своим здоровьем и поэтому живут дольше, — а любому другому человеку этот вариант гена никакой пользы не принесет.
Так как же правильно ответить на вопрос, зависит продолжительность жизни от генов или нет? Для этого ученые пользуются понятием наследуемости. Это вклад генетического разнообразия в разнообразие продолжительности жизни. Иными словами, наследуемость — это точность генетической модели: сколько случаев долголетия можно предсказать, основываясь на генотипах людей.
Сейчас считается, что наследуемость долголетия — 15–30%. Хотя и эти цифры могут быть завышены. Дело в том, что, когда исследователи подсчитывают наследуемость, они сравнивают наблюдаемый разброс в долголетии с ожидаемым. А ожидаемые значения рассчитывают в такой ситуации, когда люди скрещиваются случайным образом, то есть выбирают себе супругов независимо от генетических факторов. Однако это не всегда может быть так. В одной из работ ученые обнаружили, что продолжительность жизни часто бывает похожа даже у некровных родственников. Так, если муж и жена живут примерно одинаковое время, это может означать, что они ведут одинаковый образ жизни. Но если у мужа и сестры его жены, которые живут порознь, продолжительность жизни похожа, то это значит, что муж каким-то образом выбрал жену с близким сроком жизни. Мы до сих пор не знаем, как это могло бы работать, но с учетом избирательности скрещивания у людей реальное значение наследуемости может быть гораздо меньше — около 4–7%, по предварительным оценкам.
Кроме того, наследуемость может изменяться в зависимости от возраста. Когда человек только появляется на свет, его шансы прожить столько же, сколько и его предшественники, относительно невысоки. Но, если ему удалось дожить до 60 лет, прогноз становится более благоприятным и улучшается с каждым годом. Недавние подсчеты показали, что наследуемость продолжительности жизни достигает 30% только у 10% наиболее долго живущих людей. А вот короткая жизнь вообще, кажется, не наследуется.
Девочки и мальчики
Итак, что можно получить в наследство от родителей для долгой жизни? Самый простой вариант — вторую половую Х-хромосому. Среди млекопитающих попадаются самые разные соотношения между продолжительностью жизни самцов и самок, но человек в некотором смысле уникален: у него гендерная несправедливость сохраняется всегда и везде, вне зависимости от социальных ролей, генетических факторов и места обитания. Во всех известных популяциях женщины в среднем живут дольше мужчин, а среди долгожителей женщин обычно больше в несколько раз.
Это, впрочем, не означает, что женщины живут лучше: хоть они и умирают реже из-за возрастных заболеваний, болеют они сильнее и чаще мужчин, даже те, кто преодолели рубеж 90 лет. Этот парадокс получил название парадокса смертности-уязвимости. Для него пока нет однозначного объяснения, хотя есть несколько вариантов. Например, можно предположить, что женщины внимательнее относятся к собственному здоровью и поэтому чаще ходят к врачам. Тем не менее болезненность у них проявляется и на доклиническом уровне — пожилые женщины слабее мужчин по всем физическим параметрам. Может быть, дело в том, что у них в целом более уязвимые соединительные ткани — хрящи, кости, мышцы и связки. Поэтому с возрастом женщины слабеют и разрушение скелета причиняет им боль, хотя и не приводит к быстрой смерти.
Объяснить феномен женского долголетия по сравнению с продолжительностью жизни мужчин оказывается куда сложнее, чем парадокс смертности-уязвимости. Здесь тоже можно идти несколькими путями. Первая важная особенность женщин заключается в работе иммунной системы. По некоторым данным, тестостерон сильнее подавляет активность иммунитета, чем женские половые гормоны. У молодого организма это снижает риск развития аутоиммунных заболеваний, но в старости, когда воспаление помогает очищать организм от старых клеток, женщины оказываются в выигрыше.
Второе преимущество женщин перед мужчинами — в спасительном действии эстрогенов на клетки в тканях. Они не только стимулируют рост и деление клеток, но и защищают их от активных форм кислорода — тех самых, которые повреждают белки и ДНК в клетках и сопровождают любое воспаление. Так что эстрогены, вероятно, берегут женский организм. А вот вредит ли мужчинам их тестостерон, до сих пор неясно. Исследования на выборках кастрированных мужчин дают разные результаты. Корейские евнухи, например, жили дольше своих сверстников, а европейские певцы-кастраты, судя по всему, нет.
Наконец, решающую роль может играть и сама по себе Х-хромосома. В клетках любой самки млекопитающего их две копии, в клетках самца — одна Х- и одна Y-. Y-хромосома значительно короче, чем Х-, и содержит гораздо меньше генов. Если на Х-хромосоме у самца в каком-то гене возникает мутация, то компенсировать ее нечем, и этим тоже можно было бы объяснить повышенную смертность. Тем не менее это предположение не работает для птиц: у них, правда, все наоборот, и две одинаковых хромосомы у самцов, а не у самок. Но в таком случае самцы должны были бы жить дольше, что далеко не всегда так.
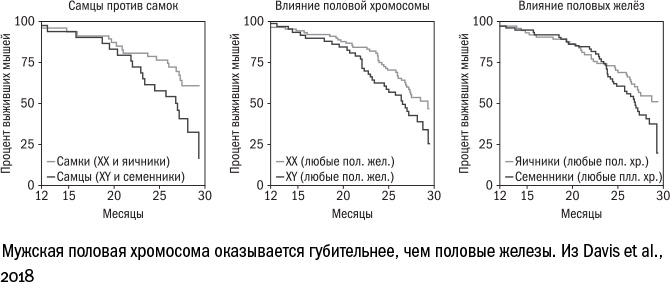
Авторы недавнего эксперимента попробовали выяснить, что влияет на продолжительность жизни сильнее — гены или гормоны. Для этого они перенесли ключевой "мужской" ген sry (именно его наличие определяет пол млекопитающих и развитие половых желез) с Y-хромосомы на неполовую хромосому. При этом физиологический пол мышей (наличие семенников или яичников) перестал зависеть от присутствия в клетке половых хромосом. Исследователи получили четыре варианта животных: ХХ (я), ХХ (с), XY (я), XY (с), где я — яичники, с — семенники, и измерили их продолжительность жизни. Как и следовало ожидать, "абсолютно женственные" мыши — ХХ (я) — продержались дольше всех, а вот "настоящие самцы" — XY (с) — первыми сошли с дистанции. При этом мыши с генотипом XY жили одинаково недолго вне зависимости от того, яичники им достались или семенники. А мыши с генотипом ХХ жили по-разному: с семенниками — меньше, с яичниками — дольше. Таким образом, если у животного уже есть Y-хромосома, то продлить жизнь женскими гормонами ему не получится. А вот если в организме выросли семенники, то дополнительная Х-хромосома несколько удлиняет его существование. Иными словами, продолжительность жизни самцов сокращают и гены, и гормоны, но гены (точнее, Y-хромосома) — сильнее.
Кот, осел и мельница
Кроме половой хромосомы, от родителей можно унаследовать теломеры. Несмотря на то что длина их зависит от возраста, в котором родители зачали ребенка, наследуются еще и гены, от которых зависит достраивание теломер в течение жизни. И в гене самой теломеразы, и в гене теломерной РНК (которую фермент использует как шаблон) есть характерные мутации, которые чаще встречаются у долгожителей одновременно с длинными теломерами. В результате этих мутаций наследуемость активности теломеразы достигает 81%.
Есть и другие варианты генов, которые регулярно находят у долгожителей из разных стран. Чаще всего они связаны со старением клеток, воспалением, обменом жиров и работой сердечно-сосудистой системы. Обратите внимание: никаких указаний ни на физическую силу, ни на активность мозга, ни на устойчивость к раку — признаки, которые у нас обычно ассоциируются с долголетием, — в этом списке нет. Вот гены, которые чаще всего связывают с долгой жизнью:
1. АРОЕ. Мы уже обсуждали этот ген, когда речь шла о болезни Альцгеймера. Его вариант APOE ε4 считается одним из главных факторов риска не только для деменции, но и для развития ожирения и гипертонии, поскольку отвечает за транспорт липидов, в том числе холестерина, по крови.
2. IL6. Интерлейкин-6, с ним мы тоже встречались, — это один из главных провоспалительных белков, который выделяют иммунные клетки и сенесцентные клетки в других тканях.
3. ACE. Этот ген кодирует ангиотензинпревращающий фермент: как следует из названия, он превращает гормон-предшественник ангиотензин I в активную форму ангиотензин II, который, в свою очередь, повышает кровяное давление.
4. KLOTHO. Белок, названный в честь греческой богини судьбы (мойры) Клото. Клото-мойра прядет нить человеческой жизни, а Klotho-белок пронизывает мембраны клеток и усиливает их чувствительность к инсулину (то есть способность поглощать глюкозу из окружающей жидкости), а также регулирует проницаемость мембраны для ионов, улучшает выживаемость стволовых клеток и защищает их от окислительного стресса.
5. FOXO3. Этот белок работает как фактор транскрипции: запускает гены, которые участвуют в починке ДНК, и тормозит другие гены, которые стимулируют рост и деление клетки. В некотором смысле он противостоит действию инсулина, тормозя клеточный обмен веществ, а точнее — переключая его на самоподдержание.
Тем не менее многие ученые скептически настроены по отношению к поискам "генов долгой жизни". Хотя бы потому, что к долголетию может вести несколько разных путей. Клаудио Франчески, например, предлагает считать итальянских обитателей "голубых зон" и европейских долгожителей фенокопиями, то есть организмами, которые достигли одного и того же результата посредством разных генетических стратегий. Так, оказалось, что долгожители-мужчины часто несут мутации в генах, связанных с воспалением — вероятно потому, что у мужчин воспалительный ответ в целом слабее. А долгожители-женщины добиваются успеха другим путем — за счет генов, связанных с обменом триптофана (предшественника серотонина, "гормона счастья", а также переносчика водородов НАД+, который может служить антиоксидантом). Поэтому вполне возможно, что единого рецепта долгой жизни у людей, как и у животных, мы так и не найдем.
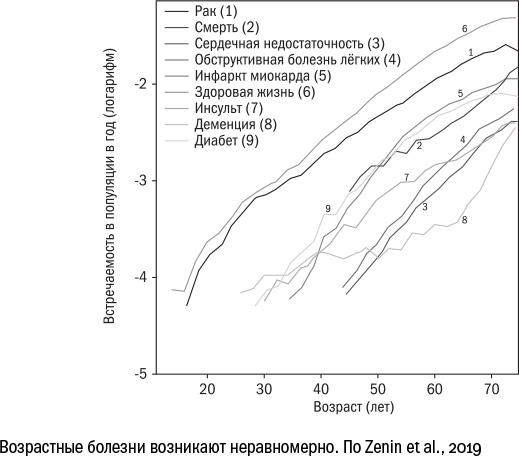
Если внимательно посмотреть на список генов, которые позволяют объяснить разброс в продолжительности жизни у людей, то можно заметить, что большинство из них так или иначе связаны с основными рисками смерти в пожилом возрасте: деменцией, сердечно-сосудистыми болезнями и раком легких. Да и сами кривые смертности от возрастных болезней подозрительно напоминают кривую Гомперца. Это позволяет предположить, что самая выигрышная стратегия для долгой жизни — избежать наиболее распространенных болезней. Но если это так, то набор генов, связанных с долголетием, будет меняться по мере развития медицины. В XIX веке люди чаще умирали от инфекций, чем сейчас, в XX веке на смену инфекциям пришли деменция и рак. Кто знает, когда мы научимся бороться и с ними, какая болезнь следующей выйдет на первый план? И тогда через сотню лет в статьях, посвященных долгожительству, будут значиться совсем другие гены.
Против логики
Долгие и безрезультатные поиски генов, которые отвечали бы за изнашивание организма, сильно подрывают позиции теории запрограммированного старения. Но это не единственный аргумент, который есть у противников этой теории.
Еще, например, они требуют объяснить, как такая программа могла бы появиться. Владимир Скулачев, например, утверждает, что выбывание старых организмов из популяции ускоряет смену поколений и, следовательно, эволюцию вида. Но, если особь дожила до пожилого возраста, это значит, что она достаточно хорошо приспособлена к условиям, в которых существует. Имеет ли смысл убивать ее в надежде, что молодое поколение случайно окажется носителем еще более "удачных" для данных условий мутаций? Учитывая, что "удачные" мутации возникают нечасто, такая стратегия может не принести непосредственной выгоды для популяции — а значит, не будет поддержана отбором.
Другое соображение сторонников программируемого старения состоит в том, что чем короче поколение, тем больше генетических вариантов "проверяется" природой одновременно, то есть выше разнообразие и выше шанс "угадать" и получить подходящий генотип. Но если условия внешней среды не изменяются постоянно, то такая спешка не приносит непосредственной выгоды — предыдущее поколение может оказаться достаточно приспособленным. А если условия внешней среды изменяются все время, то пожилые особи, с которыми должна бы бороться программа, не успевают заполнить собой всю нишу и вытеснить оттуда молодое поколение.
Наконец, идея о том, что старшее поколение "объедает" младшее и забирает себе все ресурсы, тоже не выдерживает критики: она работает только в том случае, когда каждая особь слабо подвижна и спаривается только с близко расположенными партнерами. Тогда действительно оказывается важным освобождать место за счет гибели старых особей. Но если организмы достаточно крепки, чтобы перемещаться по своей территории, то этот аргумент теряет силу.
Впрочем, самым сильным все равно остается генетический довод: как бы ожесточенно сторонники программируемого старения ни искали кнопку "пуск", до сих пор пока ничего не нашли. Ни у человека, ни у мышей, ни у беспозвоночных нет такого гена, который позволил бы отменить старение. И даже животное, которое стало эмблемой теории программируемого старения — голый землекоп — не живет вечно и страдает возрастными болезнями.
Маленькая трагедия
Тем не менее при большом желании программу в процессах старения действительно можно найти — если искать не в генах, а уровнем выше, в эпигенетике. ДНК в наших клетках день за днем покрывается новыми эпигенетическими маркерами — метильными метками, и клетки постепенно и необратимо теряют доступ к собственной генетической информации.
С точки зрения теории "тела на выброс", все части тела (сомы) обречены на смерть, кроме клеток зародышевой линии, то есть половых. Но если присмотреться внимательнее, то сома оказывается неоднородной. Стволовые клетки долго сохраняются в полудетском состоянии, не старея, и в этом смысле их можно считать непосредственным представительством зародышевой линии в соме. Но с течением времени в этих клетках включается программа — не смерти, но дифференцировки, что в некотором роде одно и то же. Получая профессию, потомки стволовых клеток прощаются с детством и бессмертием, впереди у них — долгая служба, а потом — в зависимости от обстоятельств — превращение в опухоль, старение или апоптоз. Программа, которая стоит за этими превращениями, — это фактически программа развития, и работа ее в конечном счете приводит к смерти.
Красивым подтверждением этому соображению является эксперимент со стволовыми клетками, полученными от пациентов с детской прогерией. Эмбриональные стволовые клетки, которые находятся в самом начале пути и ближе прочих к зародышевой линии, не проявляют симптомов болезни. Они не производят мутантный ламин А, а он, в свою очередь, не нарушает структуру ядра, и эпигенетически такие клетки не старше, чем эмбриональные клетки здоровых людей. И только после начала дифференцировки клетка приобретает все положенные симптомы, начиная ускоренно стареть.
Мы не очень много знаем о том, как именно реализуется эта программа. Каждая клетка реагирует на набор сигналов, который приходит из ниши: от соседей, внеклеточного матрикса и из крови. В ответ на них, как правило, начинают работать факторы транскрипции, которые включают работу одних генов и выключают — других. Вслед за факторами транскрипции в игру включаются белки ремоделирования хроматина — те, что навешивают на ДНК и гистоны химические группы (эпигенетические метки), заставляя участки цепи скручиваться и раскручиваться. Так постепенно клетка теряет доступ к части своей информации и из стволовой превращается в дифференцированную.
С этой программой умеют работать, например, пчелы. Рассказывая о неравенстве по части продолжительности жизни, которое царит в пчелином улье, я упоминала, что оно поддерживается за счет еды. Рабочие пчелы питаются в основном пыльцой, а царице достается маточное молочко. Оказалось, что в нем содержится вещество ройалактин, которое подавляет активность метилтрансферазы — фермента, который навешивает эпигенетические метки на ДНК. Таким образом, царицы дольше остаются молодыми, чем рабочие пчелы.
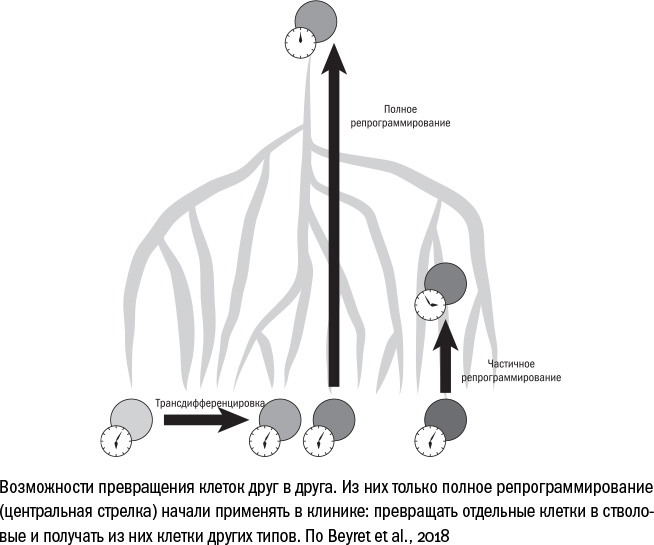
Люди же научились эту программу не только выключать, но даже поворачивать вспять. В 2006 году японские ученые Шинья Яманака и Казутоши Такахаши придумали способ репрограммировать клетки, то есть возвращать их из дифференцированного состояния обратно в стволовое. Для этого необходимо добавить в клетку четыре белка (или запустить работу соответствующих им генов): Oct3 / 4, Klf-2, Sox-2 и c-Myc. Под действием этого "коктейля Яманаки" ДНК в ядре клетки перестраивается: частично скручивается, частично разворачивается. В результате всякая, даже терминально дифференцированная, клетка превращается в эмбриональную стволовую, то есть возвращается на ту стадию, когда она способна произвести любые клеточные типы, из которых состоит тело взрослого организма. Такие стволовые клетки называют индуцированными плюрипотентными — дословно это означает, что в них искусственным образом запустили плюрипотентность, способность давать начало множеству производных.
В 2012 году ученые получили за это открытие Нобелевскую премию, а исследователи по всему миру начали придумывать, где бы еще его можно было применить. Первая мысль, которая приходит в голову, — репрограммировать клетки взрослого человека, чтобы вырастить ему какой-нибудь запасной орган или ткань. Это действительно возможно, и в некоторых странах уже идут испытания таких тканей — например, роговицы или предшественников нервных клеток для лечения болезни Паркинсона.
Но каждый орган или ткань в отдельности выращивать довольно долго и дорого, даже если не брать во внимание медицинские риски, которые при этом возникают, — например, риск отторжения трансплантата. Поэтому для борьбы со старением было бы удобнее научиться репрограммировать клетки in vivo, то есть внутри живого организма. Постепенно оказалось, что для этого есть все предпосылки: репрограммированию поддаются любые клетки человека, в том числе сенесцентные клетки и клетки, взятые у долгожителей. После обработки факторами Яманаки к этим клеткам возвращается молодость — и по длине теломер, и по набору работающих генов, и по часам метилирования они начинают напоминать клетки зародыша.
Но если омолаживать клетки непрерывно, то взрослые клетки будут превращаться в эмбриональные и образовывать опухоли. Именно это произошло с мышами, у которых ученые усилили экспрессию факторов Яманаки: в их организме появились настоящие плюрипотентные клетки и выросли тератомы — опухоли из множества разных типов клеток. Тем не менее так удалось показать, что репрограммирование in vivo тоже возможно.
Чтобы омоложение не заканчивалось ростом опухолей, нужно как-то научиться дозировать работу факторов Яманаки: тогда клетки не будут превращаться сразу в зародышевые, а просто немного "откатят" свою программу дифференцировки назад. Для этого ученые создали специальную линию мышей, у которых под действием определенного лекарства можно запустить в клетках работу четырех факторов Яманаки, а лишив их лекарства — ее выключить. Оказалось, что если включать четыре гена небольшими порциями, на два — четыре дня, а потом делать перерыв, то этого хватает, чтобы клетки потеряли признаки сенесцентных и помолодели эпигенетически, а вот потерять свою специализацию и вернуться в зародышевое состояние они не успевают.
После однократной "стимуляции молодости" признаки старости появляются снова. Но если действовать медленно и упорно, повторяя цикл "два дня омоложения — пять дней отдыха" десятки раз, то клетки не возвращаются в сенесцентное состояние. Эту методику ученые для начала проверили на ускоренно стареющих мышах — которые послужили моделью детской прогерии человека — и увеличили таким образом срок их жизни с 22 недель до 29. Потом попробовали то же самое на обычных мышах: им краткое репрограммирование позволило восстановить поджелудочную железу и мышцы после травмы.
История с репрограммированием целого организма находится еще только в начале своего пути. Данных пока немного, и мы до сих пор не знаем, удастся ли таким образом продлить жизнь здоровым животным. Кроме того, в экспериментах использовали специально выведенные линии мышей: они генетически модифицированы, чтобы запускать работу факторов Яманаки в ответ на лекарство. Едва ли этот метод напрямую можно будет применить к людям. Значит, придется придумать какие-то методы доставки "коктейля Яманаки" во взрослый организм.
Пока наиболее реалистичными выглядят методы локального репрограммирования, которые тоже постепенно начинают пробовать на мышах. Например, в эксперименте 2018 года на спине у мышей создавали незаживающую рану (для этого края раны отделяли от центра специальным стеклом), а внутрь нее вводили обезвреженные вирусы со специальным набором факторов транскрипции. Вирусы проникали в клетки соединительнотканного слоя кожи и с помощью факторов транскрипции превращали их в клетки поверхностного слоя кожи. Подобным образом удалось перепрограммировать клетки из одного типа в другой и зарастить раневую поверхность. Можно предположить, что таким же способом однажды удастся восстановить и поврежденные органы человека.
Кстати, клетки голого землекопа, в отличие от клеток мыши или человека, к репрограммированию устойчивы. В них гораздо больше метильных меток на гистонах, которые усиливают скручивание ДНК, поэтому развернуть ее обратно "коктейлю Яманаки" не под силу. Вероятно, это еще одно следствие механизмов, с помощью которых голый землекоп защищается от рака. Но, так или иначе, это лишает нас возможности попробовать продлить его жизнь еще больше. Получается своеобразный парадокс: животное, которое служит опорой теории запрограммированного старения, не способно обратить вспять единственную программу — развития и дифференцировки, — существование которой убедительно доказано.

