2. ВИНОВАТ РАК: СТАРЕНИЕ КАК ЗАЩИТА
У меня есть двойник. Ее зовут почти как меня, да и внешне мы тоже не сильно различаемся. Еще в школе мы выиграли одну и ту же олимпиаду по лингвистике в разных классах, и с тех пор она неуловимо существует где-то рядом, в одном круге знакомых. Нас до сих пор путают: мне часто пишут люди о каких-то ее рабочих делах, а ей, наверняка, о моих.
Она поступила туда, куда не пошла я, работала тем, кем не стала я, выучила тот язык, который я не смогла, и училась в той стране, где я не выдержала и года. Мы с ней никогда не встречались, но я продолжаю издалека следить за тем, как живет она — мой двойник, мое альтер эго, мое ожившее отражение, которое напоминает мне о том, кем бы могла быть и я, если бы после той самой олимпиады продолжила заниматься лингвистикой, а не переключилась на биологию.
Раковая и сенесцентная клетки тоже в чем-то довольно сильно похожи друг на друга. Обе они в некотором роде маргиналы и преследуют свои интересы, не обращая внимания на соседей. Но если я смотрю на своего двойника с завистью и любопытством, как на парад моих упущенных возможностей, то раковая клетка для старой — скорее, зловещая тень, напоминание о том, что будет, если вовремя не остановиться.
Корни беды
Рак неплохо вписывается в портрет возрастной болезни. В его основе лежит сдвиг равновесия между делением и гибелью клеток: первое начинает доминировать над вторым. Опухолевые клетки делятся, соседние — гибнут, не выдержав конкуренции, и освобождают место в ткани для роста — возникает тот самый замкнутый круг, который усиливает любое возрастное заболевание. И предотвратить его невозможно, потому что размножение клеток и конкуренция — естественные процессы, которые любой здоровой ткани приносят только пользу.
Тем не менее среди других возрастных болезней рак стоит особняком и вызывает особый трепет. И дело даже не в количестве жертв — в рейтингах ВОЗ он не поднимается даже до первой тройки причин смерти в мире. Дело и не в том, что медицина до сих пор не умеет с ним бороться. Несмотря на то что новые "лекарства от рака" раз за разом не оправдывают своих ожиданий, с лечением все обстоит вовсе не так плохо, и в развитых странах прогнозы для пациентов становятся лучше с каждым годом. В Европе, например, за последние три десятилетия смертность от рака груди сократилась в три раза.
На самом деле рак страшит нас тем, что каждый его случай уникален. Опухолевая трансформация начинается с мутаций, которые возникают у каждой клетки независимо. Набор мутаций у одного пациента может не совпадать с набором у другого, и свойства опухолевых клеток получатся разными. Поэтому некоторые исследователи даже отказываются считать рак единой болезнью. И именно поэтому универсального средства до сих пор не найдено, и едва ли стоит надеяться на то, что оно появится.
Набор причин, которые вызывают превращение клетки из порядочного гражданина в отщепенца и бунтаря, тоже у каждого пациента свой. И мутации, унаследованные от родителей, в этом процессе играют не самую важную роль. Они лишь создают в геноме "тонкие места" (протоонкогены), которые легко ломаются. Но в большинстве случаев — по некоторым подсчетам, около 80% — необходимо, чтобы "поверх" унаследованной мутации возникла новая, которая окончательно сломает ген или существенно изменит последовательность белка, превратив его в онкоген.
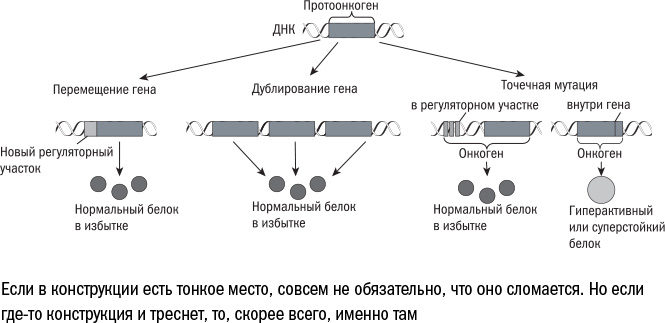
Помочь "доломать" протоонкоген могут внешние факторы — все те, которые я перечисляла, говоря о "старении" ДНК, — ультрафиолетовые лучи, радиация, канцерогены. Или же он может стать жертвой одной из множества ошибок копирования, которые неизбежно возникают при делении клеток. Поэтому опухоли часто возникают на месте хронического воспаления — например, язвы желудка. В ходе воспаления иммунные клетки выделяют активные формы кислорода, которые становятся мутагенами для здоровых клеток. В то же время более слабые клетки гибнут, и выжившим приходится размножаться, даже если они несут в себе онкогены.
Все эти факторы риска — как всегда бывает с возрастными болезнями — с течением времени лишь приумножаются. Клеточное разнообразие в тканях падает, мутантные клоны захватывают власть, матрикс разрушается, а воспаление становится сильнее. Кроме того, сенесцентные клетки подливают масла в огонь, выделяя белки SASP, которые еще сильнее фрагментируют внеклеточный матрикс и стимулируют деление окружающих клеток, в том числе опухолевых. Поэтому некоторые исследователи возлагают вину за развитие рака на его окружение: дело не в клетках, которые ломаются, а в их соседях, которые позволяют им выжить.
Укрощение строптивых
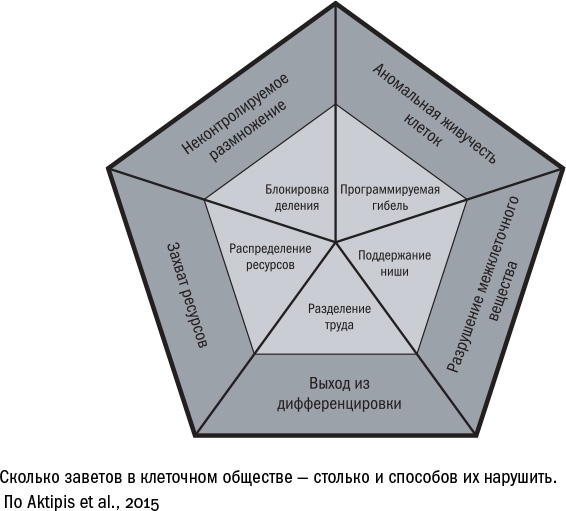
Опухолевая клетка — это мирный горожанин, который внезапно превратился в агрессивного анархиста. При этом она последовательно, один за другим, нарушает пять главных принципов, которых придерживаются клетки в ткани:
1. Контроль рождаемости. Чтобы всем хватило ресурсов — еды и места, — клетки не делятся без надобности. Они размножаются только тогда, когда получают сигнал роста. В остальное время их "подпирают" соседние клетки и волокна матрикса и запрещают им делиться. Опухолевые же клетки не реагируют на контактные сигналы. Иногда они даже выделяют факторы роста, на которые сами же охотно и реагируют, продолжая захватывать пространство.
2. Кодекс чести. Законопослушный гражданин не только рождается по команде, но и осознанно умирает, как только становится опасен для общества. Как только что-то во внутреннем мире клетки идет не по плану — накапливаются поломки в хромосомах или разрушаются митохондрии, — включается программа самоубийства (чаще всего апоптоза). Но не в опухолевых клетках, они держатся за свою жизнь до конца.
3. Разделение труда. Ткань состоит из специализированных клеток, каждой из которых предписан узкий круг обязанностей. Он определяет ее форму и функции, а зачастую еще и неспособность размножаться. При опухолевой трансформации клетки теряют свою специализацию, дедифференцируются и разрывают контракт с обществом, пренебрегая своими обязанностями и игнорируя запреты. Этим среди прочего злокачественная опухоль отличается от доброкачественной, которая представляет собой просто разрастание специализированной ткани.
4. Распределение благ. Порядочные члены общества подстраивают свои запросы под количество ресурсов: не делятся без необходимости и не едят больше положенного. Когда пищи (в первую очередь глюкозы) много, они могут позволить себе гликолиз (быстрое и малоэффективное расщепление), но в голодное время честно затягивают пояса и буквально дышат глубже, переходя на кислородное дыхание в митохондриях, — долгий и опасный, но более эффективный процесс. Но бунтарям затягивать пояса ни к чему, поэтому опухолевые клетки переходят на быстрый и малоэффективный гликолиз (это называют эффектом Варбурга) и создают так называемую ловушку: бездонную яму, в которую утекает глюкоза, оставляя ни в чем не повинных соседей голодными.
5. Общественные пространства. Большинство клеток в организме соблюдают график уборки прилегающей территории — межклеточного матрикса. При необходимости они поглощают старые молекулы и производят новые. Для клеток опухоли же внеклеточное вещество — главный барьер на пути к расселению и захвату новых территорий, поэтому они всеми способами пытаются его расщепить (и сенесцентные клетки им в этом помогают).
Давайте теперь представим, что порядочный гражданин вовремя остановился на пути превращения в анархиста. Он уже было пересек границы дозволенного, но внял голосу совести в последний момент. И получилось нечто среднее: клетка отказывается умирать по сигналу, манкирует своими обязанностями и разрушает межклеточное вещество, но совесть мешает ей размножиться и захватить ткань целиком. В этом портрете несложно узнать нашего старого (во всех смыслах) знакомого — сенесцентную клетку. Именно поэтому — хоть старые клетки и не во всем похожи на опухолевые — старость можно считать результатом действия клеточной "совести", то есть защитой от рака.
Бороться или сдаваться
Несмотря на то что рак — универсальное свойство многоклеточных организмов и встречается почти у всех известных групп за редкими исключениями (у которых, возможно, его еще просто не нашли), не все животные подвержены ему в равной степени. Иначе как объяснить тот факт, что одни звери стареют в возрасте 80 недель, а другие — в 80 лет, но частота заболеваемости раком у них одинакова?
Впервые на эту несправедливость обратила внимание в 1975 году группа британских ученых под руководством Ричарда Пето. Исследователи изучали развитие опухолей у мыши под действием бензопирена — канцерогена, который образуется, например, при горении смол в табаке. И с удивлением обнаружили, что сила канцерогенного эффекта не зависит от возраста. Это навело их на мысль, что старение не вызывает рак само по себе (как считалось в то время), а оба они независимо происходят из одной общей причины — накопления мутаций.
Однако в этой логике есть уязвимое место. Если предположить, что каждая клетка накапливает онкогенные мутации с определенной частотой, то чем больше клеток в организме, тем выше должен быть риск развития рака. И в отдельных случаях это даже правда: например, у людей с длинными ногами чаще встречаются онкологические заболевания (кроме рака легких), чем у коротышек. А у собак крупных пород в 200 раз чаще развивается остеосаркома (рак костей), чем у их мелких сородичей.
Но как только мы выходим за границы биологического вида, эта логика терпит крах. Например, подсчеты показывают, что от онкологических заболеваний умирает примерно 20% собак, 25% людей и 18% белух. Но при этом количество клеток в организме кита в 1000 раз больше, чем у человека, и, если бы рак у них развивался в 1000 раз чаще, они просто не доживали бы до репродуктивного периода. Этот парадокс — отсутствие связи между размерами тела, продолжительностью жизни и частотой заболевания — называют парадоксом Пето.
Группа Пето предлагала объяснять этот феномен тем, что у каждого вида животных мутации возникают с разной скоростью. У видов-долгожителей, например китов, эта скорость невелика, поэтому они стареют медленно и медленно же заболевают раком. Получилась конструкция, напоминающая уже знакомую нам теорию скорости жизни: чем быстрее организм мутирует, тем короче живет.
Но, подобно теории скорости жизни, эти представления не вполне соответствуют реальности. Пето и коллеги были правы лишь отчасти: у долгоживущих организмов действительно сильнее защита от стресса и, следовательно, от мутаций. Однако дело не только в этом, а еще и в том, как организм защищается от клеток-мутантов. Иными словами, разные животные придерживаются разных стратегий противоопухолевой защиты.
Русские геронтологи из Рочестера, Андрей Селуанов и Вера Горбунова, выделили у млекопитающих три такие стратегии, которые зависят от продолжительности жизни и размера каждого конкретного вида. Если речь идет о маленьком существе весом до 5 килограммов, то шансов справиться с раком у него немного, потому что даже маленькой опухоли достаточно, чтобы нарушить работу какого-нибудь из жизненно важных органов. И если при этом существо не имеет шансов прожить долго — например, мышь, которую неизбежно съедят хищники в первые годы жизни, — то ему нет нужды тратить силы на борьбу с опухолью. Гораздо выгоднее сдаться, но успеть размножиться за короткое время своего существования. Это первая стратегия для маленьких короткоживущих зверей — непротивление раку.
Совершенно по-другому складывается жизнь тех мелких млекопитающих, которые по какой-то причине избежали давления со стороны хищников и поэтому живут дольше, чем "положено" для их размера. Это некоторые белки, летучие мыши, слепыш и, конечно, голый землекоп. Поскольку для них даже небольшая опухоль может стать смертельной, они обзавелись необычайно громким "голосом совести", то есть механизмами ранней защиты. Иными словами, стратегия сводится к тому, чтобы остановить размножение подозрительных клеток на начальных этапах, не давая им шансов проверить, вырастут они в опухоль или нет.
Крупные же млекопитающие, начиная с бобров и заканчивая слонами и китами, следуют третьим путем. Поскольку их организму регулярно требуется починка, ограничивать деление клеток на ранних стадиях им неудобно. Да и опухоль необязательно грозит им смертью, особенно если она небольшая и не в жизненно важном месте. Поэтому крупные звери делают ставки на поздние механизмы защиты: они позволяют клеткам попробовать себя в качестве анархиста, но на короткий срок, — а там, как говорил Ходжа Насреддин, или шах сдохнет, или ишак. Под тяжестью мутационного груза многие бунтари гибнут, не дорастая до полноценной опухоли. С другими справляется иммунная система. И только с теми, кто не угомонился на первых стадиях развития, начинают бороться поздние механизмы защиты — ограничение деления и потеря теломер.
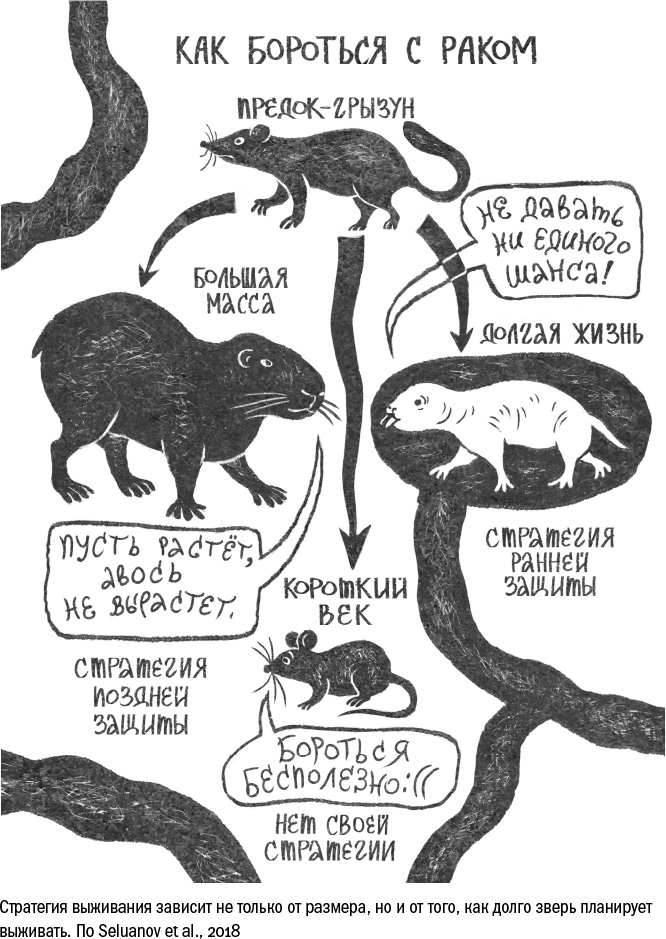
Разделение стратегий противоопухолевой защиты на три типа — сдаваться, стрелять на опережение или добить выживших — на самом деле довольно условно. В организме каждого животного все они реализуются одновременно, просто одна из них, как правило, доминирует. И способы борьбы с раком в рамках каждой стратегии тоже бывают разными, потому что возникают независимо в каждой группе долгожителей. Человек, несомненно, относится к третьей группе, наше место среди бобров, слонов и капибар. Наши клетки используют и ранние, и поздние механизмы защиты, о которых мы поговорим ниже, но первые удаются нам гораздо хуже вторых. И если мы однажды и сможем позаимствовать что-то у голых землекопов, то это будет именно способ остановить развитие рака в зародыше, дополнительный голос клеточной "совести".
Упреждающий удар
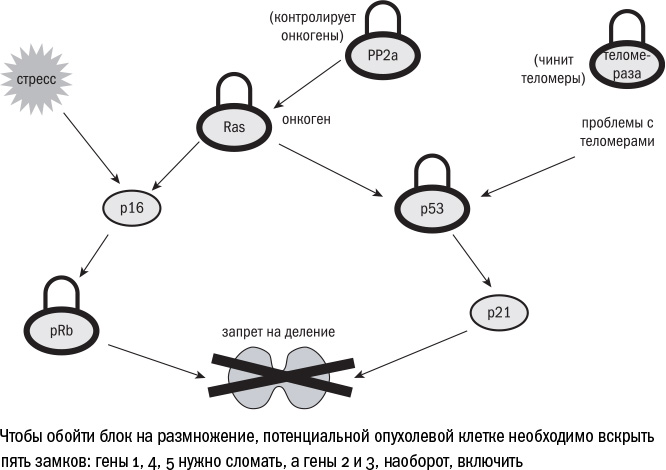
Механизмы ранней защиты действуют на этапе деления клетки и работают как замки, которые нужно взломать, чтобы деление все же произошло. Роль этих замков, голоса клеточной "совести", исполняют белки-супрессоры опухолей. Главный из них — р53. Он работает посредником между сигналами тревоги, которые посылают разные части клетки, и мерами по наведению порядка.
В предыдущей главе я уже упоминала стресс-индуцированное старение — превращение клетки в сенесцентную под действием сильного стресса. Работает это так: под действием стрессовых факторов белок р53 становится активным. Его работу запускают, например, белки репарации ДНК, когда обнаруживают поврежденные участки нити. Кроме того, он реагирует на окислительный стресс, нехватку шаперонов (если их мало, значит, все они заняты пересборкой поврежденных белков), укорочение теломер и даже раскручивание ДНК (которое, как и дедифференцировка, частый спутник злокачественных опухолей).
Когда р53 активен, он работает фактором транскрипции, то есть определяет, с каких генов будет считываться информация, а с каких — нет. В первую очередь он запускает работу гена р21, еще одного белка-супрессора опухоли. А р21, тоже фактор транскрипции, уже тормозит работу генов, ответственных за деление. Этот процесс — он называется остановкой клеточного цикла — самый мягкий способ реакции на стресс. Когда повреждения клетки незначительны, то сигналы тревоги постепенно затихают и клетка способна продолжить деление.
Если же стресс продолжается, то "просыпается" еще один белок-супрессор — р16. Он мешает работе белков, запускающих деление клетки, и под его действием остановка клеточного цикла становится необратимой. Именно поэтому его используют как маркер сенесцентных клеток: если р16 вступил в игру, то обратной дороги нет. Наконец, р16 активирует последний белок-супрессор — Rb, который занимается переупаковкой ДНК в ядре. После того как он наводит порядок в ядре, потенциальные онкогены оказываются убраны "поглубже", то есть свернуты поплотнее, и больше себя не проявляют. Зато в открытом доступе оказываются гены SASP. Так клетка становится сенесцентной.
В тех случаях, когда же стресс оказывается очень сильным, то клетка может погибнуть, не успев состариться. Для этого р53 запускает работу проапоптотических генов. Баланс сил "добра" и "зла", который обычно удерживает клетку на грани жизни и смерти, сдвигается в сторону зла, и клетка гибнет.
Что именно случится с клеткой под действием каждого конкретного стресса — остановка цикла, старение или смерть, — предсказать сложно. Каждый сигнал тревоги заканчивается навешиванием на молекулу р53 какой-нибудь химической группы, изменяющей ее активность. И сила стресса, вероятно, измеряется в количестве и качестве модифицированных молекул р53. Возможно также, что разные типы клеток по-разному реагируют на стресс: например, лимфоциты изначально настроены на апоптоз (суровые нравы в рядах иммунитета часто предписывают всем "неудачникам", "лишним" и "промахнувшимся" умереть), а клетки кожи с большей вероятностью состарятся.
Но бывает и такое, что клеточная "совесть" не успевает отреагировать вовремя, и в клетке возникает роковая мутация. Она превращает протоонкоген — ген, который кодирует полезный белок, например стимулирующий деление, — в онкоген, то есть чересчур активный ген, который может привести к опухолевой трансформации. На этом этапе у клетки есть еще один шанс опомниться — онкоген-индуцированное старение. Повышенная активность многих протоонкогенов (таких, например, как RAS или E2F) активирует р16 — и потенциальный бунтарь превращается в немощного старика. Два возможных пути старения — через р53 (стресс-индуцированное) или через Rb (онкоген-индуцированное) — становятся ответом на разные стимулы, но заканчиваются одинаково.
Таким образом, на пути опухолевой трансформации клетки стоит несколько баррикад. Чем больше белков-супрессоров опухоли, тем надежнее барьер. У мышей, как я уже говорила выше, защита от рака слабая. Она состоит всего из двух слоев: чтобы клетка стала раковой, необходимо "сломать" ген р53 или ген Rb, а также "улучшить" протоонкоген Ras.
У человека (как и у бобра) этих слоев целых пять: в опухоли должны быть сломаны одновременно р53, Rb и еще PP2a — фермент, инактивирующий многие протоонкогенные белки, а получить излишнюю активность должны Ras и теломераза (фермент, о котором речь пойдет дальше).
У других долгожителей есть свои рецепты идеальной баррикады. Слон, например, раздобыл себе целых 19 дополнительных копий гена р53. Эти копии неполноценные и содержат разные мутации, поэтому кодируемые ими белки не могут сами по себе вызвать старение или смерть, зато, вероятно, они стабилизируют "настоящий" р53 и каким-то образом мешают другим белками его заблокировать.
У голого землекопа, чьему успеху давно завидуют онкологи и геронтологи, баррикад четыре. Клеткам необходимо сломать два белка-супрессора опухолей — р16 и р27, — но при этом нельзя трогать р53 или Rb, их потеря немедленно приводит к апоптозу. Кроме того, клетки землекопов окружены необыкновенно длинными нитями гиалуроновой кислоты (в пять раз длиннее, чем у мыши), которые блокируют деление на самых ранних этапах. Поэтому, чтобы опухоль все-таки выросла, ей необходимо либо сломать белок, который строит гиалуроновые нити, либо усилить активность белка, который их расщепляет, либо выключить пути передачи сигнала от гиалуроновой кислоты внутрь клетки (а их два, независимых друг от друга). Таким образом, чтобы пробить эту противоопухолевую защиту, нужно не менее четырех точечных попаданий. Неудивительно, что все те немногие случаи рака у голых землекопов, о которых мы знаем, произошли в лабораториях, где животные попадают в непривычно теплую и светлую среду, а значит, подвержены повышенному стрессу.
Выстрел вдогонку
А вот по части поздней защиты землекопу, наоборот, было бы чему поучиться у человека. Здесь наши клетки застрахованы лучше, чем у мелких млекопитающих. И для этого у нас работает система укорачивающихся теломер.
О теломерах в контексте старения заговорили после 1973 года, когда российский молекулярный биолог Алексей Оловников выдвинул теорию маргинотомии (дословно "отсечения концов"). Он предположил, что предел Хейфлика (остановка клеточного цикла после 50 делений) объясняется тем, что концевые участки хромосом — теломеры — исчезают, при этом "обнажая" следующие за ними жизненно важные гены. И когда те повреждаются, клетка гибнет. Он же и предложил считать этот процесс причиной старения, положив начало теломерной теории старения.
Позже, правда, сам Оловников отошел от своих представлений, предпочтя им новый вариант: старение как укорочение небольших молекул ДНК, отдельных от хромосом. Ответственными за старение в его новой теории стали гормональные колебания, вызванные изменениями гравитации под влиянием Луны, а воспринимает организм эти изменения, по мнению Оловникова, с помощью специальной луносенсорной системы (в которую входит эпифиз — шишковидная железа головного мозга, ответственная за биологические ритмы). У этой экстравагантной гипотезы, в отличие от теломерной теории, последователей пока не нашлось, хотя о роли биоритмов в процессе старения в последнее время говорят все больше, и мы тоже поговорим в последней главе.
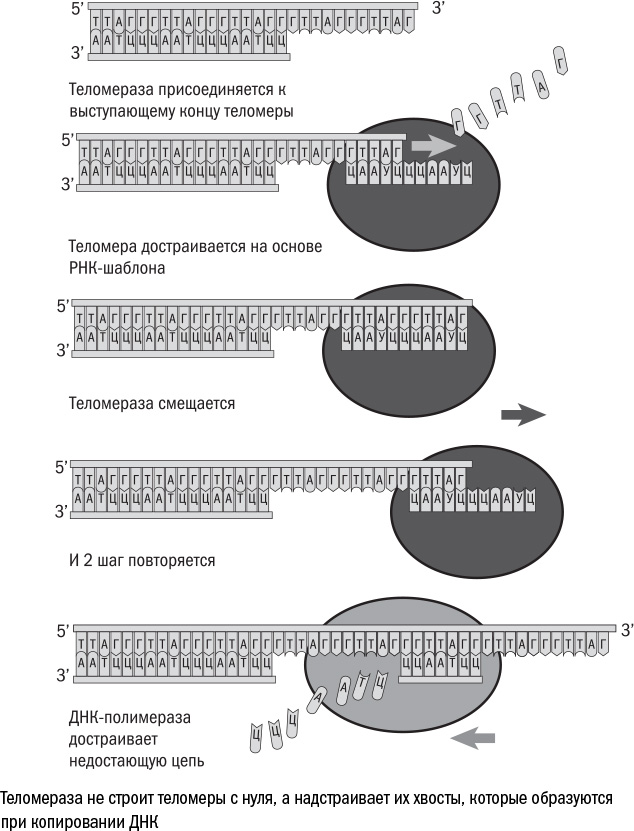
Но в некоторых случаях укорочение теломер невозможно: если бы хромосомы только и делали, что укорачивались, то каждому следующему поколению животных доставались бы все более короткие теломеры. Оловников предположил, что в половых клетках должен работать фермент, способный копировать ДНК без потери теломер. Десять с лишним лет спустя Элизабет Блэкберн и Кэрол Грайдер обнаружили, что такой фермент действительно существует, и назвали его теломеразой. Правда, работает она по-другому: она не копирует всю хромосому целиком, а занимается только восстановлением концов. Это сделать несложно, поскольку все теломеры состоят из "шестибуквенной" последовательности ТТАГГГ, повторенной более тысячи раз. Теломераза приносит "с собой" нить РНК — шаблон, по которому она может восстановить нужную последовательность. Она "прикладывает" шаблон к концу ДНК и достраивает одну из цепей, а вторую восполняет уже обычная клеточная полимераза. И теоретически ничто не мешает клетке, в которой работает теломераза, жить вечно.
Тем не менее в большинстве наших клеток спасительный механизм восстановления хромосом выключен. Теломеразу постоянно производят лишь половые клетки и, в меньшем количестве, стволовые. Остальные же никак не могут сохранить свои теломеры целыми. Это и спасает их от превращения в опухоль. Представим себе клетку, в которой мутировал какой-нибудь протоонкоген. Она начинает размножаться и постепенно лишается теломер. Обычно на конце хромосом теломерная ДНК образует петлю, с которой связано множество белков. По мере укорочения теломер петля становится короче, белкам не хватает на ней места и они выходят из ядра в цитоплазму клетки, где активируют р53. Кроме того, как только белки перестают защищать конец хромосомы, его распознает система репарации ДНК, принимает его за двунитевой разрыв посередине хромосомы и начинает бить тревогу, опять же стимулируя работу р53 — начинается репликативное старение, и клетка перестает размножаться, как бы активен ни был онкоген внутри нее.
Все три типа старения — стресс-индуцированное, онкоген- индуцированное и репликативное — сходятся к одним и тем же сигнальным клеточным путям, поэтому итог оказывается неизменным вне зависимости от причины. Более того, эти три механизма тесно переплетены друг с другом: высокая концентрация активных форм кислорода не только вызывает повреждения в ДНК, запуская р53 (стресс-индуцированный путь), но еще и активирует р16 (онкоген-индуцированный путь). В то же время окислительный стресс бьет по теломерам, повреждая их дополнительно. А мутации в остальных частях генома активируют систему репарации, которая добирается и до концов ДНК, невзирая на белковую защиту.
Вероятно, поэтому у сенесцентной клетки укорачиваются теломеры вне зависимости от того, как она постарела. И именно поэтому теломеры можно считать показателем старения человека, не разбираясь в том, почему оно произошло. Например, в своих поздних работах Элизабет Блэкберн подсчитала, что жертвы домашнего насилия несут укороченные теломеры, а осознанная медитация, напротив, их удлиняет. И в этом нет ничего удивительного: коль скоро психологический стресс зачастую связан с воспалением, а воспаление вызывает в клетках окислительный стресс, можно представить себе, что насилие влияет на длину теломер. Другое дело, что, поскольку никакого официального описания "осознанной медитации" не существует, не вполне ясно, насколько этим данным можно верить.
Тем не менее сегодня теломерная теория старения кажется чрезмерным упрощением. Не до конца понятно, само ли по себе укорочение теломер вызывает старение, или оно лишь отражает действие других факторов. А чересчур длинные теломеры не всегда благоприятны для клетки — они увеличивают риск как опухолевой трансформации, так и преждевременной гибели. И далеко не все долгожители могут похвастаться длинными теломерами: с продолжительностью жизни у разных видов животных коррелирует не сама по себе длина теломер, а скорость их сокращения.
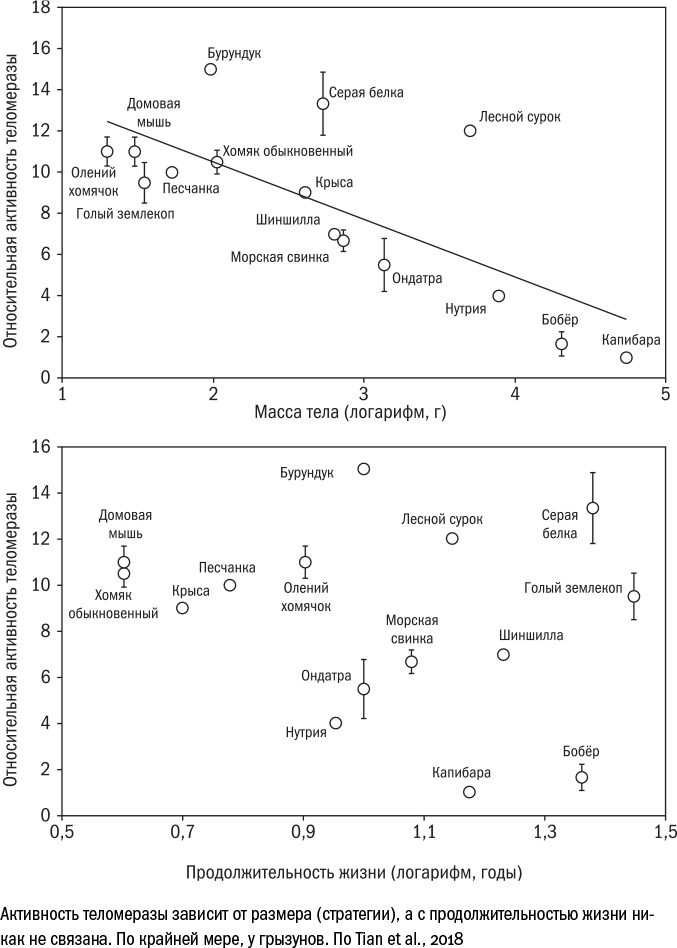
К тому же не все животные выключают теломеразу в своих клетках. Это отличительная особенность "стратегии больших животных", которой человек придерживается наряду с другими крупными млекопитающими. У мелких зверей, например у той же мыши, теломераза активна в течение практически всей жизни, и клетки делятся быстро и без потерь. У некрупных долгожителей вроде землекопа теломераза тоже работает, но клетки размножаются реже — им мешает гиалуроновая кислота снаружи и клеточная "совесть" внутри (в лице р53 и других белков-супрессоров). Поэтому никакой связи между вечной жизнью и работой теломеразы нет: что у мыши, что у землекопа она активна в одинаковой степени, а продолжительность жизни различается в десяток раз.
С учетом всех этих "но" было бы странно рассчитывать на теломеразу как на панацею или эликсир молодости. Возможно, она вообще не является необходимым условием существования организма. Во всяком случае, мыши с выключенной теломеразой способны жить и размножаться в течение нескольких поколений.
Тем не менее можно представить себе, что удлинение теломер могло бы продлить жизнь если не целого организма, то отдельных его клеток. Известно, например, что если ввести дополнительный ген теломеразы в клетки, где собственный ген выключен, то клетка или целая мышь начинают жить дольше. Даже обычные мыши, у которых теломераза, казалось бы, и без того активна, живут на 24% дольше, если добавить им еще одну копию ее гена. А мыши с искусственно удлиненными в полтора — два раза теломерами не только живут дольше обычных мышей, но и реже болеют раком.
Людям ген теломеразы пока никто не вводил — за одним исключением. В 2015 году американка Элизабет Перриш показательно сделала себе инъекцию обезвреженного вируса, который "заражает" клетки теломеразой. О своем состоянии здоровья она с тех пор ничего не сообщает, а вот о теломерах пишет, что на момент инъекции они были длиной в 6700 нуклеотидов, через год после — уже 7330, и через два года — 8120. Перриш называет это омоложением на 20 лет. Но учитывая, что предел, после которого клетка становится сенесцентной, лежит в районе 2000 нуклеотидов, средняя длина у человека — 7000, а стандартная погрешность измерений — около 700, сложно назвать эти результаты революционными. Все данные, которые приводит Перриш, попадают в пределы нормы, а о том, что именно вызвало изменение длины ее теломер (и вызвало ли), остается только гадать.
Можно подойти к проблеме и с другого конца: не добавлять в клетку лишних генов (в конце концов, это может быть небезопасно), а подействовать на клетку веществом, которое активировало бы работу теломеразы. Сегодня мы знаем одно такое вещество — циклоастрогенол, или ТА-65, выделенное из корней астрагала перепончатого. Под его действием теломераза начинает работать активнее, и в клетках ее становится больше. Продлить время жизни с помощью ТА-65 пока не удалось, по крайней мере мышам, но здоровье тех, кого кормили этим веществом, стало лучше. На людях ТА-65 уже неоднократно проверяли, и результат оказался схожим: в отдельных клинических испытаниях ТА-65 снизил проявления сердечно-сосудистых заболеваний и помог приостановить возрастную потерю зрения, но о продлении жизни речь пока не идет.
А вот попытки проверить, растут ли под действием ТА-65 теломеры, закончились неоднозначно: исследователи заверяют, что теломеры в опытной группе длиннее, чем в контроле, но разброс значений настолько велик, что едва ли можно однозначно говорить об успехе. Хорошей новостью здесь можно считать тот факт, что ни в одном из исследований у участников не развивались опухоли, то есть препарат можно считать безвредным, во всяком случае в небольших дозах, и продолжать его тестировать.
Враг или друг
Давайте теперь попробуем разобраться, в каких отношениях на самом деле находятся старение и рак. С одной стороны, рак вызывает старение, устраивая клеткам стресс: выделяет токсины, отбирает у них еду, разрушает межклеточное вещество. Старость, в свою очередь, вызывает рак: сенесцентные клетки выделяют SASP и ослабляют защиту организма. Возникает замкнутый круг, как и во многих других возрастных болезнях. С другой стороны, в отличие от прочих болезней, старость служит не только стимулом для развития рака, но и защитой от него: именно для этого подозрительные клетки превращаются в сенесцентные на ранних стадиях под действием стресса или онкогенов или на поздних — через укорочение теломер.
Но если старение защищает от рака, то он не может быть возрастным заболеванием, одно исключает другое. И действительно, распространенность злокачественных опухолей падает после какого-то возрастного порога. Так, среди итальянских стариков 36% страдают онкологическими заболеваниями в возрасте от 75 до 90 лет, но только 16% — в возрасте от 100 до 106 лет. Объяснений этому факту можно придумать множество. Например, такое: чем старше человек, тем хуже диагностика — потому что организм и так напичкан болезнями или потому что люди не заинтересованы в болезненных процедурах для подтверждения диагноза. А может быть, случаев рака становится меньше, потому что в организме заканчивается почва для его развития: меньше стволовых клеток, хуже растут сосуды (в том числе из-за атеросклероза), ниже концентрации гормонов, стимулирующих деление клеток, зато сильнее воспаление и аутоиммунная агрессия лимфоцитов.
Но можно представить и другую картину: что все, кто мог пострадать от рака, уже погибли к 100 годам, а в живых остались только самые стойкие. Этот эффект отмечает и Клаудио Франчески: среди итальянских долгожителей частота заболеваний раком и смертность от него ниже, чем в среднем по популяции, и кривая встречаемости рака с возрастом напоминает кривую смертности с характерным плато в конце. Кроме того, многие из долгожителей, по данным Франчески, когда-то уже болели раком, но смогли с ним справиться. И, учитывая, что в то время онкологическая медицина в Италии была развита хуже, чем сейчас, можно предположить, что их организм обладает какими-то особыми свойствами.
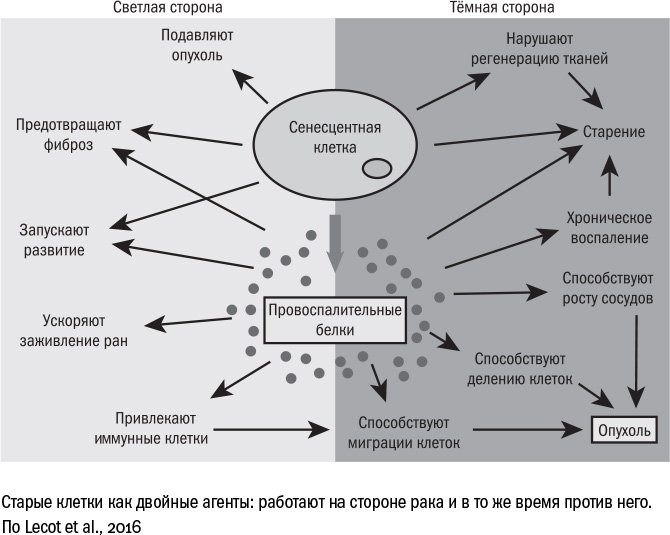
Так или иначе, защита от рака работает. Это хорошо видно на примере ускоренного старения. Например, у людей с синдромом Дауна опухоли образуются реже, чем в среднем у их сверстников. У мышей, которые служат моделью детской прогерии, опухоли возникают, но не расселяются по организму. А клетки людей, больных прогерией, вообще не удается превратить в раковые в лабораторных условиях, какие онкогены в них ни запускай. Между старением и раком организм выбирает меньшее из двух зол, то, которое позволит ему дольше прожить в сложившихся условиях.
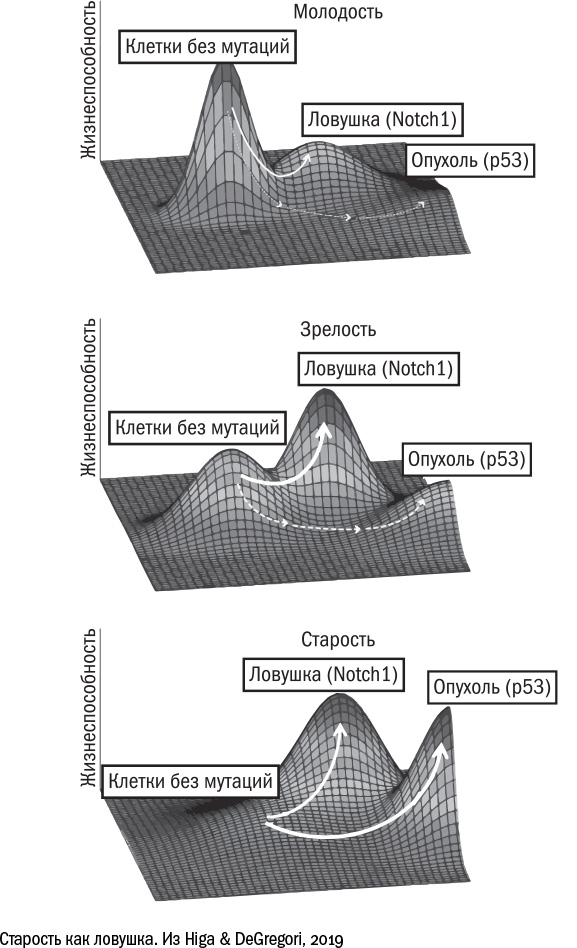
Лучше всего этот принцип иллюстрирует история с накоплением мутаций. Несколько исследователей независимо друг от друга заметили, что с возрастом в тканях начинают преобладать "хитрые мутации" — такие, которые не превращают клетку в опухоль, но делают ее жизнь немного проще. Например, мутация, которая разрушает ген Notch1, позволяет клеткам пищевода не дифференцироваться (то есть не работать), а, следовательно, лучше размножаться. Соседям "хитрых" мутантов места для размножения не достается, и у них нет другого пути, кроме как дифференцироваться и работать за двоих. Это простой пример клеточной конкуренции, когда более "наглые" клетки фактически паразитируют на своих порядочных коллегах. В то же время для ткани в целом наглость оказывается вторым счастьем. Клетки с мутацией в Notch1 получают преимущество, захватывают ресурс и лишаются стимула эволюционировать дальше. Одержав промежуточную победу, они "успокаиваются" и не ищут новых высот. Вероятно, именно поэтому в них не появляются новые онкогенные мутации, например, в гене р53.
Таким образом, некоторые мутации для клеток оказываются ловушкой, дают им промежуточное превосходство и мешают двигаться вперед. Несмотря на то что сами по себе эти мутанты для тканей скорее вредны, чем полезны, в длительной перспективе это оказывается выигрышной стратегией. Другие механизмы клеточного старения — например, укорочение теломер — можно тоже представить себе в виде ловушки: попав в нее, клетка не приносит никому пользы, но и вреда от нее меньше, чем могло бы быть, останься она на плаву и превратись потом в беспощадного анархиста. И эта стратегия позволяет организму продержаться до тех пор, пока большинство клеток в ткани не окажутся в ловушке, а оставшиеся не поднимут бунт.
На первый взгляд может показаться, что рак и старость воюют на одной стороне — против долгой жизни человека. На деле же они конкурируют друг с другом, тем самым изрядно усложняя нам задачу. Победив рак, мы столкнемся лицом к лицу с проблемой сенесцентных клеток. Избавившись от старения, мы останемся наедине с нерешенной проблемой рака.
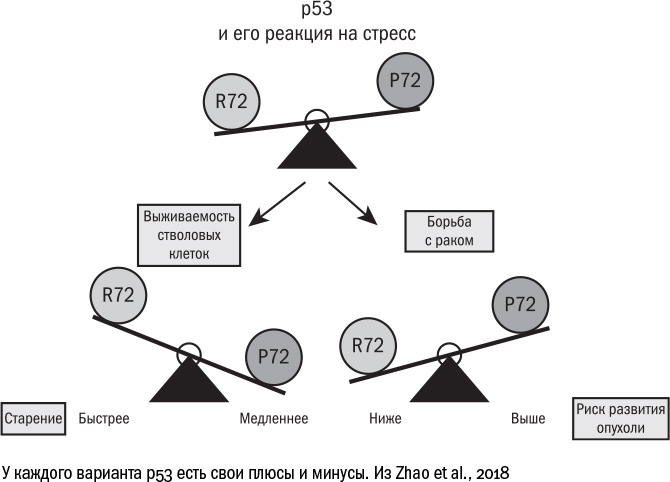
Каждый человек на самом деле уже находится на той или другой стороне этих весов. Дело в том, что у нас встречается два варианта белка р53, которые различаются всего лишь одной аминокислотой, 72-й по счету. Вариант R72 работает лучше: более прочно связывается со своими мишенями и, следовательно, эффективнее запускает в клетках старение и апоптоз. Вариант Р72 действует слабее, а его носители, по некоторым данным, чаще страдают от опухолей. Зато среди долгожителей в разных популяциях (хотя и не во всех) людей с Р72 оказывается больше, чем с R72.
Оба варианта чем-то выгодны. С одной стороны, можно иметь активный белок р53 и не страдать от онкологических болезней. Но тогда суровый охранник-р53 будет останавливать деление во всех клетках, которые покажутся ему сколько-то подозрительными, и к старости в организме останется меньше клеток, способных делиться и обновлять ткани, и жизнь окажется короче. С другой стороны, можно иметь более толерантную версию р53 и повышенный риск рака. Но если человек как-то со своей опухолью справляется, то жизнь его оказывается дольше, потому что сенесцентных клеток накапливается меньше. Как говорилось в пьесе Леонида Филатова, "но какие выживают — те до старости живут". А вот заполучить одновременно и долгую жизнь, и низкий риск развития рака, кажется, невозможно. Придется выбирать.
Старикам здесь не место
Коль скоро старение клеток в борьбе с раком неизбежно, есть только один способ противостоять им одновременно — убивать сенесцентные клетки, которые представляют собой тупиковую ветвь клеточного развития. От них не приходится ждать, что они "исправятся" или вернутся к прежней жизни. А вот проблем доставляют немало: выделяют провоспалительные белки, разрушают матрикс и заражают старостью соседей.
Первый механизм избирательного отстрела старых клеток придумал геронтолог Джеймс Киркленд. Вместе с коллегами он создал трансгенных мышей INK-ATTAC. Во всех сенесцентных клетках активна область ДНК под названием INK. Киркленд встроил после нее ген АТТАС, который кодирует одну из каспаз — белков, запускающих апоптоз. Таким образом, все сенесцентные клетки в такой трансгенной мыши производили эту каспазу. А запустить ее работу можно было с помощью специального препарата — АР20187, — тогда клетка умирала посредством апоптоза.
Так у Киркленда с коллегами получился первый сенолитик — лекарство, которое уничтожает только старые клетки. Модельные мыши INK-ATTAC под действием сенолитика прожили в среднем на треть больше контрольных животных. Для достижения этого эффекта оказалось достаточно уничтожить лишь треть сенесцентных клеток в их тканях. Позже оказалось, что сенолитик помогает мышам справиться с нарушениями обмена веществ при ожирении и возрастной атрофией межпозвоночных дисков, то есть борется с возрастными болезнями.
Вдохновившись этими результатами, ученые начали искать природные сенолитики, которые действовали бы не только на модельных трансгенных животных, но и на обычных, и в перспективе — на человека. Группа Киркленда предложила искать их среди противоопухолевых лекарств. Коль скоро сенесцентные клетки — это "недоделанные" раковые, то они должны поддаваться действию тех же препаратов, но в меньшей концентрации. И Киркленд оказался прав: подавляющее большинство известных на настоящий момент сенолитиков — это противоопухолевые лекарства, только применяются они в небольших дозировках.
Первыми найденными сенолитиками стали вещества дазатиниб и кверцетин. Дазатиниб блокирует пути передачи сигнала, которые способствуют выживанию опухоли, и хорошо себя показал против сенесцентных клеток жировой ткани. Кверцетин, вещество растительного происхождения, блокирует другие сигнальные пути и лучше справляется со старыми клетками в красном костном мозге и стенке сосудов. Вместе они воспроизводят эффекты модели INK-ATTAC, спасая мышей от фиброза легких, ожирения печени, остеопороза и последствий облучения.
У дазатиниба и кверцетина немало недостатков. Они работают не во всех экспериментах и вызывают побочные эффекты: нарушение кроветворения, задержку жидкости в организме и изменение сердечного ритма. Тем не менее они стали первыми сенолитиками, которые вышли на стадию клинических испытаний на людях. Их действие проверили у пожилых людей с фиброзом легких — стратегия, с которой мы уже встречались: сначала опробовать препарат против возрастной болезни, а потом постепенно двигаться к отдалению старости в целом. За три недели, что длилось лечение, состояние легких не изменилось, зато улучшилось общее самочувствие пациентов, они стали быстрее и дольше ходить, что можно считать признаком успеха.
Вторым сенолитиком, который вышел на клинические испытания, стал препарат UBX0101. Он связывается с белком, который блокирует р53 в сенесцентных и опухолевых клетках, и тем самым провоцирует апоптоз. Правда, по некоторым данным, он может действовать и на другие типы клеток, вызывая побочные эффекты. Но в испытаниях на людях никаких серьезных побочных эффектов не возникло. Пациентов лечили от остеоартрита колена. Как и в случае с дазатинибом и кверцетином, состояние органов осталось неизменным, но пациенты, судя по опросам, чувствовали себя лучше, а концентрация нескольких веществ из SASP в крови снизилась (правда, еще нескольких, напротив, возросла).
Список вооружений против сенесцентных клеток продолжает пополняться. Исследователи в разных лабораториях ищут более безопасные или более специфичные для старых клеток вещества. Среди них другие противоопухолевые препараты, например навитоклакс, антибиотики эритромицинового ряда (пока проверены только на клеточных культурах), аналоги куркумина и подающий большие надежды фисетин — производное кверцетина, которое можно найти в яблоках, огурцах и клубнике и которое не вызывает побочных эффектов у мышей даже в высоких дозах. Результаты проверки всех этих веществ мы, вероятно, увидим в ближайшие годы.
Тем не менее, говоря о сенолитиках, важно помнить, что сенесцентные клетки — не абсолютное зло. Они необходимы для перестройки тканей, поэтому удалять их все без разбора — едва ли хорошая идея. Например, по некоторым данным, убийство сенесцентных клеток в поджелудочной железе может привести к диабету. Поэтому, прежде чем рассматривать сенолитики в качестве профилактики старения, нам предстоит просчитать все возможные последствия и тщательно подобрать безвредную дозу, а также определить возраст, в котором имеет смысл начинать такую терапию, чтобы не помешать случайно процессам развития организма, в которых сенесцентные клетки тоже задействованы.

