5. ИММУНИТЕТ: ВОЙНА С САМИМ СОБОЙ
В детстве мне казался очень смешным анекдот про алкоголика, который утром с похмелья с недоверием смотрит в зеркало. "Вася? — спрашивает он у отражения. — Петя? А-а-а, Коля!"
Спустя много лет я нашла у него второй смысл. Идентификация "личности" — серьезная проблема, которая встает перед любым многоклеточным организмом: как вычислить чужаков среди множества клеток? Поэтому мы обзавелись специальной системой, которая умеет отделять непосредственно "личность" организма от пришельцев извне. С точки зрения иммунитета детали строения внутренних органов или особенности политических взглядов не имеют никакого отношения к идентичности человека. Значение имеет только набор молекул, из которых этот человек состоит.
Однако с возрастом эти молекулы меняются, а вслед за ними меняются и клетки. Иммунная система обнаруживает, что в ее владениях завелись чужаки, и открывает огонь на поражение. Начинается противостояние: иммунные клетки против всех остальных. И если на уровне отдельных тканей или микробных сообществ старение выглядит как революция, то уровнем выше — когда ткань идет против ткани — разворачивается буквально гражданская война.
Их разыскивает милиция
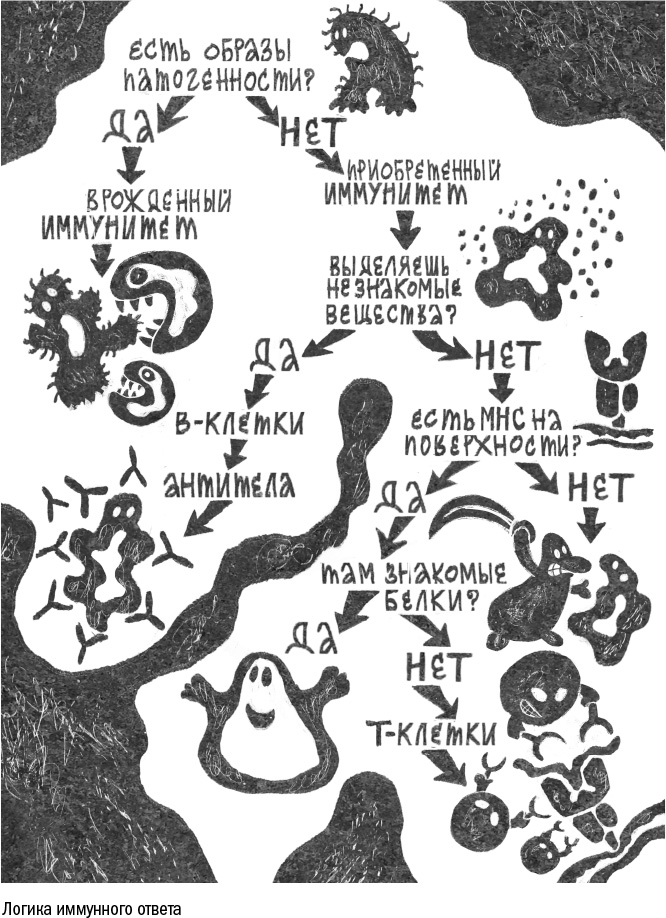
Для того чтобы засечь интервента, иммунным клеткам необязательно сталкиваться с ним нос к носу и определять, кто он такой, с точностью до вида. Достаточно уловить его следы — антигены, то есть чужеродные молекулы, которые обычно в организме не встречаются.
К счастью, многие паразиты человека похожи по молекулярному составу друг на друга. Например, у бактерий клетки окружены особой структурой — клеточной стенкой, которая сильно отличается от мембраны животных клеток. И, если в крови человека появились фрагменты клеточной стенки — липополисахарид или липотейхоевая кислота, — можно смело бить иммунную тревогу. Точно так же многие вирусные частицы содержат одноцепочечную молекулу ДНК или двуцепочечную РНК, разные паразитические черви покрыты похожей кутикулой, одноклеточные патогены выделяют токсины — и все это становится образами патогенности, характерными признаками, по которым иммунная система узнает врага.
Но работа иммунитета не сводится к расправе с паразитами. Чтобы поддерживать спокойствие среди простых граждан — клеток в тканях, — иммунные клетки нередко берут на себя роль мусорщиков и спасателей, расчищая завалы в местах массовой клеточной гибели. Поэтому иммунной системе необходимо распознавать мертвые клетки и их обломки, чтобы определить место происшествия и забить тревогу.
Самый простой способ узнать о смерти клетки — уловить ее содержимое, которое в норме не попадает в кровь. Такие внутриклеточные вещества, которые служат сигналами тревоги, называют стрессорными, или аларминами. Это может быть АТФ (энергетическая "валюта" клетки), янтарная кислота (тоже внутриклеточный продукт обмена веществ) или белки, ответственные за упаковку ДНК в ядре. Особенно удобно, что многие из аларминов похожи на образы патогенности: например, ДНК или некоторые фосфолипиды из мембраны митохондрий по сути своей бактериальные, так как митохондрия — это бывшая бактерия. Поэтому, чтобы распознать внешнее вторжение и внутренние поломки, можно использовать общую систему датчиков.
В роли датчиков в клетках выступают сенсорные молекулы, которые, как правило, закреплены в мембране и распознают конкретные образы патогенности: характерный белок, углевод, липид или нуклеиновую кислоту. Иногда их можно найти и внутри клеток: там они помогают заметить вирусную ДНК или РНК, или вышедший из-под контроля ретротранспозон.
Сенсорами оборудованы множество клеток организма. Среди них есть и те, кто не имеет прямого отношения к иммунной системе, например клетки жира или стенки сосудов. Они не способны в одиночку нейтрализовать врага, но могут выделить ряд сигнальных молекул — провоспалительных белков. Эти белки, в свою очередь, изменяют проницаемость сосудов (чтобы иммунным клеткам было легче пробраться внутрь тканей) и вязкость крови (чтобы заткнуть дырку в сосуде), а также могут заставить размножаться или двигаться сами иммунные клетки, привлекая их в очаг повреждения.
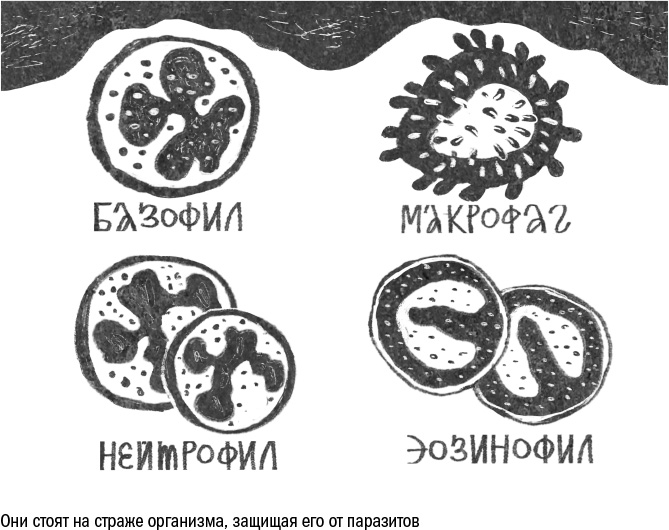
На чужеродные молекулы реагируют и профессиональные иммунные клетки, главная функция которых — разбор завалов и истребление паразитов. Это, например, макрофаги, клетки-пожиратели. При встрече с носителем образа патогенности или внеклеточным мусором они фагоцитируют его, то есть поглощают целиком. Другая группа иммунных клеток — гранулоциты — в присутствии образа патогенности выбрасывают в окружающее пространство вещества, токсичные для бактерий или червей. Вместе макрофаги и гранулоциты составляют систему врожденного иммунитета, который работает одинаково у всех здоровых людей и не зависит от их жизненного опыта и перенесенных ранее болезней.
Какие бы подозрительные вещества ни попали в ткань и какие бы клетки на них ни среагировали, клетки врожденного иммунитета запускают воспаление — боевые действия иммунной системы. Иммунные клетки размножаются, подбадривают друг друга сигнальными молекулами и выделяют токсичные для противника вещества. Но беда любой войны в том, что от нее страдает мирное население.
Атакуя противника, иммунные клетки производят огромное количество активных форм кислорода. Они рассчитывают, что смогут плотно прилипнуть к клетке-патогену и выплеснуть свой яд прицельно на нее. Но герметизация не всегда срабатывает, и свободные радикалы то и дело утекают в окружающее пространство, где начинают уничтожать мембраны ни в чем не повинных клеток ткани. Поэтому любое воспаление сопровождается жертвами среди мирных граждан. А те, кому досталось лишь немного активных форм кислорода, могут остаться в живых, но преждевременно состариться — то есть превратиться в сенесцентные клетки со всеми вытекающими последствиями.
Поэтому каждое воспаление, каждая схватка с противником приближает старость ткани. И если в молодом органе старых клеток не так уж много, а солдаты врожденного иммунитета заглядывают туда не так уж часто, то с возрастом соотношение сил изменяется.
По мере того как клетки стареют, гибнут или разрушают межклеточное вещество, в организме становится все больше молекул из черного списка, на которые тут же делает стойку врожденный иммунитет. Этот феномен Клаудио Франчески окрестил "garb-aging" (дословно "мусорное старение", от английских слов "garbage" — мусор и "aging" — старение): клетки гибнут все чаще, межклеточный мусор копится, растет концентрация стрессорных молекул, на которые иммунная система реагирует как на паразитов. Вдобавок сенесцентные клетки выделяют белки SASP и завлекают иммунные клетки в ткани.
В результате в организме развивается хроническое воспаление, причем стерильное, поскольку никакие возбудители инфекций в этой битве не участвуют. В тканях задерживается все больше макрофагов, а в крови растет концентрация провоспалительных белков — интерлейкина-6, С-реактивного белка, фактора некроза опухоли-альфа. По аналогии с "мусорным старением" эту ситуацию можно назвать "воспаленным старением" — "inflammaging" (от английского слова "inflammation" — воспаление, еще один термин от Франчески): старческое воспаление, старение как непрерывная война.
Незнакомец — значит, враг
Клетки врожденного иммунитета (гранулоциты и макрофаги) действуют, как отряд полицейских — с одной ориентировкой на всех. Те, кого нет в их черном списке, по умолчанию считаются друзьями. Такая система хорошо работает против регулярных набегов привычных бактерий, но оказывается бесполезна против незнакомых паразитов, ядов или опухоли — группы клеток, которые отличаются от соседей лишь несколькими мутантными белками.
Поэтому позвоночные животные завели себе еще один вид внутренних войск — Т- и В-лимфоциты, которые вместе отвечают за приобретенный иммунитет. Они ведут себя строго противоположным образом: реагируют на незнакомые молекулы и игнорируют привычные антигены. При этом у каждой клетки приобретенного иммунитета есть собственная ориентировка: она способна распознать только один антиген или похожие на него молекулы. Все остальные молекулы, в том числе и образы патогенности, сами по себе на нее не действуют. Но лимфоцитов в иммунных войсках столько, что среди них найдутся специалисты по любому антигену, который попадет в организм, и даже по таким молекулам, которых вовсе нет в природе.
Почему в таком случае лимфоциты не реагируют на антигены своего собственного организма? Дело в том, что они проходят суровый отбор. На первом этапе в специальных кроветворных органах — тимусе (вилочковой железе) для Т-клеток и красном костном мозге для В-клеток — образуется множество клеток-новичков. Каждый юный лимфоцит перестраивает гены, кодирующие его белок-рецептор, уникальным образом. В результате получаются миллионы клеток, каждая из которых умеет распознавать какую-то случайную молекулу.
Следующий шаг — убить всех потенциально опасных бойцов. Для этого специальные клетки в тимусе и красном костном мозге производят самые разные белки, которые закодированы в их генах, и показывают их юным лимфоцитам. Те, кто отреагировал и распознал эти белки, погибают, а все остальные созревают и становятся профессиональными воинами.
Эта система отбора довольно расточительна — иммунное войско лишается почти 90% своего изначального состава. Взамен оно приобретает важное свойство: толерантность к антигенам собственного организма. Если этот механизм по каким-то причинам не работает, у человека развиваются аутоиммунные болезни — такие, например, как рассеянный склероз (атака на миелиновые оболочки нейронов) или системная красная волчанка (атака на молекулы ДНК в крови).
Выпустившись из военных академий, лимфоциты-специалисты расходятся по тканям и органам. Дальнейшая тактика боя зависит от типа лимфоцита. Т- и В-клетки стреляют по разным мишеням. В-клетка реагирует на отдельные антигены, которые встречает в тканях, и в ответ выделяет антитела, молекулы о двух концах. Одним они связываются с антигеном, чтобы удержать молекулу и нейтрализовать ее, если это, например, бактериальный яд. Противоположный конец служит как черная метка для клеток врожденного иммунитета. Они могут за него ухватиться и проглотить пару "антиген — антитело", если она плавает сама по себе. Если же антитела налипли на поверхность бактерии или червя — это прямой сигнал для атаки.
Т-клетка действует иначе. Она тоже распознает один-единственный антиген, но не в растворе, а на поверхности других клеток. Мембраны всех клеток организма несут на себе специальные белки — главный комплекс гистосовместимости (major histocompatibility complex, МНС). Они работают как декларация о собственности: с их помощью клетка выставляет на поверхность фрагменты всех своих белков. А Т-лимфоцит, подойдя снаружи, может увидеть, что у клетки внутри: не спрятался ли там вирус и не образовались ли там мутантные белки, которые могут превратить клетку в опухолевую. Если на поверхности клетки Т-лимфоцит замечает подозрительные белки, то плотно прилипает к жертве, проделывает в ее мембране дыру и сквозь нее впрыскивает вещества, которые вызывают апоптоз, то есть заставляют клетку покончить с собой.
Несмотря на то что и Т-, и В-клетки приучены не обращать внимания на другие клетки организма, с возрастом расстановка сил меняется. Когда их обучали, их тренировали на здоровых белках, однако в стареющих тканях появляются мутантные клетки. Они не всегда превращаются в опухоли, но то и дело производят сломанные или неправильно собранные белки. А поскольку для приобретенного иммунитета "незнакомец" означает "враг", то незадачливые клетки могут оказаться под прицелом.
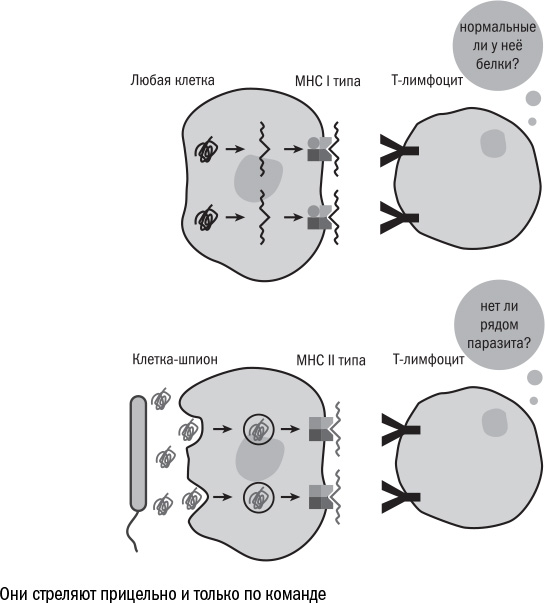
Меняется и обстановка в тканях. Лимфоциты, как бы жестоки они ни были, стреляют только по команде. Они постоянно находятся под действием сигналов извне: про- и противовоспалительных белков, которые выделяют другие клетки. Баланс этих сигналов и определяет силу иммунного ответа. Поэтому, если, скажем, Т-клетка встречает в недрах организма "свой" антиген, но не получает никаких стимулирующих сигналов, то она не бросается в атаку, а, напротив, впадает в подавленное состояние — анергию. Это еще один механизм создания толерантности. Как и любая живая система, иммунная клетка может промахнуться и связаться с неправильной молекулой. Однако у нее есть шанс исправить ошибку: оглядеться — если нет сигналов от окружающих о том, что в организме идет война, атаковать не стоит.
Но в старой ткани обстановка не располагает к спокойствию. Вокруг развивается воспаление, макрофаги ползают по клеточным завалам и постоянно выделяют сигнальные провоспалительные вещества. У лимфоцитов не остается шанса проигнорировать незнакомца, и они бросаются в аутоиммунную атаку. Поэтому в старом организме нет преобладающего направления аутоиммунной агрессии, все ткани воспалены и рискуют примерно одинаково. И многие возрастные заболевания имеют среди прочего аутоиммунную составляющую, как, например, воспаление суставов или атеросклероз.
Иммунные клетки старого организма в чем-то напоминают некоторых старых людей, которые не способны усвоить новую информацию и по умолчанию злобно реагируют на незнакомцев. Такая стратегия поведения приводит к тому, что старый организм не способен больше узнать себя в зеркале иммунитета. Старение с точки зрения иммунной системы — это размывание границ между своим и чужим. Это состояние, когда "личность" организма изменяется быстрее, чем он успевает принять новый образ себя.
Старые бойцы
С течением времени меняются не только мишени, по которым бьет иммунитет, но и расстановка сил в иммунном войске. Количество взрослых иммунных клеток в основном остается неизменным, но работают они хуже. Старые лимфоциты реже размножаются, их сложно активировать и еще сложнее убить — как и сенесцентные клетки других тканей, они приобретают устойчивость к апоптозу. Клетки врожденного иммунитета тоже слабеют — все хуже выполняют свои обязанности и медленнее ползают. Возможно, именно поэтому они накапливаются в стареющих тканях — им просто сложно вернуться домой, в органы иммунной системы.
Запасы бойцов, как и в остальных тканях, иссякают со временем. Стволовая клетка крови, из которой образуются иммунные клетки, а также предшественники эритроцитов и тромбоцитов, с возрастом делится реже. Поэтому становится меньше "наивных", молодых лимфоцитов, которые еще не встречались с антигеном. С возрастом окончательно перестает работать тимус — "военная академия" для Т-клеток. Активно поставляя новобранцев в начале жизни человека, к 15 годам тимус в существенной степени замещается жировой тканью, а после 70 лет от лимфоидной ткани в нем остаются только следы. Становится некому образовывать новые клетки и выбирать из них наименее опасные, поэтому приобретенный иммунитет работает все хуже — например, пожилые люди тяжелее переносят сезонные инфекции, чем молодые.
Вдобавок ко всему в иммунной системе, как и в других тканях, начинают доминировать избранные клоны. Но если в эпидермисе кожи это было следствием активной конкуренции, когда клетки сражались друг с другом за место на базальной мембране, то здесь это происходит естественным путем. Каждая битва Т- и В-клеток со своим антигеном не проходит бесследно. Встретившись с антигеном, клетка размножается, создавая клон — группу клеток с одинаковой специализацией. Все они атакуют свою цель, но по окончании сражения не погибают, а остаются в организме до конца его жизни.
Так формируется иммунологическая память. В следующий раз, когда та же самая бактерия или тот же вирус окажутся в крови, не нужно будет ждать, пока одна-единственная клетка-специалист до них доберется. Наготове будут уже сотни и тысячи В- и Т-клеток памяти, которые приходят на помощь по первому зову, и вторая встреча с антигеном пройдет намного быстрее, чем первая. Именно поэтому большинство людей, перенесших ветряную оспу, второй раз заболеть не могут: клетки памяти уничтожают вирус быстрее, чем он успевает размножиться.
Иммунологическая память — феномен, безусловно, полезный — с возрастом создает в ткани неравенство. Те лимфоциты, которым довелось в течение жизни встретить "свой" антиген, размножились и образовали клоны. Другим клеткам повезло меньше, например, потому что "их" антиген не встречается в природе или потому что они специализируются на яде редкой тропической бактерии, с которой не встречается среднестатистический европеец. Так или иначе, одни клетки остаются в меньшинстве, а клоны других захватывают организм. Особенно удачно это получается у тех лимфоцитов, которые охотятся за распространенными вирусами — например, цитомегаловирусом. Этим вирусом заражено, вероятно, около половины людей на планете, но подсчитать точную цифру сложно, поскольку у большинства он никак себя не проявляет. Несмотря на это, клоны лимфоцитов, который специализируются на этом вирусе, есть у многих из нас.
Но клональная экспансия чревата не только снижением разнообразия в войске. Судя по всему, "взрослые" лимфоциты тормозят развитие молодых, выделяя сигнальные вещества, которые подавляют их размножение и активацию. С одной стороны, это логично: зачем тратить ресурсы на новых воинов, если и старых уже достаточно? С другой стороны, когда все старые клетки — одинаковой специализации, вся система работает хуже.
Очень показательно, что происходит в организме при химиотерапии: часть клеток, включая старые клоны, гибнет, зато оставшиеся в живых молодые В-клетки вновь обретают способность реагировать на антиген, а в красном костном мозге возобновляется производство новых В-лимфоцитов. Таким образом, удаление старых клеток позволяет снять блок на размножение молодых и дать им дорогу (мы еще вернемся к этому феномену в главе "Виноват рак", когда речь пойдет о сенолитиках — препаратах, уничтожающих сенесцентные клетки). Правда, восстановить активность иммунитета в целом химиотерапия все-таки не позволяет, поскольку возрастные изменения касаются не только разнообразия В-клеток.
Таким образом, хоть активность отдельно взятых клеток со временем падает, иммунитет пожилого человека не бездействует. Просто приобретенный иммунный ответ постепенно уступает дорогу врожденному. Макрофаги и гранулоциты работают серьезнее, чем лимфоциты, и даже стволовая клетка крови чаще производит первых, чем вторых. Иммунитет не теряет своих функций полностью, а перестраивается на другой, "старый" режим работы (в англоязычной научной литературе для этого есть отдельный термин "immunosenescence"): его взгляд обращается внутрь организма, высвечивая не интервентов извне, а подозрительных личностей среди собственных граждан. С упорством, достойным лучшего применения, организм борется с самим собой.

Как выжить на войне
До сих пор мы говорили о воспалении как о безусловно неприятном для организма и разрушительном процессе. Тем не менее феномен долгожителей снова опровергает эту точку зрения. Несмотря на то что в их организме происходят те же процессы, что и у других стариков, — мутации копятся, бактерии сменяют друг друга, появляются новые антигены — они не страдают аутоиммунными заболеваниями. Хотя у них, как и у других пожилых людей, в крови довольно много провоспалительных белков, диабет, сердечно-сосудистые болезни и рак приходят к ним позже или вообще обходят стороной. Возможно, их пример свидетельствует о том, что старческое воспаление тоже может быть для чего-то полезно.
Одно из возможных объяснений этого феномена состоит в том, что воспаление способствует перестройке тканей. Сенесцентные клетки выделяют белки SASP для обновления матрикса и клеточного состава в целом, иммунные клетки поглощают обломки белков и останки клеток. Пока этот механизм не вышел за рамки отдельного органа, ничего вредного в нем нет. Наоборот, возможно, именно он помогает долгожителям избегать возрастных болезней.
Возможно также и то, что воспаление держит ткани долгожителей в тонусе. Под действием провоспалительных белков клетки меньше едят и реже размножаются, отсюда ниже риск развития опухолей. Наконец, третья возможная польза от воспаленного старения заключается в том, что аутоиммунитет работает как защитный механизм. Антитела к собственным антигенам организма, с одной стороны, помогают убирать межклеточный мусор, а с другой — могут закрывать собой антигены и прятать их от иммунной системы.
Какой бы из вариантов ни оказался ближе к истине, все они работают при одном условии — что воспаление не захватывает организм целиком. А это значит, что у долгожителей одновременно должна работать и другая система — противодействия воспалению. Подобно тому, как в крови одновременно работают системы образования и расщепления тромбов, чтобы поддерживать кровь в не слишком жидком и не чересчур густом состоянии, иммунная система должна поддерживать баланс между про- и противовоспалительными белками. Для этого необходима здоровая жировая ткань, активно работающие железы (мы поговорим об этом подробнее в следующей главе) и разнообразие кишечных микробов.
Смирительная диета
Отучить иммунную систему бросаться на собственные клетки практически невозможно — мы не можем запретить клеткам мутировать и звать врожденный иммунитет на помощь. Но есть и еще один фактор, который заставляет иммунную систему делать стойку даже в отсутствие инфекции или внутренних поломок. И вот с ним мы уже могли бы побороться.
Это, как ни удивительно, еда. Мы обычно воспринимаем пищу как безусловно полезную для организма вещь, но таковой она становится только после того, как пройдет множество досмотров и проверок: во рту, в кишечнике, в стенке кишечника, в печени и так далее. А изначально в еде кроется множество опасностей, от ядовитых веществ до бактерий. Кто знает, что попадется на этот раз? Поэтому после того, как в крови появляются питательные вещества, иммунитет приходит в боевую готовность — возникает метаболическое воспаление (оно же мета-воспаление, metinflammation).
Сигналом о прибытии еды в организм служат липиды. Когда их становится много, они связываются с рецепторами для бактериальных липидов на поверхности макрофагов и клеток стенки сосудов. В ответ на это клетки выделяют провоспалительные сигналы, а стенки сосудов покрываются специальными белками, к которым прилипают иммунные клетки, чтобы пробраться внутрь тканей.
Жировая ткань тоже реагирует на поступление жиров и выделяет свой набор провоспалительных веществ. Среди них — уже знакомые нам интерлейкин-6 и фактор некроза опухоли-альфа, а также лептин — белок — укротитель аппетита. И действительно: зачем есть еще, пока с предыдущей угрозой не разобрались?
Вслед за этим на какое-то время у клеток падает чувствительность к инсулину — гормону поджелудочной железы, который заставляет их захватывать глюкозу из крови. Если в организме воспаление, значит, где-то рядом могут быть паразиты, а они очень любят внутриклеточную глюкозу. Поэтому клетки переходят на питание жирами, а глюкоза отправляется в мозг, который даже в стрессовой ситуации полностью на жиры перейти не может.
Таким образом, еда становится еще одним — наряду с паразитами и внутренними поломками — источником воспаления в организме. И оно тем сильнее, чем хуже работает жировая ткань. По некоторым подсчетам, даже у здорового человека она может производить до 30% от всего количества провоспалительного интерлейкина-6. А у людей, которые страдают ожирением, белковых маркеров воспаления еще больше.
В этом смысле ожирение можно считать аналогом — хотя и не полным — ускоренного старения не только жировой ткани, но и организма в целом. Те же механизмы, которые работают в штатных ситуациях, перестают справляться, когда еды становится слишком много. Клетки жировой ткани поглощают жирные кислоты, пока не достигают критической массы — такого размера, когда существующих в ткани сосудов перестает хватать для снабжения всех клеток кислородом. В этот момент они стареют и выделяют SASP, к ним на помощь спешат макрофаги — и провоспалительных белков становится еще больше.
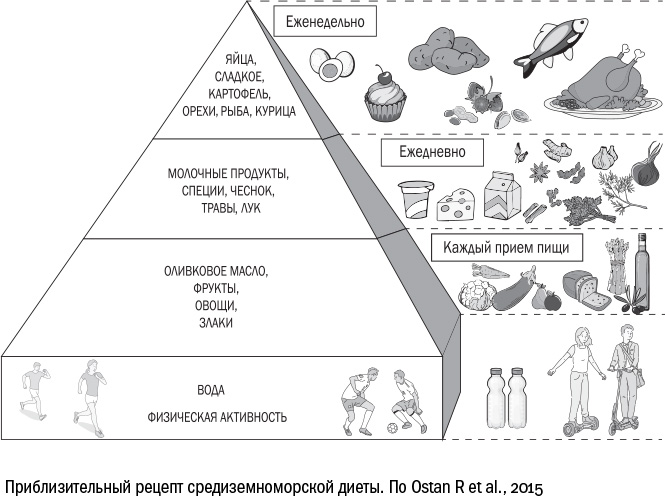
Лучшее средство, которое мы сейчас знаем, чтобы успокоить свою жировую ткань, — средиземноморская диета. Под этим термином понимают самые разные режимы питания, но основные ее составляющие везде одинаковы: много овощей, фруктов, цельнозерновых злаков, оливкового масла и морской рыбы, небольшое количество животного жира, красного мяса, молочных продуктов и регулярные, но скромные дозы красного вина.
Эффективность этой диеты сложно доказать наверняка — для этого ее пришлось бы как-то отделить от других особенностей тех, кто ее придерживается, например жизни в теплом влажном климате или работы на ферме (как у долгожителей с Сардинии из работ Франчески). Кроме того, сложный состав диеты мешает отследить влияние отдельных ее компонентов. Например, до сих пор не установлена связь между потреблением пищевых волокон из цельных зерен и продолжительностью жизни, мы знаем только, что они благотворно влияют на кишечную микрофлору. Споры на тему антиоксидантов и алкоголя тоже еще далеки от завершения, мы вернемся к ним позже, в главе "Виноват стресс".
Тем не менее известно, что средиземноморская диета снижает воспаление за счет ненасыщенных жирных кислот. В мембране наших клеток содержится жирная арахидоновая кислота, из которой образуются простагландины — еще одна группа провоспалительных белков. Ненасыщенные жирные кислоты омега-3 встраиваются в мембрану клеток, вытесняя оттуда арахидоновую кислоту. И в тот момент, когда клетки могли бы произвести провоспалительные простагландины, нужного вещества просто не оказывается под рукой. Так что в этом смысле средиземноморская диета, безусловно, полезна — не говоря уж о том, что она позволяет избежать ожирения, которое само по себе воспаляет организм.

