XII.7 Генная терапия
Кусочек ДНК как лекарство…
При генной терапии в клетку вводят небольшие фрагменты ДНК, которые содержат код для определенного белка (ген). После этого клетка начинает вырабатывать новый генный продукт, белок, как лекарство. До недавнего времени полагали, что эта новая терапия, которая лишь в последнее время опробуется экспериментально в культурах клеток и на подопытных животных, еще очень далека от клинического применения при болезнях нервной системы. Но в офтальмологии и лечении болезни Альцгеймера генная терапия уже испытывается на пациентах.
В последние годы группа Марка Тушинского в Сан-Диего впервые стала применять генную терапию при лечении болезни Альцгеймера. Исследователи заставили клетки производить фактор роста нервов (nerve growth factor, NGF) как возможное лекарство. Им воздействовали на одну из областей мозга, важную для памяти, базальное ядро Мейнерта (nucleus basalis Meynert, NBM, рис. 24). Клетки NBM находятся в основании мозга. Они отвечают за то, чтобы во всей коре мог вырабатываться химический нейротрансмиттер ацетилхолин. Это химическое вещество исключительно важно для памяти. Активность NBM-клеток с возрастом падает и при болезни Альцгеймера резко снижается. Тушинский впервые показал, что у старых макак-резус генная терапия с NGF может восстанавливать активность нейронов в базальном ядре Мейнерта (NBM). Для этого он сначала брал несколько клеток кожи, так называемые фибробласты, которые выращивал вне тела. Затем он вводил NGF-ген в эти клетки, после чего трансплантировал их в мозг старых макак в непосредственной близости к базальному ядру Мейнерта (NBM). Эти клетки кожи по меньшей мере год вырабатывали в теле макак-резус фактор роста нервов (NGF) и побуждали клетки базального ядра Мейнерта (NBM) к новой активности.
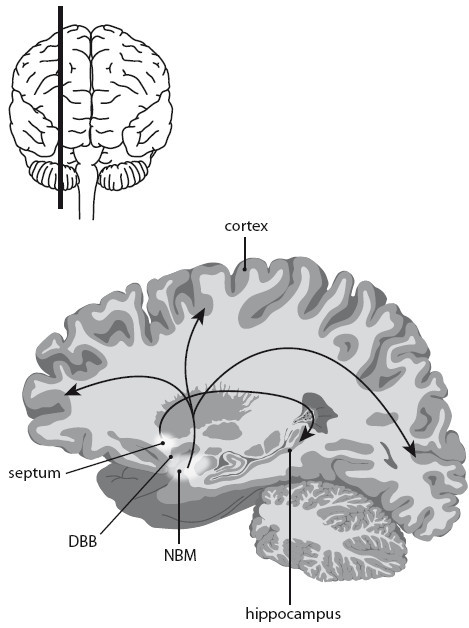
Рис. 24. Базальные ядра (базальное ядро Мейнерта, NBM; диагональная связка Брокá, DBB; и септум) являются источником химического нейротрансмиттера ацетилхолина в коре больших полушарий и гиппокампе. Этот нейротрансмиттер очень важен для памяти (см. также рис. 32).
При лечении болезни Альцгеймера следовали этой же процедуре. Для первой фазы отобрали восемь пациентов на ранней стадии болезни, так что они могли сами дать согласие на этот эксперимент и затем наблюдать за его проведением. В первой фазе исследования, направленной на то, чтобы протестировать переносимость новой терапии, выращивали культуру клеток кожи пациента вне тела. В эти фибробласты вводили NGF-ген. В качестве нейротрансмиттера использовали вирус. Вирус сделали настолько безвредным, что, хотя его вместе с NGF-геном внедряли в клетку, он не размножался и не мог стать причиной болезни. Клетки кожи, вырабатывающие NGF, посредством операции на мозге вводили вблизи базального ядра Мейнерта (NBM). Для этого применяется аппаратура, дающая возможность точно видеть, в каком месте мозга находится острие иглы, – стереотаксис, мозговой ТомТом (навигатор), как назвал его геронтолог Берт Кейзер.
Операция у первых двух пациентов прошла далеко не оптимально. Она проводилась, как это обычно бывает при стереооперациях на головном мозге, без наркоза. Хотя пациенты получили успокаивающие лекарства, они не смогли оставаться неподвижными при инъекции клеток, что привело к мозговому кровотечению и одностороннему параличу. У одного пациента паралич прошел, другой пациент умер через пять месяцев от легочной эмболии и остановки сердца, то есть от осложнений, не связанных ни с операцией, ни с генной терапией. Другим пациентам клетки вводили при полном наркозе, и осложнений из-за подвижности не возникало. Томографические наблюдения показали, что кора после операции стала активней. Утверждают, что у пациентов с болезнью Альцгеймера после генной терапии ухудшение памяти развивалось вдвое медленнее, чем у больных, не подвергшихся такой операции. Но это была лишь первая фаза, то есть это не было хорошо проконтролированным исследованием. В мозге пациента, умершего через пять месяцев после операции, можно было констатировать сильное стимулирующее воздействие на NBM-нейроны. Это позволяет надеяться на реальный успех генной терапии.
Нам остается ждать, какие результаты и побочные эффекты принесет эта терапия. Ранее в Швеции уже попытались трех пациентов с болезнью Альцгеймера лечить фактором роста нервов (NGF), который с помощью инфузионных шприцевых насосов вводили в желудочки мозга. Эти исследования, однако, пришлось прервать, так как NGF весьма незначительно влиял на функцию памяти, вызывая при этом побочные явления в виде хронических болей и потери веса. NGF, вырабатываемый клетками, которые Тушинский вводил в мозговую ткань, пусть лучше остается там, где он был, во избежание вышеуказанных осложнений. Мы установили, что у пациентов с болезнью Альцгеймера чувствительность к NGF в базальном ядре Мейнерта (NBM) резко увеличилась. Создаст ли это новые проблемы, пока не ясно. Следующий шаг, который наметил Тушинский, это с помощью другого вируса вводить NGF непосредственно в мозг, поскольку такой метод, вероятно, будет более эффективным.
В конце 2009 года пришла новость, что двух мальчиков, страдавших болезнью мозга адренолейкодистрофией (ALD), вылечили с помощью генной терапии. Если у человека из-за мутации отсутствует ALD-белок, жирные кислоты не расщепляются, а накапливаются в миелине, покрывающем нервные волокна мозга. Это приводит к сильным нарушениям работы мозга. Болезнь приобрела известность благодаря фильму Lorenzo’s Oil [Масло Лоренцо], где отец такого больного пытается лечить его, правда безуспешно, смесью растительных масел. В стволовые клетки, изолированные из костного мозга одного из мальчиков, был посредством вируса (лентивирус) введен здоровый ген ALD и откорректированные клетки возвращены обратно в костный мозг. Как именно эти исправленные клетки устранили дефект в мозге, пока не ясно, но оба семилетних мальчика вот уже два года чувствуют себя хорошо.
Во многих лабораториях ведутся работы по развитию генной терапии самых разнообразных болезней. В нашей лаборатории профессор Йоост Ферхаген разрабатывает генную терапию для лечения повреждений спинного мозга у взрослых. Время, когда паралич и инсульты будут излечиваться, еще далеко, но первые многообещающие результаты, полученные на животных, указывают на потенциальную эффективность генной терапии. Чтобы поврежденные нервные клетки могли вырасти снова, различные виды клеток снабжают фактором роста нервной системы (NGF) и вводят в поврежденные участки спинного мозга. Помимо этого, тормозят факторы, мешающие росту нервных клеток поврежденного спинного мозга. Здесь есть и новые достижения: в Цюрихе профессор Мартин Шваб, после успешных опытов на животных, проводит клинические исследования недавно возникших поражений позвоночника, пытаясь с помощью антител нейтрализовать белок, который тормозит рост нервных клеток спинного мозга.
С развитием генной терапии болезней нервной системы прогресс в офтальмологии зашел дальше всего. Дети, страдающие болезнью Лебера (врожденная форма слепоты), с рождения видят плохо и, становясь взрослыми, полностью слепнут. Болезнь вызывается генной мутацией. У собак с болезнью Лебера генная терапия уже доказала свою эффективность. После этого для трех молодых людей с сильным повреждением сетчатки была проведена первая фаза исследований, в ходе которой изучали, надежна ли генная терапия с маленьким фрагментом ДНК отсутствующего гена. Она оказалась надежной, никаких тяжелых осложнений не отмечалось. К тому же у одного из пациентов было достигнуто поразительное улучшение зрения. В отличие от состояния до операции, он вновь получил возможность различать предметы при тусклом освещении. Сейчас проводят такое лечение у детей с врожденной болезнью Лебера, пока их сетчатка еще в некотором роде здорова. Обезьян с красно-зеленой цветовой слепотой с помощью генной терапии удалось полностью вылечить. Уже через пять недель было отмечено заметное улучшение, а через полтора года они различали все цвета.
Первые клинические исследования применения генной терапии для лечения дементных и слепых больных провозглашают совершенно новую эру возможного лечения болезней мозга. В прошлые годы генная терапия, ко всеобщему ужасу, привела к смерти одного юного пациента и у нескольких детей вызвала лейкемию. Но в последнее время этот метод продемонстрировал новый многообещающий старт.

