XII.5 Мозговые протезы
Звонили из мастерской. Ваш мозг готов.
Уоллес У. Туртеллотте
Наш мозг получает от органов чувств информацию из внешнего мира и берется за дело, управляя моторикой. До недавнего времени выход из строя одного из органов чувств был равнозначен слепоте или глухоте в течение всей жизни, а повреждение спинного мозга приводило к параличу. В ходе работы International Summerschool of Brain Research [Международной летней школы исследований мозга] Нидерландского института неврологии в 2008 году были представлены новейшие разработки, которые с помощью интерфейсов «мозг – компьютер», или нейропротезов, позволяли заглянуть в будущее, когда слепые снова прозреют и парализованные снова смогут ходить. В протезировании слуха достижения особенно впечатляющие. С 1960 года в случае глухоты из-за болезни внутреннего уха применяется бионическое ухо, кохлеарный имплантат для стимуляции нервных клеток, соединенных с уже не действующими волосяными клетками во внутреннем ухе. Начиная с 1980 года стало возможно имплантировать 22 электрода, и уже более 100 000 пациентов получили кохлеарные имплантаты, с помощью которых они стали гораздо лучше слышать или даже обрели совершенно нормальный слух. Если глухота вызвана двусторонним повреждением слухового нерва, имплантат не работает. В этом случае с недавнего времени имплантируют 12 электродов в ствол мозга, благодаря чему слуховая информация может достигать мозга и коммуникация улучшается.
Во всем мире насчитываются миллионы людей, ослепших из-за разрушения светочувствительных клеток сетчатки, так называемых фоторецепторов. Джералд Чейдер, глазной врач из Лос-Анджелеса, сообщил об исследованиях трех полностью слепых пациентов. От миниатюрной камеры в очках информация посылалась в миниприемник, имплантированный в сетчатку. Микропроцессор преобразовывал зрительные сигналы в электрические. 16 электродов были соединены с нижними нервными клетками сетчатки, которые еще были активны и передавали информацию по глазному нерву дальше в мозг. После длительной тренировки пациенты могли различать крупные предметы (голову или тарелку). Число электродов шаг за шагом увеличивают до 1 000, так что через 5–10 лет уже можно будет различать лица. Другая группа исследователей информацию от миниатюрной камеры посылает для электронной обработки в прибор, который пациент носит в брючном кармане. Оттуда информация передается к приемнику, который соединен с многочисленными микроэлектродами, имплантированными в зрительную кору больших полушарий (рис. 21).
Исходя из электрической активности множества управляющих моторикой клеток коры головного мозга, становится всё более возможно делать заключение об их намерениях и тем самым управлять, например, рукою-роботом. Это позволяет надеяться, что в будущем от паралича можно будет успешно избавиться. Опыты на животных показали, что при параличе, при отсутствии управления со стороны мозга, возможно выработать динамический стереотип для ходьбы с помощью электростимуляции спинного мозга, трехмесячной тренировки и медикаментозной поддержки. Грегуар Куртин из Цюриха рассчитывает, что в течение ближайших пяти лет сможет применить эту технику на парализованных пациентах. Впечатляющий результат был достигнут у 25-летнего Мэтью Нейгла, который был полностью парализован после удара ножом в шею. Ему имплантировали в моторную область коры пластинку величиной 4 × 4 мм с 96 электродами (рис. 21). Электрической активности клеток мозга, управляющих моторикой, оказалось достаточно, чтобы работать с компьютером. Он за несколько минут научился этому после того, как его попросили представить себе, что он двигает рукой, чтобы управлять курсором на экране компьютера. Ему удалось также, только силой воображения, нарисовать круг на экране, читать электронную почту, играть в компьютерные игры и даже сжимать и разжимать пальцы протеза руки. Эксперимент выявил не только возможности такого нейропротеза, но и его границы. Нейгл еще до операции мог управлять компьютером с помощью голоса. После операции он был привязан к большому компьютеру, и при нем всегда находился ассистент для поддержки. Из-за всего этого добавочная ценность электродов в мозге была не столь уж и велика. Когда по прошествии девяти месяцев электрический сигнал из мозга ослаб, он попросил удалить электроды. Здесь еще много чего нужно улучшить, но в этой области всё время появляются новые многообещающие разработки.
XII.6 Трансплантация зародышевой мозговой ткани
Если трансплантация зародышевой мозговой ткани прошла успешно, какие свойства могут быть приобретены от донора?
Для болезни Паркинсона характерно отмирание дофаминовых клеток в черной субстанции (substantia nigra) мозгового ствола (рис. 23). При вскрытии эта область мозга из-за пигментации клеток, вырабатывающих дофамин, выглядит как проходящая через мозговую ткань черная лента. И если эти клетки мертвы, их сразу же видно, как, например, при болезни Паркинсона. Тогда клетки не могут больше иннервировать полосатое тело (стриатум), моторную область в центре мозга, то есть снабжать ее нервными волокнами и управлять ею. Из-за недостатка в стриатуме дофамина возникают типичные для этой болезни расстройства движения. Что может быть логичнее, чем лечить эту болезнь заменой умерших клеток? В 1987 году в ведущем профессиональном журнале The New England Journal of Medicine [Медицинский журнал Новой Англии] появилась статья мексиканского врача Мадрасо, в которой он сообщал о поразительном улучшении у больного паркинсонизмом после аутотрансплантации ткани дофаминсодержащих клеток надпочечников в хвостатое ядро (nucleus caudatus, рис. 23). В ближайшие два года сообщение привело к лавине из 200 подобных трансплантаций. Но операция оказалась неэффективной, и в течение двух лет после нее 20 % пациентов умерли. Исследование мозга умерших показало, что трансплантированная из надпочечников ткань в мозге не прижилась. В стриатуме были видны только шрамы. Многообещающие результаты Мадрасо были основаны, вероятно, на непрофессионально проведенных исследованиях в сочетании с эффектом плацебо (см. XVII.4).
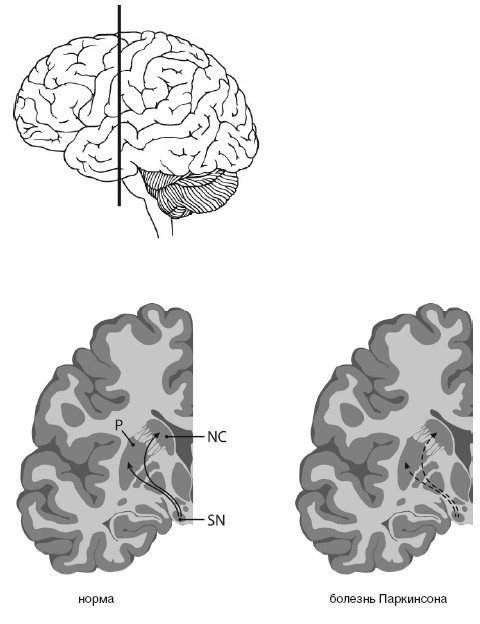
Рис. 23. При болезни Паркинсона пигментированные черным клетки, производящие дофамин в черной субстанции (SN), умирают и уже больше не могут управлять моторной областью – полосатым телом, стриатумом (P – putamen, скорлупа; NC – nucleus caudatus, хвостатое ядро).
С 1988 года больным паркинсонизмом вместо аутотрансплантации в стриатум ткани надпочечников производят пересадку дофаминсодержащих клеток фетального мозга. Для достижения эффекта ткань должна быть взята у плода возрастом от 6 до 8 недель. Позитронно-эмиссионная томография показала, что при жизни наличие трансплантата можно было установить в мозге примерно 85 % прооперированных пациентов. В стриатуме мозга скончавшегося пациента дофаминсодержащие клетки, связанные с клетками мозга реципиента, были найдены через 16 лет после операции. Но иногда всё же новые дофаминовые клетки также перенимают симптомы болезни Паркинсона. Тот факт, что болезнь иногда переходит на трансплантат, является, возможно, причиной последующего ухудшения состояния пациентов, которые сначала выиграли от операции. Для имплантации необходим материал от четырех эмбрионов. Получить такой материал нелегко, поскольку источником его служит аборт, причем должно быть получено предварительное согласие женщины на трансплантацию. Поэтому сейчас возлагают большие надежды на эмбриональные стволовые клетки как альтернативный источник для трансплантации, так как при их выращивании можно дифференцировать дофаминовые нейроны. В настоящее время, впрочем, эта терапия обладает многими недостатками и таит в себе немало опасностей. Зафиксирован случай, когда у больного через 4 года после инъекции стволовых клеток в мозжечок образовалась опухоль мозга. Из стволовых клеток в принципе может вырасти что угодно, в том числе и опухоль.
Трансплантация зародышевых дофаминовых клеток в мозг больных паркинсонизмом может иметь определенный успех, так как тогда их лекарство, леводопа, требуется им в меньшем количестве, и к тому же двигательные расстройства снижаются. Но об окончательном выздоровлении речь не идет, и результаты варьируются. Кроме того, и позитивное воздействие, и побочные эффекты трансплантации те же, что и у леводопы. Примерно в 15 % случаев осложнения при трансплантации проявляются в виде нарушений движений (дискинезии), что возникает также и при приеме леводопы. Проводились плацебо-контролируемые исследования, когда половина пациентов (которые не знали, к какой именно группе они относятся), хотя и были оперированы, не получили трансплантата. Через два года, в том, что касается двигательных расстройств, не было никакой разницы между мнимо оперированными пациентами и пациентами с трансплантатом. В итоге убедительных результатов до сих пор не имеется (см. XVII.4).
Другая болезнь, при экспериментальном лечении которой применяют трансплантацию зародышевой ткани, это болезнь Хантингтона, наследственная болезнь расстройства движений, при которой отмирают мозговые клетки полосатого тела (стриатума). В поздней стадии болезни наступает деменция. Сравнительно недавно возникшая мутация, ставшая причиной этой болезни, является настолько редкой, что все случаи заболевания в Южной Африке восходят к одному-единственному матросу, который в 1652 году на корабле Яна ван Рибеека прибыл на мыс Доброй Надежды. Первые трансплантации зародышевой ткани стриатума уже были проведены пациентам с болезнью Хантингтона и сопровождались клиническими улучшениями. В настоящее время проводятся многосторонние исследования. Изучение умерших пациентов показало, что трансплантат содержит живые клетки, интегрированные в сеть мозговых клеток реципиента. В одном случае трансплантат вырос настолько сильно, что это привело к неврологическим проблемам. Здесь также следует проявлять очень осторожный оптимизм.
При глазных болезнях, при которых слепоту вызывает дегенерация нервных клеток, как при пигментном ретините (retinitis pigmentosa) или макулярной дегенерации, трансплантируют зародышевую сетчатку. Результаты обнадеживающие.
Если трансплантация зародышевой мозговой ткани в будущем действительно окажется успешной и можно будет эффективно восстанавливать дефекты мозга, тогда возникает важный вопрос. Ведь в конце концов наш характер и многие наши качества закладываются в структуре нашего мозга в процессе развития плода. Какие свойства донора могут передаваться, если зародышевый материал его мозга трансплантируется в наш собственный мозг? Свойства должны зависеть от того, какой именно зародышевый ареал мозга трансплантируется и в какое место мозга реципиента. Очень трудно предсказать заранее, какие свойства могут при этом быть переданы. Если метод докажет свою эффективность и будет применяться на более высоких структурах мозга, таких как кора больших полушарий, можно будет задаться вопросом, не создаст ли это нового человека и какое количество трансплантата должно будет заставить реципиента взять в качестве второй фамилии фамилию донора. Будет особенно интересно, если удастся трансплантировать вещество мозга, взятое у другого вида. Поскольку доступность зародышевого материала мозга представляет собой большую проблему, больным паркинсонизмом уже трансплантировали зародышевую мозговую ткань свиней и затем с помощью медикаментов подавляли реакцию отторжения. Однако до сих пор безуспешно. Лишь немногие свиные клетки приживались в мозгу больных паркинсонизмом. Но если однажды такая ксенотрансплантация всё же удастся, передаст ли человеку трансплантат свиньи хоть малую толику ее дружелюбия и ума?

