3. Образование и свойства молекул
Устойчивость молекул
Выше мы объяснили, почему некоторые элементы стремятся образовать ионы, чтобы иметь такое же число валентных электронов, как у ближайшего инертного газа. Но кроме образования ионов существует другой способ соответствовать правилу дуэта или октета.
В частности, очень трудно сформировать ион, несущий двойной отрицательный заряд: действительно, из-за электростатического отталкивания электрон никогда не приблизится к отрицательному иону, чтобы добавить ему отрицательный заряд. Так, ион O2– образуется с большим трудом, хотя это и позволяет кислороду окружить себя восемью электронами.
Чтобы соответствовать правилу октета, эти элементы, расположенные в правой верхней части таблицы, предпочитают объединять свои электроны с электронами другого атома, соединяясь с ним.
Продолжим пример с кислородом: у него 6 валентных электронов, то есть ему не хватает двух, чтобы соответствовать правилу октета. Между тем один атом водорода содержит один электрон. Предположим, что атом кислорода «приклеивается» к двум атомам водорода: электроны двух атомов водорода оказываются в окружении кислорода, который, таким образом, окружен восемью электронами. Правило октета выполняется (➙ рис. 24.5): кислород, соединенный с двумя атомами водорода, устойчив, а в одиночку нет: так формируется молекула воды H2O. Отметим, что водород также удовлетворен такой ситуацией: когда водород соединяется с кислородом, один из электронов кислорода прибавляется к окружению водорода. Таким образом, водород окружен двумя электронами, что соответствует правилу дуэта.
Стремление получить такую же структуру, как у ближайшего инертного газа, объясняет образование молекул и их устойчивость. Отметим глубокое влияние экранирующего эффекта, механизмы которого описаны в предыдущем параграфе.
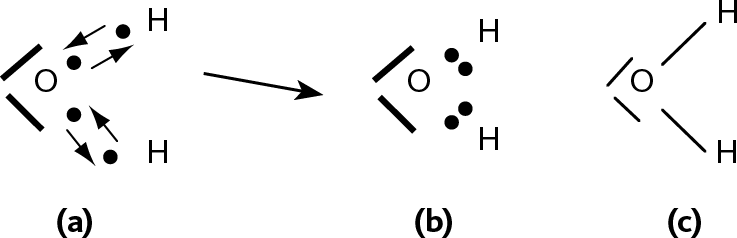
Рис. 24.5 – Образование молекулы воды
На схеме мы изобразили каждый атом, окруженный валентными электронами: каждая точка представляет электрон, каждый штрих представляет 2 электрона. Это так называемая структура Льюиса.
Итак, кислород окружен 6 электронами, а у водорода 1 электрон (а). Соединяясь друг с другом, атомы получают дополнительные электроны: кислород приобретает 8 электронов, а водород 2 электрона (b). Правило октета и правило дуэта подтверждаются.
На практике молекулу воды изображают, как указано в части (с): каждая пара электронов (b) была заменена штрихом, который изображает «связь», возникшую между кислородом и водородом.
Необыкновенная молекула: H2O
Полярность молекулы воды
Те же механизмы позволяют понять многие химические реакции между молекулами. Для этого мы обобщим все, что было сказано о свойствах различных элементов:
• элементы, расположенные в правой стороне таблицы, имеют тенденцию притягивать электроны, а те, что расположены слева, имеют тенденцию их терять;
• элементы, расположенные внизу, имеют тенденцию терять больше электронов, чем те, что расположены наверху (образование положительных ионов).
Говорят, что элементы, расположенные справа вверху, очень «электроотрицательные»: они стремятся притянуть к себе электроны и стать отрицательно заряженными.
Эти свойства оказывают интересное влияние на молекулы. Возьмем пример с водой H2O: в этой молекуле кислород сильно притягивает электроны, сильнее, чем водород (потому что кислород расположен в таблице справа вверху). Это значит, что электроны связей ближе к кислороду, чем к водороду. На самом деле, облака, состоящие из электронов, меняются в направлении ядра кислорода. В молекуле воды кислород оказывается отрицательно заряженным, а водород положительно заряженным (➙ рис. 24.6).
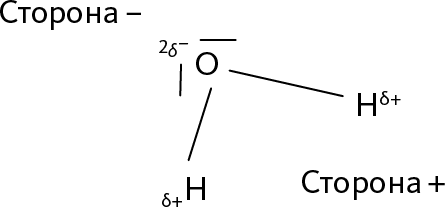
Рис. 24.6 – Полярность молекулы воды
Заряды, которые несет каждый атом, обозначены δ+ и δ–
Поскольку молекула воды изогнута (предположим это), это значит, что у нее есть положительная и отрицательная сторона: такую молекулу называют полярной. Мы уже видели некоторые последствия этого в главе 11: две полярные молекулы сильно притягиваются, что объясняет устойчивость жидкой воды, так же как, кроме прочего, феномен поверхностного давления.
Растворение и ионизация
Существует другое важнейшее следствие полярности воды. Возьмем пример со столовой солью NaCl, которую положим в воду. Периодическая система поможет нам узнать, что натрий Na стремится отталкивать электроны (он находится в левой части таблицы), тогда как хлор стремится их притягивать (он справа). Таким образом, в молекуле NaCl Na заряжен положительно, а Cl отрицательно.
Оказавшись в воде, соль вступает в реакцию с молекулами H2O. Из-за электростатического притяжения в воде Na притягивается к атому кислорода, в то время как Cl притягивается к водороду (➙ рис. 24.7). Многочисленные молекулы воды окружают хлор с одной стороны и натрий с другой. Молекулы NaCl оказываются разъединены и окружены молекулами воды H2O: соль растворилась. Песчинки твердого тела исчезли, поскольку объединения NaCl уже не скреплены друг с другом.
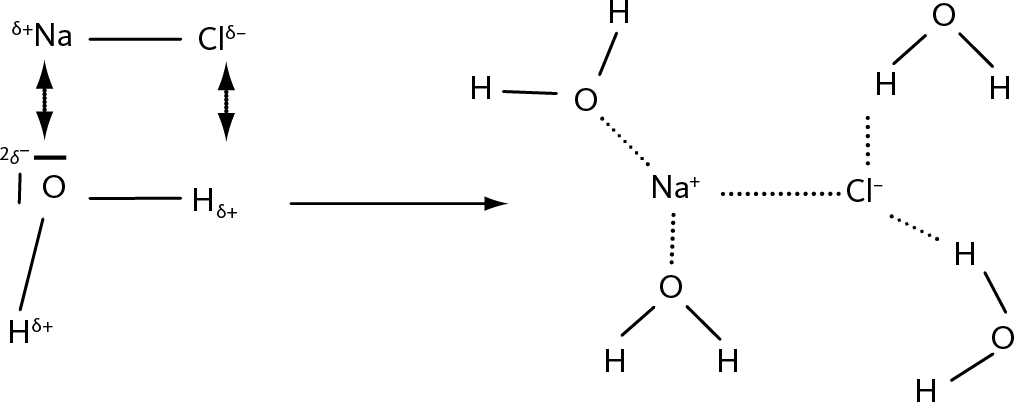
Рис. 24.7 – Растворение соли
В молекуле воды кислород несет отрицательный заряд, а водород положительный, потому что кислород стремится притянуть к себе электроны связи. Также в NaCl (столовая соль) натрий несет положительный заряд, а хлор отрицательный. NaCl и H2O притягиваются благодаря действию электростатической силы. Связи, созданные с молекулами воды, ослабляют связи между Na и Cl, пока не разобьют их. Полученные ионы Na+ и Cl–, окруженные молекулами воды, больше не могут соединиться.
Более того, связь между Cl и Na разрушилась под воздействием окружающих молекул H2O. В конечном итоге это может разрушить связь NaCl, чтобы создать Na+ и Cl–: произошла ионизация. Если бы эти два иона были одни, они притянулись бы друг к другу, поскольку имеют противоположные заряды, пока не сформировали бы новые молекулы NaCl. Но они окружены массой молекул воды, которые препятствуют этому восстановлению.
Роль воды в химии и биологии
Таким образом, из-за полярности молекулы H2O вода способствует растворению многих веществ, так же как и их ионизации. Между тем после растворения эти вещества могут реагировать между собой гораздо эффективнее.
РАСТИТЕЛЬНОЕ МАСЛО И СПИРТ
Растительное масло является совокупностью молекул, составленных из длинной аполярной цепи атомов углерода и водорода, – эти молекулы не могут электростатически притягиваться к молекулам воды. Это объясняет, почему масло «плавает» на поверхности воды, не смешиваясь с ней, что может представлять определенную трудность при приготовлении соусов… Говорят, что вода и масло представляют собой две различные фазы.
В свою очередь, этанол является спиртом, составленным из полярных молекул, которые могут склеиваться с молекулами воды: как и соль, этанол полностью растворим в воде. Смесь вода-этанол составляет единую фазу: к счастью, иначе, открывая бутылку вина, первые пили бы чистый спирт (первую фазу), а следующие довольствовались бы виноградным соком, оставшимся в бутылке (вторая фаза)…
Возьмем пример: первичная атмосфера Земли состояла в основном из углекислого газа CO2. Океаны содержали элемент кальций в виде Ca2+ реакция с CO2 и H2O сформировала известняк CaCO3.
Если бы CO2 не растворялся в воде, реакция прошла бы только на поверхности, там, где есть контакт CO2 и Ca2+. Но на практике часть CO2 растворилась в воде (именно благодаря этому свойству мы производим газированные напитки). Таким образом, реакция между CO2 и Ca2+ смогла произойти во всем океане, а не только на поверхности. Без этого феномена, успешно образующего известняк, CO2 преобладал бы по-прежнему, и температура на Земле была бы невыносимой.
Так, растворяя самые разные вещества, вода позволяет им вступать в контакт в полном объеме, что ускоряет химические реакции. Это позволяет развивать разнообразные и сложные химические процессы, в частности при создании живых организмов. По этой причине жизнь, которая характеризуется чрезвычайно сложной химией, нуждается в жидкой воде, чтобы начаться и продолжаться. В том числе и поэтому наше тело большей частью состоит из воды.
Мы всегда может придумать другую полярную жидкость, которая сыграла бы ту же самую роль; но вода состоит из элементов, наиболее распространенных во Вселенной (Н и О), и самых простых молекул, какие только бывают. Именно поэтому появление жизни при отсутствии жидкой воды кажется маловероятным.
Окислители, восстановители и батарейки
Реакция между окислителем и восстановителем
Продолжим обзор важного влияния воды на химические свойства веществ, сосредоточившись теперь на химии в водном растворе.
Окислителем называют вещество, способное легко отнять электрон. Мы видели, что элементы, расположенные справа вверху таблицы, к этому особенно расположены. В частности, слово «окислитель» произошло от слова «кислород». В качестве распространенного окислителя можно взять двухатомный кислород.
Восстановителем называют вещество, способное легко отдавать электрон. Мы видели, что это, в частности, касается элементов слева внизу таблицы. Например, все «переходные металлы» хорошие восстановители. В качестве примера среди многих других можно назвать железо.
Восстановитель хочет отдать электрон, а окислитель хочет его забрать: хороший восстановитель охотно прореагирует с хорошим окислителем. По этой причине железный гвоздь реагирует на присутствие двухатомного кислорода, образуя «ржавчину» (если добавить воду, реакция ускорится). В ржавчине Fe2O3 железо потеряло 3 электрона, а кислород приобрел 2.
Конструкция батарейки
Теперь предположим, что мы соединили окислитель с восстановителем с помощью вещества-проводника, например медной проволоки (➙ рис. 24.8). Свободные электроны могут перемещаться по меди: окислитель, таким образом, может взять один из этих свободных электронов, создав в веществе положительный заряд. Что касается восстановителя, он склонен отдавать электрон, что компенсирует положительный заряд.
В конечном итоге восстановитель отдал электрон окислителю с помощью проводника. Если медную проволоку поместить в два разных раствора, содержащие по отдельности сильно концентрированный окислитель и восстановитель, множество электронов могут поменяться местами при помощи медной проволоки (➙ рис. 24.8).
По мере того как восстановитель отдает электроны, раствор слева должен был бы стать положительно заряженным, что предотвратило бы отток новых электронов. Также приток электронов к окислителю должен был бы дать раствору отрицательный заряд. Именно поэтому необходимо соединить два раствора с помощью содержащего ионы электролита (так называемого солевого моста): отрицательные ионы электролита устремляются влево, компенсируя положительный заряд; положительные ионы устремляются вправо, нейтрализуя отрицательный заряд. Реакции будут, таким образом, продолжаться, и ток может циркулировать в созданной цепи.
Совокупность двух растворов и солевого моста образует батарейку: благодаря химическим реакциям есть «отрицательный полюс» со стороны восстановителя (который стремится отдать электроны) и «положительный полюс» со стороны окислителя (который стремится забрать электроны).
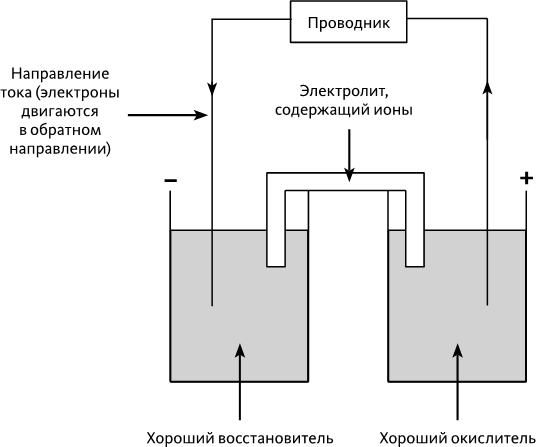
Рис. 24.8 – Принцип батарейки
ЭЛЕКТРИЧЕСКАЯ ПРОВОДИМОСТЬ
Тенденция забирать или терять электроны также может объяснить некоторые физические (а не химические) свойства веществ. Так, вещество, которое легко теряет электроны, чаще всего является хорошим проводником, потому что потерянные электроны свободно перемещаются в веществе. Хорошая проводимость свойственна металлам: становится понятно, что металлы расположены слева внизу таблицы.
Скорость и энергия реакции
Температура и скорость реакции
Во время образования ржавчины Fe2O3 гораздо устойчивее соединения Fe и O2. Если ждать достаточно долго, целостность железа разрушается, и образуется ржавчина.
Между тем происходящая реакция не выглядит особенно бурной, потому что протекает она очень медленно. Таким образом, скорость реакции не связана с «силой» окислителя или восстановителя. Проблема здесь в том, что реакция протекает на границе соприкосновения гвоздя и воды, содержащей растворенный двухатомный кислород, то есть в ней участвует не весь объем раствора. Чтобы увеличить скорость реакции, простейшее средство – повысить температуру: молекулы будут в среднем двигаться быстрее, и их столкновения станут чаще. Между тем именно во время их столкновений, когда молекулы приближаются друг к другу, происходит реакция.
Именно поэтому необходим холодильник: снижая температуру, он замедляет химические реакции. А развитие бактерий на пище происходит благодаря химическим реакциям (не будем забывать, что сама Жизнь является лишь сложной формой химии…): бактерии, как и Человек, строятся благодаря химическим реакциям.
Это также объясняет необходимость поддерживать в нашем теле температуру выше температуры окружающей среды (37 °C): это значительно повышает химическую активность внутри нашего тела, наше ежедневное развитие и повседневную деятельность.
Энергия, освобожденная реакцией
Кроме того, химические реакции сами могут менять температуру окружающей среды. Молекулы обладают «микроскопической потенциальной энергией» благодаря электростатической силе, действующей на заряды. Когда молекулы меняют атомы и свою структуру, эта энергия может меняться. Если потенциальная энергия уменьшается, значит, увеличивается кинетическая энергия молекул (на практике электростатическая сила придает скорости зарядам, содержащимся в молекулах). Атомы молекул начинают вибрировать быстрее, и эта кинетическая энергия, таким образом, передается посредством столкновений: молекулы перемещаются быстрее, а значит, температура повышается. Такие химические реакции называются экзотермическими.
В конечном итоге именно благодаря химическим реакциям человеческое тело может поддерживать в себе температуру 37 °C. Химические реакции поддерживают высокую температуру, что позволяет увеличить скорость химических реакций. Таким образом, в энергетическом плане химические реакции поддерживают сами себя…
ЭНТАЛЬПИЯ
Существует ситуация, когда снижение потенциальной энергии во время химической реакции не переходит в повышение энергии кинетической: так происходит, когда вещества, образованные реакцией, занимают больше места, чем изначальные вещества. Образованные молекулы должны «расчистить себе место», расталкивая другие: мы видели в главе 11, что это «расширение» сопровождалось охлаждением. Энергия, освобожденная реакцией, потом используется для этого расширения, а не для повышения температуры.
Между тем чаще всего в химии интересна только тепловая энергия: в общей энергии, освобожденной реакцией, энергия, служащая для расширения пространства, отбрасывается. В данном случае вместо того, чтобы обращать внимание на внутреннюю энергию U (учитывающую всю микроскопическую энергию), предпочитают иметь дело с «энтальпией» Н, обозначенной H = U + PV (где P – давление, а V – объем). Можно показать, что если внутренняя энергия во время расширения уменьшается под воздействием атмосферного давления, энтальпия, напротив, остается постоянной (в H = U + PV, U уменьшается, но V увеличивается, поэтому Н остается постоянной). Таким образом, использование энтальпии позволяет принимать во внимание только образование тепловой энергии во время реакции, оставляя в стороне энергию, связанную с расширением.
Пламя и взрывы
В некоторых случаях процесс повышения температуры, вызванный химическими реакциями, может выйти из-под контроля. Возьмем реакцию между H2 и O2, образующими молекулу H2О, которая является экзотермической. Реакция не спонтанна, потому что ей нужна энергия, чтобы начаться: в самом деле, чтобы превратиться в H2O, атомы Н и О проходят промежуточные неустойчивые стадии, которые сложно создать (высокая потенциальная энергия).
Мы подносим спичку: благодаря высокой температуре она передает необходимую энергию, чтобы вызвать реакцию. Будучи высокоэкзотермической, эта реакция создает больше энергии, чем необходимо для ее осуществления, то есть она еще сильнее повышает температуру. Таким образом, начавшись, реакция образует избыток энергии, которая не только служит для поддержания реакции, но и нагревает окружающее пространство.
Именно по этой причине, когда древесина «занялась», она продолжает гореть сама по себе (см. врезку ниже). Но в случае с H2 + O2 все идет дальше: повышение температуры такое быстрое и мощное, что в месте реакции это создает аномально повышенное давление (давление P пропорционально температуре Т: P = nkT). В каком-то смысле благодаря своей высокой скорости молекулы резко расталкивают воздух вокруг себя. Вследствие подобного быстрого расширения зоны высокого давления происходит взрыв. Все химические взрывы основаны на этом принципе…
ОГОНЬ
Реакция горения древесины – прекрасный пример самоподдерживающейся экзотермической реакции между окислителем (двухатомный кислород воздуха) и восстановителем (деревом). Освобожденная кинетическая энергия сопровождается значительным повышением температуры.
Между тем мы видели, что тело с очень высокой температурой начинает излучать свет, – именно по этой причине светит солнце. Так же и здесь, пыль и газы, находящиеся вблизи действия реакции, излучают свет благодаря повысившейся температуре: это и есть пламя.
Кроме того, химические реакции задействуют валентные электроны: во время реакции они могут переходить на более высокую орбиталь (образование возбужденных атомов). Мы видели, что потом они спонтанно вновь спускались на нижнюю орбиталь, излучая фотон.
Это вторая причина, по которой пламя излучает свет: в отличие от предыдущей, эта причина не связана с повышением температуры окружающей среды, а является более прямым следствием освобожденной энергии реакции, которая «возбуждает» атомы.
В конечном итоге мы убеждаемся, что огонь есть не что иное, как газы и пыль твердых веществ с очень высокой температурой, которые излучают свет благодаря энергии, выделенной при химических реакциях.
Кислоты и щелочи
Завершим этот небольшой обзор, кратко изложив понятие «кислоты» и «щелочи». Кислота является веществом, стремящимся отдавать протон (который также обозначается H+, поскольку водород, утративший свой единственный электрон, является протоном…). Щелочь – вещество, способное забирать протон.
Если реакции между кислотами и щелочами лучше проходят в воде, это потому, что молекула H2O служит посредником при передаче протонов: кислоте и щелочи необязательно вступать в реакцию напрямую, чтобы реакция произошла.
В самом деле, H2O способна забрать протон у кислоты, чтобы образовать H3O + H2O, а также способна отдать протон щелочи, образовав мимоходом OH–. Протон H+ может таким образом переходить от одной молекулы воды к другой, пока наконец не перейдет от кислоты к щелочи.
Элементы, расположенные в левой части периодической таблицы, легко теряют электроны (это восстановители): таким образом, можно понять, что они легко освобождают группы OH– (щелочи). Также элементы, расположенные в правой части таблицы, которые легко принимают электроны (окислители), легко освобождают протоны OH+ (кислоты).
Самая распространенная сильная щелочь – это сода NaOH на базе натрия (расположенного в левой части таблицы). Очень распространенная сильная кислота – соляная HCl, на базе хлора (расположенного в правой части таблицы). Таким образом, сода и соляная кислота бурно реагируют между собой.
Обобщающий синтез химических свойств
Подведем итоги: богатое разнообразие химии связано с существованием атомных орбиталей, средним расстоянием до ядра и определенной энергией в соответствии с законами квантовой физики. Экранирующий эффект делает остальное, чтобы объяснить взаимодействие на уровне валентных электронов, которые участвуют в переформировании молекул. Теоретически законы квантовой физики могли бы объяснить все наблюдаемые химические реакции. Но на практике вычисления чрезвычайно сложны: большое число валентных электронов оказывают друг на друга взаимное влияние, внутри атома и между разными атомами молекул, одновременно испытывая на себе влияние атомных ядер. Поэтому для того, чтобы узнать, в какой степени данная реакция является полной или частичной, с какой скоростью она происходит, необходимо идти опытным путем: характеристики каждой реакции заносятся в специальные таблицы в книгах. В будущем развитие информационных технологий наверняка позволит вычислить эти различные значения теоретически.
СЛЕДУЕТ ЗАПОМНИТЬ
• Электроны атомов – это «облака», которые могут принимать лишь определенные формы, называемые атомными орбиталями. Каждой орбитали присуща своя энергия и среднее расстояние до ядра.
• Два разных электрона не могут занимать одну и ту же орбиталь и занимают в первую очередь орбиталь с наиболее слабой энергией. Электроны, расположенные «с внешней стороны», называются валентными: именно они вступают в химические реакции.
• В периодической системе элементы расположены по числу возрастания протонов. В одной колонке расположены элементы с одинаковым числом валентных электронов: их химические свойства похожи. Колонки называются группами, строки называются периодами.
• С точки зрения валентных электронов, электроны, расположенные ближе к ядру, экранируют его заряд. Это объясняет тенденцию элементов терять или приобретать электроны, чтобы повысить их число до числа валентных электронов ближайшего инертного газа.
• В частности, многие элементы, среди которых очень распространенные, такие как углерод, азот и кислород, стремятся окружить себя восемью электронами: это правило октета. Это в том числе объясняет образование молекул.
• Электроотрицательность представляет собой свойство притягивать электроны в молекуле. Наиболее электроотрицательные элементы расположены в верхней правой части таблицы.
• Наиболее электроотрицательные элементы стремятся принести в молекулу отрицательный заряд. Молекулы, имеющие отрицательный и положительный заряды по обеим сторонам, называют полярными.
• Полярность молекул воды способствует растворению многих веществ: распределяя эти вещества по всему раствору, жидкая вода в большой степени способствует химическим реакциям, что объясняет ее важность в появлении и развитии жизни.
• Тенденция приобретать или терять электроны объясняет также реакции между окислителями и восстановителями и, более косвенно, между кислотами и щелочами. Это также объясняет проводимость металлов.
• Высокая температура увеличивает скорость химических реакций за счет увеличения количества столкновений молекул. Это объясняет важность того факта, что температура человеческого тела составляет 37 °C, и роль холодильника.
• Переформирование молекул во время химической реакции меняет их потенциальную электростатическую энергию: когда энергия высвобождается в тепловой форме, это называется экзотермической реакцией. Это объясняет некоторые феномены реакции горения: пламя и взрыв.





