2. Свойства атомов
Экранирующий эффект
Принцип
Электроны в атоме не только испытывают на себе влияние ядра, но влияют друг на друга.
Для примера возьмем литий Li, который содержит 3 электрона: два на уровне n = 1 и 1 на уровне n = 2, который является единственным валентным электроном (➙ рис. 24.3.а). Рассмотрим этот последний электрон: он находится значительно дальше от ядра, чем 2 других. То есть он видит положительно заряженное ядро, вокруг которого находятся 2 отрицательно заряженных облака (2 электрона n = 1). Эти 2 электрона создают экранирующий эффект: заряд ядра, который чувствует валентный электрон, очень слаб, потому что его отчасти компенсируют заряды двух других электронов.
Это значит, что валентный электрон лития менее связан с ядром: он может легко покинуть атом. В самом деле, опыты показывают, что литий легко становится ионом Li+ (из-за потери валентного электрона).
Теперь возьмем пример фтора F, который содержит 9 электронов: 2 на уровне n = 1 и 7 на уровне n = 2 (➙ рис. 24.3.b). Мы видим, что ему не хватает одного электрона, чтобы заполнить уровень n = 2 (в котором 8 орбиталей).
Рассмотрим точку зрения одного валентного электрона: он видит только 2 электрона, расположенные близко к ядру. 6 других электронов, расположенных на уровне n = 2, едва экранируют ядро.
В ядре содержится 9 протонов, и его экранируют только 2 электрона: таким образом, положительный заряд, который чувствует валентный электрон, довольно сильный. То есть валентный электрон сильно притягивается к ядру и не стремится покинуть атом: образование иона F+ невозможно.
С другой стороны, представим, что мимо пролетает дополнительный электрон: высокий заряд ядра притягивает его к атому, пока он не осядет на орбитали уровня n = 2. Таким образом, мы легко получаем ион F–.
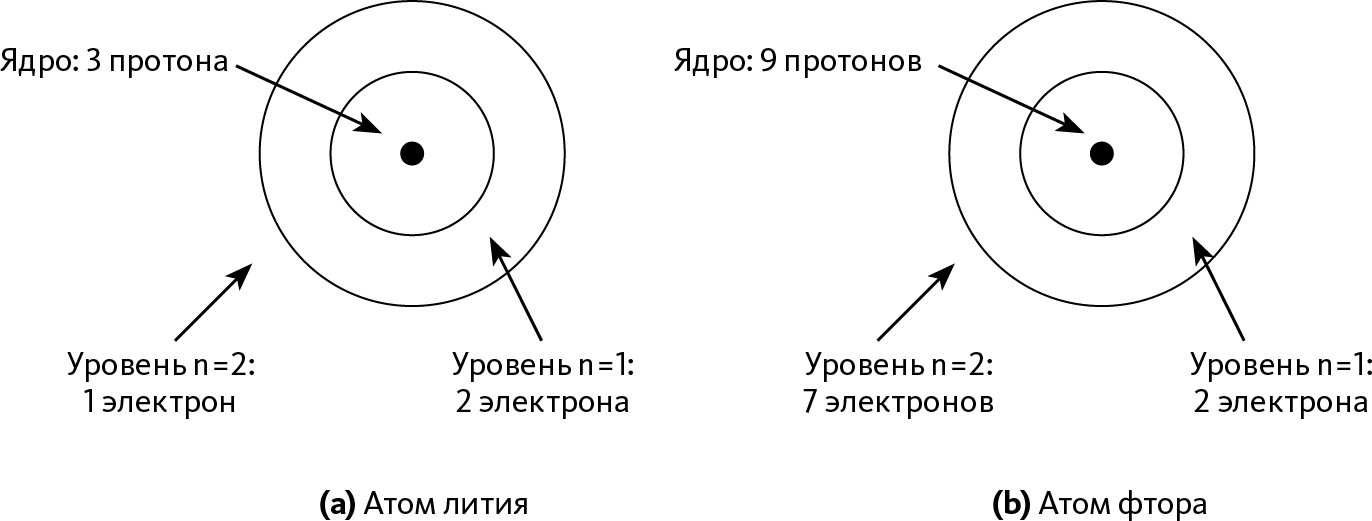
Рис. 24.3 – Атомы лития и фтора
Чтобы было понятнее, мы представили орбитали в форме орбит, а не облаков: на этой схеме каждый уровень n представлен орбитой, расположенной на некотором расстоянии от ядра, и содержит несколько орбиталей. Валентные электроны принадлежат уровню n = 2. Экранирование ядра у лития и фтора похоже, потому что в том и другом случае связано с двумя электронами n = 1. Зато заряд ядра фтора гораздо больше, чем у лития: валентные электроны сильнее привязаны к атому, чем в литии.
Таким образом, литий легко теряет валентный электрон, а фтор легко принимает лишний электрон из-за притяжения ядра.
Обобщение
Посмотрим на периодическую систему (➙ рис. 24.2): литий находится слева и стремится потерять один электрон. Фтор расположен справа и стремится приобрести электрон. На самом деле из-за экранирующего эффекта все атомы, расположенные в таблице слева, имеют тенденцию терять электроны, все атомы справа имеют тенденцию приобретать электроны (или притягивать их к себе).
Пойдем немного дальше: литий, теряя электрон, остается всего с двумя электронами, как и гелий (инертный газ в последней группе). Фтор приобретает электрон, и их становится 10, как у неона (также инертный газ из последней группы). Все элементы стремятся окружить себя таким количеством электронов, как у ближайшего инертного газа. При таком расположении экранирующий эффект больше не способствует ни притягиванию новых электронов, ни их отталкиванию.
Устойчивость инертных газов
Чтобы в этом убедиться, возьмем для примера неон, инертный газ, имеющий 2 электрона на уровне n=1 и 8 на уровне n=2. Таким образом, у него 8 валентных электронов (➙ рис. 24.4). С точки зрения валентного электрона только 2 других электрона сильно экранируют ядро, как и у всех элементов этого периодического ряда. Но у ядра есть 10 протонов, то есть оно обладает сильным положительным зарядом. Во всем ряду это самый сильный заряд, и неон никак не может потерять электрон благодаря сильному притяжению ядра.
Представим, что мы, наоборот, стремимся добавить ему электрон. Для нового электрона нет места на уровне n = 2, значит, ему придется перейти на уровень n=3. Это значит, что перед ним будет 10 электронов, расположенных ближе к ядру и дающих экранирующий эффект, то есть вновь прибывший электрон почти не почувствует заряда ядра. Дополнительный электрон не способен оставаться в атоме из-за недостатка притягивающей силы: таким образом, неон не имеет тенденции приобретать лишний электрон.
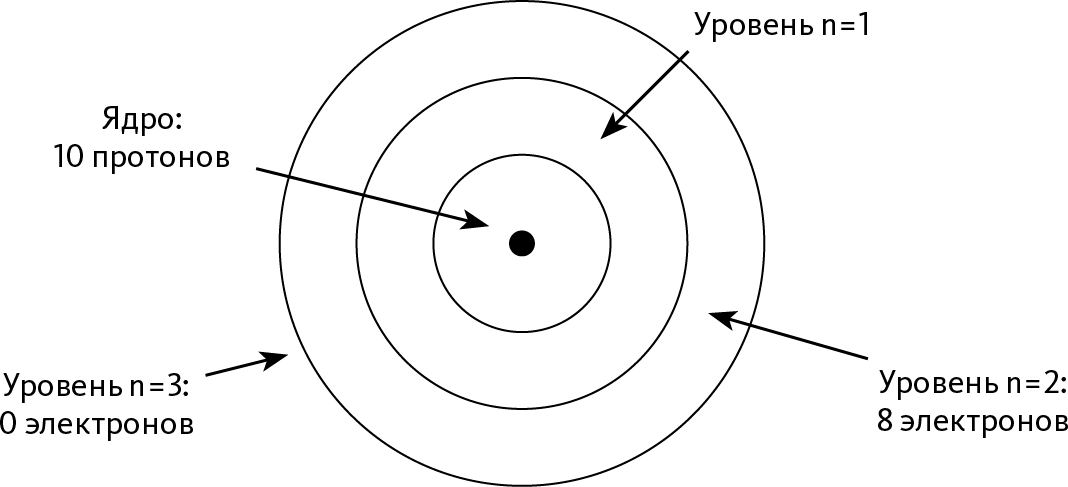
Рис. 24.4 – Атом неона
Валентные электроны принадлежат уровню n = 2: их 8. Только 2 электрона находятся близко к ядру и экранируют. Таким образом, положительный заряд довольно силен, что крепко привязывает электроны к атому.
Потенциальный дополнительный электрон пришел на уровень n = 3: под ним оказались бы 10 электронов, которые полностью загородили бы от него ядро. Этот дополнительный электрон не смог бы удержаться из-за недостатка притягивающей силы.
В итоге неон не может ни легко терять, ни приобретать электроны.
В итоге, как всем инертным газам, «неону хорошо таким, какой он есть», у него нет стремления приобретать или терять электроны. Такой же структуры, как у инертных газов, стремятся достичь все другие периодические элементы.
Мимоходом заметим, что инертные газы, будучи чрезвычайно устойчивыми, не имеют тенденции вступать в химические реакции: благодаря этой инертности их очень трудно обнаружить. Именно поэтому они также имеют название «редкие газы»: они кажутся редкими, потому что очень незаметны, однако их в природе отнюдь не меньше, чем других элементов. Например, аргон является третьей по величине составляющей воздуха после диазота и двухатомного кислорода.
Правило октета
Ознакомление
Посмотрим на инертные газы в периодической системе (➙ рис. 24.2): неон и аргон имеют по 8 валентных электронов, потому что расположены в восьмой группе. Все элементы, имеющие соседнее атомное число, стремятся окружить себя восемью электронами: это правило октета.
Однако некоторые из них являются элементами, наиболее часто встречающимися во Вселенной, и именно они наиболее часто вступают в химические реакции. Речь идет об углероде, азоте, кислороде, а также фторе, натрии, магнии, алюминии, кремнии, фосфоре, сере, хлоре, калии и кальции. Таким образом, правило октета играет важную роль в химии.
Что касается гелия, у него 2 валентных электрона. Единственный распространенный элемент, близкий к гелию, – это водород, который стремится окружить себя двумя электронами, – это правило дуэта.
Тяжелые элементы
Для более тяжелых элементов системы (начиная со скандия, чей атомный номер 21) понятие валентного электрона уже не так уместно, потому что все верхние орбитали имеют очень близкую друг другу энергию, поэтому разница между электронами внутренними и периферическими более искусственна. Никакое правило, подобное правилу октета, здесь не действует.
Зато все эти элементы, имея много протонов и электронов, являются объемными: электроны заполняют орбитали даже на большом расстоянии от ядра. Следовательно, эти электроны легко оторвать, поскольку электростатическое притяжение ослаблено из-за большого расстояния до ядра. Таким образом, элементы, расположенные в нижней части таблицы, имеют тенденцию легче терять электроны, чем те элементы, что расположены выше. То есть многие из них образуют положительно заряженные ионы.
В частности, элементы, занимающие 10 групп, расположенных в центре таблицы, называются переходными металлами. Обнаружено, что многие среди них довольно легко теряют 2 электрона: так, часто встречаются ионы Mn2+, Fe2+, Co2+, Ni2+, Cu2+, Zn2+… Это легко понять, если взглянуть на расположение и энергию орбиталей.
Как мы видели, 2 орбитали 4s отличаются значительным средним расстоянием до ядра, в то время как их энергия слабее, чем у орбиталей 3d. Орбитали 4s, таким образом, заполняются электронами раньше, чем 3d (из-за более слабой энергии), хотя они расположены дальше. Их удаленность от ядра делает электроны орбиталей 4s очень чувствительными к окружающей среде: на практике те самые два электрона легко оторвать. Что образует ионы с двойным положительным зарядом.
Можно, однако, образовать Fe3+ или Mn4+, что показывает, что никакое определенное правило не может быть тут приложено: близость энергетически более сильных орбиталей позволяет формировать большое разнообразие относительно устойчивых, положительных ионов у переходных металлов.

