24. Химические реакции
Волновая природа электронов в атоме и молекуле дает ключ к пониманию научной области, долго остававшейся во власти знахарей и шарлатанов, – химии. Квантовая физика позволяет понять свойства различных элементов (водорода, углерода, азота, кислорода…), общий обзор которых дает периодическая система. Таким образом, мы сможем объяснить, почему образуются молекулы, и подробно рассмотрим исключительные физико-химические свойства молекулы воды. Мы поговорим о тепловых аспектах химии: например, о том, почему температура человеческого тела составляет 37 °C и как потребленная пища позволяет поддерживать эту температуру. Мы также узнаем, что такое огонь, как он возникает и как сохраняется. Наконец, мы определим, что такое окислитель и восстановитель, их роль в батарейках, а также что такое щелочь и кислота.
1. Электронная структура атомов
Занятие атомных орбиталей
Необходимость классификации атомов
Химические реакции состоят в разъединении атомов молекул и объединении их в новые молекулы, при этом меняются свойства веществ, участвующих в реакции. Чтобы лучше понять, почему и как происходит химическая реакция, необходимо подробно рассмотреть электроны атомов, потому что именно они взаимодействуют между собой и меняют структуры молекул.
Количество электронов, которое содержит каждый атом, очень важно. Чтобы в этом разобраться, необходимо расположить атомы по возрастанию количества электронов. Для нейтрального атома это означает также количество протонов в ядре (равное количество положительных и отрицательных зарядов), что называется атомным числом.
Если расставить элементы по возрастанию атомного числа, первым будет водород (один протон, один электрон), затем гелий (два протона) и так далее до урана (92 протона). Можно создавать атомы с числом протонов больше, чем у урана, но они не устойчивы, и в природе их не существует.
Затем необходимо рассмотреть формы облаков электронов внутри атома, которые также будут управлять химическими реакциями. Уравнение Шрёдингера позволяет узнать форму волн. На рис. 24.1 мы изобразили разные возможные геометрические формы. Они обозначены буквами s, p, d (еще бывает f, но здесь мы ее не показываем). Через мгновение мы вернемся к этим буквам.
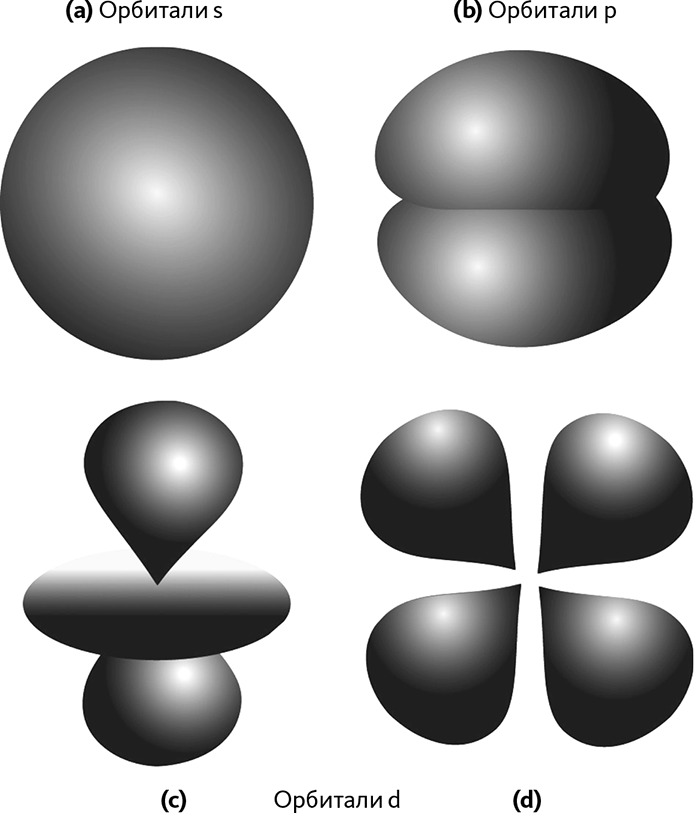
Рис. 24.1 – Формы различных орбиталей
Отметим, что буква d обозначает много очень разных орбиталей. Они собраны под одной буквой, потому что формам (с) соответствуют формы (d) одинаковой энергии.
Распределение электронов в орбиталях
Наконец, среди всех возможных орбиталей необходимо знать, какие из них выбирают электроны. Вот несколько простых правил:
• В изолированном атоме электрон всегда стремится выбрать свободную атомную орбиталь меньшей энергии. На самом деле в изолированном атоме электрон не может приобрести энергию (она должна поступить извне), но всегда может ее потерять (излучив фотон). В итоге он может лишь спуститься на более слабую орбиталь. И только достигнув этой орбитали, он укрепляется: спуститься еще ниже он уже не может и перестает эмитировать излучения.
• Кроме того, два электрона не могут накладываться друг на друга (принцип исключения Паули). Другими словами, они не могут занимать одну и ту же атомную орбиталь. Таким образом, два разных электрона занимают две различные атомные орбитали. Электрон в первую очередь стремится к энергетически более слабой орбитали, но если она уже занята, он вынужден идти к более сильной.
Энергия орбиталей
Итак, теперь мы знаем, как распределяются электроны в атоме в зависимости от орбиталей. Уравнение Шрёдингера дает нам прекрасные пояснения относительно энергии орбиталей:
• Две орбитали расположены очень близко к ядру и относятся к типу s (➙ рис. 24.1): именно они обладают самой слабой энергией. То есть электроны в первую очередь стремятся к ним. Например, в атоме гелия два единственных электрона выбирают именно эти две орбитали. Они обозначены числом n = 1 (так обозначается энергетический уровень n = 1). Орбитали называют «1s», чтобы сразу обозначить уровень и тип орбитали.
• Следующая орбиталь значительно дальше от ядра, ее энергия гораздо выше. В этой зоне находятся 8 орбиталей с похожей энергией: 2 орбитали типа s и 6 типа p. У шести орбиталей типа p одинаковая энергия: по этой причине они объединены под одной буквой.
• Все эти орбитали обозначаются n = 2, то есть здесь мы различаем орбитали типа 2s и 2p. Например, неон, у которого 10 электронов, имеет 2 электрона на орбиталях n = 1 и 8 других дальше от ядра на орбиталях n = 2.
• Еще дальше от ядра сосредоточены 18 других орбиталей похожей энергии, обозначенные n=3. Среди них 2 типа s, 6 типа p и 10 типа d. Эти десять орбиталей типа d имеют одинаковую энергию, поэтому их обозначили одной буквой, несмотря на их различные формы (➙ рис. 24.1). Уточним, что энергия орбиталей 3d значительно выше энергии орбиталей 3s и 3p, то есть здесь наблюдается значительный энергетический скачок между 8 орбиталями 3s и 3p, с одной стороны, и 10 орбиталями 3d, с другой стороны.
• Наконец, еще дальше от ядра находятся 32 другие орбитали с похожей энергией, обозначенные числом n = 4, типов s, p, d и f. Мы резюмируем описание разных возможных орбиталей в рамке ниже.
Валентные электроны
В химических реакциях участвуют самые легковозбудимые электроны: эти электроны наиболее удалены от ядра и меньше с ним связаны. Их называют валентными электронами: они принадлежат к наиболее удаленным от ядра орбиталям, то есть тем, у которых самое высокое число n.
Приведем несколько примеров. У углерода 6 электронов: 2 на орбиталях n = 1 и 4 на орбиталях n = 2. То есть углерод имеет 4 валентных электрона.
У кремния 14 электронов: 2 на уровне n = 1, 8 на n = 2 и 4 на n = 3. Таким образом, у кремния 4 валентных электрона, как и у углерода. Значит, он должен обладать похожими с углеродом химическими свойствами: именно это подтверждают опыты.
РАЗНЫЕ ОРБИТАЛИ
Начиная с орбиталей наиболее близких к ядру, мы видим:
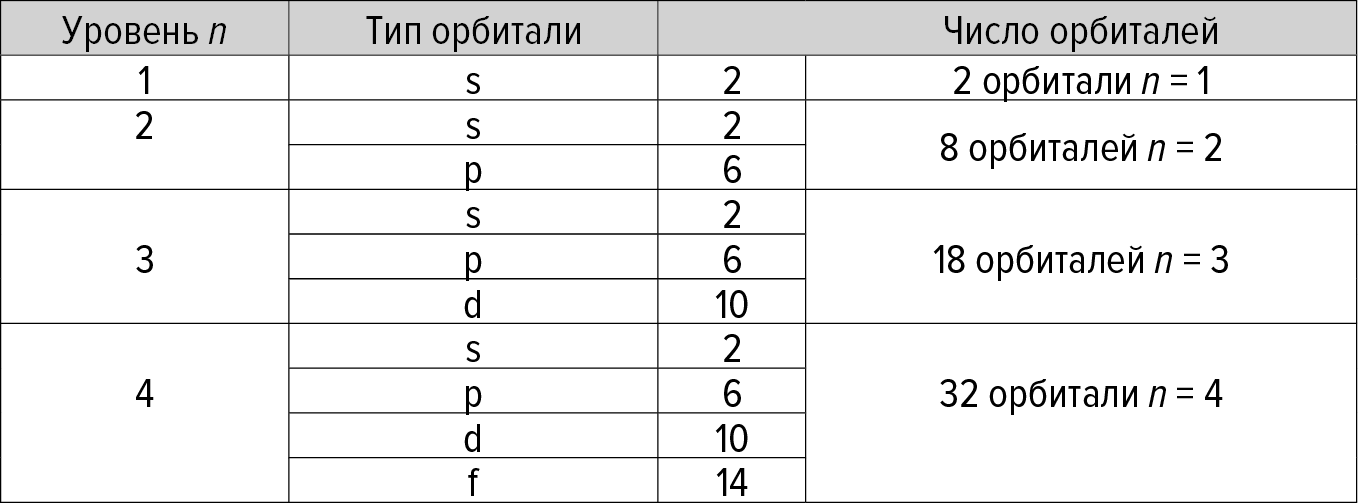
Отметим, что вышеуказанные орбитали не классифицированы в точном энергетическом порядке, – например, энергия орбиталей 3d выше, чем энергия орбиталей 4s.
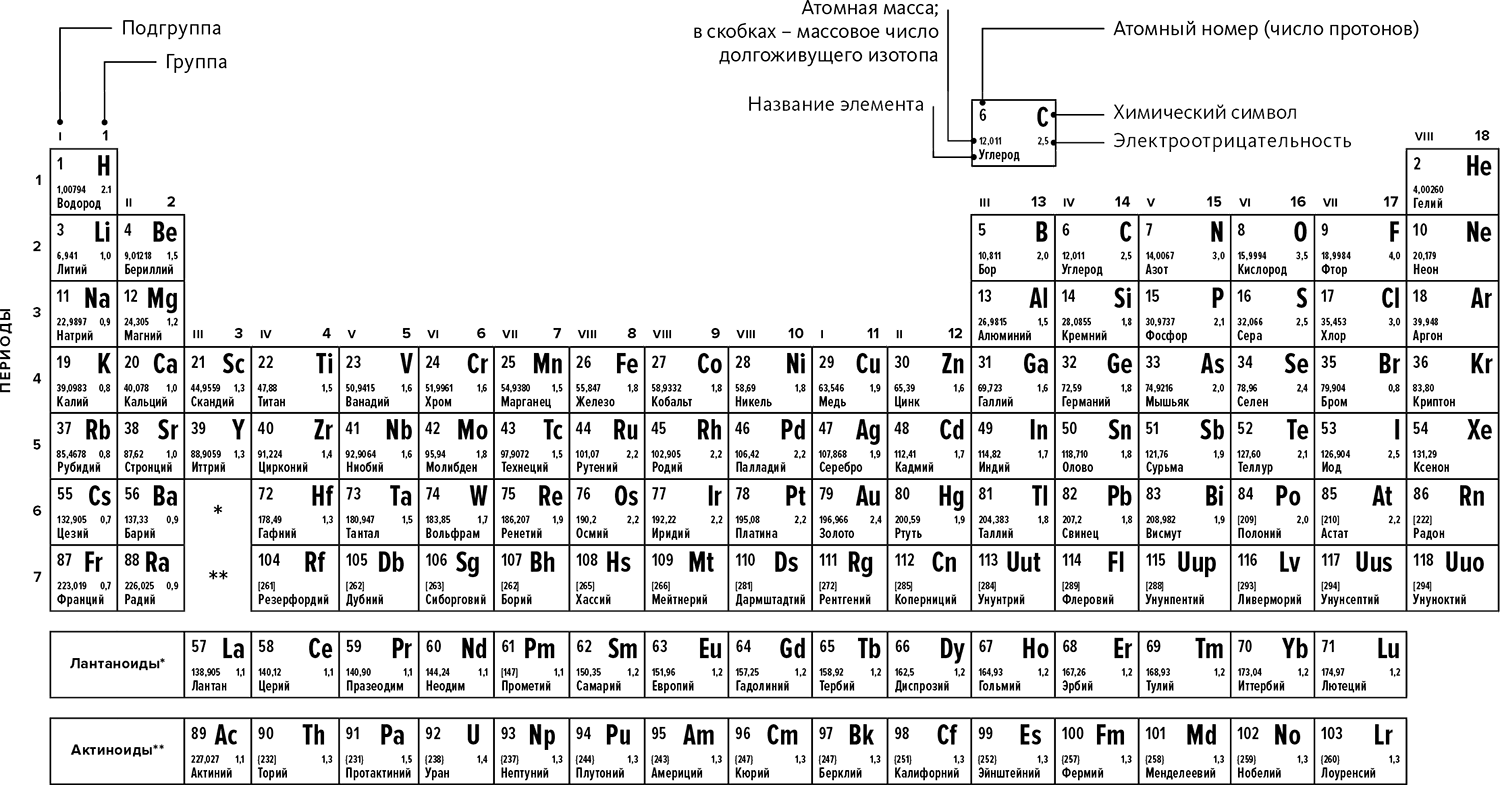
Рис. 24.2 – Периодическая система элементов
Периодическая система химических элементов
Создание периодической таблицы
Пересчитывать электроны в атомах довольно трудно, но существует таблица, названная «периодической системой элементов», которая позволяет узнать число валентных электронов, стоит лишь заглянуть в нее (➙ рис. 24.2).
В этой таблице, которая читается слева направо и сверху вниз, элементы расположены по возрастающему атомному числу, то есть все начинается с водорода (1 электрон в нейтральном атоме), затем гелий (2 электрона), потом литий (3 электрона) и так далее.
Кроме того, элементы одной группы имеют одинаковое число валентных электронов на одинаковых типах орбиталей (гелий составляет исключение, на котором мы не будем останавливаться).
Например, водород имеет один электрон на орбитали 1s. Литий имеет 3 электрона: 2 на орбитали 1s и 1 на орбитали 2s. Как и у водорода, у него всего один валентный электрон, расположенный на орбитали s: литий и водород расположены в одной группе.
Это значит, что каждый переход дальше по строке связан с переходом валентных электронов на более высокий энергетический уровень.
Так, первый ряд соответствует электронам с валентностью энергетического уровня n = 1. Второй – n = 2. Есть 8 групп, потому что мы видели, что существует 8 возможных орбиталей на этом уровне. У лития единственный электрон занимает уровень n = 2 (1 валентный электрон). У неона заняты 8 орбиталей (8 валентных электронов).
Третий ряд соответствует 8 орбиталям с наименьшей энергией уровня n=3 (орбитали типа s и p), то есть здесь тоже 8 групп.
Четвертый ряд содержит 10 дополнительных групп: это 10 орбиталей 3d, которые добавляются к 8 орбиталям типа s и p, которые уже были в предыдущих рядах. Здесь 18 групп.
Отметим, что начиная с шестого ряда появляется орбиталь типа f: здесь понадобились бы 32 группы, а это было бы очень много. Поэтому 15 элементов вынесены под таблицу в строку «лантаноиды». То же самое в седьмом ряду (строка под таблицей «актиноиды»).
Чтение периодической таблицы
По этой таблице можно легко узнать количество валентных электронов. Например, у углерода 4 валентных электрона, и мы видим его в четвертой группе (➙ рис. 24.2). Кремний расположен сразу под ним, и сразу понятно, что у него такое же количество электронов. Два элемента одной группы гомологичны: у них похожие химические свойства, потому что они имеют одинаковое число валентных электронов на одних типах орбиталей.
В первой группе расположены щелочные элементы, во второй щелочно-земельные металлы, в предпоследней галогены, и в последней инертные газы. Ряды также объединяются в «периоды», поскольку химические свойства элементов в каждом новом ряду периодически повторяются.


