Противоположность энергии: энтропия
В 1854 году Клаузиус выявил новую функцию состояния, работая с тепловым двигателем Карно в цикле. Достаточно удивительным для того времени было то, что он не дал этой функции имя, но тем не менее все-таки определял ее как «тепло к температуре». Это могло бы быть, к примеру, процессом, при котором тепло покидает горячий резервуар, разделенным на температуру горячего резервуара, или теплом, переходящим в холодный резервуар, разделенным на температуру холодного резервуара. А именно:
q / T,
где q – это тепло, а T – температура в Кельвинах.
Вспомните, что в тепловом двигателе Карно (обратимом и идеализированном) единственное тепло, которое терялось при работе, попадало в холодный резервуар. Это необходимая потеря, которая нужна для использования теплового двигателя, и обойти это правило невозможно. Тем не менее тепловой двигатель Карно – все еще самый эффективный тепловой двигатель, хотя, конечно, мы знаем, что он существует только на бумаге; построить совершенно обратимый тепловой двигатель Карно вы не сможете.
Реальный тепловой двигатель необратим – это означает, что у него есть другие процессы, которые объясняют потерю тепла и его рассеивание в окружающей среде, такие как механическое трение, потеря тепла посредством проводимости и других тепловых механизмов. В результате всех тех остальных процессов сумма значений эквивалентности Клаузиуса, которая равнялась нулю для обратимого процесса, всегда больше нуля для необратимого процесса. Оказывается, сумма Клаузиуса – не что иное, как сумма всех q/T, которые составляют процесс:
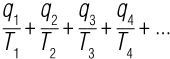
Итак, это означает, что для обратимого процесса, протекающего циклично, у данного q/T есть другой q/T, который уравновешивает его, как партнер, если угодно, таким образом гарантируя, что общее количество для всех них будет нулем. Однако для необратимого процесса дело обстоит иначе; не у каждого q/T нет партнера, и в итоге получается остаток q/T (или некомпенсированное преобразование, как называл его Клаузиус), который делает сумму больше нуля – положительным значением. Природные процессы необратимы, поэтому у них иногда есть остаточное q/T, который способствует (добавляя это положительное значение к сумме) постоянному увеличению количества энтропии во Вселенной.
Особый тип необратимого процесса – спонтанный процесс. Спонтанный процесс протекает без какой-либо дополнительной помощи; он движется в предпочтительном направлении без приложения работы. Так, когда ваш кофе остывает (так как тепло из него уходит в окружающую среду); стакан разбивается после падения на землю (после того как выполнят работу, например, подтолкнув его к краю прилавка); кубики льда тают в вашем напитке – у этих и многих других спонтанных процессов есть положительное значение. Чем выше это значение, тем более «предпочтительным» является процесс и тем сильнее он увеличивает энтропию Вселенной.
Клаузиус сформулировал многие из своих идей в теории, выдвинутой в 1854 году, где он вводит новую переменную q/T, оставляя ее безымянной. Однако в 1865 году, после дальнейших размышлений, Клаузиус пишет:
«Я считаю, что лучше заимствовать названия важных величин из древних языков, чтобы их могли использовать без изменений во всех современных языках. Я предлагаю назвать величину S энтропией тела – от греческого слова, используемого для обозначения трансформации. Я намеренно создал слово «энтропия» таким образом, чтобы оно было максимально близким к слову «энергия»; так как две величины, обозначаемые этими словами, так близко связаны в своем физическом значении, что кажется нужным некоторое сходство и в их названиях».
Наконец, в 1865 году Клаузиус завершил свою работу, в которой первое и второе начала были сформулированы так:
1. Энергия Вселенной постоянна.
2. Энтропия Вселенной стремится к максимуму.
Хотя энергия Вселенной остается константой (сохраняется), энтропия продолжает увеличиваться. Поэтому никакой из происходящих процессов никогда не приведет к уменьшению уровня энтропии Вселенной в целом. Склонность Вселенной к увеличению энтропии напоминает об «универсальной тенденции к рассеиванию механической энергии», как гласят работы Томсона, и Клаузиус отметил эту связь.
Действительно, именно этот распад – потеря энергии, которую иначе можно было бы использовать для работы, – отличает обратимый процесс от необратимого. Очевидно, все это часть плана природы по максимизации энтропии Вселенной, которая в конечном счете приведет к ее тепловой смерти. Когда энтропия Вселенной наконец достигнет своего максимума, когда больше энтропии быть просто не сможет, все, что останется – энергия, рассеянная в виде тепла. Эта энергия будет распространена среди всех атомов и молекул во Вселенной. Это распределение энергии будет подобно примеру с энергией океана (против энергии реки), в котором у нас не будет способа использовать ее для работы. Другими словами, вся полезная энергия во Вселенной закончится, и все, что останется, – бесполезное тепло!
Клаузиус также связал энтропию с тем, что он назвал дезинтеграцией. Для Клаузиуса распад был мерой разделения молекул, из которых состоит объект, друг от друга. Рассмотрим кубик льда, который в конечном счете получил достаточно тепла и тает, чтобы стать жидкой водой. Согласно Клаузиусу, у воды как жидкости величина дезинтеграции больше, чем у льда. В среднем (по времени) молекулы воды более отделены друг от друга, чем молекулы твердых тел, и еще больше, когда они – газ.
Клаузиус пытался создать молекулярную интерпретацию энтропии. Тем не менее Клаузиус подчеркнул, что первые и вторые начала были аксиомами и, следовательно, не нуждались в молекулярной интерпретации; она была всего лишь дополнением.
Клаузиус был основным исследователем в области термодинамики. Его развитие идеи энтропии и второго начала, которое следует из нее, являются понятиями, которым все еще учат и которые используются в науке сегодня. (Печально, что его вклады часто остаются незамеченными.) И хотя он всегда тщательно подходил к развитию своих теорий, этого было недостаточно, чтобы защитить ее от недопониманий и резкой критики.
Работы Клаузиуса часто написаны излишне многословно, его идеям недостает четкости формулировок. Это осложнялось тем, что Клаузиус часто излагал свои мысли, опираясь на интуицию. Кроме того, расчеты, которые он использовал, были столь сложны, что бросали вызов таким математикам, как Томсон и Максвелл. Хуже всего, что в математическом обосновании энтропии он неумело начинал с одной условности, только чтобы переключиться в конце на противоположную.
Самым постоянным и откровенным критиком Клаузиуса был Питер Гатри Тайт (1831–1901). Тайт интерпретировал энтропию как меру энергии, доступной, чтобы производить работу. Это достаточно удивительно, учитывая, что энтропия в первую очередь не форма энергии, и даже мимолетный взгляд на математическую формулу проясняет этот факт, показывая, что единицы энтропии проистекают из тепла (которое, как вы знаете, является энергией), разделенного на температуру (в градусах Кельвина).
И если бы не было достаточно, что в 1868 году эта явная ошибка появилась в книге Тайта «Эскизы термодинамики», – она возникла снова в учебнике Джеймса Клерка Максвелла (1831–1879) под названием «Теория тепла», который, кроме этой ошибки, проигнорировал бо́льшую часть работ Клаузиуса. После того как Клаузиус написал письмо в «Философский журнал», Максвелл отметил свою ошибку и исправил ее во втором выпуске книги, также указав, что энтропия на самом деле связана с энергией, которая не доступна системе для выполнения работы. Сегодня мы понимаем, что максимальное количество энергии системы, доступное для совершения работы, – это свободная энергия системы.
Энтропия, по мнению Клаузиуса, предоставляет собой противоположность энергии. В то время как энергия Вселенной сохраняется, как настаивает первое начало, ее энтропия стремится к максимуму. Энергия и первое начало, которое управляет ей, не могут объяснить, почему определенные процессы протекают в каком-то выбранном направлении; для этого нам и нужна энтропия. Тем не менее ее определение с точки зрения термодинамики – «отношение тепла к температуре» – оставляет желать лучшего. Мы понимаем, что тепло – это одна из форм энергии, проистекающая из движения крошечных элементов материи (атомов). Однако в термодинамике нет определений, которые так или иначе связывают энтропию и атомы; не существует никакой микроскопической интерпретации.
Потребовались поразительные усилия нескольких ученых, чтобы показать, что у энтропии действительно есть микроскопическая интерпретация, что не только дополняет термодинамическое описание Клаузиуса, но и существенно расширяет его, делая понятие энтропии еще более мощным инструментом современной науки.

