Книга: Сердце. Справочник кардиопациента
Назад: Глава 19 Болезни сердца у детей: профилактика начинается сейчас!
Дальше: Эпилог Лишаем кардиологов работы
Раздел пятый
Глядя вперед
Глава 20
Здоровье (и восстановление) сердца в будущем: звездный путь, а вот и мы!
Общая картина
Болезни сердца не проходят. Несмотря на наше все возрастающее их понимание и новые эффективные стратегии профилактики, болезни сердца будут оставаться для будущих поколений проблемой здоровья номер один. Но эта отрезвляющая информация не означает, что мы должны отказаться от борьбы. Мы делаем успехи в нашей битве за здоровое сердце и предвидим огромный прогресс в течение грядущих нескольких десятилетий.
Что будет представлять собой кардиология через пять, десять или двадцать лет? От крошечного, имплантируемого целиком искусственного сердца, которое работает всю жизнь, до применения стволовых клеток для восстановления поврежденной сердечной мышцы – мы подходим все ближе к резким изменениям наших возможностей лечить больные и поврежденные сердца. Сегодня такие виды терапии – это перспективные компоненты удивительной научно-исследовательской разработки системы искусственного кровообращения. В не слишком отдаленном будущем они вступят в клиническое русло, где смогут продлить и улучшить жизнь миллионов людей.
Одновременно с прогрессом в кардиобиотехнологии для восстановления повреждений сердца мы также проводим расшифровку генетического кода с целью определения, является ли проблема с сердцем у пациента генетической и постигнет ли его детей та же участь. Сегодня мы можем точно определить генетические причины только нескольких сердечно-сосудистых заболеваний – гипертрофической кардиомиопатии, синдрома Марфана, отдельных видов сердечной аритмии и некоторых других. Но что же с ишемией, самой распространенной болезнью сердца? При чем тут генетика?
Поиск в Google заставит вас поверить, что предсказать ваш генетический риск развития ишемической болезни сердца очень легко. В самом деле, десятки сайтов предлагают «возможность» потратить тысячи долларов, чтобы определить ваш генетический профиль и риск заболевания. Компании, которые делают этот вид прямых продаж непосредственно потребителю генетического тестирования, предоставляют информацию, которая сбивает с толку, вызывает уныние и в практическом плане бесполезна. Мы поможем вам сэкономить деньги и избежать тревоги, пояснив, когда сегодня генетическое тестирование на болезни сердца уместно и куда генетические технологии могут завести нас в будущем.
Тем, у кого уже диагностировано сердечное заболевание, автоматизированный электронный кардиомониторинг поможет избежать осложнений и сохранить качество жизни. Если вы знаете, как работать с iPod или BlackBerry, вы сможете понять новейшую и самую лучшую технологию кардиомониторинга. Идея сродни с указателем уровня топлива в вашем автомобиле, который сообщает вам, когда пора остановиться для заправки, чтобы избежать огорчения, когда у вас закончится бензин в середине дороги в никуда. Ученые предполагают подобную парадигму для кардиомониторинга: раннее предупреждение негативной тенденции подскажет меры для предотвращения болезни и госпитализации. Представьте себе крошечный сенсор, имплантированный в вашем сердце, который следит за вашей застойной сердечной недостаточностью и сообщает вам, когда приближается беда. На вашем ночном столике должен загореться индикатор, советуя избегать соли, снизить потребление жидкости или позвонить вашему врачу. Технологии мониторинга, которые предоставляют такого рода критическую информацию в режиме реального времени, всего в паре шагов от широкого клинического применения.
Будущее высокотехнологично и блестяще, нас ждут впечатляющие достижения в кардиологической помощи, которые обеспечат увеличение продолжительности и повышение качества жизни. Давайте заглянем в хрустальный шар и увидим передовые исследования, которые будут формировать новое поколение кардиологической помощи.
Новое сердце целиком: какие имеются варианты?
Сегодня мы сильно ограничены в своих возможностях осуществить «ремонт» сердечной мышцы, если она повреждена. Когда человек переносит инфаркт, мышечные клетки отмирают, и определенная область сердца перестает сокращаться. В большинстве случаев такое снижение функции сердца является постоянным. Если у человека имеется достаточное повреждение сердца от сердечных приступов, вирусных инфекций, заболеваний клапанов сердца или по другим причинам, может возникнуть сердечная недостаточность. Сегодня насчитывается более 5 миллионов американцев, которые страдают сердечной недостаточностью, и ежегодно у еще 500 тысяч человек развивается это состояние. Тяжелая сердечная недостаточность часто плохая новость; 50 % пациентов умирает в течение последующих пяти лет. Но врачи и ученые прогнозируют, что качественно новые успехи создадут более светлое будущее для этих пациентов.
Пересадка сердца
В теории идеальная терапия сердечной недостаточности – это замена поврежденной мышцы мышцей работающей. Мы можем сделать это с помощью пересадки сердца. Первая пересадка сердца была проведена в 1967 г., и, хотя вначале кардиотрансплантации возникали осложнения и смерти, сегодня пациенты после трансплантации чувствуют себя вполне хорошо. 50 % реципиентов сердца прожили по крайней мере десять лет после пересадки, что представляет огромный прорыв по сравнению с нашими первыми результатами.
Многие из ранних проблем были вызваны отторжением пересаженного сердца. Мы продолжаем работать над новыми препаратами, предотвращающими отторжение, но сегодня самым большим ограничением трансплантации является нехватка доноров сердца. Во всем мире хирурги производят около 3500 трансплантаций сердца в год (2300 человек из них в Соединенных Штатах, где почти сто больниц аккредитованы для трансплантации сердца). Но в любой момент времени существует более 10 тысяч человек в очереди за новым сердцем, и от 10 до 15 % из них умрет прежде, чем они его получат.
Сегодня трансплантация сердца является отличным вариантом для пациентов с конечной стадией сердечной недостаточности. А поскольку у нас такие скудные ресурсы донорских сердец, трансплантацию предлагают только тяжело больным, и многие другие умирают прежде, чем получат новое сердце. Кроме того, пожилым людям и пациентам с другими заболеваниями, такими как болезни легких, нарушения функции почек, тяжелые формы сахарного диабета и инсульты, не предлагают такую терапию. А что, если бы у нас было неограниченное количество новых сердец, чтобы помочь этим людям? Мы заменяем человеческие клапаны сердца клапанами свиней, коров и даже лошадей. Почему бы не расширить эту концепцию и не пересаживать целое сердце животного человеку?
ГОНКИ, ЧТОБЫ СДЕЛАТЬ ЧЕЛОВЕКУ ПЕРВУЮ ПЕРЕСАДКУ СЕРДЦАМедицинский прогресс часто характеризуется как гонка. Последние, разрекламированные медицинские гонки были в расшифровке генома человека, разработке первого лекарства от эректильной дисфункции, и дизайне и имплантации первого коронарного стента с лекарственным покрытием. Но ни одно из них не разожгло так воображение общества, как соревнование в стремлении сделать первую пересадку сердца.К середине 1967 г. несколько хирургических кардиокоманд во всем мире выстроились на старте, готовые выполнить первую в мире пересадку сердца. Кардиохирург Кристиан Барнард выиграл эту гонку в Кейптауне, Южная Африка. 3 декабря 1967 г. он имплантировал сердце молодой женщины Луи Вашканскому, пятидесятичетырехлетнему бакалейщику с последней стадией сердечного заболевания. Поддерживаемый командой в тридцать медсестер и врачей, Барнард с волнением сосредоточился на операционном поле после завершающего стежка, вшив новое сердце в грудь Вашканского. Когда он увидел, как забилось пересаженное сердце, Барнард подытожил результат своих усилий, смело заявив: «Работает».Но успех был кратковременным. Вашканский умер восемнадцать дней спустя, после пневмонии, которая была частично вызвана лекарствами против отторжения, обусловленного трансплантацией. Невзирая на эту неудачу, хирургов привлекала эта невиданная операция, опубликованная на обложке «Тайм». В течение следующего года трансплантация сердца была проведена у 102 пациентов по всему миру. Результаты были плачевными. Долго прожившие пациенты были редки. К концу 1968 г. энтузиазм прошел, и большинство хирургов отказалось от программ по пересадке сердца.Но Норман Шумвей, станфордский кардиохирург, не отказался. Шумвей был хирургом-первопроходцем, который научил Барнарда, как делать пересадку сердца. Опираясь на десятилетия исследований, Шумвей и его команда продолжали совершенствовать и методику трансплантации и, что не менее важно, комплексное медицинское обслуживание реципиента. Шумвей сделал большие успехи, что позволило врачам наблюдать и лечить отторжение нового сердца. Барнард, возможно, и выиграл гонку, но Норман Шумвей, истинный победитель, закончил марафон, чтобы обеспечить место в нашем медицинском арсенале для трансплантации сердца, продлевающей жизнь тысячам пациентов с его заболеваниями.
Ксенотрансплантация: использование сердца от другого вида
Концепция межвидовой трансплантации, или ксенотрансплантации, является простой, но с точки зрения биологии невероятно сложной. Тем не менее один предприимчивый хирург рванул напрямик, чтобы выиграть эту гонку, пропустив несколько важных шагов в своей спешке заменить сердце человека сердцем животного. 26 октября 1985 г. первая ксенотрансплантация была проведена кардиохирургом Леонардом Бейли из города Лома-Линда, который пересадил сердце павиана в грудь младенца по имени Стефани Фэй Боуклэр, ставшей всемирно известной как Беби-эльф.
Беби-эльф родилась с болезнью, которая называется синдромом гипоплазии левых отделов сердца, врожденным дефектом сердца, поголовно смертельным без хирургического вмешательства. Хирургическая операция этого дефекта является чрезвычайно сложной и рискованной, так что некоторые хирурги выступают в пользу трансплантации сердца у этих несчастных младенцев. Бейли понимал, что получить подходящее донорское сердце ребенка вряд ли удастся. Поэтому он предложил родителям Беби-эльф пойти на эксперимент.
Как и с первой пересадкой сердца Барнардом восемнадцать лет назад, операция прошла хорошо. Сердце бабуина начало биться сразу. Безумству СМИ не было предела, они показывали кадры отснятого видеоматериала комфортно отдыхающей Беби-эльф и кормления малышки. Но лучшие лекарства не смогли остановить иммунную систему Беби-эльф от нападения и систематического разрушения сердца, которое поддерживало ее жизнь. Не прожив и двадцати дней, Беби-эльф умерла – еще одна медицинская гонка была и выиграна и проиграна.
Легко оглядываться назад и критиковать фиаско с Беби-эльф. Но важнее смотреть вперед и задаваться вопросом: «Есть ли будущее у ксенотрансплантации?» Хотя ученые сделали огромные шаги в понимании и лечении отторжения органов, на сегодняшний день Беби-эльф является единственным реципиентом сердечного ксенотрансплантата. Ученые в настоящее время сосредоточены на свиньях как источниках органов, генетически модифицируя их сердца с целью убедить иммунную систему человека, потому что свиное сердце выглядит как человеческое. Сегодня свиное сердце может прожить в обезьяне шесть месяцев – лучше, чем двадцать дней у Беби-эльф, но недостаточно хорошо для рутинного использования. Мы думаем, немало времени пройдет, прежде чем межвидовая трансплантация станет клинической реальностью. Суммируя огромные проблемы, связанные с ксенотрансплантацией, новатор в пересадке сердца кардиохирург Норман Шумвей прокомментировал: «Ксенотрансплантация есть и всегда будет нашим будущим».
Полностью искусственное сердце: на сцену выходит машина
Если мы не можем использовать сердце свиньи или павиана, как насчет полностью созданного руками человека искусственного сердца для замены поврежденного сердца у пациента с сердечной недостаточностью? Оно было названо Святым Граалем медицины.
Трудно ли создать машину, которая воспроизводит функции сердца?
В 1964 г. президент Линдон Джонсон призвал Национальный институт здоровья субсидировать программу создания искусственного сердца. С этого времени мы высадили человека на Луну, сделали смартфон, заменили пишущие машинки компьютерами и окружили земной шар спутниками GPS, которые могут определять наше местоположение с точностью до нескольких метров. Но у нас до сих пор еще нет реального работающего постоянно искусственного сердца – увы!
БАРНИ КЛАРК: ЕГО ИСКУССТВЕННОЕ СЕРДЦЕ, ЕГО ЖЕРТВА И РАЗВИТИЕ НАУКИШестидесятиоднолетний стоматолог Барни Кларк умирал в Сиэтле от сердечной недостаточности, когда его кардиохирург Уильям Деври спросил, не хочет ли он стать первым человеком, получившим экспериментальное искусственное сердце в качестве постоянного трансплантата. Стоя на пороге смерти, Кларк понимал, что операция не возвратит его к нормальной жизни, что его шанс на долгосрочное выживание почти нулевой. Но с целью расширения наших знаний и помощи другим в будущем он согласился.2 декабря 1982 г. Деври удалил большую часть сердца Кларка и заменил его искусственным сердцем Jarvik 7. Прикрепленный к консоли размером с холодильник силовыми кабелями, Jarvik 7 перекачивал достаточно крови, чтобы выполнять функцию системы кровообращения Кларка.Кларк несколько дней чувствовал себя хорошо. Затем возникли проблемы. Сначала потребовалась повторная операция, чтобы починить устройство. Затем последовали кровотечения, инсульты и инфекции. Он так и не вышел из больницы, умер, проведя 112 дней в борьбе с неполадками оборудования и обширными осложнениями. Но жертва Кларка привела к новым знаниям и прогрессу, который в конечном счете спас сотни жизней.
Прогресс искусственных сердец затмил ксенотрансплантацию. К 2005 г. были одобрены два разных полностью искусственных сердца. Одна платформа, SynCardia Total Artificial Heart, – это современная версия Jarvik 7. Данное устройство может перекачивать по 9 литров крови в минуту (сейчас ваше сердце, вероятно, перекачивает 5 или 6 литров в минуту) и было имплантировано почти тысяче пациентов с тяжелой сердечной недостаточностью. Оно используется прежде всего как мост к трансплантации, и это означает, что пациента держат на искусственном сердце, пока он не получит донорское сердце. Тогда при повторной операции удаляют искусственное сердце и пересаживают новое донорское сердце.
80 % пациентов переживают эти две операции. Однако такая стратегия имеет некоторые ограничения. Как и Кларк, сегодня реципиенты искусственного сердца привязаны к большой консоли кабелями питания, которые проходят через кожу. Они не могут покинуть больницу в течение длительного периода времени, пока ожидают трансплантата. Кроме того, различные осложнения, в том числе инфекции и кровотечения, могут замедлить прогресс и поставить под угрозу результаты.
Второй одобренный вариант цельного искусственного сердца предназначен для установки аппарата вспомогательного кровообращения, который является постоянной заменой собственного сердца пациента. Замещающее сердце AbioCor весит около 1 килограмма (примерно в три раза больше, чем человеческое) и питается от внешнего источника, который подает энергию к устройству через кожу. Теоретически пациент может идти домой с таким имплантированным устройством; однако большинство пациентов не выписывают из больницы. Опыт работы с таким сердцем ограничен. Проведено менее двадцати имплантаций, а самая продолжительная жизнь пациента составила 512 дней. И все-таки это приводит нас на шаг ближе к нашей цели – постоянной замене сердца.
Исследователи усердно работают над созданием следующего поколения искусственного сердца. Цель в том, чтобы создать небольшое, полностью имплантируемое устройство, которое будет в состоянии работать пять лет и далее. У него не будет механических сбоев, и оно не станет провоцировать образование сгустков крови, которые могут привести к инсультам. Устройства с такими характеристиками уже имплантированы в животных, и первые результаты выглядят многообещающими. Наш прогноз: в отличие от поисков Святого Грааля поиск надежного цельного искусственного сердца будет происходить в течение десятилетий, а не столетий, и придет к успешному завершению.
Желудочковый аппарат вспомогательного кровообращения: замена одной сердечной камеры за один раз
Есть очень хороший промежуточный шаг между целиком искусственным сердцем и трансплантацией сердца, и эта опция доступна сегодня. Как вы помните из главы 15, желудочковый аппарат вспомогательного кровообращения является имплантируемым механизмом, который берет на себя функцию перекачивания правого или левого желудочка сердца. Это устройство несколько проще, чем целиком искусственное сердце, так как оно заменяет только один желудочек сердца. Процедура достаточно проста, и сегодня эта терапия довольно обычное дело.
У большинства пациентов левожелудочковый аппарат вспомогательного кровообращения (ЛЖАВК) используется как мост к трансплантации. В период ожидания донорского сердца насос обеспечивает отличное кровообращение, позволяя почкам, печени и другим органам оправиться от разрушительного воздействия сердечной недостаточности. Когда наконец донорское сердце становится доступным, пациент является хорошим кандидатом для сердечной трансплантации.
Бывший вице-президент Дик Чейни в настоящее время наиболее известный реципиент ЛЖАВК. Как и большинство устройств других реципиентов, устройство Чейни – сравнительно громоздкий насос, устанавливаемый с помощью стандартной кардиологической операции, включающей методику стернотомии (разреза посередине грудины) и использование аппарата искусственного кровообращения. Значительный прогресс обещает, что следующее поколение желудочковых аппаратов вспомогательного кровообращения будет выглядеть как «феррари» по сравнению с пегой лошадкой сердечного насоса Чейни.
Проходящие в настоящее время клинические испытания новейшие желудочковые аппараты вспомогательного кровообращения – просто инженерное чудо. Размером с батарейку АА, эти небольшие насосы перекачивают от 2 до 3 литров крови в минуту, и их можно устанавливать с помощью минимально инвазивных хирургических методов (никакого большого разреза, проходящего через грудину). Этот вид терапии сократит «лист ожидания» операций по пересадке сердца и обеспечит раннюю терапию больных с умеренной сердечной недостаточностью, недостаточно разрушительной, чтобы оправдать пересадку сердца. Эти новые устройства будут существенным сдвигом в нашей помощи миллионам нынешних и будущих пациентов, страдающих сердечной недостаточностью.
Лечим сердце стволовыми клетками: пересадка по одной клетке за один раз
В каждом из нас есть сокровище, клад из возобновляемых источников жизни, которые могут быть направлены на исцеление и восстановление активности сердечной функции.Доктор Эмерсон Перин по поводу перспектив терапии пациентов с заболеваниями сердца стволовыми клетками
Пересадка сердца ограничена дефицитом доноров, а у рукотворных насосов много технологических проблем. Признавая эти трудности, многие ученые обратились к терапии стволовыми клетками, чтобы раскрыть секреты, которые позволят нам лечить сердечные заболевания. Стволовые клетки – средоточие нашего воображения и планов лечения различных заболеваний, начиная от болезни Альцгеймера, кончая сердечной недостаточностью. Остро почувствовав их перспективность, СМИ освещают тему стволовых клеток, описывая драматические научные прорывы, разочарование неудач в ходе исследований и политическую перепалку по поводу их использования. Отодвинем политику в сторону, к делу относится только следующий медицинский вопрос: «Можно ли использовать стволовые клетки для восстановления поврежденного сердца?» Ответ в настоящее время таков: «Да, но…» И прежде чем добавить к этому ответу подробную информацию, позвольте дать вам краткий урок по биологии стволовых клеток.
Стволовые клетки: три типа и что они могут
Легко понять увлекательную медицинскую перспективу замены поврежденных или больных органов или тканей новыми тканями, полученными из стволовых клеток. Но что такое эти волшебные клетки и где мы их найдем?
Стволовые клетки – это незрелые, неспециализированные клетки, которые можно активировать для дифференциации и превращения в специализированные клетки, составляющие тканей нашего организма (например, сердечную мышцу, печень, почки, сосуды и др.). Стволовые клетки присутствуют и в эмбрионах, и у взрослых людей. В эмбрионе эти клетки отвечают за развитие всех различных органов и тканей. У взрослых стволовые клетки стратегически расположены по всему телу, где они функционируют как система внутреннего ремонта организма.
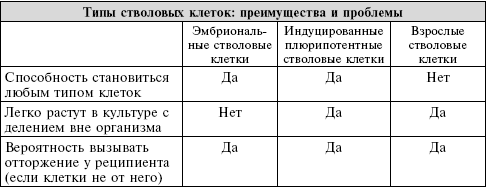
Существуют важные различия между эмбриональными и взрослыми стволовыми клетками. Эмбриональные стволовые клетки – это «чистейший» тип стволовых клеток. С согласия доноров клиники для больных бесплодием эмбриональные стволовые клетки получают из оплодотворенных эмбрионов, которые не были имплантированы для оплодотворения in vitro, а были отправлены на уничтожение. Эмбриональные стволовые клетки можно заставить воспроизводиться, создавая клеточные линии. Мы говорим, что эмбриональные стволовые клетки «тотипотентны», то есть они могут стать любым видом клеток в организме – от волос до нервных и сердечных клеток. Этот широкий круг потенциальных типов клеток, которыми могут стать эмбриональные стволовые клетки, является их огромным преимуществом.
Взрослые стволовые клетки несколько иные. Они разбросаны по всем тканям нашего тела, ожидая – иногда в течение многих лет – сигналов дифференцироваться и делиться для восстановления повреждений органа или ткани, в которых они находятся. В большинстве случаев взрослые стволовые клетки – это клетки-«предшественники», они могут заменить или отремонтировать только родную ткань. Так, стволовые клетки мышц становятся мышечными волокнами, стволовые клетки в мозгу дифференцируются в нервные клетки и их вспомогательные структуры, а стволовые клетки сердца заменяют сердечные и сосудистые клетки. Эти взрослые органоспецифические стволовые клетки, как правило, заменяют клетки и ткани, утраченные в результате обычного износа повседневной жизни. В некоторых тканях, таких как желудочно-кишечный тракт и костный мозг, стволовые клетки постоянно дифференцируются и делятся. В других, включая сердце и поджелудочную железу, стволовые клетки присутствуют, но редко исполняют свое предназначение создания новых тканей.
В то время как эмбриональные и взрослые стволовые клетки встречаются в природе, недавно ученые создали третий тип стволовых клеток – «индуцированные плюрипотентные стволовые клетки». Чтобы сделать эти клетки, ученые брали обычные взрослые клетки, такие как клетки кожи, и генетически изменяли их, чтобы заставить вести себя как эмбриональные стволовые клетки, восстанавливая их способность дифференцироваться в различные типы клеток. Сегодня ученые разрабатывают методы контроля этого процесса, так чтобы клетки могли перестраиваться в клетки заданного типа. С этим открытием у нас появилась вероятность получить в ближайшем будущем большой доступный источник универсальных стволовых клеток.
Три различных типа стволовых клеток – эмбриональные, взрослые и индуцированные плюрипотентные стволовые клетки – представляют явные преимущества и проблемы, когда дело доходит до их использования для восстановления тканей и органов.
Стволовые клетки: помогают ли они?
Стволовые клетки являются частью как будущего, так и настоящего. Они уже вышли на широкую клиническую арену при трансплантации костного мозга. При пересадке костного мозга реципиент получает клеточную смесь, богатую стволовыми клетками, которая обновляет костный мозг, создавая новые делящиеся клетки у больных раком, которые потеряли собственные клетки костного мозга из-за болезни или вследствие химиотерапии, используемой для ее лечения. Обладая регенеративной способностью, стволовые клетки также перспективны в лечении болезней Альцгеймера и Паркинсона, диабета, артрита, травм спинного мозга, ожогов и, конечно, болезней сердца.
Целевой группой населения с заболеваниями сердца являются те пациенты, у которых есть повреждение сердца, как от острого инфаркта или давней дисфункции сердечной мышцы из-за хронической сердечной недостаточности. В обоих случаях насосная функция сердца нарушена. План состоит в введении новых клеток на замену поврежденных и дисфункциональных мышечных клеток. В то время как концепция проста, научная сторона чрезвычайно сложна.
Первые несколько попыток экспериментов со стволовыми клетками животных и человека столкнулись с серьезнейшими проблемами. Для терапии стволовыми клетками заболеваний сердца требуется больше чем просто доставка этих клеток в сердечную мышцу. Вопросов возникает множество, начиная от лучшей методики доставки стволовых клеток в сердце (прямая инъекция, внутривенные инъекции или инъекции в коронарные артерии), кончая правильным типом стволовых клеток для восстановления сердца. Список трудностей лечения стволовыми клетками длинный, но ни одна из этих проблем не является непреодолимой.
Лечение стволовыми клетками: проблемы:
• определить лучший тип стволовых клеток для каждой проблемы;
• наработать большое количество таких стволовых клеток;
• добиться того, чтобы клетки дифференцировались в клетки нужного типа;
• создать «дружелюбное» окружение, чтобы клетки прижились у реципиента, а не подвергались отторжению;
• усилить интеграцию стволовых клеток в окружающие ткани;
• обеспечить, чтобы стволовые клетки функционировали надлежащим образом в течение длительного периода времени;
• предотвратить «одичание» стволовых клеток и перерождение в другие типы тканей или даже опухоли.
Предварительные данные более десяти исследований подтверждают будущую роль стволовых клеток в лечении пациентов с заболеваниями сердца. В некоторых исследованиях доставка стволовых клеток к поврежденным участкам сердца, казалось, приносила измеримую пользу, в том числе увеличение притока крови, небольшие уменьшения повреждения, вызванного инфарктом, и небольшой рост сердечной функции. В двух недавних исследованиях имеющиеся в продаже препараты стволовых клеток ассоциировались с небольшим улучшением работы сердца, снижением симптоматики и уменьшением сердечной аритмии у инфарктников.
КОМБИНИРОВАННАЯ ТЕРАПИЯ: СТВОЛОВЫЕ КЛЕТКИ И ЛИПОСАКЦИЯВы прочитали правильно – существует связь между стволовыми клетками и липосакцией. Ученые всегда ищут новые источники стволовых клеток. До сегодняшнего дня в большинстве клинических испытаний терапии стволовыми клетками использовались стволовые клетки, полученные из костного мозга. Выращивание клеток костного мозга является трудной, несколько неудобной медицинской процедурой, и 3 столовые ложки костного мозга, типичное выращенное количество, содержат лишь около 25 тысяч стволовых клеток. В отличие от этого легко вырастить 170 граммов жировой ткани у больных, перенесших липосакцию, и эта процедура дает миллионы стволовых клеток. Могут ли стволовые клетки от вашего спасательного круга на талии помочь вашему поврежденному сердцу? Предварительные данные представляются обнадеживающими.Голландские исследователи вводили стволовые клетки, полученные из жира, в коронарные артерии десяти пациентам, перенесшим инфаркт. Через шесть месяцев после инфаркта у них немного улучшилась сердечная функция и кровоток, а также сократилось рубцевание по сравнению с пациентами-инфарктниками, получавшими плацебо. Этого исследования не вполне достаточно, чтобы доказать полезность, но они предполагают возможности.
Пока продемонстрированная польза для сердца стволовых клеток небольшая, но обнадеживающая. По мере разрешения проблем, связанных со стволовыми клетками, мы будем совершенствовать процедуры и стратегии, и это, вероятно, увеличит полезность. По пути мы выясним, как на самом деле работают стволовые клетки, чтобы лечить болезни. Опять же, наука не так проста, как мы думали. Представления о том, что стволовые клетки будут дифференцироваться в клетки сердца и помогать ему биться более эффективно, могут не оправдать наших ожиданий. В экспериментальных исследованиях только небольшое количество вводимых стволовых клеток выживает в сердце и становится функциональными клетками сердечной мышцы, и этого количества недостаточно, чтобы объяснить наблюдаемую пользу для сердца.
Наиболее популярная теория сейчас заключается в том, что стволовые клетки секретируют химические вещества, которые оказывают положительное влияние на соседние нативные (родные) сердечные клетки. Эти химические вещества стимулируют рост кровеносных сосудов, уменьшают воспаление, ускоряют заживление и даже могут вызывать деление собственных сердечных стволовых клеток у пациента и заменять поврежденные мышечные клетки. В ближайшие несколько лет мы будем совершенствовать наше понимание того, как терапия стволовыми клетками работает, и это поможет нам оптимизировать лечение.
Не все ученые разделяют нашу веру в перспективы терапии стволовыми клетками. Мы признаем, что существуют значительные несоответствия в результатах испытаний терапии стволовыми клетками пациентов с инфарктом. Но ни одно лекарство не работает одинаково у всех, и периодические сбои в лечении не должны заставлять нас отказываться от лекарства или процедуры. Кроме того, объяснить противоречивые результаты можно значительными различиями между процедурами испытания – от типа стволовых клеток до способа доставки. В данный момент мы не знаем правильного «рецепта» лечения стволовыми клетками пациентов с заболеваниями сердца. Но яйца не учат ученых куриц, и мы надеемся, что в конечном счете они создадут рецепт, который обеспечит победу.
СТВОЛОВЫЕ КЛЕТКИ, МАГНИТЫ И НАНОТЕХНОЛОГИЯДетский магнит. Это может быть ответом на вопрос о том, как нам заставить стволовые клетки перейти в нужное место в организме и оставаться там. Исследователи из Медицинского центра СедарсСинай выращивали стволовые клетки крыс и нагружали их крошечными наночастицами железа. Затем они воссоздали у крыс инфаркт и вводили железосодержащие стволовые клетки в сердечную мышцу вблизи области инфаркта. Держа простой магнит над сердцами животных в течение 10 минут, они притягивали железо в стволовых клетках и смогли утроить количество стволовых клеток, которые расположились в сердце. С увеличением количества стволовых клеток в сердце размер инфаркта уменьшился, а функция сердца улучшалась. Высокотехнологичные стволовые клетки в сочетании с низкотехнологичными магнитами могут способствовать повышению надежности и эффективности терапии стволовыми клетками.
Ваши гены, ваше сердце и ваша судьба
Все мы знаем, что семейный анамнез – важный фактор риска развития ишемической болезни сердца. Но семейный анамнез играет еще большую роль при менее распространенных сердечных заболеваниях, в том числе синдроме Марфана, гипертрофической кардиомиопатии и ряде нарушений сердечного ритма, которые вызывают внезапную смерть; семьи с такими заболеваниями часто могут проследить наследование этого заболевания через несколько поколений. Переменное воздействие семейного анамнеза на риски различных видов заболеваний сердца предоставляет ключевой момент в генетике сердечных болезней.
Чем больше мы узнаем о генетике сердечных заболеваний, тем сложнее складывается картина. Не существует единого «гена сердечного заболевания». Влияние генетических факторов на развитие сердечных заболеваний зависит от конкретных проблем с сердцем и множества факторов окружающей среды. Как следствие, взаимоотношения между генами и здоровьем сердца далеко не просты.
Генетическая карта: что мы в действительности знаем?
Врачи и пациенты мечтают о применении генетической карты, представленной проектом «Геном человека», чтобы определить риск развития сердечных заболеваний у человека и на основании полученной информации создать индивидуальный медицинский план. Идея привлекательна – на основании генетического анализа каждый человек получает номер от 0 до 100, представляющий риск развития ишемической болезни сердца в течение жизни. Но для кардиолога или генетика такое представление в настоящее время кажется недостижимым, почти романтическим идеалом. Развитие ишемической болезни сердца связано как с различными факторами окружающей среды, так и с многими другими генами, а наше понимание этих генов в частности и генетики человека в целом неполно.
Как может это последнее заявление быть правильным? Проект «Геном человека» был завершен в 2003 г., и тринадцать лет и 3 миллиарда долларов спустя создалось весьма популярное мнение о том, что теперь у нас имеются все ответы. Фактически, хотя проект «Геном человека» и предоставил большое количество информации, он не ответил на большую часть наших вопросов о генах. Проект «Геном человека» идентифицировал почти все наши 20–25 тысяч генов (осталось еще несколько) и определил последовательность 3 миллиардов химических пар оснований, или строительных блоков, которые составляют человеческую ДНК. Примечательно, что ученые обнаружили, что 99,6 % этих генетических последовательностей идентичны между собой, но с 3 миллиардами пар оснований ДНК это оставляет 24 миллиона потенциальных различий между людьми.
Каждый человек имеет уникальный генетический состав. Созданная путем анализа ДНК лишь нескольких доноров генетическая карта, произведенная проектом «Геном человека», не представляет ваш конкретный набор генов. Более того, она не говорит нам о функции каждого гена, его диапазоне возможных мутаций и способе, которым контролируются ее функция и экспрессия другими сегментами ДНК. Итак, у нас есть карта ДНК, но у нас нет ключа к этой карте, который дал бы нам индивидуальный план здоровья, основанный на уникальных генах индивидуума. Теперь вы понимаете, почему рано говорить, что мы взломали генетический код.
Тем не менее поиск в Интернете «генетического тестирования» приводит вас к неправильному выводу, что ученые знают ответы на все вопросы. Вы найдете десятки компаний, которые обещают обнаружить персонально у вас риск развития широкого спектра заболеваний, включая ишемическую болезнь сердца. Тестирование представляет собой вводящий в заблуждение скрининг сотен тысяч или даже миллионов точек генетической изменчивости. Но эти тесты не дадут вам ни полной карты вашей ДНК, ни вашего истинного риска развития распространенных заболеваний. После того как с вашей кредитной карты снимут 1000 долларов или больше, вы получите список болезней, к которым вы «предрасположены». Это не совсем то же самое, что «индивидуальный план здоровья, основанный на ваших собственных генах».
Генетическое тестирование на сердечные заболевания: когда оно помогает
Несмотря на многие пробелы в наших знаниях и ограничения генетического тестирования, гены человека могут многое рассказать нам о наличии и риске развития определенных видов сердечных заболеваний. У нас есть лучшие рычаги управления группой сравнительно необычных болезней, на которые оказывают сильное влияние небольшое количество генов и, что неудивительно, которые четко передаются в семье. Как мы упоминали ранее, этот короткий список включает гипертрофическую обструктивную кардиомиопатию, синдром Марфана и три синдрома аритмии: кардиомиопатия правого желудочка, синдром удлиненного интервала QT, синдром Бругада.
Каждое из этих условий связано с внезапной смертью, и каждое вызывается мутацией в одном гене. Генетическое тестирование этих заболеваний повышает точность диагностики, помогает в терапии и информирует о диагнозе и лечении других членов семьи. Из них гипертрофическая кардиомиопатия – опасное разрастание части сердечной мышцы – понятна лучше всего и служит примером правильного применения генетического тестирования в современном лечении сердечно-сосудистых заболеваний.
Многие люди с гипертрофической кардиомиопатией имеют одну генетическую мутацию, предполагая, что скрининг на это состояние может быть довольно простым, если просто поискать мутированный ген у каждого человека. Но есть проблема – не у всех больных с гипертрофической кардиомиопатией встречается одна и та же мутация в одном гене.
ГЕНЕТИЧЕСКОЕ ТЕСТИРОВАНИЕ НАПРЯМУЮ ПОТРЕБИТЕЛЮ: ПОТРЕБИТЕЛЬ, ОСТЕРЕГАЙСЯУвидев знак доллара (а не двойную спираль) в вашей ДНК, ряд компаний обходят больницы и врачебные кабинеты, предлагая генетическое тестирование напрямую потребителю через Интернет. Доступно более 1300 различных генетических тестов, в том числе скриниг около 100 генов, связанных с болезнями сердца. Некоторые компании заявляют, что их тест-киты (комплекты для тестирования) могут предсказывать риск заболевания и направлять потребителя к персонализированной медицине, в том числе продуктам питания, витаминам, препаратам, подходящим для конкретного генетического профиля. Но, покупатель, остерегайся!Мы уже обозначили научные ограничения, присущие этим тестам. Но с этими тестами есть и другие, не менее важные проблемы, включая их регламентирование и интерпретацию. Но кто регулирует генетическое тестирование и решает, является ли тест точным и когда он будет готов для широкого использования? Никто! Компании могут свободно заявлять свои претензии безо всякого надзора. В то время как некоторые генетические тесты валидализированы (утверждены), как, например, на муковисцидоз, другие, в том числе те перспективные оценки риска ишемической болезни сердца и диабета, еще не могут стать частью рутинной клинической помощи. Более того, пациенты и даже врачи часто не понимают результатов этих тестов, а ученые до сих пор спорят о лучших способах их выполнения и о том, что означают их результаты. Этот «удобный случай» не стоит 1000 долларов. В будущем хорошо продуманные и тщательно валидализированные – и более дешевые – генетические тесты, безусловно, помогут нам оценивать и лечить сердечно-сосудистые заболевания. Но пока мы рекомендуем, чтобы большинство людей тратило деньги на что-то другое.
На сегодняшний день выявлено более 900 различных мутаций тринадцати различных генов у людей с этим заболеванием. В то время как все пациенты «кажутся» похожими с точки зрения клиники, ведь они имеют классические результаты ЭхоКГ, они часто разные с точки зрения генетики. Каждая семья с наследственной гипертрофической кардиомиопатией, как правило, имеет собственные уникальные, вызывающие болезнь мутации; генетики называют их «частными мутациями». На данный момент мы охарактеризовали около двух третей мутаций, вызывающих гипертрофическую кардиомиопатию. За десяток лет мы, вероятно, достигнем 90 % и более.
Поэтому генетическая основа относительно простого генетического заболевания, которое передается от родителей к ребенку 50 % времени, на самом деле весьма сложна. Но мы все-таки можем использовать основанный на генетике целевой скрининг, чтобы помочь людям с гипертрофической кардиомиопатией и их семьям.
Генетическое обследование начинается с определения первого человека в семье, у которого имеется заболевание; этот человек называется пробанд. Этот человек должен пройти генетическое тестирование, чтобы определить конкретную мутацию, которая вызывает болезнь. В случае гипертрофической кардиомиопатии врачи могут идентифицировать вызывающие заболевание мутации в 65 % случаев. Если это удалось, проверяют всех родственников первой степени (братьев, сестер, детей, родителей), чтобы определить, являются ли они носителями дефектного гена. Эта информация клинически полезная. Членов семьи, у которых нет такого гена, заверяют, что у них, скорее всего, эта болезнь не будет развиваться. Однако тех, у кого нашли ген гипертрофической кардиомиопатии, можно контролировать и лечить, помогая им избежать серьезных осложнений.
Аналогичное генетическое тестирование рекомендуется для семей, которые страдают синдромом Марфана, синдромом удлиненного интервала QT, синдромом Бругада и аритмогенной кардиомиопатией правого желудочка. Учитывая, что первым симптомом каждого из этих заболеваний может быть внезапная смерть, очевидно, важно обеспечить их диагностику до проявления этого симптома. Синдром удлиненного интервала QT особенно известен, так как с ним связывают синдром внезапной младенческой смерти. В будущем возможность скрининга этой болезни избавит родителей от боли потери ребенка. В целом эти проблемы с сердцем встречаются относительно редко, от 1 на 1000 до 1 на 5000 человек, так что генетический скрининг рекомендуется, только если у вас есть член семьи с этим заболеванием. Тем не менее мы считаем, что тесты на сердечные заболевания, которые вызывают внезапную сердечную смерть, вероятно, в будущем станут рутинной процедурой.
Генетическое тестирование: проблема с ишемической болезнью сердца
Пока мы делали акцент на горсточке сравнительно редких сердечных проблем, на которые сильно влияют гены. Они представляют собой скорее исключение, чем правило. Большинство распространенных заболеваний, таких как ишемическая болезнь сердца, сахарный диабет и гипертония, являются гораздо более сложными, на них оказывают влияние несколько генов и множество экологических факторов. Несмотря на эти сложности, ученые без устали проводят исследования роли генетики у нашего основного убийцы – ишемической болезни сердца.
Мы знаем, что не найдем какого-то одного гена, который вызывает коронарную болезнь сердца. Десятки генетических сайтов связаны с ишемической болезнью сердца, почти сто генетических изменений связаны только с уровнем холестерина ЛПНП. И эти цифры растут по мере продолжения исследований.
Признавая, что на ишемическую болезнь сердца оказывают влияние разнообразие генов, некоторые ученые сгруппировали их вместе, тестируя предсказательную силу мультигенетических профилей. В рамках исследований генома женского здоровья ученые изучили 101 генетический маркер у 19 тысяч женщин и оценивали здоровье их сердечно-сосудистой системы в течение двенадцатилетнего периода. Авторы обнаружили, что стандартные факторы риска: пожилой возраст, курение, высокое кровяное давление, диабет, уровень холестерина и семейный анамнез – решительно предсказывали развитие сердечно-сосудистых заболеваний, а генетические маркеры ишемической болезни сердца не внесли ничего нового. Авторы пришли к выводу, что гены сами по себе редко являются причиной сердечных заболеваний.
Основная цель генетического тестирования – или любой прогностической модели риска, если уж на то пошло, – это выявить людей с риском заболевания и дать им возможность принять меры для улучшения их здоровья в будущем. В случае ишемической болезни сердца идея состоит в том, чтобы адаптировать профилактику, образ жизни и медикаментозное лечение к индивидуальной биологии человека, в том числе и к генетической структуре. Возможно, понимание человеком, что гены обусловливают ему вероятность инфаркта выше средней, будет способствовать улучшению его рациона питания, усиленным занятиям физкультурой, отказу от курения. Мы, конечно, делаем такие рекомендации независимо от генов человека. Но есть надежда, что генетическая информация дополнительно подтолкнет его к здоровому образу жизни.
У других врачей иной подход к применению генетических тестов у больных с ишемической болезнью сердца. Одна идея связана с использованием генетической информации для выяснения причины боли в груди, возникает ли она от сердца и заслуживает ли дальнейшего детального обследования сердца. Сегодня многие люди с болью в груди проходят инвазивную катетеризацию сердца, чтобы определить, является ли боль результатом развития ишемической болезни сердца, и у 30 % из них обнаруживаются нормальные артерии. Что, если бы мы могли воспользоваться генетическим профилем человека, чтобы определить, нужна ли катетеризация сердца? Прямо сейчас генетического тестирования недостаточно, чтобы исключить сердечную причину болей в груди. Но более продвинутые генетические тесты в конечном счете смогут помочь нам решить, кто должен, а кто не должен подвергаться сердечной катетеризации.
Было бы непростительно, если бы мы не упомянули о семейной гиперхолестеринемии, генетическом заболевании, которое поражает 1 из 500 человек и существенно увеличивает риск развития сердечных заболеваний. У людей с этим состоянием есть мутации в гене, кодирующем поверхностные клеточные рецепторы к холестерину ЛПНП. Обычно такой рецептор помогает удалить холестерин ЛПНП из крови. У пациентов с семейной гиперхолестеринемией поврежденные рецепторы не могут удалять ЛПНП из крови, что приводит к высокому уровню циркулирующего ЛПНП, вызывая развитие сердечно-сосудистых заболеваний в молодом возрасте. Если болезнь вовремя не диагностировать и не лечить, люди с гетерозиготной (одна копия аномального гена) семейной гиперхолестеринемией будут страдать от преждевременной ишемической болезни сердца, и у 60 % мужчин и 30 % женщин ишемическая болезнь сердца разовьется к 60 годам. Один из каждого миллиона человек имеет две копии аномального гена (гомозиготная семейная гиперхолестеринемия (СГ), в результате чего у него бывает чрезвычайно высокий уровень холестерина, который нередко превышает 1000 мг/дл. У большинства людей с гомозиготной СГ происходят инфаркты в возрасте до 30 лет, а иногда и в детском или подростковом возрасте.
Мы знаем, что в большинстве случаев семейная гиперхолестеринемия обусловлена генетической мутацией в 19-й хромосоме, и у нас есть возможность обнаружить такую мутацию. Поэтому мы имеем очень хорошо охарактеризованное состояние, понимание его генетической основы; в этом случае, кажется, есть необходимость в генетическом тестировании, чтобы подтвердить диагноз и назначить соответствующее лечение этого заболевания (статины). Звучит как идеальная ситуация для генетического тестирования – за исключением одного факта: для диагностики этого расстройства нам вовсе не нужно генетическое тестирование. Если у человека уровень холестерина ЛПНП превышает 220, можно предположить, что у него семейная гиперхолестеринемия, и лечить человека статинами, диетой, а также использовать другие стратегии для снижения уровня холестерина в крови. Мы также скринируем членов семьи, изучая их анамнезы и измеряя их уровни холестерина в крови. Это генетическое заболевание, но только потому, что у нас есть сложный и дорогой тест, не значит, что мы им должны воспользоваться. Во многих случаях старая добрая медицина – медицинский анамнез, осмотр и обычные анализы крови – предоставляет всю необходимую нам информацию.
Заболевания клапанов сердца: ЭхоКГ, не генетическое тестирование
Какова роль генов у 300 тысяч человек, которым ежегодно делают операцию на сердечных клапанах? Гены человека действительно влияют на развитие заболевания клапанов сердца, но на данный момент мы не рекомендуем делать генетический скрининг этого состояния.
Пролапс митрального клапана является наиболее распространенной патологией клапанов сердца, поражающей 2–3 % населения. Хотя семейные формы действительно существуют, в большинстве случаев это заболевание не передается по наследству. Аналогичным образом проблемы с аортальным клапаном не имеют столь мощной генетической основы. Тем не менее есть одно исключение. Один процент людей рождается с двустворчатым аортальным клапаном, то есть в таком сердечном клапане имеется две створки, а не три. Двустворчатый аортальный клапан, который идентифицируется на ЭхоКГ, со временем становится суженным (стенозированным) или протекающим в обратном направлении (регургитирующи). Примерно в 10 % случаев патология этого клапана встречается в семьях. Если член семьи имеет заболевание аортального клапана, вызываемое двустворчатым клапаном, мы рекомендуем семейный скрининг – но с помощью ЭхоКГ, а не генетического теста.
ГЕНЫ И КОВБОЙ МАЛЬБОРОКурение у вас в генах? Это интригующая концепция. Если определенные гены заставляют людей курить, возможно, мы сможем разработать способ изменить воздействие генов и помочь людям бросить курить. Подобно сердечным заболеваниям, курение имеет тенденцию встречаться в семьях. Когда курят родители, существует 50%ная вероятность того, что и у детей будет эта привычка. Но насколько виноваты в этом гены по сравнению с окружением?Исследования более чем 100 тысяч человек показали, что несколько областей 15-й хромосомы по соседству с геном, ответственным за рецепторы к никотину, воздействуют на привычку курения. Но это воздействие будет незначительным. Наименее благоприятный генетический профиль в этой области увеличивает потребление человеком табака только на одну сигарету в день. Ученые считают, что через годы лучшее использование генетической информации курильщиками будет при выборе программы прекращения курения. Но мы все еще далеки от полной характеристики роли генов в привычке к курению.
Как ваши гены будут руководить вашим выбором лекарственных средств
В дополнение к идентификации людей, больных или рискующих заболеть, генетическое тестирование когда-нибудь будет использоваться для выбора медикаментозной терапии, говоря нам, какие пациенты с большей вероятностью будут реагировать на определенные лекарства. Эта концепция уже на пути к использованию в медицинской практике. Ученые показали, что генетический профиль человека помогает предсказать ответ на антикоагулянт варфарин и риск развития редкого, но серьезного повреждения мышц от терапии статинами. Генетическое тестирование перед применением этих препаратов может стать обычным явлением в будущем, частично в зависимости от результата теперешнего спорного теста, касающегося генетического тестирования на восприимчивость к клопидогрелю.
Клопидогрель – это лекарство, которое снижает свертываемость крови, ингибируя функции тромбоцитов. Он широко используется у пациентов с сердечно-сосудистыми заболеваниями и особенно важен, когда дело доходит до предотвращения образования сгустков крови у пациентов, которым поставили кардиостенты. Нам уже давно известно, что клопидогрель не работает, пока не превращается в активный метаболит под воздействием ферментов печени. Оказывается, разные люди имеют различные уровни функции этих ферментов печени, и эта особенность обусловлена генетически.
30 % людей имеют одну копию гена, который замедляет у них метаболизм клопидогреля. Кроме того, 2 % людей имеют две копии этого гена, и метаболизм у них еще медленнее. В результате препарат менее эффективен в ингибировании функции тромбоцитов. Некоторые, но не все, обсервационные исследования показывают, что у таких людей клинический результат хуже – у них больше инфарктов, инсультов и смертей. Этот повышенный риск оказывается самым высоким у тех, кто подвергается катетеризации сердца и имплантации стента, особенно при инфаркте.
На основании этих предварительных наблюдений выпущено «предостережение в черной рамке» о пониженной эффективности клопидогреля у людей с низким метаболизмом из-за этих двух копий гена. Некоторые врачи стали рекомендовать генетическое тестирование перед тем, как прописать это лекарство, и оно стало нормой в некоторых крупных медицинских центрах. Хотя мы считаем, что этот подход может быть полезным в будущем, сегодня он представляется преждевременным. Помните, генетическое тестирование – как и любое медицинское тестирование – подходит, только если результаты теста повлияют на терапию и исход болезни. В настоящее время мы пока не определили изменения в терапии, которые представляли бы собой правильный ответ на положительный тест медленного метаболизирования клопидогреля.
Генетическое тестирование: путь в будущее
На арене сердечно-сосудистых заболеваний генетическое тестирование в настоящее время играет большую роль в здоровье немногих и небольшую – в здоровье многих. С продолжением исследований и новыми открытиями это изменится. В случае редких, но серьезных заболеваний, таких как гипертрофическая кардиомиопатия, аритмии и синдромы, связанные с внезапной смертью, широко распространенный и недорогой скрининг даст возможность их раннего выявления и спасет жизни. В случае более распространенных заболеваний, таких как ишемическая болезнь сердца, генетический профиль, вероятно, внесет свой вклад в более широкий профиль риска, но не будет полностью определять риск. Когда условия окажутся определены, генетическая структура будет руководить выбором терапии, обеспечивая персональный медицинский подход, который годится пациенту как хорошо сшитый костюм.
Генетическое тестирование поднимает три ключевых вопроса, на которые врачи и пациенты должны ответить, пока исследователи решают научные вопросы: кого нужно тестировать? Какой совет даст генетический тест? Кто будет иметь доступ к этой информации? Ответы на эти вопросы должны быть оговорены в хорошо продуманных, основанных на фактических данных законодательных актах. Правительство уже оказало некоторую помощь, приняв в 2006 г. Закон о запрете генетической дискриминации, который запрещает страховым компаниям и работодателям дискриминацию, основанную на информации, полученной в результате генетического тестирования. Это важный первый шаг. Широко распространенное генетическое тестирование на обычные заболевания не нужно проводить, пока в нашем распоряжении есть и наука для проведения тестов, и мудрость, чтобы ответить на эти вопросы.
Большой брат следит за вами: мониторинг вашего сердца
Ожидая впечатляющих успехов в прогнозировании и лечении сердечных заболеваний, мы также предвидим огромные улучшения в методах, которые используем для мониторинга людей с заболеваниями сердца, что позволяет провести профилактическую терапию до того, как возникнет проблема. Представьте себе iPhone в сочетании с манжетой для измерения кровяного давления, автоматически посылающий данные о кровяном давлении вашему врачу в режиме реального времени из вашего дома. По мере того как интегрируемся в различные технологии, мы сможем диагностировать проблемы раньше и реагировать быстрее, вылечивая их до того, как они вызовут необратимые повреждения или потребуют госпитализации.
Электронный мониторинг: во главе кардиостимуляторы и дефибрилляторы
Конвергенция медицинских и информационных технологий прогрессирует самыми быстрыми темпами с разработкой новых кардиостимуляторов и внутренних дефибрилляторов. Начиная с 1970-х гг. пациенты могли передавать информацию со своих кардиостимуляторов по телефонным линиям. Первоначально передаваемая информация была ограничена, но современные кардиостимуляторы хранят мегабайты диагностических данных как о сердечном ритме пациента, так и о функции самого устройства. Эта информация легко передается по телефонной линии через Интернет, что позволяет своевременно выявлять нарушения сердечного ритма и сбои в работе устройства.
Возможности внутренних дефибрилляторов даже более впечатляющи, чем возможности кардиостимуляторов. Многие современные дефибрилляторы автоматически передают ежедневную порцию данных с помощью беспроводной передачи. Если ежедневная передача сигнализирует либо о ненормальном сердечном ритме, либо о поломке устройства, пациент может получить тревожный, но, возможно, спасительный телефонный звонок. В одном клиническом исследовании такого рода ежедневный мониторинг сокращал число врачебных визитов и койкодней в стационаре. Если вы или член вашей семьи имеете дефибриллятор или кардиостимулятор, расспросите о такого рода мониторинге.
ДЕФИБРИЛЛЯТОРЫ СТАНОВЯТСЯ БЕСПРОВОДНЫМИКогда пациентам с сердечной недостаточностью ставят внутренний дефибриллятор, они получают генератор, размером чуть больше старинного серебряного доллара и с проводами, которые проходят через кровеносные сосуды от генератора внутрь сердца. Эти провода и являются ахиллесовой пятой устройства. Размещение их может вызывать осложнения, в том числе повреждение сердца, кровеносных сосудов и легких. Кроме того, выводы могут разрушаться – одна из наиболее распространенных причин отзыва этих кардиоустройств. Почему бы не устранить эти проволочные выводы?Признавая необходимость создания беспроводного дефибриллятора, ученые создали внутренний дефибриллятор, который отслеживает и корректирует сердечный ритм без размещения проводов в сердце. Система беспроводного дефибриллятора состоит всего из двух компонентов, которые вживляются под кожу. Имплантат не требует рентгеновской ориентации для размещения (никакого облучения), и нужно всего лишь 30 минут, чтобы его установить. Эта процедура проста, дешева и менее инвазивна, а также дает отличные результаты. Данные исследования, опубликованные в «Медицинском журнале Новой Англии», говорят, что новый беспроводной дефибриллятор корректирует серьезную сердечную аритмию в 98 % случаев. Подобно домашнему компьютеру и его подключению к Интернету, будущие дефибрилляторы и кардиостимуляторы станут использовать удобство беспроводных технологий.
Использование информационных технологий для помощи пациенту с сердечной недостаточностью
Врачи особенно заинтересованы в использовании информационных технологий для улучшения лечения пациентов с сердечной недостаточностью. Лечение таких пациентов является сложной задачей, так как на первый взгляд они выглядят здоровыми, но, возможно, балансируют на грани вызова скорой. Одной чашки куриной лапши с ее тяжелой солевой нагрузкой может быть достаточно, чтобы нарушить у пациента жидкостный баланс и отправить в больницу. В Соединенных Штатах сердечная недостаточность служит причиной более миллиона госпитализаций в год. В ходе этих визитов пациента «отрегулируют» – скорректируют прием лекарств, а лишнюю жидкость, которая собирается в легких, вызывая одышку, и в лодыжках, вызывая отек, удалят. К сожалению, эта регулировка не постоянна – одного из четырех пациентов снова госпитализируют в течение двенадцати недель.
Как врачи, так и коммерческие фирмы предполагают, что мы могли бы снизить госпитализацию пациентов с сердечной недостаточностью с помощью более частой оценки их состояния в домашних условиях. Вместо их осмотра через каждые несколько недель в кабинете врача мы могли бы собирать ежедневную информацию и сразу же вмешиваться, когда это необходимо. Признавая потенциальные выгоды информации и раннего вмешательства, предприниматели и производители медицинского оборудования разработали разнообразные технологии домашнего мониторинга, названные системами телемониторинга.
Технология телемониторинга позволяет ежедневно (а в некоторых случаях два раза в день) электронным способом передавать данные из дома пациента. Данные включают вес, частоту сердечных сокращений, артериальное давление, насыщение крови кислородом и наличие симптомов. В большинстве случаев любое значение вне ус тановленного диапазона ведет к уведомлению врача или сестры, которые контактируют с пациентом, чтобы отрегулировать терапию и попытаться избежать госпитализации. Например, прибавка в весе на 1 килограмм в течение двух дней, что может быть ранним признаком перегрузки жидкостью и надвигающейся одышки, будет оповещать о необходимости визита к больному медсестры или врача, который посоветует ограничить жидкость и отказаться от соли и, возможно, увеличит пациенту дозу мочегонного. И это все без посещения кабинета врача.
Несколько клинических исследований показывают, что домашний мониторинг сердечной недостаточности у пациентов снижает число госпитализаций, визитов в отделение неотложной помощи, беспокойство пациентов и даже смертность, а также улучшает качество их жизни. Однако эти предполагаемые преимущества противоречивы. Последние опубликованные рандомизированные контролируемые исследования, в которых половина больных подвергалась телемониторингу, а половина – обычному уходу, не показали никаких преимуществ телемониторинга. Сторонники телемониторинга указывают, что исследование имело недостатки, в том числе автоматизированную, голосовую систему для контакта с пациентом, а не прямой контакт с медсестрой или врачом и существенный износ, 45 % пациентов с телемониторингом не могли пользоваться системой после шести месяцев.
Наше мнение заключается в том, что такого рода телемониторинг – ограниченная оценка симптомов, веса и жизненно важных показателей без прямого контакта с лицом, осуществляющим уход, – может быть недостаточно у большинства пациентов с сердечной недостаточностью. Но это не означает, что такая идея бесполезна. Скорее мы должны использовать эффект рычага в технологии, чтобы получить другую, более содержательную информацию, которую действительно можем использовать для улучшения лечения кардиопациентов. Именно так мониторинг пациента с сердечной недостаточностью становится поистине высокотехнологичным.
Ученые создали небольшой датчик, который можно разместить внутри сердца пациента, для сбора и передачи физиологических данных, которые отражают баланс жидкости пациента. В недавнем исследовании пациентов с сердечной недостаточностью этот датчик размером с бумажную скрепку был имплантирован в легочную артерию, где увеличение давления является очень ранним признаком перегрузки жидкостью у пациентов с сердечной недостаточностью.
Эти изменения происходят раньше, чем появляются такие симптомы, как увеличение веса, одышка или отечность лодыжек. С помощью беспроводной технологии датчик передает давление в легочной артерии в защищенную базу данных, куда имеют доступ врачи и медсестры, которые и принимают при необходимости упреждающие меры. Исследователи снизили госпитализацию из-за сердечной недостаточности на одну треть в течение года. Старший исследователь в этом проекте отметил, что это одно из «первых значительных улучшений в лечении сердечной недостаточности почти за десятилетие». Мы согласны с тем, что результаты многообещающие, но требуют осторожного подхода. Нам нужны дополнительные исследования, чтобы точно определить, какие пациенты могут получить выгоду от устройства такого типа.
С беспроводным мониторингом, который может обеспечивать физиологические данные в реальном времени, мы готовы войти в новую эру в лечении пациентов с заболеваниями сердца. Эти датчики – шаг вперед в кардиомониторинге, вызывают аналогии с бензобаком, когда загорающаяся на приборной панели автомобиля лампочка говорит вам, когда бак пустой. Подобно контролю содержания глюкозы в крови у диабетиков, когда пациент может получить данные (показатели сахара в крови) и соответственно скорректировать лечение (дозу инсулина), скоро у нас появится возможность следить за сердцем человека.
У НАС ДЛЯ ЭТОГО ЕСТЬ ПРИЛОЖЕНИЕПациенты – не единственные, кто скоро будет эксплуатировать высокотехнологичные устройства мониторинга на ежедневной основе. Врачи и медсестры также готовы добавить их в свою повседневную деятельность. Больницы могут теперь загрузить программное обеспечение, которое обеспечивает передачу в режиме реального времени данные госпитализированных пациентов на дисплее реанимационного отделения на iPhone, iPod Touch и iPad. Такая система облегчает общение между членами медицинской команды пациента, гарантируя, что все они имеют самые последние данные, когда принимают ключевые решения.Когда врач получает в 2:00 ночи звонок о госпитализированном пациенте, которому стало хуже, он может использовать это приложение для доступа к данным пациента. Такое приложение затем может быть использовано для проведения конференции по лечению пациента одновременно с несколькими ухаживающими за больным специалистами, которые не могут добраться до постели больного; эта функция должна повысить эффективность принятия решений на командной основе, особенно в сельских районах, где есть недостаток в специалистах. Компания, которая спроектировала это приложение (AppPoint, от фирмы Airstrip Technologies), утверждает, что такая платформа поддерживает многозадачность и текущие реалии, с которыми сталкиваются врачи и медсестры. Она также может оказаться неоценимым помощником для улучшения ухода за госпитализированными пациентами. И это круто.
Достижения кардиологии: восстанавливаем кровообращение – и домой к полудню
Когда в 1950-х гг. была разработана операция на открытом сердце, она воспринималась как чудо медицины. Мысль о том, что хирург может остановить человеческое сердце, «починить» его, а затем заставить «отремонтированное» сердце забиться, снова бросала вызов всем ожиданиям. Возможно, нет проблемы с сердцем, которую мы не могли бы исправить.
В течение нескольких десятилетий более миллиона людей ежегодно подвергались кардиохирургии. Результаты были отличные, 99 % пациентов выживали после стандартных операций, а большинство вернулось к нормальной жизни в течение нескольких недель. Хирургические методы продолжали усовершенствоваться, возникали минимально инвазивные и даже робототехнические подходы к проблемам восстановления сердца.
Кардиохирурги и их команды спасали жизнь миллионам больных. Но сегодня рамки кардиохирургии очень быстро раздвигаются в результате достижений интервенционной кардиологии. Инновационные кардиологи и инженеры разработали разнообразные нехирургические методы решения структурных проблем с сердцем. В большинстве случаев эти процедуры зависят от доступа к сердцу через кровеносные сосуды организма с помощью катетеров, полых трубок, через которые можно доставлять и манипулировать инструментами и устройствами. Возможность работы внутри бьющегося сердца через катетер, введенный через небольшой разрез на руке или ноге, революционизирует наш подход к разнообразным сердечным проблемам.
Наиболее известные процедуры интервенционной кардиологии – ангиопластика с имплантацией стента у пациентов с закупоренной бляшками артериями. В то время как шунтирование перенаправляет поток крови вокруг препятствующих бляшек, ангиопластика со стентированием предполагает работу изнутри артерии. Оба метода эффективны, но сегодня ангиопластика со стентированием – наиболее широко используемое хирургическое вмешательство у пациентов с ишемической болезнью сердца. В 2006 г. насчитывалось около 1,1 миллиона процедур ангиопластики, выполненных в Соединенных Штатах, по сравнению с только 250 тысячами операций шунтирования. Хотя последние данные подтверждают более длительную продолжительность жизни после операции у определенных групп пациентов, основанную на использовании катетера, менее инвазивные подходы являются выбором номер один у пациентов для лечения ишемической болезни сердца.
БИОРАССАСЫВАЮЩИЕСЯ (РАСТВОРИМЫЕ) СТЕНТЫКогда пациент получает один из наших последних стентов коронарной артерии с лекарственным покрытием, он должен принимать кроверазжижающие препараты год или более для предотвращения образования тромбов, образующихся в металлическом стенте. Что, если бы у нас был стент, который растворялся после того, как сделал свое дело? Это может устранить необходимость приема клопидогреля и других лекарственных средств. Кроме того, с современными постоянными металлическими стентами долгосрочная работа кровеносных сосудов явно ненормальна; некоторые считают вполне вероятным, что артерии будут функционировать более нормально в долгосрочной перспективе, если их станут лечить растворимыми или биорассасывающими стентами. Такие стенты, сконструированные из биоразлагаемых полимеров, сейчас находятся в процессе испытаний. Предварительные результаты выглядят обнадеживающими, хотя большинство экспертов предсказывают, что эти стенты полностью не заменят металлические.
Мы также разработали нехирургические методы восстановления поврежденных сердечных клапанов. За последние пять лет кардиологи и пациенты с дефектами сердечных клапанов взволнованы достижениями в чрескожной или нехирургической замене аортального клапана. Традиционный подход к большинству проблем аортального клапана состоит в том, чтобы вскрыть грудину, удалить старый клапан и вшить новый. В 1990-х гг. исследователи заключили, что возможно разработать искусственный сердечный клапан, который складывается, как зонтик; этот клапан можно затем протолкнуть в сердце через катетер под рентгеновским контролем и открыть внутри поврежденного родного клапана. Если новый клапан открыть с достаточной силой, он бы не только оставался на одном месте в сердце, но и разрушил бы больной клапан пациента. Некоторые хирурги ответили на эту концепцию такими словами: «Удачи вам. Это не сработает».
Но сработало. Более 30 тысяч европейцев получили новые аортальные клапаны, поставленные с помощью такой процедуры. В последнем испытании в Северной Америке пациенты, состояние которых не позволяло провести обычную операцию, были рандомизированы либо на получение медикаментозного лечения, либо нового клапана нехирургическим путем. Результаты были потрясающими: вероятность того, что те, кто получили клапан нехирургическим путем, будут живы через год после лечения, оказались на 20 % больше по сравнению с пациентами, которые получали только медикаментозную терапию.
Чрескожная методика введения аортального клапана еще не совершенна. Риск инсульта в течение тридцати дней после процедуры – около 5 %, а во многих случаях возникает утечка вокруг клапана. Кроме того, мы не знаем, как долго эти клапаны проработают. В результате эпоха хирургического лечения аортального клапана, при которой, как нам известно, клапаны могут проработать двадцать лет или больше, все еще не закончилась. Однако в течение нескольких лет возможность отказаться от операции, но получить лечение аортального клапана будет клинической реальностью. Между тем нехирургический аортальный клапан уже стал благом для Дорис Шнайдер, которая получила его в возрасте 101 года и отпраздновала свой 102-й день рождения вскоре после этого. Ее следующий шаг – распланировать 103-й день рождения.
Методология развивается немного медленнее, когда дело доходит до восстановления митрального клапана без хирургического вмешательства. Причиной этого отставания является то, что хирурги, как правило, восстанавливают, а не заменяют митральный клапан. Восстановление клапана гораздо сложнее, чем его замена, требуются различные хирургические маневры, а в настоящее время невозможно повторить все эти хирургические действия с помощью катетеров. Но в некоторых случаях скобки в форме бельевой прищепки, которая удерживает две части «протекающего» митрального клапана вместе, улучшая функцию клапана, бывает достаточно, чтобы люди почувствовали себя лучше. Элизабет Тейлор избежала инвазивной операции на сердце, предпочтя такую экспериментальную процедуру.
Давайте закончим наше обсуждение новых «восстановительных» технологий и вернемся к началу кардиохирургии. Многие из первых операций на открытом сердце были выполнены у детей, чтобы закрыть врожденные отверстия в сердце.
Большинство из этих отверстий являются дефектами межжелудочковой перегородки, из-за которых происходит ненадлежащее смешивание обогащенной кислородом и деоксигенированной крови между левым и правым сердечными желудочками, повышая нагрузку на сердце. Сегодня мы можем закрыть эти отверстия без хирургического вмешательства, используя катетеры для закрытия этого отверстия с помощью устройств, похожих на открывающиеся зонтики. Данная технология означает, что многие дети (и некоторые взрослые с поздним диагнозом проблемы) могут пройти простую с низким уровнем риска процедуру восстановления отверстия в сердце и вернуться домой на следующий день.
Восстановление кровообращения Versus профилактика
По мере продолжения марша технологий элегантные эффективные, менее инвазивные процедуры позволят резко сократить необходимость в операциях на открытом сердце и других «больших» кардиопроцедур. Во многих случаях мы в ближайшее время сможем «починить» ваше разбитое сердце утром и отправить вас домой в полдень. Но даже эти подходы будут иметь риски и ограничения. А в случае ишемической болезни сердца профилактика всегда предпочтительнее наших лучших стентов или операций. Лучшая медицинская процедура – это та, которая вам не нужна.
Назад: Глава 19 Болезни сердца у детей: профилактика начинается сейчас!
Дальше: Эпилог Лишаем кардиологов работы

