Глава 7
Подсчет рисков
Весной 2014 года, спустя примерно год после моей первой встречи в Давосе, я ощутила первые признаки того, что скоро оформилось в международную кампанию по определению будущего технологии CRISPR.
Прошло меньше двух лет с момента публикации нашей статьи в Science, в которой описывалось, каким образом CRISPR можно применять для редактирования генов, однако весть о появлении этой технологии уже распространилась по всему научному сообществу и даже вышла за его пределы. Всеобщий энтузиазм по поводу CRISPR постоянно усиливался благодаря появлению в СМИ все новых оптимистических публикаций, посвященных исследованиям по редактированию генома. Но по мере того как эти исследования набирали ход, а число их все увеличивалось, многие ученые старались сосредоточиться на лабораторной работе – заниматься совершенствованием методов редактирования генома и находить этим методам новые применения – и не оказаться вовлеченными в общественное обсуждение проблемы.
Подобно этим моим коллегам я продолжала исследовать и развивать CRISPR в своей лаборатории в Беркли, уделяя все больше времени тому, чтобы лучше разобраться в проблемах, связанных с терапевтическим редактированием генома человека. Подобная же работа шла в бесчисленных научных лабораториях и начиналась в нескольких биотехнологических стартапах. Было здорово ощущать себя частью масштабной коллективной попытки раскрыть механизмы работы технологии CRISPR и высвободить ее огромный потенциал управления генетической информацией внутри клеток. Большую часть времени я ощущала огромный энтузиазм в отношении CRISPR и надежду, что наши старания дадут начало полезным разработкам в самых различных сферах деятельности – от сельского хозяйства до медицины. Однако порой я вдруг обнаруживала, что лежу без сна среди ночи и размышляю, что случится, если люди за пределами академической науки тоже всерьез заинтересуются этой бурно развивающейся областью исследований – и не обязательно по благородным причинам.
Примерно в тот же период соавтор этой книги, Сэм Стернберг, в то время работавший над своей диссертацией под моим научным руководством, получил электронное письмо от некоей предпринимательницы – назовем ее Кристина. Кристина интересовалась, не захочет ли Сэм стать частью коллектива ее новой компании, имеющей какое-то отношение к CRISPR; она просила о встрече, чтобы ознакомить Сэма со своей бизнес-идеей.
На первый взгляд в этом приглашении Кристины не было ничего удивительного. Учитывая скорость, с которой развивалась и распространялась технология CRISPR, новые компании, разработки и лицензии, связанные с редактированием генома, появлялись едва ли не каждую неделю. Но, как скоро выяснил Сэм, бизнес Кристины отличался от остальных – и при этом сильно.
Сэм понятия не имел, чего ему ожидать, когда он встретился с Кристиной за обедом в дорогом мексиканском ресторане рядом с кампусом, и его явно застал врасплох предмет их разговора. Письмо Кристины было очень обтекаемым, но при личной встрече она открыто объяснила, каким образом хочет использовать технологию, которую Сэм помогал разработать.
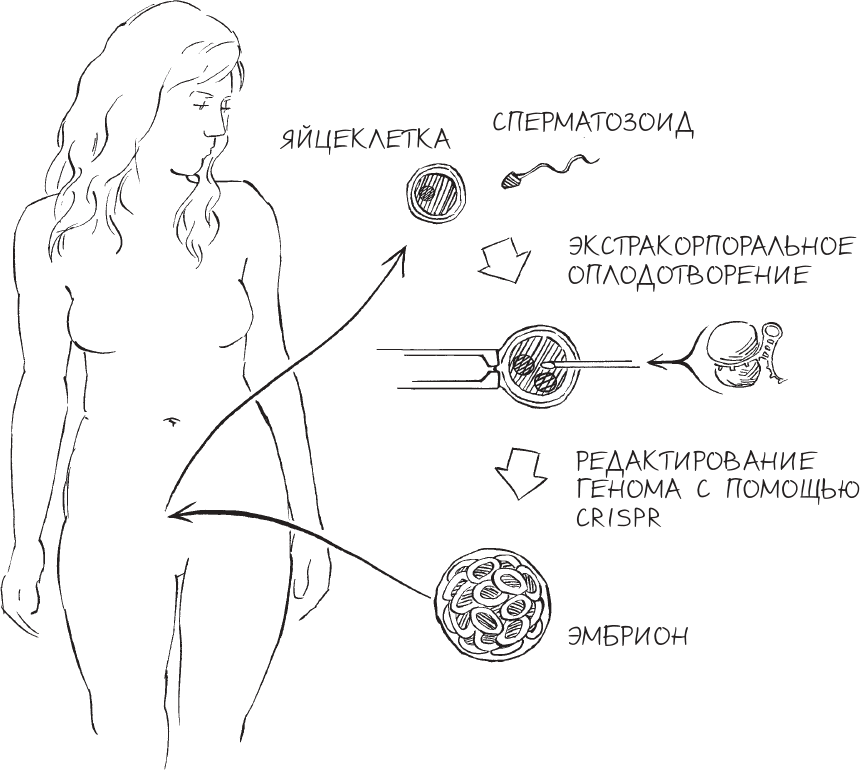
За коктейлями Кристина воодушевленно рассказывала Сэму, что надеется однажды предложить какой-нибудь счастливой паре первого здорового “CRISPR-младенца”. Этот младенец, объяснила она, будет получен в лаборатории методом экстракорпорального оплодотворения и будет иметь особые характеристики – кастомизированные мутации, внедренные в ДНК с помощью CRISPR, чтобы исключить любую возможность генетических заболеваний. Пытаясь рекрутировать Сэма в качестве исследователя, Кристина заверила его, что ее компания планирует внедрять генетические модификации в ДНК человеческих эмбрионов исключительно в профилактических целях; и если Сэм согласится с ней работать, он может быть уверен: ему придется иметь дело исключительно с такими мутациями, которые совершенно необходимы для гарантии стопроцентного здоровья еще не рожденного ребенка.
Кристине не надо было объяснять Сэму, как будет работать эта технология и насколько легко будет ей воспользоваться. Чтобы отредактировать геном человека таким образом, как предлагала Кристина, врачу было бы достаточно тех методов, которые на тот момент были уже хорошо известны: создание эмбриона in vitro из яйцеклеток и сперматозоидов будущих родителей, введение заранее запрограммированных молекул CRISPR для редактирования генома эмбриона и имплантация эмбриона с отредактированной ДНК в матку матери. Об остальном позаботится природа.
Еще до десерта Сэм извинился и сказал, что ему нужно идти; ему было довольно услышанного. Несмотря на заверения Кристины о “профилактическом характере” процедур, этот разговор смутил его. Сэм чувствовал, что Кристина была просто одержима мощью и возможностями CRISPR. Как он сказал мне позднее, он заметил в ее глазах “прометеев блеск” и заподозрил, что она размышляет не только о “хороших” правках ДНК с благой целью, но у нее в планах есть и другие, более смелые генетические улучшения.
Перспектива редактирования генома человеческих эмбрионов
Если бы этот разговор состоялся всего несколькими годами ранее, то мы с Сэмом отнеслись бы к предложению Кристины как к чистой фантазии. Да, генетически модифицированные человеческие существа хорошо смотрятся в научной фантастике и дают повод для бесконечных философских и этических дискуссий о возможности эволюции человека, направляемой им самим. Но до тех пор пока не появилось технической возможности управлять геномом Homo sapiens так же просто, как геномом лабораторной бактерии вроде E. coli, практически не было и шансов, что кто-то вдруг возьмется претворить в жизнь такие проекты в духе Франкенштейна.
Теперь же смеяться над подобными идеями не получалось. Ведь благодаря CRISPR манипулировать человеческим геномом действительно стало так же просто, как геномом бактерии. К примеру, всего за месяц до встречи Сэма с Кристиной родились первые обезьяны, чьи геномы были переписаны с использованием точного редактирования ДНК, – а отсюда уже рукой подать до эволюции Homo sapiens, направляемой CRISPR. В свете этого эксперимента на приматах и предшествовавших экспериментов на множестве других видов, ДНК которых была модифицирована с помощью CRISPR – от червей до коз, – включение человека в растущий список видов, представители которых когда-либо подвергались редактированию генома, стало казаться лишь вопросом времени.
Я хорошо осознавала существование такой возможности и имела по этому поводу самые дурные предчувствия. Хотя я не отрицала все положительные изменения, которые принесла в наш мир технология CRISPR, – возможность лучше понять генетику человека, производить больше пищи, притом за счет устойчивого развития, лечить жертв тяжелых генетических заболеваний, – меня все больше тревожили другие возможные применения CRISPR, которые почти наверняка можно претворить в жизнь. Выходит, наше открытие сделало редактирование генома слишком простым? Не слишком ли быстро ученые осваивали новые области знаний, не задумываясь, уместны ли их эксперименты и каковы будут последствия этих экспериментов? Есть ли вероятность злоупотребления CRISPR, особенно в том, что касается генома человека?
А особенно меня тревожило, что, быть может, ученые вскоре попытаются внести в человеческий геном наследуемые правки – не для того, чтобы вылечить заболевание у конкретного пациента, а с тем, чтобы исключить саму возможность болезни у еще не рожденного и даже не зачатого ребенка. В конце концов, именно в этой области Кристина предлагала поработать Сэму. И пусть Сэм не согласился, кто возьмется утверждать, что не согласится кто-нибудь другой?
Вероятность такого события угнетала меня. У человечества никогда раньше не было инструмента, подобного CRISPR, а у этой технологии есть потенциал перекроить не только геномы ныне живущих людей, но и геномы будущих поколений, создав общий палимпсест, с которого можно стереть и на котором можно написать заново любой фрагмент генетического кода в зависимости от нужд поколения, в котором выполняется редактирование. Более того, такие встречи, как встреча Сэма с Кристиной, еще больше убеждали меня, что не все разделяют мое беспокойство по поводу перспектив переписывания ДНК будущих поколений без полного понимания возможных последствий. Наверняка есть кто-нибудь, кто собирается воздействовать CRISPR на эмбрионы человека – возможно, ради устранения серповидноклеточной анемии в отдельно взятой семье, а возможно, и ради немедицинских улучшений, – и это вполне может изменить ход истории нашего вида в дальней перспективе, притом непредсказуемым образом.
Я начинала осознавать, что вопрос не в том, будут ли применены методы редактирования генома к ДНК клеток зародышевого пути человека, а в том, когда и как это произойдет. Также мне становилось очевидно, что, если я хочу повлиять на то, когда и как CRISPR используют для изменения генетики будущих людей, мне прежде всего необходимо четко понять, насколько более продвинутым по отношению к предыдущим достижениям науки будет редактирование генома клеток зародышевого пути. Какие вмешательства в зародышевую линию человека уже имели место и к каким последствиям они привели? Каковы были цели подобных вмешательств? И что мои предшественники – а конкретно светила науки прошлых поколений – имеют сказать по поводу манипуляций с ДНК зародышевого пути, вероятность которых так меня тревожила?
Не то чтобы споры по поводу модификации клеток зародышевого пути человека начались только с появлением CRISPR. Это далеко не так. Еще в те времена, когда появлялись первые намеки на редактирование генома, специалисты по репродуктивной медицине уже отбирали конкретные эмбрионы для внедрения их в матку пациентки – иными словами, решали, какие гены будут переданы следующим поколениям. И еще раньше практикующие специалисты и наблюдатели выражали тревогу по поводу того, что люди однажды могут стать основными авторами собственного набора генов.
Как только была доказана роль ДНК в кодировании генетической информации, исследователи начали рассматривать возможность рационального изменения генетического кода, хотя инструментов для таких манипуляций еще не существовало. Маршалл Ниренберг, один из биологов, расшифровавших в 1960-х годах генетический код (и удостоенный за это Нобелевской премии по физиологии и медицине), писал в 1967-м о том, что у человека
есть власть определять свою собственную генетическую судьбу. Эта власть может быть использована мудро или же легкомысленно, во благо человечества или во вред ему.
Уверенный в том, что подобная власть не должна находиться под контролем одних лишь ученых, Ниренберг продолжал:
Окончательные решения по поводу приложения этого знания должно принимать общество, и только хорошо информированное общество способно принимать эти решения осмысленно.
Не все ученые были склонны к такому самоограничению. Всего несколькими годами позже в статье для American Scientist Роберт Синсхаймер, в те годы профессор биофизики в Калтехе, описывал генетическую модификацию человека как
потенциально одну из наиболее важных концепций, появившихся за всю историю человечества… Впервые живое существо понимает свое происхождение и может направлять свое будущее.
Синсхаймер высмеивал критиков, считавших, что генная инженерия – это просто современная версия бесплодной мечты о совершенном человечестве:
Человек, и это абсолютно очевидно, – слишком несовершенное создание, полное изъянов. Учитывая ход его эволюции, вряд ли могло получиться иначе… А сейчас перед нами мелькает перспектива другого пути – шанс ослабить внутренние ограничения и непосредственно исправить изъяны собственного устройства, чтобы идти вперед к совершенству, далеко за пределы нашего сегодняшнего видения, этого примечательного продукта эволюции длиной в два миллиона лет.
В течение двадцати лет с момента публикации эссе Синсхаймера ученые стремительно наносили на карту путь к совершенству, который ему в конце 1960-х виделся лишь в самых общих чертах. К началу 1990-х уже начались испытания генной терапии на пациентах-людях, и, хотя было очевидно, что точные манипуляции ДНК клеток зародышевого пути человека пока недоступны – даже при наличии сравнительно продвинутой технологии, – исследователи все равно не переставали страстно мечтать о такой возможности. Френч Андерсон, проводивший эти первые клинические испытания, открыто высказался об опасностях и этических неоднозначностях генной терапии в целях улучшения человека независимо от места ее приложения – будь то соматические клетки или клетки зародышевого пути. Помимо всего прочего, он задался вопросом, все ли ученые способны ответственно обращаться с этой новой силой, или найдется исследователь, который
будет скорее подобен маленькому мальчику, которому нравится разбирать механизмы. Ему хватает ума разобрать часы и, вероятно, даже собрать их заново, так чтобы они тикали. Но что, если он попробует “усовершенствовать” их? Например, поставить стрелки покрупнее, чтобы проще было разглядеть, который час. Но если эти стрелки будут слишком тяжелы для механизма, то они будут двигаться слишком медленно, неравномерно или вовсе остановятся… Попытки этого мальчика внести улучшения в часы только навредят им.
Несмотря на предупреждения ведущих ученых, таких как Андерсон, идея изменения или улучшения человеческих генов продолжала притягивать некоторых биологов в последнем десятилетии XX века. Воодушевление этих женщин и мужчин поддерживалось текущими исследованиями и разработками в генной терапии, равно как и прорывными достижениями в трех больших областях: исследованиях репродуктивной функции, экспериментах на животных и генетике человека.
В то время любому ученому, мечтающему об “улучшении” генофонда человечества, не нужно было далеко ходить за вдохновением: источником этого вдохновения были успехи в лечении бесплодия. В 1978 году родилась Луиза Браун, первый “ребенок из пробирки”, и это стало важнейшей вехой в развитии репродуктивной биологии: было доказано, что размножение человека можно свести к простым лабораторным методикам – смешиванию очищенных яйцеклеток и сперматозоидов в чашке Петри, инкубации зиготы и получившегося из нее многоклеточного эмбриона и имплантации этого эмбриона в матку женщины. Экстракорпоральное оплодотворение (ЭКО) дало возможность людям с различными формами бесплодия иметь детей, биологически родственных им, и в то же время открыло путь для других манипуляций, которые когда-нибудь можно будет провести с эмбрионами на ранних стадиях развития, пока их выращивают в лабораторных условиях.
В конце концов, если человеческий организм можно создать в чашке Петри, в том же стерильном окружении, где были разработаны инструменты редактирования генома, казалось вполне правдоподобным, что две этих разработки когда-нибудь удастся совместить. Исследования способов лечения бесплодия помогли создать специфическую процедуру, которая впоследствии станет аргументом во всех дискуссиях о допустимости манипуляций с геномами клеток зародышевого пути человека.
Эксперименты на животных также воодушевляли ученых, считавших, что до редактирования генома клеток зародышевого пути человека рукой подать. В последние несколько десятилетий XX века исследователи разрабатывали все более замысловатые способы проектирования геномов животных – от клонирования до добавления генов с помощью вирусных векторов и самых первых вариантов прицельного редактирования ДНК. К 1990-м годам создание новых линий мышей, моделирующих заболевания человека, путем модификации клеток зародышевого пути стало вполне обычным делом. И, хотя ту же самую методику нельзя было применить к людям, она подготовила почву для таких инструментов, как ZFN и CRISPR, превративших изначально грубый метод редактирования генома клеток зародышевого пути у мышей в четкую, отточенную и хорошо оптимизированную методику, гораздо лучше подходящую для применения на людях.
В том же десятилетии мир стал свидетелем первого успешного клонирования млекопитающего: овечка Долли родилась в 1996 году и стала всемирной знаменитостью. Йэн Уилмут и его коллеги в Шотландии перенесли ядро (и всю содержащуюся в нем ДНК) соматической клетки, взятой у взрослой овцы, в яйцеклетку реципиента, собственное ядро из которой заранее извлекли, стимулировали гибридную клетку к делению и затем внедрили образовавшийся эмбрион в матку суррогатной матери; геном получившегося ягненка был точной копией генома донора.
ЭКО и клонирование были существенными прорывами, которые помогли заложить основу технологии модификации генома клеток зародышевого пути. Эти прорывы не только показали, что ученые способны создать жизнеспособный эмбрион в лаборатории, смешав яйцеклетки и сперматозоиды, но и продемонстрировали, что эмбрионы можно собрать с использованием генетической информации всего лишь одного животного. Это достижение заставило законодателей по всему миру зашевелиться и приступить к разработке законов, запрещающих репродуктивное клонирование человека. Но клонирование млекопитающих оказалось настолько сложным в техническом плане, что лишь очень немногие лаборатории в мире попробовали его осуществить. Таким образом, в отличие от CRISPR, технология переноса ядер соматических клеток успешно ограничивала собственное применение тем, что требовала высокой квалификации от ученых, которым предстояло проводить соответствующие манипуляции.
Наконец, энтузиазм по поводу внесения изменений в ДНК еще не родившегося человека был естественным следствием прорывов в генетике человека, в особенности секвенирования человеческого генома. Невероятный прогресс привел многих к мысли, что генетики скоро смогут найти причины заболеваний, ранее совершенно загадочных, а также генетическую подоплеку гораздо более широкого спектра фенотипических признаков человека, чем были известно ранее, – от чисто физических до когнитивных. Когда мы до конца поймем, какие генетические факторы определяют здоровье и возможности человека, мы сможем отбирать – или даже проектировать – эмбрионы с набором генов, отличным от родительского. Лучшим, чем родительский.
По крайней мере, на это надеялись некоторые ученые. А я, например, была настроена скептически по отношению к тому слепому оптимизму, свидетелем которого была в эпоху накануне появления CRISPR, – с бурными проявлениями восторга по поводу возможностей перестройки зародышевого пути, но без должного внимания к ее возможным последствиям. Действительно ли подобные манипуляции позволят без вреда для здоровья всем потомкам конкретного человека избавиться от генетического заболевания, или они могут дать побочные эффекты, которые мы не в состоянии предугадать? Даже эксперименты, которые могли бы дать ответы на эти вопросы, казались совершенно немыслимыми. И пусть изменение генома клеток зародышевого пути не будет иметь вредных последствий – смогут ли врачи и их пациенты ограничиться строго необходимыми медицинскими процедурами или захотят провести и необязательные модификации? Хотя в то время я не слишком обстоятельно размышляла над этими вопросами, они тем не менее возникали у меня всякий раз, когда речь заходила о клетках зародышевого пути.
В 1998-м растущее восхищение – или напряжение, в зависимости от того, по какую сторону баррикад вы находитесь, – по поводу модификации клеток зародышевого пути побудило двух ученых, Джона Кэмпбелла и Грегори Стока, организовать один из первых симпозиумов по этой теме в Калифорнийском университете в Лос-Анджелесе. Главным событием симпозиума, получившего название Engineering the Human Germline (“Проектирование человеческих клеток зародышевого пути”), стали доклады ученых, находившихся на переднем крае в этой области исследований, – в частности, Френча Андерсона, пионера генной терапии, Марио Капекки, одного из отцов ранних вариантов редактирования генов, и Джеймса Уотсона, сооткрывателя структуры ДНК. Я не участвовала в конференции – в то время мои исследования были сконцентрированы на том, каким образом миниатюрные молекулы РНК сворачиваются в сложные трехмерные структуры, – однако когда я, уже через несколько лет, слушала в записи и читала эти доклады, то убедилась, что не одну меня беспокоят эксперименты с геномами клеток зародышевого пути человека – и что в моем беспокойстве нет абсолютно ничего нового.
Участники конференции в Калифорнийском университете в Лос-Анджелесе пытались разобраться со многими тревожными вопросами о модификации клеток зародышевого пути человека, и эти вопросы: согласие, неравенство, доступ и непредвиденные последствия для будущих поколений – вновь всплыли на поверхность в последние годы с появлением CRISPR. Каждому неравнодушному ученому сегодня приходится искать ответ на вопрос: не нарушит ли он законы природы или божественные законы, изменив клетки зародышевого пути человека? И не будут ли подобные манипуляции расценены как евгеника – порочная система взглядов и подходов, распространенная в начале XX века, но ныне подвергутая обстоятельной и жесткой критике со стороны ортодоксальной науки. Но в дополнение к этим важным этическим вопросам (а может, и несмотря на них) участники симпозиума 1998 года были, очевидно, воодушевлены возможностью использовать последние достижения науки для улучшения человечества. Панельные дискуссии были посвящены уничтожению заболеваний, профилактике серьезных генетических дефектов и общей оптимизации хода эволюции – которая, по мнению участников, может иногда быть настолько жестокой, что требует нашего вмешательства.
Доклад, выпущенный несколько лет назад Американской ассоциацией содействия развитию науки и посвященный наследуемым генетическим модификациям человека, был значительно более сдержанным. Рабочая группа пришла к заключению, что вмешательства в геном клеток зародышевого пути (пока) невозможно осуществить с полной гарантией безопасности или ответственности, что связанные с ними этические проблемы серьезны, а риск использования редактирования генома клеток зародышевого пути человека для улучшения индивидов – особенно серьезен. Несколькими годами позже Центр общественной политики в отношении генетики (Genetics and Public Policy Center) пришел к сходным выводам, но в то же время признал, что потребительский спрос на определенные аспекты применения этой техники мог бы поменяться – если бы ученые разработали практически применимые методики.
Вдобавок к этим конференциям и докладам произошло и еще одно событие, ставшее поводом к дискуссии (и разногласиям): появилась медицинская процедура, позволяющая пациентам выбирать, пусть и в ограниченном диапазоне, какой именно генетический материал унаследуют их дети.
Как только технология экстракорпорального оплодотворения превратила акт зачатия в сравнительно простую лабораторную процедуру, появилась возможность подвергнуть человеческий эмбрион на ранних стадиях развития – так же как и любой другой биоматериал – анализу на последовательность его ДНК. Поскольку каждый из родителей передает ребенку только 50 % своей ДНК, то конкретный набор хромосом и генов, которые наследует ребенок, фактически случаен. Но когда стало возможным создавать множество эмбрионов в лаборатории, используя множество яйцеклеток и сперматозоидов, это изменило всю картину. Вместо того чтобы имплантировать в матку будущей матери случайным образом выбранные эмбрионы, специалисты по ЭКО могли теперь сначала проанализировать состав ДНК кандидатов на имплантацию, дабы убедиться, что отобраны эмбрионы, имеющие наиболее здоровые геномы. Эта практика получила название предимплантационной генетической диагностики (ПГД).
Конечно, пренатальная генетическая диагностика выполняется и для эмбрионов, зачатых естественным путем, – это сегодня повсеместная практика. Амниоцентез или просто анализ образца крови, взятого у матери (и содержащего следовые количества ДНК плода), может вскрыть хромосомные аномалии, такие как синдром Дауна, или даже конкретные генные мутации, приводящие к заболеваниям. Но и сегодня возникают важные этические вопросы, которые приходится рассматривать в связи с ПГД. В конце концов, если пренатальная генетическая диагностика покажет, что конкретный плод имеет серьезные генетические дефекты, то из этой ситуации, как правило, есть два исхода – продолжить беременность или прервать ее. С учетом споров вокруг избирательного прерывания беременности неудивительно, что применение ПГ-диагностики тоже стало причиной жарких дискуссий.
Предимплантационная генетическая диагностика пытается избегнуть сложных вопросов, подобных этому, отбирая эмбрионы еще до начала беременности (хотя для нее нужно провести экстракорпоральное оплодотворение, что довольно дорого и предполагает инвазивную процедуру извлечения яйцеклетки из организма матери). У ПГД пока есть ряд технических сложностей, но в целом она эффективно предотвращает появление детей с определенными генетическими нарушениями и стала привлекательным вариантом для будущих родителей, которые рассматривают возможность ЭКО. Однако несмотря на то, что этой технологии удалось уйти от этической проблемы, связанной с абортом, у нее есть собственное и серьезное этическое обременение.
В своих самых ранних воплощениях ПГД применялась для выбора пола эмбриона. Изначально это делалось по медицинским показаниям: определенных заболеваний, связанных с мутациями в генах на X-хромосоме (так называемых X-хромосомных болезней), можно было избежать, если оставлять зародыши только женского пола. Но несмотря на благие намерения ученых, многие наблюдатели и законодатели просто не могли свыкнуться с мыслью, что ПГД позволяет пациентам самим решать, завести им девочку или мальчика, – особенно учитывая, что во многих странах дочери менее желанны, чем сыновья. В настоящий момент использование предимплантационной генетической диагностики для выбора пола эмбриона незаконно во многих странах (включая Индию и Китай) или разрешено только для избежания сцепленных с X-хромосомой заболеваний (как в Великобритании). Однако оно законно в Соединенных Штатах, где множество клиник по лечению бесплодия предлагают эту услугу в том числе и тем родителям, у которых нет серьезных медицинских показаний для того, чтобы выбирать пол ребенка.
ПГД использовали и для других неоднозначных целей, таких как создание так называемых запасных сиблингов, которым с момента имплантации суждено служить донорами органов или клеток для своих братьев и сестер. А в будущем родителям, возможно, предложат выбрать признаки, затрагивающие не только восприимчивость к болезням и пол, но и поведение, физические способности или даже интеллект. Список известных нам ассоциаций конкретных вариантов генов с разнообразными признаками продолжает расти, и по мере того как технологии ПГД совершенствуются, становится все менее понятно: что удержит клинику или врача, занимающегося лечением бесплодия, от того, чтобы сообщить эту информацию пациентам? Почему не предложить пациенту еще больший выбор вариантов для отбора “лучших” эмбрионов?
Возможности этой разновидности генетического тестирования могут быть совершенно невероятными, при том что это даже не самая новая и не самая продвинутая из вспомогательных репродуктивных технологий. Пальма первенства тут уходит митохондриальной заместительной терапии, которую в прессе часто называют “ЭКО с тремя родителями”. Необычно, что каждый ребенок, родившийся в результате этой процедуры, несет в себе ДНК не двух родителей, а трех: одного отца и двух матерей. Этот вид терапии – включающий перенос ядра одной яйцеклетки в другую, ядро которой было предварительно удалено, – нацелен на избавление еще не рожденных детей от группы генетических недугов, которых невозможно избежать другими методами, – митохондриальных заболеваний. Вторая яйцеклетка не содержит ядра, но имеет митохондрии, несущие небольшую часть человеческого генома, поэтому описанная процедура приводит к появлению индивида, генетически родственного трем родителям: матери, чей геном получает ребенок с ядром яйцеклетки (и она же, скорее всего, будет этого ребенка вынашивать), матери, в чью яйцеклетку пересадили это ядро (в этой клетке содержится небольшой, но крайне важный набор генов собственно митохондрий), и отца, который стал донором сперматозоида и, следовательно, половины ядерного генома.
Уже известно, что митохондриальная заместительная терапия работает на мышах и нечеловекообразных обезьянах, а кроме того, эту процедуру проводили на яйцеклетках человека. В полной безопасности этой технологии все еще есть сомнения, однако ее клиническое применение уже маячит на горизонте. Совет по надзору за исследованиями в области репродукции и лечением бесплодия Великобритании представил митохондриальную заместительную терапию в докладе 2014 года, а после одобрения ее парламентом в 2015-м Соединенное Королевство стало первым в мире государством, одобрившим законы, регулирующие клиническое применение этой технологии. США, скорее всего, несильно отстанут; в начале 2016 года Национальная академия наук, Национальная инженерная академия и Национальная академия медицины США сходным образом рекомендовали Управлению по контролю за продуктами питания и лекарственными средствами США одобрить применение ЭКО с тремя родителями в будущем.
Процедуры, подобные ПГД и ЭКО с тремя родителями, показывают, что научное и медицинское сообщества хотят раздвинуть границы этически допустимого ради того, чтобы у людей могли рождаться здоровые дети. Даже ЭКО с тремя родителями, которое с технической точки зрения в некоторых аспектах очень близко к репродуктивному клонированию, вошло в нашу жизнь после сравнительно небольшой философской и законодательной дискуссии (если сравнивать с полемикой о ПГД). Хотя ЭКО с тремя родителями тоже необратимо меняет геном человека (а с ним и клетки зародышевого пути) таким образом, что эти изменения отныне навсегда будут передаваться будущим поколениям. Регуляторы тем не менее дали зеленый свет этой вспомогательной репродуктивной технологии.
Читая об этом, мне приходилось спрашивать себя: неужели законодатели (и ученые) так же, без тени сомнений, разрешат (и будут) использовать CRISPR для внесения наследуемых изменений в геном человека – при том что возможности этого метода гораздо шире, чем у более ранних технологий (ПГД и так далее)? Когда специалисты по репродуктивной медицине поймут, что у них появилась возможность наделять геномы эмбрионов гораздо, гораздо более широким набором вариантов генов, чем могут предоставить любые родители, – остановятся ли они, чтобы обдумать возможные последствия? Или будут искать все новые применения для новообретенной силы, бездумно работая генетическим инструментом, который невозможно полностью контролировать, если использовать его без полного представления о его возможностях?
Я не привыкла задавать себе подобные вопросы в повседневной жизни профессора и биохимика. Хотя я помню, что в заявке на вакансию писала, что интересуюсь научной коммуникацией, на самом деле мне гораздо больше нравилось работать в лаборатории и проводить новые эксперименты, нежели размышлять о теоретических, отдаленных перспективах моих исследований и о том, как объяснить их неспециалистам. И чем больше я погружалась в свою область исследований, тем больше времени я проводила в разговорах со специалистами и меньше – с людьми из других сфер деятельности, не имеющих отношения к моим текущим занятиям. Так я угодила в распространенную ловушку: ученые, как и все остальные, чувствуют себя наиболее комфортно, находясь в окружении себе подобных – людей, которые говорят на том же языке и интересуются теми же проблемами, будь они большими или мелкими.
Через два года после того, как мы с коллегами опубликовали статью с описанием CRISPR в качестве новой платформы для редактирования генома, я уже не могла оставлять в стороне глобальные вопросы этики и прочего подобного, связанные с ней, и оставаться внутри хорошо знакомого круга ученых. По мере того как исследователи применяли CRISPR для редактирования генома все большего числа видов животных и расширяли возможности этого инструмента, я осознавала, что остается не так много времени до того момента, когда какой-нибудь исследовательский коллектив протестирует CRISPR на человеческих яйцеклетках, сперматозоидах или эмбрионах с целью навсегда переписать геном еще не рожденного человека.
Невероятно, но никто не обсуждал эту возможность. Революция в редактировании генома происходила словно за спинами тех людей, которых ее последствия должны были коснуться в первую очередь. Даже когда область исследований CRISPR начала стремительно расширяться, словно ударная волна после взрыва, никто за пределами узкого круга моих коллег будто бы не знал или не понимал, что именно произойдет совсем скоро. В итоге между моей профессиональной деятельностью и моей личной жизнью возник огромный разрыв. Днем я обсуждала результаты работы с коллегами, вечером ужинала с друзьями и соседями или общалась с другими родителями на родительских собраниях – и все время удивлялась, насколько мало друг о друге знают представители этих двух миров. И когда власти Великобритании инициировали открытую дискуссию о митохондриальной заместительной терапии, я начала задавать себе вопрос: а смогу ли я выдержать бурю этических вопросов, которая разгоралась вокруг технологии, которую я сама же помогла создать.
Не то чтобы я была категорически против идеи использования редактирования ДНК для внесения наследуемых изменений в геном человека. Разумеется, существуют многочисленные философские и технические проблемы, а также вопросы безопасности – о многих из них я расскажу в следующей главе, – которые заслуживают вдумчивого обсуждения и даже жарких дискуссий, но ни один из них нельзя признать решительным аргументом в пользу того, чтобы полностью запретить это применение технологии. Меня гораздо больше беспокоили две других, более ощутимых опасности: во-первых, в результате серии авантюрных, непродуманных экспериментов ученые могут преждевременно использовать CRISPR – без должного надзора и серьезной оценки рисков; во-вторых, из-за его эффективности и простоты в применении CRISPR могут незаконно использовать в неблаговидных целях.
Сложно было предсказать, какие это могут быть злоупотребления и кто их может совершить. Даже весной 2014-го, еще до того, как у меня появилась возможность всесторонне рассмотреть эти проблемы, мое подсознание подкидывало ответы в виде ночных кошмаров – один из них я описала в начале этой книги.
В одном из таких снов мне явилась коллега, спросившая, не интересно ли мне будет объяснить некоему человеку механизм работы технологии редактирования генома. Я пошла вслед за ней в некую комнату, где нас ждал этот человек, и, к своему ужасу, увидела перед собой Адольфа Гитлера – при этом вместо лица у него была свиная морда (вероятно, потому, что в тот период я очень много думала над гуманизированным геномом свиньи, переписанным с помощью CRISPR). Гитлер основательно подготовился к нашей встрече: у него были наготове ручка и бумага. Глядя на меня с неподдельным интересом, Гитлер сказал: “Я хочу понять, какие применения есть у этой удивительной технологии, которую вы создали”.
Его ужасающий вид и мрачный вопрос выдернули меня из сна. Лежа в темноте, с бешено колотящимся сердцем, я не могла избавиться от ужасного предчувствия, которое породил во мне этот кошмар. Способность перекраивать геном человека – действительно невероятная мощь, и она может привести к разрушительным последствиям, если попадет не в те руки. Эта мысль пугала меня еще сильнее, поскольку к тому времени CRISPR уже использовали во всех уголках земного шара. Десятки тысяч связанных с CRISPR инструментов уже отправились к покупателям из десятков разных стран, а теория и протоколы манипуляций, требуемые для создания “дизайнерских мутаций” у млекопитающих – по крайней мере, у мышей и обезьян, – были очень подробно описаны во множестве научных статей. Вдобавок к этому CRISPR применяли не только в сотнях академических и коммерческих лабораторий по всему миру; в интернете наборы для модификации генома мог купить любой, у кого имелась сотня долларов. Конечно, эти CRISPR-наборы в стиле “сделай сам” были предназначены для модификации генов только у бактерий и дрожжей, но технология была достаточно простой, и лабораторные эксперименты с геномами животных стали настолько обычными, что не составляло труда представить, что биохакеры начнут работать и с более сложными системами генов – включая нашу собственную.
Что мы наделали! Эммануэль, и я, и наши коллабораторы представляли, что технология CRISPR будет спасать жизни, помогая излечивать генетические заболевания. Но когда я думала об этом позже, я едва ли была в состоянии хотя бы обзорно охватить все варианты того, каким образом нашу непростую научную работу можно извратить. Обескураженная тем, насколько стремительно развиваются события и как быстро стало казаться, что буквально все может пойти не так, я начала чувствовать себя доктором Франкенштейном. Я создала монстра?
И как назло, будто бы мой разум был недостаточно сильно занят этими тревожными мыслями, я обнаружила, что переживаю по поводу еще одной вероятности: что ученые не смогут проводить свои исследования с должной степенью открытости. В конце концов, наука не делается в вакууме. Это особенно справедливо для прикладных наук, открытия в которых часто оказывают непосредственное влияние на общество. Я абсолютно уверена, что ученые, работающие в этой области, обладают достаточной степенью ответственности, чтобы проводить свои исследования открыто, чтобы объяснять свои работы неспециалистам и чтобы участвовать в общественных дискуссиях по поводу вероятных рисков, пользы и разновидностей своих экспериментов перед проведением любого из них, способного, образно говоря, пересечь Рубикон.
В случае с CRISPR казалось очевидным, что общественное обсуждение сильно отстает от научных исследований, продвигающихся с головокружительной быстротой. Мне было интересно, случится ли резкий откат назад, если эксперименты на людях попытаются провести до того, как пройдет широкая открытая дискуссия о редактировании генов. И казалось вполне возможным, что такой откат может остановить или отсрочить применение CRISPR для решения более важных и менее противоречивых задач, таких как лечение генетических заболеваний у взрослых пациентов. Я все больше беспокоилась по поводу таких перспектив и стала отчаянно искать какие-то подсказки: как же быть дальше?
Примерно в это время я поняла, что мне на ум постоянно приходят аналогии с ядерным оружием – областью, в которой научные разработки велись в секрете и без адекватной дискуссии о том, как именно следует использовать полученные исследователями результаты. Особенно это относится к эпохе Второй мировой войны. Роберт Оппенгеймер, бывший профессор физики из Беркли и один из отцов атомной бомбы, говорил ровно о том же в серии слушаний по безопасности по окончании войны – уже после своих смелых призывов к окончанию ядерной гонки вооружений (не будем тут о его связях с коммунистами) и к вящей ярости политиков. Комментируя американскую реакцию на испытания первой советской атомной бомбы и начавшиеся после этого споры о том, не следует ли США разработать еще более мощную водородную бомбу, Оппенгеймер сказал:
Мое суждение о таких вещах следующее: когда видите нечто очень привлекательное с технической точки зрения, вы идете и делаете это. А вопросы о том, что теперь делать с этим изобретением, вы начинаете задавать позже, уже после того, как оно доказало свою успешность. Именно так было с атомной бомбой. Я не думаю, что кто-то возражал против ее создания; дебаты о том, что же теперь с ней делать, появились уже после того, как она была создана.
Слова Оппенгеймера еще больше растравили мне душу. Возможно, однажды мы скажем то же самое по поводу CRISPR и генетически модифицированных людей. Хотя редактирование генома человека почти наверняка никогда не приведет к таким же катастрофическим последствиям, к каким может привести взрыв атомной бомбы, казалось вполне вероятным, что излишняя поспешность в исследованиях все же может нанести вред – как минимум подорвав доверие общества к этому новому виду биотехнологий. В самом деле, учитывая общую обеспокоенность некоторыми разновидностями генной инженерии применительно к сельскому хозяйству и даже резкие возражения против них, меня все больше волновало, что недостаток данных о редактировании генома клеток зародышевого пути – или распространение неверной информации об этом – может помешать нашим попыткам использовать CRISPR в гораздо более безобидных и одновременно более важных целях.
Мой разум пытался продраться через все эти сценарии, и я все больше думала о том, как бы выкарабкаться из настоящего клубка проблем. Мне хотелось придумать какие-то упреждающие меры и запустить честное и открытое общественное обсуждение технологии, которую я помогла создать. Могла ли я и другие обеспокоенные ученые спасти CRISPR от самого себя – не после того, как худшее уже случится, как было с ядерным оружием, а до катаклизма?
Я искала ответы и во время другого ключевого момента в истории биотехнологии – эпизода, когда тревожные голоса раздавались и в научном сообществе, и за его пределами. Тогда, как и сейчас, причиной для беспокойства был прорыв в генной инженерии – создание рекомбинантных ДНК. И в том случае ученые предприняли активные действия – которые в конечном счете оказались успешными, – чтобы их работа не привела к непреднамеренному ущербу.
В начале 1970-х годов ученые совершили важнейшие открытия в зарождающейся области сплайсинга генов – химического слияния (рекомбинации) очищенных фрагментов генетического материала от разных организмов для создания ранее никогда не существовавших синтетических молекул ДНК. Пол Берг, биохимик из Стэнфорда, впоследствии получивший Нобелевскую премию, был первым, кто смог осуществить такой сплайсинг, и он сделал это, скомбинировав ДНК из трех источников: бактериофага, известного как фаг лямбда, бактерии E. coli и поражающего обезьян вируса, известного как вирус обезьян 40, или SV40. После получения рекомбинантных ДНК бактерии и вирусов Берг планировал ввести образовавшиеся гибридные мини-хромосомы в клетки, чтобы он мог изучать функции отдельных генов, когда они экспрессируются вне своего обычного окружения.
Но при этом Берг и другие ученые поняли, что эксперименты с модифицированным генетическим материалом могут иметь многочисленные непредсказуемые и потенциально опасные последствия. Возможно, наиболее неприятной была мысль о том, что может случиться, если синтетическая ДНК из-за недостаточного ограничения ее перемещений каким-то образом окажется за пределами лаборатории. Изначальный план Берга заключался в том, чтобы внести генетический материал в лабораторные линии бактерии E. coli, но поскольку пищеварительная система человека от природы содержит миллиарды безвредных представителей этого вида, казалось возможным, что генетически модифицированные кишечные палочки могут проникнуть в организм людей и навредить нам. Более того, поскольку известно, что вирус SV40 способен вызывать опухоли у мышей, существовала вероятность того, что фрагмент его ДНК может создать новый канцерогенный патоген, который при попадании в окружающую среду, вероятно, нанесет серьезный ущерб.
Из-за этих опасений Берг и его сотрудники отложили свои эксперименты. Вместо этого Берг созвал слушателей и спикеров на конференцию, которая проходила в красивом Асиломарском конференц-центре (Asilomar Conference Grounds), расположенном в Пасифик-Гроув, штат Калифорния, на западной оконечности полуострова Монтерей. Прежде чем продолжать исследования, он хотел, чтобы его коллеги помогли ему провести тщательный анализ затрат и выгоды намеченных экспериментов.
Эта встреча состоялась в 1973 году и стала первой (из двух) Асиломарской конференцией. Она была сосредоточена на ДНК онкогенных вирусов и на рисках, которые они несли; конференция не затрагивала напрямую новые опыты с рекомбинантной ДНК, которые продумывал Берг. Впрочем, в том же году ученые провели и вторую конференцию, посвященную именно сплайсингу генов. Опасения, высказанные на этой встрече, заставили ученых попросить Национальную академию наук организовать комитет для официального исследования новой технологии. Берг выступал в роли председателя этой группы, Комитета по рекомбинантным молекулам ДНК, первая встреча которого прошла в МТИ в 1974 году. Вскоре после этой встречи было опубликовано важное сообщение под названием “Возможные биологические риски использования рекомбинантных молекул ДНК”.
В “моратории Берга”, как его теперь часто называют, выдвигались беспрецедентные требования: запретить во всем мире эксперименты, которые комитет счел наиболее опасными, – те, что были направлены на создание устойчивости к антибиотикам у новых штаммов бактерий, и те, что были направлены на создание гибридных ДНК с онкогенными вирусами животных. Это был один из первых случаев, когда ученые добровольно отказались от проведения целого класса экспериментов без каких бы то ни было законов или запретов со стороны правительства.
Мораторий Берга включал и три других рекомендации: во-первых, ученые должны крайне осторожно подходить к любым экспериментам, в которых предполагается комбинировать ДНК бактерий и животных; во-вторых, Национальные институты здравоохранения должны организовать экспертную комиссию для мониторинга будущих неоднозначных ситуаций с рекомбинантной ДНК; и в-третьих, должна быть созвана международная встреча, чтобы ученые со всего мира могли оценить недавние успехи в данной области и обсудить, что делать с потенциальными опасностями. Эта последняя рекомендация была реализована в виде второй Асиломарской конференции – она же Международный конгресс по проблеме рекомбинантных ДНК (International Congress on Recombinant DNA Molecules), – прошедшей в феврале 1975 года.
Много написано по поводу второй Асиломарской конференции. В ней приняли участие примерно сто пятьдесят человек, в основном ученые, но также юристы, представители правительства и журналисты. Временами дискуссия становилась жаркой, и даже эксперты-биологи не могли договориться друг с другом в оценке размера возможного вреда от экспериментов с рекомбинантными ДНК. Кое-кто считал, что снимать мораторий слишком рано, так как, по их мнению, определенные опыты должны быть запрещены до тех пор, пока не станет известно больше о связанных с ними рисках; другие считали, что эти риски, скорее всего, нереалистичны или, по крайней мере, их вероятность минимальна – и уж точно они не так серьезны, чтобы от них не могли защитить элементарные меры безопасности. В конце концов Берг и его коллеги решили, что большинство экспериментов следует продолжить, но только с соответствующими мерами безопасности, а именно: биологическими и физическими преградами для перемещения генетически модифицированных организмов.
Хотя эти заключения были, несомненно, важны, ничуть не менее важно, что вторая Асиломарская конференция позволила установить связь между учеными и общественностью. Представители различных медиа, посетившие встречу, рассказали своим аудиториям о дискуссиях, которые вели ученые. Эта прозрачность не привела к неразберихе и драконовским ограничениям, вопреки страхам некоторых исследователей, а помогла достичь договоренности, позволившей ученым продолжать исследования при поддержке общественности.
Впрочем, у второй Асиломарской конференции были также и критики. На конференцию можно было попасть только по приглашениям, и учитывая, что не-ученых на ней было очень немного, некоторые наблюдатели посчитали, что мероприятие не смогло охватить достаточно большую аудиторию вне научного сообщества. Другие видели проблему в том, что на конференции совершенно не затрагивались такие темы, как биологическая безопасность и этика. Возможно, наибольшей критике подверглась идея о том, что именно эксперты должны определять ход дискуссии, поскольку они имеют больший доступ к информации, лучше осведомлены о рисках, выгодах и этической неоднозначности новой технологии и им проще просчитать эти риски. Бенджамин Херлбат, историк науки из Университета штата Аризона, говорит по этому поводу:
Этот подход свидетельствует о неправильном понимании демократии. Мы должны сфомулировать наше представление о желаемом демократическом будущем, и развитие наших технологий должно зависеть от этого будущего, а не наоборот. Наука и технологии часто объявляют себя слугами общества; они должны с полной серьезностью относиться к собственным заявлениям. Размышления о том, что правильно для нашего мира, что подходит ему – и что угрожает его моральным устоям, – задача демократии, а не науки.
Я абсолютно согласна с тем, что общество в целом – а не отдельные ученые и не группы ученых – должно решать, как использовать каждую конкретную технологию. Но тут есть одна трудность: общество не может принимать решений по поводу технологий, которые оно не понимает, и тем более по поводу тех, про которые оно вообще не знает. И задача ученых – обратить внимание публики на очередной научный прорыв, как это сделал Берг с коллегами, рассказать о новейших технологических достижениях и развенчать мифы вокруг них, чтобы общественность могла понять, каковы возможности и варианты применения этих технологий. В конце концов, когда методика сплайсинга генов была только разработана, многие биологи даже не знали о ее существовании; понадобилась дискуссия внутри сообщества с привлечением экспертов, которые понимали, что собой представляет эта технология и каковы ее возможности. Сделав подобную дискуссию публичной и пригласив на нее представителей прессы, которые могли бы рассказать общественности о новой технологии в понятной неспециалисту форме, Берг и его коллеги помогли сломать стену между учеными и общественностью и проложить путь к созданию регулирующего органа – Консультативного совета по рекомбинантной ДНК, который в дальнейшем осуществлял мониторинг новых исследований рекомбинантной ДНК и ее клинических применений.
Примерно сорок лет спустя, в начале 2014-го, я решила, что нам стоит применить аналогичный подход – не только для CRISPR, но и для редактирования генома в целом. Технология уже распространилась по научному сообществу, как лесной пожар; за его короткую историю высокоточное редактирование генома применили ко множеству видов животных (и список “отредактированных” продолжает расти), и все говорит о том, что до применения редактирования генома соматических клеток человека в терапевтических целях рукой подать. Однако ученые и общество будто бы игнорируют вполне реальную возможность того, что ту же технологию скоро применят к клеткам человеческих эмбрионов, и кажется, что они совершенно не принимают во внимание значение этого варианта редактирования геномов клеток зародышевого пути.
Открытое и честное обсуждение редактирования геномов клеток зародышевого пути абсолютно точно должно было начаться незамедлительно, и я чувствовала, что должна как-то стимулировать это обсуждение. Подобно тому как Берг и его коллеги забили тревогу, когда риски в их работе стали очевидными, мне нужно было выйти из зоны комфорта – собственной лаборатории – и помочь распространить информацию о последствиях наших экспериментов. Только так технологию CRISPR смогут полностью понять люди, чьи жизни она скоро затронет. Только так, надеялась я, можно избежать наихудших последствий ее появления.
Для ученого вроде меня одно дело – организовать встречу коллег для обсуждения тем, в которых я свободно ориентируюсь. Совершенно другое – взять на себя ответственность за дискуссию о более отдаленных следствиях применения технологии, за обсуждение не научных вопросов кинетики реакций, биофизических механизмов и взаимоотношений структуры и функций, а вопросов политики, этики и юридического урегулирования. Я никогда раньше не играла подобной роли, и сперва она чрезвычайно меня пугала.
К счастью, мне не пришлось выполнять эту работу в одиночку. Незадолго до этого я выступила сооснователем Института инновационной геномики (ИИГ), целью которого было совершенствование технологий редактирования генома, и очень быстро поняла, что ИИГ, расположенный в Области залива Сан-Франциско, отлично подходит для того, чтобы провести в нем конференцию, подобную тем, что Берг устраивал в Асиломаре. Но я понимала, что общественная дискуссия должна развиваться самостоятельно и не следует ускорять ее искусственно, сразу устраивая масштабный конгресс. Я решила, что сначала стоит организовать небольшой однодневный форум, пригласить на него примерно двадцать человек. Я видела непосредственную цель форума в том, чтобы составить “белую книгу” – доклад, в котором был бы намечен путь дальнейшего развития этой области науки и содержался бы призыв к другим заинтересованным лицам высказаться на тему редактирования генома. Я надеялась, что наша первая встреча, которую мы в конце концов назвали Форум ИИГ по биоэтике, станет прелюдией к гораздо более масштабной конференции, которая охватит бóльшую аудиторию.
Мы назначили форум на январь 2015 года и выбрали в качестве места его проведения гостиницу Carneros Inn в долине Напа, известном винодельческом регионе, всего примерно в часе езды от Беркли. Помогали организовать форум Джонатан Вайссман, мой близкий коллега из Калифорнийского университета в Сан-Франциско и содиректор ИИГ; Майк Ботчан, коллега из Беркли и административный директор ИИГ; Джейкоб Корн, научный директор института; и Эд Пенэт, заслуженный профессор в Беркли и сооснователь биотехнологической фирмы Chiron.
Одним из первых приглашение получил сам Пол Берг (он сейчас заслуженный профессор в Стэнфорде), и я была взволнована, когда узнала, что он это приглашение принял. Также в списке приглашенных был Дэвид Балтимор, лауреат Нобелевской премии, биолог из Калтеха и коллега Берга; Балтимор не только участвовал во встрече 1974 года, но и был соавтором написанной по ее итогам статьи, призывавшей к мораторию на исследования рекомбинантных ДНК. Кроме того, он играл ключевую роль в обсуждениях на второй Асиломарской конференции. Участие Пола и Дэвида в форуме означало, что он будет напрямую связан с событиями, которые и вдохновили меня на организацию этой встречи. Что еще важнее, их знания в данной области, несомненно, должны были помочь нам пройти сложный путь, лежавший перед нами.
Также свое участие подтвердили Алта Чаро, профессор права и биоэтики в Висконсинском университете в Мэдисоне; Дана Кэрролл, одна из пионеров редактирования генов в эпоху до появления CRISPR; Джордж Дейли, эксперт в области стволовых клеток из Бостонской детской больницы; Марша Феннер, руководитель программ ИИГ; Хэнк Грили, директор Центра права и биологических наук Стэнфордского университета; Стивен Мартин, заслуженный профессор Калифорнийского университета в Беркли и бывший декан биологического факультета там же; Дженнифер Пак, профессор педиатрии в Калифорнийском университете в Сан-Франциско; Джон Рубин, продюсер и режиссер кино, Сэм Стернберг, мой соавтор и в то время соискатель степени доктора философии; и Кит Ямамото, профессор Калифорнийского университета в Сан-Франциско и административный директор ИИГ. Некоторых других ученых тоже приглашали, но они отказались участвовать (Джордж Чёрч и Мартин Йинек не присутствовали, но в итоге тоже подписали статью, опубликованную по итогам встречи).
Мы провели форум 24 января 2015 года. Семнадцать его участников представили доклады о генной терапии и улучшении генома клеток зародышевого пути, о существующих законодательных нормах, регулирующих генетически модифицированные продукты, и о частных деталях CRISPR. Еще интереснее, что эти доклады, по моему мнению, были скорее вольными рассуждениями собравшейся группы о будущем редактирования генома. Эти разговоры были полны энтузиазма и новых идей и затрагивали темы, которые я раньше проговаривала только сама с собой.
Когда мы начали обсуждать авторство “белой книги”, в которой были бы собраны наши выводы, возникли дебаты о том, кто же будет целевой аудиторией доклада и чего мы надеемся достигнуть. Должны ли мы описать все последствия использования CRISPR – включая новые типы ГМО и даже дизайнерские организмы – или только его потенциальную роль в редактировании генома клеток зародышевого пути? Действительно ли CRISPR поднял новые вопросы о модификации зародышевого пути – или различия между этим методом и более ранними технологиями только количественные? И какой вердикт редактированию генома клеток зародышевого пути вынесет наша небольшая группа – следует ли полностью запретить технологию или оставить возможность ее применения в будущем?
В ходе этих обсуждений постепенно начало вырисовываться единое мнение. Мы решили, что использование редактирования генома конкретно в клетках зародышевого пути человека должно стать центральной темой нашего доклада. Генную терапию на тот момент применяли в соматических клетках пациентов уже два с лишним десятилетия, и ранние технологии редактирования генома соматических клеток также были уже испытаны в клинике. Было очевидно, что редактирование клеток зародышевого пути – такая область, о которой мало кто знает и для которой необходимость общественного обсуждения была наиболее насущной. Во многом так получилось потому, что CRISPR, как все признают, снизил технические барьеры, которые в свое время делали редактирование генома клеток зародышевой линии человека сложным, почти невозможным делом.
Несмотря на множество статей, написанных раньше о модификации геномов клеток зародышевого пути, несмотря на конференцию, проведенную в 1998 году в Университете Южной Калифорнии в Лос-Анжелесе, вопреки сценариям Судного дня, придуманным фантастами в последние годы, до появления CRISPR было просто невозможно отредактировать клетки зародышевого пути человека хоть сколь-нибудь точно. Теперь, конечно, все иначе – и на это обратил внимание один из участников форума, рассказавший нам, что рукопись некоей научной статьи с описанием экспериментов, в ходе которых человеческие эмбрионы были отредактированы с помощью CRISPR, уже ходит по редакциям ведущих научных журналов. Эта работа (если она действительно была проведена) стала первой, в ходе которой ученые специально “подкрутили” выбранные ими последовательности ДНК в геноме потенциального человеческого существа.
Если и стоило затевать общественное обсуждение, то это нужно было делать прямо сейчас. Но какой будет наша позиция? Многие из нас в принципе не были уверены в безопасности внесения наследуемых изменений в геном человека – учитывая, что любые ошибки в нем могут оказаться катастрофическими и для конкретного индивида, и для будущих поколений. Можно ли оправдать подобные изменения с точки зрения этики – совершенно другой вопрос.
Мы рассуждали о вопросах социальной справедливости и свободы деторождения и открыто выражали свои страхи по поводу евгеники. Некоторых участников беспокоило, что наука как раз и движется в направлении евгеники, в то время как другие признавались, что они не видят ничего плохого в редактировании генома клеток зародышевого пути человека – по крайней мере в теории. Эти люди считали, что если мы сможем доказать его безопасность и эффективность, а потенциальная польза существенно перевесит риски, то нет смысла задавать для этого вида терапии более серьезные ограничения, чем для других методов лечения.
Впрочем, в конце концов до нас дошло, что не мы должны принимать решения по этому поводу. Не эти семнадцать человек в помещении вольны определять, что должна общественность думать о редактировании зародышевой линии. Мы ощущали бремя двойной ответственности. Во-первых, нам нужно было информировать публику о том, что редактирование генома клеток зародышевой линии – новая общественная проблема, на которую нужно обратить внимание, которую необходимо изучать, обсуждать и принимать по ней решения. Во-вторых, нам нужно было призвать научное сообщество – тех людей, которым уже были известны тонкости технологии, и тех, кто агрессивно продвигал ее во все новые области, – несколько притормозить на этом направлении исследований. Нам казалось критически важным убедить коллег, что сейчас не стоит бросаться сломя голову в любые новые исследования, связанные с изменением зародышевого пути человека, не говоря уже о попытках медицинского применения редактирования генома. В общем, мы хотели, чтобы научное сообщество, так сказать, нажало на “паузу” в экспериментах в этой области до тех пор, пока общественные, этические и философские последствия редактирования генома клеток зародышевого пути не будут проработаны с должной степенью подробности – и в идеале на мировом уровне.
Как лучше всего достигнуть этих целей? Может быть, написать колонку в одну из больших газет? Устроить пресс-конференцию? Или поместить в каком-нибудь академическом журнале обзорную статью – фактически научную колонку? После некоторых размышлений мы выбрали последний вариант, решив, что тут мы сможем охватить наибольшее число заинтересованных исследователей – а также, вполне вероятно, текст будет замечен и неспециализированными СМИ, как это часто происходит с резонансными статьями в научных журналах. А поскольку наш форум был посвящен одной из наиболее горячих тем во всей биологической науке, то мы не сомневались, что статья наделает шума.
В завершение встречи мы набросали первый эскиз статьи, которую планировали послать в журнал Science. Цель статьи, решили мы, – в привлечении внимания к теме без излишнего погружения в дебри деталей. Конечно, в этой теме есть множество спорных вопросов, которые в конце концов придется обсуждать, но эта первая публикация не казалась подходящим местом для такого обсуждения. Мы хотели просто сдвинуть дело с места, а подробные обсуждения оставить для будущих встреч, которые сможет посетить большее количество человек.
Вечером, когда наша энергия окончательно иссякла, мы с коллегами направились в французский ресторан Angèle, расположившийся неподалеку от реки Напа. Сидя на улице за длинным овальным столом, овеваемые прохладным ветерком с близлежащих холмов, мы попивали местное вино, наслаждались закусками и непринужденной болтовней о работе, семьях и путешествиях. Все мы были рады на время отложить в сторону непростые темы, обсуждениям которых отдали все утро и весь день. Но что касается меня лично, то я все равно мысленно постоянно возвращалась к ним.
Правильно ли я поступила, что вышла на эту новую для себя сцену? Идея выступать перед общественностью по поводу специальной научной проблемы, вне зависимости от ее важности, казалась мне совершенно чуждой, почти вызывающей. Было совершенно неясно, окажет ли наша статья серьезный эффект и будет ли она воспринята именно так, как мы хотели. Даже если все пройдет хорошо, то, возможно мы сделали слишком мало, слишком поздно. Рукопись, о которой рассказал нам коллега, – та, которую рецензировали для публикации несколько ведущих научных журналов, – беспокоила меня. Возможно, идут и другие подобные эксперименты, или же их собираются провести в ближайшем будущем. Будут ли они опубликованы до того, как у нас появится шанс обнародовать свои выводы?
Я была уверена только в одном: теперь, когда я ступила на этот путь, мне надо двигаться быстро. В тот же вечер, вернувшись домой в Беркли, я тут же начала разбирать свои заметки и составлять черновой план статьи. Написать ее оказалось непросто, однако через пару недель я отправила ее первую версию остальным участникам нашего форума в долине Напа, и мы начали поочередно, по кругу вносить в нее исправления и изменения. 29 марта 2015 года статья была опубликована онлайн под заголовком “Продуманный план дальнейшего развития геномной инженерии и модификации генома клеток зародышевого пути” (A Prudent Path Forward for Genomic Engineering and Germline Gene Modification).
В статье объемом всего в несколько страниц объяснялась суть технологии и высказывались наши опасения по ее поводу. После краткого описания CRISPR, концепции редактирования генома и ее уже опробованных приложений мы обратились к теме редактирования генома клеток зародышевого пути человека. По поводу этого мы выдвинули четыре конкретные рекомендации.
Мы попросили экспертов из научного и биоэтического сообществ провести собственные форумы, на которых заинтересованные представители общественности смогут получить достоверную информацию о новых технологиях редактирования генома, их потенциальных рисках и выгодах, а также об этических, социальных и юридических последствиях этих технологий.
Мы призвали исследователей к тому, чтобы они продолжили тестировать и развивать технологию CRISPR на культурах человеческих клеток и на нечеловекообразных обезьянах, чтобы мы смогли лучше представлять себе профиль безопасности этой технологии – прежде чем каким-либо образом применять ее в клинике.
Мы предложили организовать международную встречу, чтобы убедиться, что все проблемы безопасности и этики можно открыто и с полной прозрачностью обсудить – не только в кругу ученых и специалистов по биоэтике, но и с участием множества самых разных заинтересованных лиц, которые, очевидно, тоже захотят сказать свое слово: представителей духовенства, борцов за права пациентов и инвалидов, социологов, представителей правительственных регуляторов и других.
В последнем и, вероятно, самом важном пункте мы просили ученых воздержаться пока от попыток внести наследуемые изменения в геном человека. Мы хотели, чтобы исследователи даже в тех странах, где этот вопрос регулируется слабо, приостановили соответствующие эксперименты, чтобы дать правительствам и гражданам других государств шанс рассмотреть вопрос. Хотя мы избежали использования слов “запрет” и “мораторий”, суть послания была ясна: в ближайшее время нельзя рассматривать какую-либо возможность клинического применения.
Все мои страхи по поводу того, как примут нашу статью и какой эффект она произведет, рассеялись, как только она была опубликована. В последующие дни многие коллеги связывались с нами, чтобы поблагодарить за то, что мы подняли эту тему, и узнать подробности предстоящей встречи. Кто будет ее организатором – профессиональные сообщества или национальные академии? Как будет организовано участие других стран? Пройдет ли она в Асиломаре, как предыдущие имеющие историческое значение конференции, или мы выберем другое место? Множество сообщений пришло и от журналистов, и от простых граждан, и это в большой степени заслуга прессы, которую привлекла наша статья. Газета New York Times опубликовала первополосную статью, получившую сотни комментариев от читателей; наш обзор также был замечен такими крупными медиа, как National Public Radio и Boston Globe, а также многочисленными блогами и сайтами. Без сомнения, помог и тот факт, что коллектив авторов журнала Nature призвал к запрету редактирования генома клеток зародышевого пути человека буквально за несколько дней до того, как мы сделали то же самое, а научный журнал MIT Technology Review не так давно опубликовал захватывающую статью на ту же тему.
Тема в одночасье стала популярной. В мгновение ока CRISPR превратился из революционной, но слегка загадочной технологии в нечто обыденное. Теперь, когда выдающиеся последствия применения этой технологии для будущего человечества стали достоянием общественности, я позволила себе надеяться, что у нас получится разносторонний честный разговор о редактировании клеток зародышевого пути: когда мы должны разрешить его применение (если вообще должны), как мы будем регулировать его и с какими его последствиями мы готовы смириться, а с какими не готовы. Было отрадно наконец начать публичное обсуждение CRISPR – но путь впереди лежал еще долгий.
Назад: Глава 6 Исцелить больных
Дальше: Глава 8 Что впереди

