Глава 6
Исцелить больных
Год 2015-й подходил к концу, и я завершала обычные для конца семестра дела: выставляла оценки студентам и составляла сметы проектов, а также определяла цели научных исследований на будущий год. Впрочем, одновременно с этим я готовилась к выполнению еще одной необычной задачи – докладу, который мне предстояло вскорости представить вице-президенту Джо Байдену на Всемирном экономическом форуме в Давосе, Швейцария, в январе 2016 года.
Приглашение выступить вместе с вице-президентом было самым свежим подтверждением статуса CRISPR как медицинского инструмента. Но еще до этого приглашения я планировала посетить Давос, где лидеры государственных структур и частных компаний собираются каждую зиму, чтобы обсудить глобальные насущные вопросы. Этот визит на форум должен был стать для меня вторым, и на нем, как и в предыдущий раз, меня попросили рассказать о технологии CRISPR и ее влиянии на мировую экономику и общественную жизнь, включая те воздействия, которые она способна оказать на мир медицины.
Однако приглашение вице-президента Байдена было, вероятно, наиболее весомым признанием значения этой технологии для сферы здравоохранения. Не менее значима была и непосредственная причина приглашения: Байден должен был дать пресс-конференцию, на которой вместе с учеными и врачами рассказал бы об инициативе президента Обамы по координации усилий в борьбе с раком. В стиле американской космической программы 1960-х, в рамках которой планировалось отправить человека на Луну – и в короткие сроки эти планы воплотились в жизнь, – этот “полет к раку” был призван собрать вместе лучшие умы страны ради поиска средств для исцеления от рака во всех его проявлениях. Тот печальный факт, что незадолго до этого после многолетней борьбы с раком мозга ушел из жизни Бо Байден, сын вице-президента, сделал повод еще более весомым, обнажив человеческие трагедии и боль, которую рак, не разбирая, причиняет такому множеству семей.
Хоть это и было непросто, я сумела найти коллегу, который мог в январе подменить меня на кафедре, и отправилась в Давос пораньше, чтобы принять участие в пресс-конференции Байдена, которая оказалась ровно настолько прекрасной, насколько и предполагалось. Я узнала много нового от других участников, многие из которых были учеными, непосредственно принимавшими участие в исследованиях рака, в разработке лекарств и лечебной практике. По мере того как они делились с аудиторией новейшими открытиями в этой области медицины, мне становилось все яснее, как далеко мы продвинулись в лечении рака с 1995 года, когда мой отец вступил в краткую и столь неравную борьбу с меланомой. Но так же четко я поняла, сколько нам еще требуется пройти, чтобы найти эффективные средства лечения этой болезни – и уж тем более полного избавления от нее. И тут я в очередной раз напомнила себе, каким образом CRISPR может ускорить процесс прохождения этого пути.
На пресс-конференции, обсуждая технологию CRISPR и ее применение в лечении рака, я видела перед собой батарею телекамер и толпу аккредитованных журналистов – и внезапно почувствовала, что смотрю на себя глазами этих репортеров, недоумевающих: а что специалист по биохимии РНК делает рядом с врачами, посвятившими себя борьбе с раком? Для меня было честью присутствовать там, и в то же время я была слегка смущена тем, какой далекий – и в прямом, и в переносном смысле – путь я проделала, чтобы обсуждать столь важный вопрос здравоохранения плечом к плечу с вице-президентом Соединенных Штатов.
Среди политиков и ученых (да и во всем обществе) все больше признается важная роль, которую редактирование генома может сыграть в разработке новых методов лечения или даже в полной победе над различными заболеваниями. В дополнение к федеральной поддержке фундаментальных исследований в этой области в форме грантов в процесс все больше вовлекается и частный бизнес. В число сооснователей трех связанных с терапией стартапов, два из которых базируются в Кембридже, штат Массачусетс, и один – в швейцарском Базеле, входят ученые (включая меня и Эммануэль), и эти стартапы уже получили венчурные инвестиции в размере сотен миллионов долларов. На момент написания этих строк все эти три компании стали открытыми акционерными обществами. Пенсильванский университет проводит клиническое исследование основанного на CRISPR средства, которое может стать первым разрешенным в США препаратом подобного рода; инвестор проекта – интернет-миллиардер Шон Паркер. Новый биотехнологический институт в Сан-Франциско, аффилированный с Калифорнийским университетом в Беркли, Калифорнийским университетом в Сан-Франциско и Стэнфордским университетом, получил щедрую поддержку более чем в полмиллиарда долларов от основателя Facebook Марка Цукерберга и его жены, педиатра Присциллы Чан. А в Области залива Сан-Франциско я имела честь открыть Институт инновационной геномики, в чьи цели входит управление CRISPR-подобными технологиями таким образом, чтобы эти технологии направляли революцию в генной инженерии на борьбу с недугами.
Если эти примеры на что-то и указывают, так это на то, что в будущем медицина будет все чаще пользоваться CRISPR; при этом будут возникать новые альянсы и новые способы партнерства общественных и частных спонсоров. Но нам не нужно ждать, чтобы своими глазами увидеть мощь CRISPR в предотвращении заболеваний. Свидетельства уже сегодня прямо перед нами.
Доклинические испытания на животных уже показали невероятную способность CRISPR находить и “чинить” мутировавшие гены внутри живых организмов. В декабре 2013-го, меньше чем через год после того, как несколько лабораторий, включая мою собственную, сообщили об успешном использовании полученных из бактерий молекул CRISPR для редактирования генома клеток человека, группа китайских ученых запрограммировала те же молекулы CRISPR находить и исправлять мутацию размером в одну “букву” среди 2,8 миллиарда “букв” ДНК в геноме мыши. Таким образом, они впервые смогли полностью вылечить генетическое заболевание с помощью CRISPR, применив его на целом животном (а не отдельных клетках).
Эта новость повергла меня в шок, хоть я и не могу сказать, что была удивлена, учитывая, как быстро появлялись новые варианты использования технологии. И все же налицо было фундаментальное достижение: был создан первый представитель нового типа ювелирно точных средств генетической терапии, и его появление, по всей видимости, отметило начало новой эры в медицине – эры, в которой хотя бы некоторые из семи с лишним тысяч генетических заболеваний человека, каждое из которых вызвано “собственной” мутацией в одном конкретном гене, могут быть излечены благодаря универсальному молекулярному инструменту.
Проведенные в Китае эксперименты, подтверждающие такую возможность, излечили мышей от врожденной катаракты – недуга, при котором дефектная копия гена приводит к затуманиванию и общему ухудшению зрения. На протяжении следующей пары лет ученые применили CRISPR для излечения мышей от мышечной дистрофии (тяжелого заболевания, при котором истощается мышечная ткань), а также от различных нарушений обмена веществ, затрагивающих печень. Параллельно с этим, работая на культурах человеческих клеток, часто берущих начало от образцов тканей пациентов, сотни исследователей использовали CRISPR для исправления непрерывно растущего числа мутаций ДНК, связанных с некоторыми из наиболее тяжелых генетических болезней – от серповидноклеточной анемии и гемофилии до муковисцидоза и тяжелого комбинированного иммунодефицита. Неважно, какие именно изменения ДНК стали причиной заболеваний – неверные “буквы” в последовательности, пропущенные “буквы”, лишние “буквы” или даже масштабные хромосомные нарушения, – казалось, нет такой “однобуквенной” ошибки, которую CRISPR неспособен исправить!
Некоторые ученые используют CRISPR, чтобы блокировать вирусные инфекции в человеческих клетках, то есть фактически делать то же самое, что эта система молекулярной защиты делает в клетках бактерий. Первые клинические испытания редактирования генома нацелены на излечение ВИЧ/СПИД путем изменения клеток собственной иммунной системы пациента таким образом, чтобы вирус не мог войти в них. В другом выдающемся исследовании человеческая жизнь была впервые спасена с помощью редактирования генома в сочетании с другим прорывом в медицине – технологией иммунотерапии рака, в ходе которой иммунную систему пациента “натаскивают” на то, чтобы она сама находила и уничтожала раковые клетки.
Поддаться всеобщему энтузиазму легко. Тот факт, что редактирование генома потенциально может навсегда повернуть вспять течение болезни, воздействовав на лежащую в основе этой болезни генетическую аномалию, будоражит воображение. Но еще сильнее волнует нас тот факт, что CRISPR можно перепрограммировать на охоту за новыми ДНК-мишенями, а значит, и за новыми заболеваниями. Учитывая выдающийся потенциал CRISPR, я за последние несколько лет привыкла к частым просьбам о помощи от фармацевтических компаний, которым необходима информация о технологии CRISPR и о том, как ее можно задействовать в поиске новых терапевтических средств.
Но терапевтическое редактирование генома по-прежнему находится в зачаточном состоянии – клинические испытания только-только начались, – и существует еще несколько фундаментальных вопросов о том, как дальше будут развиваться события. Многолетние попытки воплотить в жизнь теоретические обещания, которые дает генная терапия, должны служить напоминанием, что прорывы в медицине почти всегда оказывается сложнее осуществить, чем думалось изначально. И для CRISPR дорога от лаборатории в клинику тоже будет длинной и трудной.
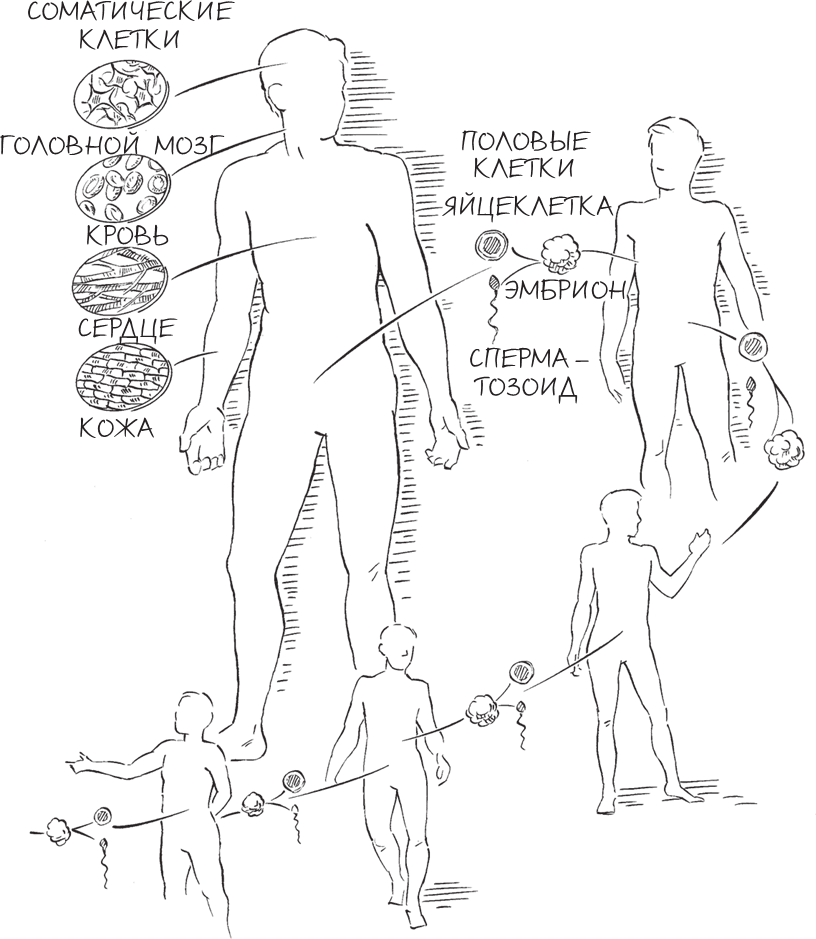
Клетки каких типов сделать мишенью – вот одна из многих дилемм, стоящих перед исследователями. Стоит ли редактировать соматические клетки (от греческого σῶμα, то есть “тело”) или половые, герминативные клетки (от латинского germen, что означает “бутон” или “росток”)? Различия между этими двумя типами клеток – тема одной из наиболее жарких и оживленных дискуссий в мире современной медицины.
Половые клетки – это любые клетки, чей геном может быть унаследован следующими поколениями, поэтому они составляют зародышевый путь организма – поток генетического материала, передаваемый от поколения к поколению. Самые известные и очевидные половые клетки в организме – яйцеклетки и сперматозоиды, но, помимо них, зародышевый путь включает в себя предшественников этих зрелых гамет, а также стволовые клетки, имеющиеся в эмбрионе начиная с самых ранних стадий развития.
Соматические клетки – это фактически все остальные клетки тела: сердце, мышцы, головной мозг, кожа, печень – любая клетка, чья ДНК не может быть передана потомкам.
Специалисты по генетике мышей (и животноводы в целом) ухватились за возможность менять геном половых клеток с помощью CRISPR. Редактирование генома клеток зародышевого пути – наиболее эффективный способ применения технологии. Обычно к тому времени, как мышь с болезнетворной генетической мутацией достигнет зрелости, исправлять ошибку уже слишком поздно: изначальная ошибка в одной оплодотворенной яйцеклетке скопировалась в миллиарды потомков этой клетки, и теперь устранить все до единого следы заболевания уже невозможно. (Представьте, что вы пытаетесь исправить ошибку в газетной заметке, когда газета уже напечатана и ее развезли по киоскам. А теперь сравните это с ситуацией, когда заметка с ошибкой все еще представляет собой лишь текстовый файл в компьютере редактора.) Сосредоточив усилия на клетках зародышевого пути, ученые могут отправить CRISPR в эмбрион на самой ранней стадии развития и устранить мутацию в единственной клетке, из которой этот зародыш состоит. На протяжении всего развития эмбриона до стадии взрослого организма “починенная” ДНК аккуратно копируется в каждую дочернюю клетку, включая половые клетки, которые в конечном счете передадут геном последующим поколениям.
Редактирование геномов клеток зародышевого пути оказалось полезным инструментом исследований на лабораторных мышах, однако его применение на человеке ставит серьезные вопросы безопасности и этики. Стоит ли нам манипулировать геномом нерожденных младенцев и подчищать генофонд Homo sapiens – причем таким образом, что эти изменения нельзя будет просто взять и отменить? Готовы ли мы как вид взять на себя управление собственной эволюцией и ответственность за нее, преднамеренно внося мутации в наш геном, – вместо того чтобы оставить это случайности? Ответы на эти чрезвычайно сложные вопросы имеют огромное значение, и я еще остановлюсь на них подробно в двух последних главах книги.
Различия между соматическими и половыми клетками
С этической точки зрения с редактированием соматических клеток для лечения генетических болезней все обстоит гораздо проще, чем с редактированием половых клеток, поскольку изменения в первых не могут передаться потомкам пациента. На практике, правда, все намного сложнее. Исправить патогенную мутацию в одной-единственной половой клетке намного проще, чем пытаться сделать то же самое примерно в пятидесяти триллионах соматических клеток, составляющих человеческое тело. Чтобы обойти это препятствие, ученым придется решить ворох новых проблем – но это нам придется сделать, если мы хотим помочь множеству мужчин, женщин и детей, страдающих генетическими заболеваниями. В таких случаях редактирование половых клеток никак не поможет облегчить страдания: уже слишком поздно. Редактирование генома соматических клеток – единственный способ.
Трудно себе представить, что редактирование генома может обратить вспять течение заболевания у любого человека, и уж тем более у взрослого, который существовал с этим заболеванием всю жизнь. Болезнь к моменту начала генной терапии может укорениться уже очень глубоко, и изменение ДНК пациента не обязательно избавит его от накопившихся в течение жизни последствий поломки генетического кода.
Разумеется, есть границы того, что мы можем делать с помощью CRISPR в этом ключе. Некоторые заболевания не имеют четко известных генетических причин, и при определенных недугах, таких как шизофрения или ожирение, генетике отводится сложносоставная роль: многие гены вовлечены в развитие патологии, но каждый привносит лишь небольшой вклад. Учитывая, как тяжело будет использовать CRISPR для безопасного и эффективного редактирования единственного гена в человеческом теле, вряд ли мы в обозримом будущем сможем одновременно редактировать несколько генов сразу.
CRISPR дает наиболее широкие возможности для лечения моногенных наследственных заболеваний – таких, которые вызываются мутацией в одном-единственном гене. Говоря простыми словами, эти заболевания возникают, если в результате экспрессии мутантного гена либо получается дефектный белок, либо вообще не образуется белка. Если редактирование гена сможет восстановить нормальное производство полностью функционального белка до того, как генная мутация нанесет непоправимый вред, то это редактирование может стать одноразовым вмешательством, терапевтический эффект которого продержится до конца жизни пациента. Это отличает генную терапию от существующих сегодня способов лечения генетических заболеваний, которые обычно заключаются во временных решениях с использованием трансплантатов или периодических введений лекарств. Что важно, врачам не нужно будет редактировать все клетки тела пациента, чтобы излечить генетическое заболевание. Даже если все клетки несут патогенную мутацию, симптомы зачастую проявляют себя только в тех тканях, где наиболее важно нормальное функционирование мутантного гена. К примеру, иммунодефициты по большей части влияют на белые кровяные тельца; хорея Гентингтона в первую очередь губит нейроны головного мозга; серповидноклеточная анемия затрагивает только красные кровяные тельца, а муковисцидоз наносит ущерб по большей части легким. А коль скоро проявления генетических заболеваний локальны, то и методы их лечения должны быть направлены на клетки в наиболее затронутых болезнью частях тела. Никто не говорит, что будет легко доставить CRISPR в эти места и уж тем более – внедрить его именно в нужные клетки. Задача доставки – одна из главнейших проблем, с которыми столкнутся технологии редактирования генома соматических клеток.
Доступные стратегии доставки можно разделить на две основных категории: редактирование генома in vivo (от латинского “в живом”, как упоминалось ранее) и редактирование генома ex vivo (от латинского “вне живого”). В рамках первого подхода CRISPR направляют прямо в тело пациента, чтобы инструмент проделал свою работу в месте повреждения; в рамках второго клетки пациента редактируют вне тела пациента и затем возвращают в него. Терапия ex vivo – гораздо более простой подход, и поскольку ученые освоили редактирование геномов клеток в лаборатории, мы на один шаг ближе к ней, чем к генной терапии in vivo. Другое преимущество редактирования генома ex vivo заключается в том, что клетки с отредактированными генами можно подвергнуть строгому контролю качества, прежде чем возвращать их в тело пациента.
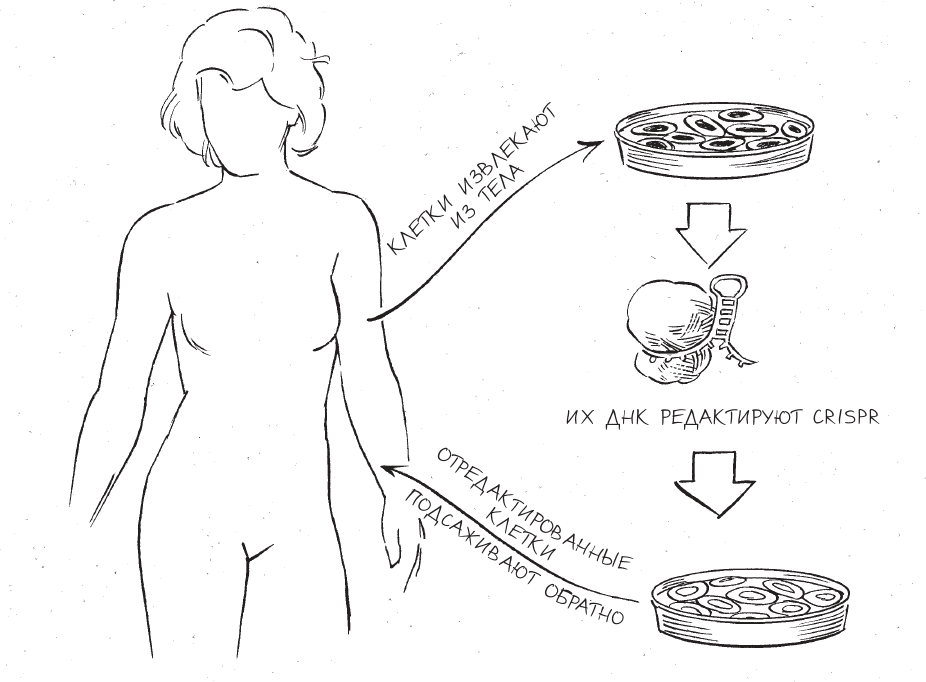
CRISPR-терапия ex vivo
Поскольку для редактирования генома ex vivo необходимо извлечь больные клетки из тела пациента, этот метод отлично подходит для терапии заболеваний крови. Используя комбинацию редактирования генома, донорства крови и методов ее переливания, врачи могут изъять пораженные клетки крови из тела пациента, отредактировать их с использованием CRISPR и вернуть в кровеносную систему. Две потенциальных мишени для CRISPR-терапии ex vivo – это серповидноклеточная анемия и бета-талассемия. Оба эти генетических заболевания характеризуются тем, что возникают из-за дефектов молекулы гемоглобина – это главная белковая составляющая красных кровяных телец, вещество, переносящее кислород от легких к другим тканям тела. Причины дефектов в этой молекуле – мутации в гене бета-глобина, кодирующем одну из двух уникальных белковых цепочек, составляющих молекулу гемоглобина.
Серповидноклеточную анемию и бета-талассемию и сегодня можно полностью вылечить пересадкой красного костного мозга. Когда врачи пересаживают костный мозг от здорового донора больному реципиенту, стволовые клетки крови, коих множество, начинают образовывать новые здоровые красные кровяные тельца, и этот процесс работает до конца жизни пациента. Проблема с этим типом пересадки стволовых клеток заключается в нехватке здоровых доноров, которые одновременно подходят реципиенту с иммунной точки зрения и согласны пройти инвазивную процедуру. Даже когда подходящий донор найден и тело пациента приняло пересаженные клетки, процедура несет определенные риски; у многих больных развивается болезнь “трансплантат против хозяина”, вариант обратной иммунной реакции, который может привести к летальному исходу.
Редактирование генома может решить эту проблему, позволяя пациентам одновременно играть роль и реципиента, и донора стволовых клеток. Если врач сможет изолировать стволовые клетки из красного костного мозга пациента, “починить” мутантные гены с помощью CRISPR, а затем вернуть эти отредактированные клетки пациенту, то не придется думать о доступности донорского материала и о риске иммунного конфликта между телом пациента и пересаженными клетками. Многочисленные исследовательские коллективы уже убедительно показали, что геномы клеток пациентов можно с высокой точностью репарировать в лаборатории и что эти отредактированные клетки производят заметные количества здорового гемоглобина; ученые даже показали, что отредактированные клетки человека могут функционировать в теле иммунокомпрометированных (то есть имеющих ослабленный иммунитет) мышей. Сегодня исследователи и в научных учреждениях, и в коммерческих компаниях работают над тем, чтобы сделать эту процедуру доступной для пациентов.
Есть веская причина для оптимизма по поводу клинических испытаний с редактированием генома ex vivo, учитывая недавние успехи на смежном поле генной терапии ex vivo же. (Вспомните, что при редактировании генов репарация мутантных копий происходит прямо в геноме, в то время как при генной терапии в ДНК вводятся новые, здоровые гены.) Биотехнологическая компания Bluebird Bio разрабатывает продукт для лечения бета-талассемии и серповидноклеточной анемии посредством вставки новых генов бета-глобина в стволовые клетки крови, а GlaxoSmithKline сходным образом создала эффективное средство для генной терапии, которое излечивает тяжелый комбинированный иммунодефицит путем вставки недостающего гена в геном. В обоих случаях общая стратегия вмешательства одинакова: изъять клетки пациента, исправить их в пробирке, а затем вернуть в тело пациента. Впрочем, редактирование генома с большой вероятностью будет более безопасным, поскольку оно вносит настолько мало изменений в геном, насколько это возможно.
Самое первое клиническое испытание редактирования генов ex vivo показало, насколько перспективна эта процедура и как много она умеет. По иронии судьбы мишенью в тот раз была вовсе не генетическая болезнь, а вирус иммунодефицита человека (ВИЧ). И хотя протокол этого клинического испытания был разработан до того, как технология CRISPR появилась на свет, – в нем использовалась технология нуклеаз с цинковыми пальцами (ZFN), описанная в первой главе, – его успех означает, что с помощью редактирования генома можно будет бороться с пандемией СПИД, а также лечить множество генетических заболеваний.
Вы не поверите, но некоторые люди от природы невосприимчивы к ВИЧ. У этих счастливчиков не хватает тридцати двух “букв” ДНК в гене, кодирующем белок CCR5, расположенный на поверхности белых кровяных телец – тех самых клеток, что образуют костяк иммунной системы. Белки CCR5 – класс элементов на поверхности клетки, на которые заякоривается частица ВИЧ на первых стадиях инфицирования. Описанная специфическая 32-буквенная делеция приводит к тому, что синтез молекулы белка CCR5 обрывается и она не выходит на поверхность клетки. Не имея рядом белка CCR5 для присоединения, ВИЧ не может заражать клетки.
У людей африканского и азиатского происхождения 32-буквенная делеция в гене CCR5 практически не встречается, но она довольно значительно распространена у европейцев; 10–20 % европеоидов несут одну копию мутантного гена, а гомозиготы – те, у кого таких копий две, – полностью невосприимчивы к ВИЧ. Приблизительно от 1 до 2 процентов европеоидов по всему миру (большинство из них из Северо-Восточной Европы) посчастливилось иметь такой признак. Эти люди без полнофункционального CCR5 во всех остальных аспектах абсолютно здоровы и даже имеют меньший риск развития определенных воспалительных заболеваний; нехватка указанного белка не приводит ни к каким побочным эффектам. Фактически единственный известный минус отсутствия белка CCR5 – повышенная восприимчивость к вирусу лихорадки Западного Нила.
Неудивительно, что фармацевтическая индустрия направила громадное количество ресурсов на разработку лекарств, разрывающих связь между ВИЧ и CCR5, в надежде защитить людей, не вошедших в число счастливчиков с 32-буквенной делецией в геноме. Но недавние исследования убедительно продемонстрировали, что мы можем достичь того же самого – то есть предотвратить связывание ВИЧ с CCR5, – удалив сам ген CCR5. Множество исследовательских коллективов уже начали попытки сделать это с помощью CRISPR, по крайней мере на клетках в чашках Петри. Но пальма первенства за первое успешное редактирование гена CCR5 у людей принадлежит технологии ZFN, разработанной в калифорнийской компании Sangamo Therapeutics.
Работая вместе с врачами из Пенсильванского университета, исследователи из Sangamo провели клинические испытания препарата для редактирования генома, нокаутирующего ген CCR5. Главной целью первых стадий испытания было выяснить, безопасно ли это средство; ученые хотели узнать, примет ли тело реципиента без серьезных побочных эффектов отредактированные клетки, ДНК которых была модифицирована искусственным путем. Но в конце концов исследование также дало ответ на вопрос, насколько эффективно редактирование генома может обращать вспять ход заболевания.
Все двадцать ВИЧ-положительных пациентов, принимавших участие в исследовании Sangamo, сначала сдали образец крови, из которого были извлечены белые кровяные тельца. Затем эти клетки были отредактированы в пробирке посредством ZFN, который находил и вырезал 155-ю “букву” в гене CCR5. Поскольку репарация разрезанного гена производилась с помощью ненадежного метода соединения концов, изменений, получившихся в результате, было достаточно для того, чтобы инактивировать ген и предотвратить образование функциональных молекул белка CCR5. Затем отредактированным клеткам дали размножиться в лабораторных условиях. Наконец каждому пациенту заново ввели его или ее отредактированные клетки, после чего за состоянием участников эксперимента наблюдали примерно девять месяцев.
Ученые, проводившие испытания, заключили, что вливания клеток иммунной системы с модифицированным CCR5 “безопасны в рамках данного испытания”. Может, это и не самый впечатляющий результат, но тем не менее воодушевляющий признак того, что редактирование генома можно использовать в терапевтических целях на настоящих, живых людях – по крайней мере ex vivo, если клетки выращивать и их геномы редактировать вне организма. А в разделе “Результаты” статьи, описывающей это исследование, скрывались еще более обнадеживающие данные. Врачи обнаружили: вдобавок к тому, что пересаженные клетки долгое время после трансплантации обнаруживались в теле (признак того, что они прижились в организме и стали размножаться), отредактированные клетки задерживали восстановление уровня ВИЧ до прежних значений, когда антиретровирусную терапию на время прерывали. Другими словами, налицо были явные признаки того, что действие ZFN помогло снизить интенсивность инфекции, не таким способом, как обычные лекарства, но благодаря однобуквенным изменениям в геномах пациентов.
Хотя технология ZFN очень бодро стартовала, надо заметить, что CRISPR уже использовали для исследования нескольких возможных способов терапии, направленной на избавление от ВИЧ. Один из подходов включает программирование CRISPR, нацеливающее инструмент на генетический материал от ВИЧ, избавляя клетки пациента от этого вируса, буквально вырезая ДНК инфекционного агента из их геномов. Другой метод лучше всего описывается фразой “оглуши и убей” (shock and kill): в рамках этого подхода используется дезактивированная форма CRISPR – специально для того, чтобы “разбудить” покоящийся вирус: тогда его можно будет атаковать с помощью существующих лекарств.
Стало ясно, что возможности для применения редактирования генома ex vivo в клинике невероятно разнообразны, независимо от того, что именно предстоит лечить – генетические заболевания или вирусные инфекции. Но, конечно, не все болезни коренятся в крови. В случае заболеваний, поражающих “твердые” ткани тела, врачи не могут рассчитывать на методы лечения, требующие извлечения и возвращения поврежденных клеток; аналогичные процедуры в таких случаях будут слишком рискованными и потребуют излишнего инвазивного вмешательства. Чтобы лечить подобные заболевания, нам необходимо доставить CRISPR в тело пациента, к ткани, в которой болезнь проявляется наиболее сильно. И хотя до того момента, когда этот способ лечения можно будет в самом деле предложить пациентам, еще пройдет немало времени, в данной области уже налицо прогресс – в том числе самые невероятные разработки в области медицины из всех, что мне доводилось видеть.
Прежде чем мы сможем лечить пациентов методами редактирования генома in vivo, ученым предстоит решить множество задач, которые редактирование генома ex vivo аккуратно обходит стороной. Врачам нужно понять, как доставить CRISPR в ткани, наиболее затронутые конкретной болезнью. Кроме того, доставку необходимо осуществить таким образом, чтобы не спровоцировать иммунный ответ в телах пациентов. Далее, Cas9 и его направляющая РНК должны быть достаточно стабильными, чтобы дожить в теле до момента окончания редактирования.
Чтобы решить эти задачи, некоторые ученые, работающие с CRISPR, обратились к одному из своих любимых средств доставки – вирусам. Вирусы невероятно искусны в “подкидывании” генетического материала в клетки хозяев – в конце концов, они оттачивали это мастерство миллионы лет. Вирусы хорошо приспособлены к заражению конкретных типов тканей и органов, при этом использование некоторых вирусов стало сравнительно безопасным. Благодаря десятилетиям генной инженерии удалось полностью перевооружить специализированные вирусы таким образом, чтобы они все же могли доставить ДНК в тело – либо в организм в целом, либо к конкретному органу, – но не были способны заразить своих хозяев ничем, кроме терапевтического “полезного груза”, введенного в них исследователями.
Один из векторов – так в генетике называют носителей генетической информации – оказался особенно важным подспорьем для ученых, разрабатывающих варианты редактирования генома in vivo: это безобидный вирус человека, известный как аденоассоциированный вирус (ААВ). ААВ вызывает лишь слабый иммунный ответ, и не известно ни одной болезни человека, которую вызывал бы этот вирус. Этот вирусный вектор легко можно “нагрузить” терапевтическими генами, кодирующими белок Cas9 и направляющую его РНК, – и вирус крайне эффективно доставит свой генетический материал к клеткам хозяина. Более того, вирус можно запрограммировать таким образом, что он не встроит свою ДНК в геном человека навсегда, так, как это делает большинство вирусов. Это свойство помогает избежать вставки неуместной ДНК в геном – именно это затрудняло попытки такой терапии в прошлом.
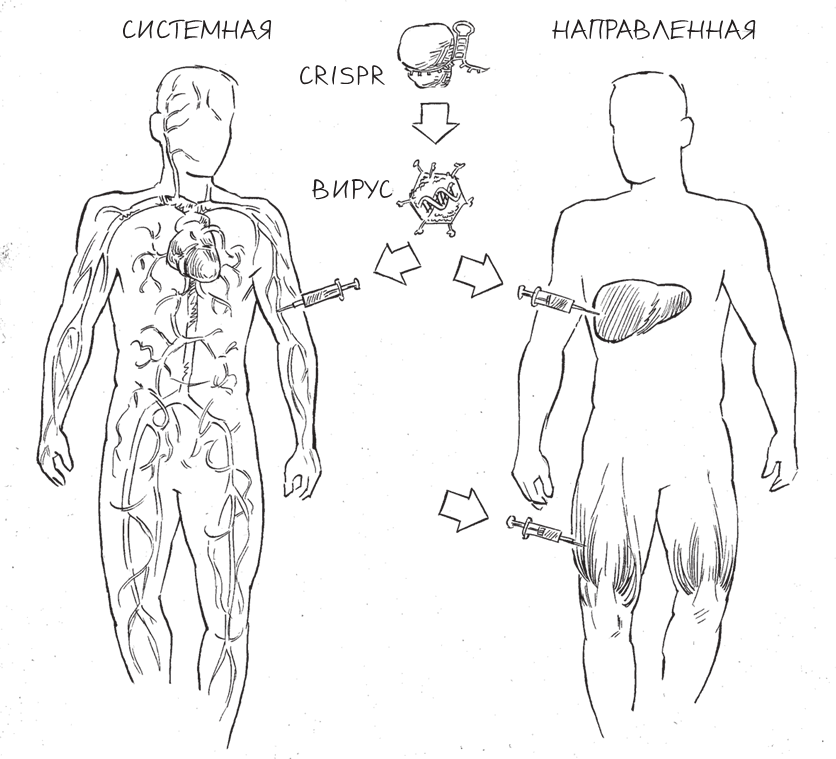
CRISPR-терапия in vivo
Еще одна удобная особенность ААВ – необычайное многообразие форм. Изолируя различные штаммы вируса и затем комбинируя их в различных соотношениях, ученые собрали семейство ААВ-векторов, чьими мишенями могут быть клетки во множестве различных типов тканей. Один из штаммов ААВ может лучше всего подходить для доставки CRISPR в клетки печени, в то время как другой наиболее эффективно работает в центральной нервной системе, легких, глазах либо сердечных и скелетных мышцах.
Именно в мышцах мы увидели одну из самых первых и наиболее ярких демонстраций того, что CRISPR может облегчить симптомы генетического заболевания in vivo. Хотя действие технологии пока испытали только на мышах, есть все основания полагать, что она будет эффективной и в организме человека – не в последнюю очередь потому, что генетическое заболевание, которое пытались лечить с помощью CRISPR, к сожалению, часто встречается у представителей нашего вида.
Смертельная болезнь, истощающая мышцы, – мышечная дистрофия Дюшенна (МДД) – наиболее распространенный тип мышечной дистрофии в мире; ее наследует примерно 1 из 3600 появившихся на свет мальчиков. У пациентов с МДД при рождении нет симптомов болезни, но она проявляется – и прогрессирует с ошеломляющей скоростью – в возрасте около четырех лет. Дети, пораженные МДД, страдают от тяжелой мышечной дистрофии; к десяти годам они обычно уже прикованы к инвалидной коляске, а к двадцати пяти годам большинство из них умирает от затруднений дыхания и от истощения самой главной мышцы тела – сердечной.
Миодистрофия Дюшенна может быть результатом одной из нескольких мутаций в гене DMD – самом крупном из известных генов человека, который кодирует белок под названием дистрофин. Этот белок помогает мышечным волокнам сокращаться, и нехватка функциональных молекул белка дистрофина – основная проблема в случае пациентов с МДД. У мужчин болезнь проявляется значительно чаще; поскольку ген DMD находится на X-хромосоме, а у мужчин в каждой клетке только одна такая хромосома (ее пара – Y-хромосома, наследуется от отца), единственная мутантная копия гена DMD оставляет организм без единой “здоровой” молекулы дистрофина. Напротив, у женщин в каждой клетке две X-хромосомы, а значит – две копии DMD; до тех пор пока одна из двух копий имеет нормальное строение, она способна предотвращать разрушительные симптомы заболевания. И хотя эти женщины не страдают МДД, они являются носителями заболевания и передадут мутантный ген DMD примерно половине своих потомков мужского пола. (Такой характер наследования делает МДД примером рецессивного заболевания, сцепленного с X-хромосомой.)
Сможет ли CRISPR обратить вспять развитие МДД? Ответ на этот вопрос еще предстоит получить – нам все еще потребуются годы доклинических и клинических исследований, – но если недавние эксперименты на мышах о чем-то говорят, есть основания полагать, что терапия in vivo поможет это сделать. К концу 2015-го не менее четырех независимых лабораторий доставили CRISPR в клетки половозрелых мышей, страдающих от мышечной дистрофии, и показали, что разрушительное течение болезни можно обратить вспять. Поместив генетические инструкции для CRISPR в ААВ-векторы, исследователи восстановили волокна скелетных и сердечных мышц либо введением нагруженных этими инструкциями вирусов в мышцы мышей, либо доставкой вирусов в те же ткани через кровоток. Ученые успешно “включили” здоровые гены дистрофина, и у мышей, на которых подействовали таким образом, сила мышц после терапии значительно увеличилась.
Я посетила доклад об этом исследовании, прочитанный Эриком Олсоном, профессором Юго-Западного медицинского центра Техасского университета, и меня воодушевили новые результаты применения CRISPR-терапии in vivo. Работа, о которой идет речь, вселяет в меня надежду, что однажды станет возможным устранять симптомы или даже полностью излечивать другие генетические заболевания, не только МДД. К примеру, используя вариант CRISPR, запрограммированный на редактирование другого гена, и вариант ААВ, наиболее подходящий для доставки в печень, команда исследователей из МТИ применила редактирование генома, чтобы избавить мышей от генетической мутации, вызывающей тирозинемию. У людей эта болезнь может приводить к накоплению токсичных продуктов обмена и обширному повреждению печени; если ее не лечить, пациенты обычно погибают, не достигнув десятилетнего возраста. В модели болезни на мышах тем не менее CRISPR “починил” поврежденный ген и обратил ход заболевания.
ААВ также доставил CRISPR в мозг взрослых мышей, в их легкие и в клетки сетчатки глаза. Каждый такой эксперимент может дать начало своему виду лечения генетических заболеваний, таких как хорея Гентингтона, муковисцидоз и врожденная слепота. Кстати, первый препарат для генной терапии, разрешенный для коммерческого использования на Западе, включает в себя ААВ-вектор, и, возможно, первое средство для редактирования генома на основе CRISPR, доставляющееся в клетки in vivo, будет действовать так же.
И все же ААВ – лишь один из многих способов доставки, разработанных для перемещения CRISPR в живые клетки целого организма. В одном только мире вирусов существует множество переоснащенных “троянских коней”, доступных для использования, и у каждого из них собственный набор достоинств и недостатков. Один из примеров – аденовирус, который вызывает простуду (и помогает аденоассоциированным вирусам заражать своих хозяев, откуда и проистекает имя последних). После “потрошения” этих вирусов и удаления их генов, ответственных за развитие заболеваний, ученые могут внедрить в них большее количество терапевтической ДНК, чем позволяют ААВ-векторы. Лентивирусы, наиболее известный пример которых – ВИЧ, также удалось обезвредить в лаборатории и превратить в эффективные средства доставки терапевтических средств. Их емкость близка к емкости ААВ, но они способны навсегда встраивать свой генетический материал в ДНК клеток, в которые они вторгаются. Эта особенность удобна для фундаментальных лабораторных исследований, а для проведения терапии in vivo ученые могут “выключить” функцию встраивания.
Кроме того, существуют также стратегии доставки, вообще не задействующие вирусы. Используя новейшие достижения нанотехнологий – то есть технологий, работающих с субмикроскопическими размерами, – исследователи тестируют различные способы применения липидных наночастиц для транспортировки CRISPR по телу. Устойчивые к деградации и легкие в производстве, эти средства доставки имеют еще одно преимущество: они выпускают белок Cas9 и его направляющую РНК строго по дозам. Вирусы (и их груз – CRISPR) могут находиться в клетках долгое время, что, как я объясню дальше, может приводить к проблемам в процессе редактирования, а липидные наночастицы доставляют CRISPR таким образом, что он быстро действует до того, как его разберут “мусороперерабатывающие заводы” клетки.
Помимо разработки препаратов для лечения ряда генетических заболеваний, есть еще одна область биотехнологий, где CRISPR имеет все шансы совершить революцию. А сама эта область тоже вполне революционным образом меняет наш подход к исследованию и лечению одной из самых страшных болезней, известных человечеству, – к лечению рака.
Рак вызывается мутациями в ДНК, часть из которых унаследованы, а часть – накоплены в ходе жизни пациента. Поэтому кажется очевидным, что редактирование генома способно помочь вылечить рак или даже предотвратить его, убрав эти мутации до того, как они нанесут непоправимый вред. Но это не та область, в которую CRISPR вносит наибольший вклад, – по крайней мере, в настоящий момент.
В онкологии CRISPR не служит терапевтическим средством сам по себе, а играет роль инструмента, обеспечивающего работу существующих способов терапии. Он расширяет наше понимание биологии рака, а также ускоряет действие иммунотерапии, которая использует собственную иммунную систему пациента для борьбы со злокачественными опухолями. На обоих указанных фронтах CRISPR демонстрирует свою пригодность и в качестве еще одного оружия – и одного из мощнейших – в растущем арсенале нашей многолетней войны со страшным недугом.
Из всех вкладов CRISPR в медицину этот мне ближе всех. Даже если вы сами не болели раком, велика вероятность, что вы знаете кого-то, чью жизнь он испортил или оборвал. Если говорить о моей семье, то смерть моего отца от меланомы глубоко потрясла нас, и этот опыт привлек мое внимание ко множеству проблем, с которыми люди сталкиваются, когда имеют дело с этой болезнью. Рак – одна из наиболее частых причин смерти в Соединенных Штатах, уступающая только заболеваниям сердца. Хотя повышение эффективности ранней диагностики и лечения существенно повысили показатели выживаемости в последние десятилетия, смерти от рака по-прежнему являются ужасающей частью повседневности. В одних только США за год выявляют более полутора миллионов новых случаев рака, и полмиллиона людей погибает от рака каждый год. Это больше полутора тысяч смертей в день.
Мутации в ДНК, связанные с раком, иногда наследуются; они также могут возникать спонтанно или вызываться употреблением табака или действием других канцерогенов. В последние десять лет или около того мы начали все чаще использовать секвенирование ДНК для создания каталога бесчисленных мутаций, отличающих раковые клетки от здоровых. Логика в том, что если эти мутации можно выявить, то возможно и создание лекарств, останавливающих действие любых генов, запускающих размножение (пролиферацию) клеток, уже прошедших злокачественное перерождение.
Но вот беда: у нас попросту слишком много информации. Действительно важные онкогенные мутации тонут в глубоком море “дополнительных”, которые сами по себе не меняют течение болезни. Вообще, один из характерных признаков рака – повышенная частота, с которой мутации ДНК закрадываются в геном, усложняя выявление именно тех мутаций, которые на самом деле играют важнейшую роль в образовании опухолей.
До CRISPR арсенал инструментов для изучения онкогенных мутаций был довольно ограниченным: ученые могли обнаружить и идентифицировать мутации в образцах живых тканей, взятых у пациентов в ходе биопсии, и изучить небольшое число конкретных мутаций на мышиных моделях. Но сейчас, когда у исследователей появилась возможность точно воспроизвести мутации, вызывающие рак, – по одной или по несколько сразу, причем за небольшую долю того времени, которое требовалось раньше, и гораздо дешевле, чем раньше, – исследования в области онкологии просто не могли не расцвести. Вместо скрупулезного выискивания клеток, мутировавших строго определенным образом (с эффективностью один к миллиону), или разведения мышей необходимых линий (на что требуются годы) ученые могут использовать CRISPR для эффективного внедрения мутаций всего за одно поколение. Эта способность позволяет ученым эффективнее выявлять генетические факторы, из-за которых клетки перестают отвечать на сигналы, в норме регулирующие их рост.
К примеру, в одном из исследований, проведенных Гарвардской медицинской школой, группа ученых под руководством Бенджамина Эберта хотела понять генетические причины острого миелоидного лейкоза, рака белых кровяных телец. Запрограммировав CRISPR на редактирование различных генов – для каждого из них использовали свою соответствующую направляющую РНК, – они сумели нокаутировать восемь кандидатных генов. Такое множественное редактирование генома раньше невозможно было представить, но с CRISPR оно стало простым. После редактирования генов в стволовых клетках крови во всех возможных сочетаниях и последующего их возврата в организм живых мышей исследователи некоторое время ждали – смотрели, у кого из животных все-таки разовьется острый лейкоз (вариант обратного применения технологии ex vivo). Затем, сравнивая результаты этого эксперимента с тем, что получалось на мышах, которым определенные гены “выключили” посредством CRISPR, группа Эберта определила точное сочетание мутаций, необходимое и достаточное для развития лейкоза. Подобные опыты бесценны для прогресса в исследовании рака у человека.
Способность редактировать множество генов сразу – одна из ключевых характеристик CRISPR. Процедура настройки CRISPR таким образом, чтобы он научился нацеливаться на новую 20-буквенную последовательность в геноме (в отличие от аналогичной процедуры для технологий, предшествовавших CRISPR), достаточно проста, чтобы ее освоил старшеклассник, – более того, можно даже запрограммировать на ее выполнение компьютер. Сейчас исследователи используют методы вычислительных наук и редактирование генов, чтобы проникнуть в глубины генома в погоне за новыми генами, которые ассоциируются с раком и о которых у ученых пока нет никакой информации.
Технически это непросто сделать, но в конечном счете этот подход со всеобщим наложением (ultimate multiplexing approach) позволяет исследователям редактировать и нокаутировать каждый ген в геноме – и это в рамках единственного эксперимента. Дэвид Сабатини, профессор из МТИ, был одним из первых, кто провел такой полногеномный скрининг нокаутов (genome-wide knockout screen). Однако группа Сабатини не задавалась вопросом, какие генные мутации вызывают рак (этот вопрос исследовала группа Эберта). Сабатини хотел выявить генные мутации, делающие рак невозможным, – другими словами, определить, существуют ли гены, без мутаций в которых клетки совершенно неспособны стать раковыми. В ходе поистине виртуозной работы команда Сабатини исследовала этот вопрос для четырех различных линий злокачественно переродившихся клеток крови и обнаружила целый пласт новых генов, по-видимому играющих ключевую роль для процветания таких клеток. За счет выявления новых вариантов генетической предрасположенности к лейкозам и лимфомам эти эксперименты указали на новые перспективные мишени для химиотерапии.
Последующие исследования, проведенные в других лабораториях, обнажили слабые места других типов рака, и в числе этих типов колоректальный рак, рак шейки матки, меланома, рак яичников и глиобластома (особенно агрессивный вариант рака мозга). Ученые даже применили полногеномные поиски для определения неизвестных генетических факторов, дающих раковым клеткам страшную способность перемещаться с кровотоком и внедряться в “чужие” ткани, то есть участвовать в процессе под названием “метастазирование”.
Прогресс в нашем понимании рака может быть слишком медленным с точки зрения полезной практической информации и конкретных новых методов лечения, но важность данной работы невозможно переоценить. По мере персонализации медицины ученым и врачам приходится иметь дело со все большим количеством информации, позволяющей отличить рак у одного пациента от рака у другого, и такая информация будет давать подсказки, как подобрать схему лечения, наилучшим образом подходящую для биологии конкретного типа заболевания. Инструменты редактирования генома помогут извлечь пользу из этой информации, выявляя, какие мутации наиболее тесно связаны с раком и какие мутации могут уменьшить или увеличить восприимчивость конкретных раковых клеток к конкретным лекарствам.
Однако есть намеки на то, что редактирование генома способно быть не только инструментом разведки в борьбе человечества с раком, но и оружием. В этом плане его наиболее многообещающая роль – система поддержки формы лечения, на которую в последние годы обращают особенно много внимания: иммунотерапия. Этот революционный метод борьбы с раком отличается от трех “классических”, давно применяемых типов лечения – оперативного вмешательства, лучевой терапии и химиотерапии. В отличие от этих более старых подходов, иммунотерапия рака нацелена на использование иммунной системы самого пациента для выслеживания и поимки опасных клеток. Иммунотерапия проводится в рамках совершенно отличной от предыдущих парадигмы, и ее мишенью служат не опухоли, а тело больного: она дает пациенту силы самостоятельно бороться с раком.
Ключевая идея в основе иммунотерапии рака заключается в том, чтобы настроить иммунную систему человека, и в особенности ее главную силу – Т-клетки. Программируя эти клетки на распознавание молекулярных меток рака, ученые помогают Т-клеткам запускать иммунный ответ для уничтожения раковых клеток. Главная задача – выяснить, каким образом полностью реализовать потенциал Т-клеток.
Одна из многообещающих разработок включает ингибиторы контрольных точек – лекарства, отключающие тормоза, которые обычно ограничивают иммунный ответ на раковые клетки. В рамках другой стратегии создаются генетически модифицированные Т-клетки, которые нацеливаются точно на рак конкретного пациента. Этот процесс, представляющий собой очередной пример терапии ex vivo, известен как адоптивный перенос клеток, и именно в этой разновидности иммунотерапии на сцену выходит редактирование генома.
Основная цель адоптивного переноса клеток, или АПК, – повысить способность Т-клеток находить раковые клетки. Т-клетки наделяют новым геном, кодирующим белок, который называется рецептор и настроен распознавать молекулярные метки рака и наводить атаку на них. Но есть проблема: у Т-клеток уже имеется “природный” ген рецептора, и наличие сразу нескольких подобных генов вызовет беспорядок на молекулярном уровне. В настоящее время ученые могут избежать этого, используя CRISPR для нокаутирования “родного” гена рецептора и таким образом расчищая место под ген рецептора, способный обнаруживать рак. Затем к тем же клеткам можно применить другие варианты редактирования генов, делающие их еще более эффективными.
Представляется вероятным, что редактирование генома сделает шаг вперед и преобразует иммунотерапию рака в более простой в применении метод, когда единственную партию Т-клеток, настроенную на борьбу с конкретным видом рака, можно дать фактически всем пациентам, страдающим от данного заболевания. Сейчас проводятся клинические испытания этого варианта переноса клеток, и трогательная история, датируемая концом 2015 года, дает представление о его потрясающих возможностях. Фактически героиня этой истории Лайла Ричардс – первый человек, чья жизнь была спасена благодаря терапевтическому редактированию генома.
В то время Лайле был год, и она страдала от острого лимфобластного лейкоза – именно эта форма рака наиболее часто встречается у детей. Врачам лондонской клиники, где лечилась Лайла, пришлось признать, что у девочки один из наиболее агрессивных видов лейкоза, которые им доводилось видеть. Хотя примерно у 98 % детей с этой болезнью после начала лечения наблюдается ремиссия, состояние Лайлы не улучшалось – несмотря на химиотерапию, пересадку костного мозга и применение препарата, основанного на антителах. Пересадка собственных перенастроенных клеток Лайлы обратно в ее организм тут не годилась: иммунная система девочки была настолько ослаблена лейкозом (в конце концов, этот недуг портит как раз те белые кровяные тельца, что нужны для нормальной работы иммунной системы), что у нее не хватало Т-клеток для извлечения и последующего изменения.
Положение Лайлы выглядело безрадостным, и доктора уже предложили родителям девочки паллиативный уход, чтобы облегчить предсмертные страдания. Но затем, в последнюю минуту, открылась новая возможность лечения.
В той же самой больнице, где проходила лечение Лайла, размещалась лаборатория, редактирующая Т-клетки с помощью TALEN, одной из технологий, предшествовавших CRISPR. Клетки подготавливала французская биотехнологическая компания под названием Cellectis – для использования в клинических испытаниях. Получив разрешения от родителей Лайлы и Cellectis, врачи первыми применили эти непроверенные клетки для лечения живого человека. Подобное разрешается в исключительных обстоятельствах.
Т-клетки, которые получила Лайла, были в некотором смысле особенными. Во-первых, они несли новый ген рецептора, специально настроенного так, чтобы он выявлял любые клетки, содержащие молекулярные метки лейкоза. Во-вторых, геном Т-клеток был отредактирован таким образом, чтобы Т-клетки не запускали иммунный ответ против собственных клеток Лайлы, что было бы неизбежно, не будь они отредактированы (донор и реципиент в данном случае не были иммуносовместимыми). Наконец, в геном Т-клеток были внесены поправки, делавшие их “невидимыми” для местных иммунных клеток, благодаря чему они могли дольше выживать в теле Лайлы.
В течение нескольких недель после введения клеток в организме годовалой девочки произошли чудесные изменения: ее лейкоз начал реагировать на присутствие отредактированных Т-клеток. Лайле снова провели пересадку красного костного мозга, когда ее здоровье улучшилось достаточно, и через несколько месяцев уже наблюдалась стабильная ремиссия. То, что началось как очень рискованное предприятие – тестирование метода лечения, который до этого проверяли только на мышах, – обернулось ошеломительным успехом и весомым свидетельством в пользу применения редактирования генома в новых средствах для иммунотерапии.
Благодаря случаю Лайлы (и некоторым другим) компании по производству средств CRISPR-терапии уже заключили с производителями средств иммунотерапии масштабные договоры о совместных разработках. Editas Medicine получила от Juno Therapeutics исключительные права на разработку препаратов для Т-клеточной терапии, а Intellia Therapeutics объединила усилия с гигантом здравоохранения Novartis, чтобы подобным же образом развивать иммунотерапию рака. Национальные институты здравоохранения одобрили первые в США клинические испытания CRISPR-отредактированных клеток, проведенные учеными из Пенсильванского университета, и в октябре 2016-го группа китайских исследователей из Сычуаньского университета впервые сделала людям инъекции клеток, модифицированных с помощью CRISPR. Эти похвальные начинания помогут открыть доступ к положительным эффектам от редактирования генов тем пациентам, кто в них нуждается.
Я искренне надеюсь, что история Лайлы однажды перестанет быть исключительной и превратится просто в один из множества примеров спасения человеческой жизни в результате прорывов в редактировании генома. Определенно, мы потихоньку движемся к этому светлому будущему. Однако прежде чем мы окажемся там, нам нужно будет решить одну большую проблему редактирования генома. До тех пор пока эта проблема – проблема точности поправок, вносимых CRISPR, – не будет решена, случай Лайлы и подобные ему не смогут из исключений превратиться в правило.
CRISPR – по крайней мере, его изначальная версия, которой обладают прокариоты, – не стопроцентно точный метод разрезания ДНК. Это было очевидно еще при проведении самых первых экспериментов с CRISPR в моей лаборатории.
После определения основной функции CRISPR Мартин приступил к измерению точности разрезающего ДНК фермента Cas9 и его направляющей РНК. Казалось, что этот крошечный самонаводящийся снаряд способен находить и атаковать любые последовательности ДНК, совпадающие с его направляющей РНК, выслеживая их с впечатляющей точностью. Но есть ли пределы его точности? Действительно ли может CRISPR отличать одну двадцатибуквенную последовательность – ту, что подходит его РНК, – от остальных последовательностей, которые, вероятно, отличаются от этой всего на одну-две “буквы” ДНК? Чтобы появилась хоть какая-то надежда на превращение этой бактериальной системы защиты в достаточно безопасное для использования на людях средство редактирования генома, требовалось прежде всего ответить на этот вопрос.
Мартин обнаружил, что, когда он “спустил” CRISPR-систему на последовательности ДНК, в которых некоторые “буквы” были специально заменены на неправильные и больше не подходили РНК, фермент Cas9 в ряде случаев все же разрезал ДНК. Выходило, что CRISPR порой может совершать ошибки и путать одни “буквы” ДНК с другими, – да, точность функции поиска на компьютере явно выше: она не выдаст вам документы со словом “эффект” вместо запрошенных файлов со словом “аффект”.
Позже мы совместно с коллективом ученых из Гарвардского университета под руководством Дэвида Лю повторили эти эксперименты гораздо тщательнее. Мы провели исчерпывающее тестирование различных мутаций ДНК, чтобы определить, какие нецелевые (то есть не совпадающие с направляющей РНК) последовательности достаточно похожи на целевую последовательность (совпадающую с направляющей РНК), чтобы их обнаружил и вырезал CRISPR. Другие лаборатории тоже проводили похожие эксперименты в клетках, чтобы показать, каким образом сделанные CRISPR ошибочные надрезы могут привести к перманентным изменениям ДНК в тех местах, куда их не предполагалось вносить.
Само собой, буквально все медицинские препараты обладают какой-либо нецелевой активностью – и до тех пор, пока эти риски перевешивает польза от целевых эффектов, врачи и регуляторы в целом весьма снисходительны. К примеру, антибиотики уничтожают и патогенные, и полезные штаммы бактерий, а препараты для химиотерапии убивают и раковые клетки, и здоровые. Но в случае CRISPR проблема в специфичности: тут речь о разработке лекарства, которое настолько точно нацелено на свою предполагаемую мишень, что изменение положения всего нескольких атомов ослабит взаимодействие в такой степени, что лекарство не будет давать побочных эффектов.
Какая-то нецелевая активность всегда неизбежна (и поэтому в инструкции к любому лекарству есть пункт о побочных эффектах), но если речь идет о редактировании генома, то эти побочные эффекты могут быть особенно опасными. В конце концов, побочные эффекты от лекарства обычно проходят, когда пациент прекращает его прием, – однако в случае редактирования генома любая нецелевая последовательность ДНК, будучи однажды отредактирована, изменится необратимо. Непреднамеренные изменения ДНК не только сохраняются навсегда, но и будут скопированы в каждую клетку-потомка изначальной клетки. И хотя большая часть случайных изменений вряд ли нанесет повреждения клетке, но – если мы правильно понимаем результаты исследований некоторых разновидностей рака и других заболеваний, – даже одной мутации может быть достаточно, чтобы нанести серьезный ущерб организму.
К счастью, нецелевые правки ДНК, внесенные CRISPR (как и другими технологиями редактирования генома), чаще всего весьма предсказуемы, поскольку они появляются только в последовательностях ДНК, наиболее сходных с соответствующей направляющей РНК. Если CRISPR запрограммирован на обнаружение 20-буквенной последовательности в гене X, но ген Y содержит сходную последовательность, отличающуюся лишь на одну “букву”, есть определенная вероятность, что CRISPR внесет правки в оба гена. Чем меньше две последовательности похожи друг на друга, тем ниже вероятность появления нецелевых мутаций.
Исследователи уже начали искать окружные пути, позволяющие обойти эту потенциальную трудность. Во многих лабораториях были написаны компьютерные алгоритмы, автоматически проверяющие состоящий из трех миллиардов “букв” человеческий геном: сколько его участков несут в себе последовательность, близкую к той, которую собираются отредактировать ученые. Если число нецелевых последовательностей ДНК, которые могут быть затронуты, слишком велико, то исследователь при помощи алгоритма сможет выбрать в качестве мишени другой участок (во многих случаях ученые могут редактировать один и тот же ген, выбрав из нескольких близко расположенных последовательностей ДНК). Впрочем, недостаток этого подхода в том, что компьютерный алгоритм – независимо от того, насколько хорошо он написан, – не всегда может успешно предсказать нецелевые правки.
Эти “известные неизвестные” заставили исследователей прибегнуть ко второй стратегии: по умолчанию исходить из того, что не известно вообще ничего. Они полагают, что каждая версия CRISPR неизбежно продемонстрирует нецелевые эффекты и единственный способ обнаружить их – сначала просто провести эксперимент, а затем уже разыскивать новые мутации в местах, где их не должно быть. Вместо предсказаний на основе компьютерных вычислений эта стратегия предполагает простую эмпирическую проверку. Прежде чем выбирать последовательность ДНК для редактирования у пациентов, ученые в рамках этой стратегии проводят исчерпывающую проверку нескольких близких последовательностей ДНК в культуре клеток, определяют, какие из них дадут наименьшее количество нецелевых “срабатываний” CRISPR, и только потом – когда определится “победитель” – приступают к клиническим испытаниям.
Существует и третья стратегия избегания потенциальных нецелевых мутаций, и в ней ученые уже добились значительных успехов: настройка CRISPR таким образом, чтобы он четко отличал целевую ДНК от других. К примеру, удалось успешно расширить последовательность нуклеотидов ДНК, которую CRISPR требуется распознать, уменьшив вероятность несовпадений, – нечто подобное вы делаете, удлиняя пароль, чтобы снизить вероятность, что кто-нибудь его подберет. За счет одного лишь изменения оригинальной версии белка Cas9 в нескольких различных местах – замены одних аминокислот на другие – исследователи, в том числе Кит Джоунг из Гарвардской медицинской школы и Фэн Чжан из МТИ, разработали высокоточные версии CRISPR, менее склонные к нецелевому редактированию генома, чем версия той же системы, созданная самой природой.
Наконец, размер введенной дозы CRISPR влияет на вероятность появления в геноме непредвиденных мутаций. В целом чем больше молекул Cas9 и направляющей РНК получает клетка и чем дольше они в ней находятся, тем выше вероятность, что CRISPR обнаружит близкие, но все же иные последовательности и внесет нецелевые правки. Фокус в том, чтобы ввести в клетки ровно столько CRISPR, чтобы он отредактировал только нужные фрагменты ДНК, и не более того.
Оттачивая этот метод в лаборатории, исследователи продолжают работу, дабы убедиться, что CRISPR можно безопасно вводить пациентам. Если достигнутое ими что-нибудь значит, то пройдет не слишком много времени, прежде чем точность этой молекулярной машины станет приемлемой для ее применения в клинике – а не только в лаборатории.
Технология CRISPR появилась всего несколько лет назад, но уже сейчас непросто найти заболевание, которое не предлагали лечить с ее помощью. Помимо рака, ВИЧ-инфекции и уже упомянутых генетических заболеваний, быстрый поиск по опубликованным научным статьям выдает непрерывно растущий список болезней, потенциальные методы избавления от которых были разработаны с помощью CRISPR: ахондроплазия (карликовость), хронический гранулематоз, болезнь Альцгеймера, врожденная тугоухость, боковой амиотрофический склероз (БАС), высокое содержание холестерина в крови, диабет, болезнь Тея – Сакса, заболевания кожи, синдром ломкой X-хромосомы и даже бесплодие. Практически во всех случаях, когда конкретную мутацию или дефектную последовательность ДНК можно связать с патологией, CRISPR в принципе может обратить мутацию или заменить поврежденный ген на “здоровую” последовательность нуклеотидов.
Благодаря легкости, с которой CRISPR находит и “чинит” любую последовательность ДНК, этот инструмент часто называют “прорывом, благодаря которому болезни исчезнут с лица Земли”. Но не все так просто. Существует множество недугов – от аутизма до болезней сердца, – у которых нет четко выраженной генетической подоплеки или же они вызваны сложным сочетанием генетических факторов и условий окружающей среды. В этих случаях редактирование генома не слишком поможет. Кроме того, даже если редактирование генома способно “починить” ДНК в культурах клеток человека, пройдут годы, прежде чем его эффективность (или неэффективность) будет показана в клинике. А несколько успешных клинических испытаний (в комбинации с иммунотерапией рака и в лечении ВИЧ) еще не гарантируют, что на этом пути будут достигнуты и дальнейшие успехи.
Более ранние технологии генной инженерии, включая генную терапию и РНК-интерференцию, тоже (как впоследствии CRISPR) превозносились как знаковые прорывы, которым суждено полностью преобразить медицину, – однако сотни неудачных клинических испытаний заметно охладили этот энтузиазм. Я не говорю, что нас ждет аналогичный “холодный душ” и в случае редактирования генома, я лишь напоминаю, что важно отличать ажиотаж от реалистичных ожиданий, методических исследований и тщательно проведенных клинических испытаний. Только при этом условии мы будем уверены, что первая волна средств CRISPR-терапии имеет максимальные шансы на успех и минимальный риск опасных побочных эффектов.
Когда я пишу эти строки, эти средства, основанные на редактировании генома, развиваются с небывалой скоростью – и это касается как фундаментальных исследований, так и коммерческих разработок. Новые работы появляются c частотой примерно пять публикаций в день, а инвесторы уже вложили существенно больше миллиарда долларов в разнообразные стартапы, связанные с основанными на CRISPR биотехнологическими инструментами и терапевтическими средствами.
Я невероятно радуюсь любым успехам в области CRISPR (а они феноменальны) и каждый раз настроена оптимистично, когда узнаю об очередном таком успехе, – за исключением лишь одной области применения этой технологии. Я считаю, что нам следует воздержаться от использования CRISPR для необратимого редактирования геномов будущих поколений людей – по крайней мере до тех пор, пока мы не обдумаем как следует все проблемы, которые могут возникнуть при редактировании генома клеток зародышевого пути. Пока у нас не будет четкого понимания всех проблем безопасности и этических проблем, пока мы не позволим присоединиться к обсуждению этих проблем максимальному числу заинтересованных лиц, ученым лучше не трогать клетки зародышевого пути. Но на самом деле еще большой вопрос, достигнем ли мы вообще когда-нибудь достаточного морального и интеллектуального уровня, чтобы управлять судьбой собственного генофонда, – и я думаю над этим вопросом с тех пор, как начала понимать, на что способен CRISPR. По этой и по ряду других причин я провожу четкую границу между процедурами, описанными в этой главе, – и тем, что может быть использовано в редактировании геномов клеток зародышевого пути. Стоит подумать дважды, прежде чем пересекать эту границу. А потом подумать еще раз.
Назад: Глава 5 CRISPR-зоопарк
Дальше: Глава 7 Подсчет рисков

