Исследование № 36
Мутирующее человечество: что мы узнали о своих мутациях за 15 лет геномной эры
Нередко приходится слышать, что биологическая эволюция человека прекратилась и ее место заняла эволюция культурная. Это неправда: оба процесса идут рука об руку. Биологическая эволюция человека остановиться не может хотя бы потому, что нельзя остановить мутагенез, а ведь мутации – основа эволюционных изменений. Отбор тоже не может перестать действовать, поскольку никакая культура и никакая цивилизация не в силах отменить влияние генотипа на приспособленность (которая в современных развитых обществах благодаря очень низкой детской смертности почти целиком сводится к репродуктивному успеху – числу оставляемых потомков). Скорее наоборот: по мере развития цивилизации вклад случайных внешних факторов в изменчивость по репродуктивному успеху сглаживается, а относительный вклад генов растет. Чтобы понять современные эволюционные тенденции, для начала необходимо выяснить, с какой частотой возникают мутации у современных людей. В последние годы появилась возможность весьма точно оценить масштаб и специфику мутагенеза в современных человеческих популяциях. Этой возможностью мы обязаны в первую очередь прорыву в прочтении генома человека. В 2000 году был получен первый черновой вариант человеческого генома – положено своего рода символическое начало “геномной эре” в биологии. С того момента знания о мутациях, то и дело возникающих в наших генах, многократно увеличились, а методы изучения мутаций стали намного эффективнее и разнообразнее. В 2015 году журнал Science опубликовал обзорную статью американских генетиков, в которой подводятся итоги изучения мутационного процесса у Homo sapiens за первые полтора десятилетия геномной эры (Shendure, Akey, 2015).


Мутагенез – одно из самых фундаментальных биологических явлений. Геномы всех без исключения живых существ подвержены мутациям. Случайные изменения в последовательности нуклеотидов ДНК возникают как во время репликации ДНК, так и в промежутках между актами репликации (например, под действием ультрафиолетового излучения и других мутагенов). Большинство мутаций сразу исправляется специальными системами починки (репарации) ДНК, но даже самые сложные и совершенные системы репарации не обеспечивают стопроцентную защиту.
Темп мутагенеза сильно различается у разных организмов, однако ни у одного существа – от вирусов до человека – он не равен нулю. Этот факт может показаться тривиальным, но на самом деле он требует объяснений, и вот почему.
Как правило, среди не нейтральных (влияющих на приспособленность) мутаций гораздо больше вредных, чем полезных. Так получается по чисто вероятностным причинам: случайно испортить сложный работающий механизм или осмысленный текст гораздо проще, чем случайно его подправить. Следовательно, чем ниже темп мутагенеза, тем выше, при прочих равных условиях, будет средняя приспособленность потомков данного организма. Поэтому отбор, казалось бы, всегда должен благоприятствовать снижению темпов мутагенеза. Системы репликации и репарации под действием отбора должны становиться все точнее и эффективнее. Почему же они так и не стали абсолютно безошибочными?
Причин, скорее всего, две. Первую можно условно назвать экономической. Сверхточные системы репликации и репарации, по всей вероятности, были бы слишком дороги: громоздки, энергоемки, их работа замедляла бы репликацию или имела какие-то другие неприятные побочные эффекты. К тому же чем точнее работают эти системы, тем слабее давление отбора, направленного на их дальнейшее усовершенствование.
Вторая причина состоит, конечно же, в том, что полезные мутации тоже происходят, причем иногда – например, при резком изменении условий среды – вероятность того, что случайная мутация принесет пользу, оказывается не такой уж и низкой (это было очень наглядно показано в Исследовании № 4). Поэтому, хотя средняя приспособленность потомков у мутирующих организмов всегда ниже, чем у немутирующих, разброс приспособленности и максимальная приспособленность у первых выше. В результате в переменчивой среде преимущество будет на стороне мутирующих организмов не только в долгосрочной перспективе (тысячи и миллионы лет), но и в краткосрочной (в масштабе одного или нескольких поколений).
Так или иначе, мутации неизбежны, вредных среди них гораздо больше, чем полезных, и всему живому приходится с этим мириться (и, более того, к этому приспосабливаться). Мы, люди, не только не являемся исключением, но даже, вместе с остальными млекопитающими, сильно опережаем большинство живых существ по темпам мутагенеза в расчете на особь за поколение (рис. 36.1).
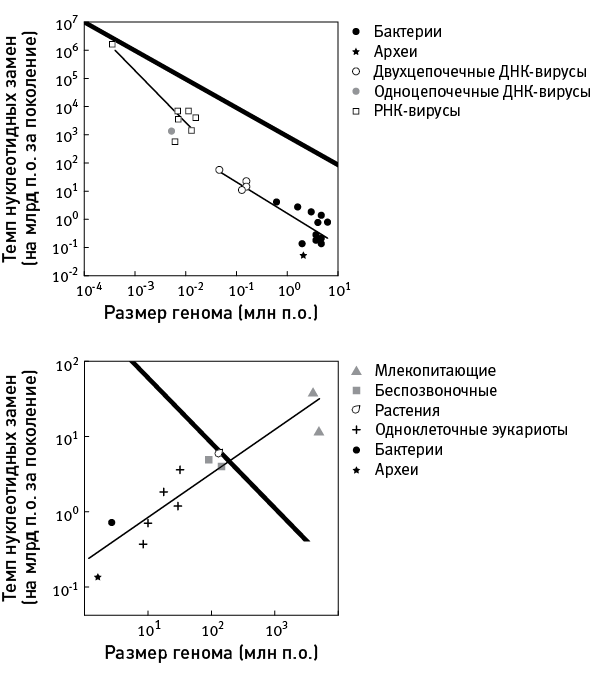
рис. 36.1. Скорость мутагенеза у разных организмов. По вертикальной оси – темп нуклеотидных замен (на миллиард пар оснований за поколение), по горизонтальной – размер генома (в миллионах пар оснований). Вверху – вирусы и прокариоты, внизу – эукариоты (на втором графике также показаны усредненные значения для бактерий и архей). Толстая черная линия соответствует уровню мутагенеза, равному одной мутации на геном за поколение. Видно, что у вирусов и прокариот чем больше геном, тем ниже темп мутагенеза, тогда как у эукариот наблюдается обратная зависимость. Видно также, что млекопитающие характеризуются экстремально высоким темпом нуклеотидных замен. По рисунку из Lynch, 2010a.
Геном Homo sapiens впервые был вчерне прочтен в 2000 году. С того момента началась новая эра в изучении мутационного процесса у нашего вида. Благодаря стремительному развитию технологий секвенирования и анализа геномных последовательностей сегодня мы знаем неизмеримо больше, чем в начале XXI века, о темпе мутаций, о закономерностях их распределения по геному, об их роли в развитии различных патологий и о других особенностях нашего мутагенеза, имеющих как теоретическое, так и практическое значение.
Темп мутаций зародышевой линии. Все мутации подразделяются на соматические (происходящие в соматических, то есть неполовых, клетках организма) и мутации зародышевой линии, меняющие геном половых клеток и передающиеся по наследству потомкам. С медицинской точки зрения важны оба типа мутаций, с эволюционной – вторые, конечно, важнее.
Первые оценки скорости, с которой возникают мутации в зародышевой линии у человека, были сделаны задолго до геномной эры, однако их точность была невелика. Сегодня для этого используют несколько подходов. Один из них – изучение родословных с целью подсчитать вновь возникающие мутации с четким фенотипическим эффектом и высокой пенетрантностью (то есть такие, которые меняют фенотип, во-первых, строго определенным образом, во-вторых – наверняка). Как правило, изучают мутации, вызывающие врожденные патологии – менделевские (передающиеся потомкам в соответствии с законами Менделя) наследственные болезни. Они наследуются по Менделю, потому что вызываются единичными мутациями, а не хитрыми комбинациями десятков и сотен “аллелей риска” в сочетании с факторами среды. В одном из исследований, основанных на этом подходе, темп однонуклеотидных замен у людей был оценен в 1,28 мутации на 100 млн пар оснований за поколение, или 1,28 × 10–8 на нуклеотид за поколение (Lynch, 2010b). Поскольку в диплоидном геноме человека примерно 6 млрд пар оснований, это соответствует 77 новым мутациям на геном за поколение.
Другой подход к оценке скорости мутирования основан на сравнении геномов человека и других приматов. Подсчитав различия в нейтральных (не находящихся под действием отбора) участках генома, нужно сопоставить результат со временем существования последнего общего предка сравниваемых видов (насколько это время можно оценить по палеонтологическим данным). Согласно нейтральной теории молекулярной эволюции, скорость накопления нейтральных генетических различий между видами в идеале определяется просто-напросто скоростью нейтрального мутагенеза (за одно поколение между двумя видами накапливается столько же различий, сколько новых мутаций возникает суммарно у среднестатистической особи первого вида и среднестатистической особи второго). Поэтому, зная время дивергенции, темп мутагенеза можно рассчитать по формуле m = D/2t, где D – число нейтральных различий между видами, t – время жизни последнего общего предка, измеряемое в “поколениях назад”. Двойка в формуле появляется из-за того, что оба вида после расхождения накапливали мутации независимо друг от друга (обо всем этом подробно рассказано в нашей книге “Эволюция. Классические идеи в свете новых открытий”).
Впрочем, существует куча факторов, нарушающих правильный ход “молекулярных часов”, да и палеонтологические датировки для последних общих предков, мягко говоря, не всегда точны. Поэтому надежность данного метода невысока. Неудивительно, что результаты он дал несколько иные. Например, после прочтения генома шимпанзе темп человеческого мутагенеза был оценен в 2,2 × 10–8 замен на нуклеотид за поколение, или 132 новых мутации на каждого новорожденного. Это почти вдвое больше, чем показал анализ наследственных болезней (и другие, еще более надежные методы, о которых речь пойдет ниже). Расчеты основывались на предположении, что предки человека и шимпанзе разделились около 7 млн лет назад. Сегодня на основе новых данных (и прежде всего на основе более точных независимых оценок темпа мутагенеза) это событие относят к более далекому прошлому – порядка 13 млн лет назад.
Появились и другие “палеонтологические” подходы, основанные на палеогенетических данных. Например, прочтение геномов неандертальцев и других древних людей позволило оценивать темп мутагенеза по числу “недостающих мутаций” в этих геномах, то есть по тому, насколько меньше генетических отличий от общего предка успела накопить линия, вымершая десятки тысяч лет назад, по сравнению с нами сегодняшними. Этот и другие новые методы дают оценки в диапазоне от 1,0 × 10–8 до 1,2 × 10–8 замен на нуклеотид за поколение, то есть 60–72 новых мутации на каждого новорожденного, что, по-видимому, близко к истине (см. Исследование № 37).
Конечно, это средние значения: у отдельных индивидов число новых мутаций бывает как меньше, так и больше. В любом случае сомневаться не приходится: мы все – закоренелые мутанты. Далеко до нас всякой мелочи вроде бактерий или дрожжей, у которых одна-единственная новая мутация может приходиться на сотни, а то и тысячи “новорожденных” (рис. 36.1).
У млекопитающих влияет на приспособленность (“находится под отбором”, как говорят молекулярные генетики) лишь 5–10 % генома. Все остальное – в основном генетический мусор. Если выразиться политкорректно, то это области, в которых все или почти все мутации оказываются нейтральными, то есть не влияют на приспособленность и не подвергаются действию отбора. Следовательно, из 60-70 новых мутаций в геноме среднестатистического новорожденного примерно 3-7 не нейтральны, а если еще точнее – вредны, поскольку, хотя темп возникновения полезных мутаций точно не известен, обычно предполагается, что он пренебрежимо мал по сравнению со скоростью появления мутаций вредных.
От трех до семи новых вредных мутаций у каждого человека в каждом поколении – это угрожающе много. Нужен сильный очищающий отбор, чтобы избежать вырождения, то есть неуклонного накопления генетического груза. Если же на отбор надежда плохая, то остается рассчитывать только на высокие биотехнологии: генную инженерию, генную терапию, экстракорпоральное оплодотворение с искусственным отбором эмбрионов и т. п. Впрочем, об угрозе вырождения мы поговорим чуть позже (см. Исследование № 40).
Кроме однонуклеотидных замен бывают еще вставки и выпадения (делеции), инверсии (повороты на 180°) и дупликации фрагментов ДНК разной длины. Такие мутации происходят реже, чем однонуклеотидные замены, зато затрагивают большее число нуклеотидов, тоже, конечно, влияя на вероятность развития всевозможных болезней. По имеющимся оценкам, пока еще не очень точным, каждый человек несет в среднем около 3 новых мелких (≤ 20 пар оснований) вставок и делеций и 0,16 более крупных (> 20 пар оснований).
Зная темп мутагенеза, численность населения и рождаемость, можно примерно оценить общий масштаб генетического разнообразия современного человечества. И он впечатляет: только за время жизни одного последнего поколения в человеческой популяции должно было появиться более 1011 новых точечных мутаций – много больше, чем нуклеотидов в геноме! По-видимому, каждая возможная точечная мутация (кроме несовместимых с жизнью) имеется в данный момент хотя бы у сотни-другой живущих на планете людей. Зарегистрированных полиморфизмов, разумеется, гораздо меньше, ведь до поголовного прочтения геномов дело еще не дошло.
Закономерности распределения мутаций по геному. Как известно, мутации случайны. По крайней мере, в первом приближении. Это не значит, что вероятность возникновения всех мутаций абсолютно одинакова или что процесс мутагенеза совершенно хаотичен во всех своих аспектах. Под “случайностью” мутаций подразумевается вполне конкретная вещь, а именно отсутствие связи между полезностью или вредностью мутации и вероятностью ее возникновения. У живых существ нет механизма, позволяющего заранее рассчитать, какая именно мутация будет им полезна в данных условиях, и внести именно эту мутацию в свой геном. Правда, есть механизмы, позволяющие несколько повысить вероятность появления полезных мутаций (например, при формировании приобретенного иммунитета случайные мутации вносятся специальными ферментами в определенные участки генов антител; подробнее см. в нашей книге “Рождение сложности”) и снизить вероятность появления вредных. В частности, оказалось, что частота мутирования у людей связана с последовательностью репликации хромосом. В участках, реплицирующихся раньше других, возникает меньше мутаций, чем в участках, реплицирующихся в последнюю очередь. Это выгодно, поскольку первыми, как правило, реплицируются участки, в которых много генов. Соответственно, мутации в этих областях часто оказываются вредными. Последними же реплицируются участки ДНК, где преобладает “мусор” и в которых поэтому большинство мутаций оказываются нейтральными.
Самый сильный перекос в распределении мутаций по человеческому геному касается частоты мутирования четырех нуклеотидов: чаще всего мутируют нуклеотиды Ц (цитозины), а за ними Г (гуанины). Цитозин вообще – “слабое звено” ДНК, поскольку склонен превращаться в урацил (У) в результате спонтанного дезаминирования (отщепления аминогруппы). Однако системы репарации бдительно следят за тем, чтобы никаких урацилов в ДНК не было, и быстро исправляют большинство таких мутаций.
Динуклеотиды ЦГ отличаются тем, что входящие в их состав цитозины часто подвергаются метилированию. Метилированный цитозин в результате дезаминирования превращается уже не в урацил, а в тимин (Т) – законное основание, в норме входящее в состав ДНК. Обнаружить такую мутацию системам репарации гораздо труднее.
В результате частота мутирования цитозинов в динуклеотидах ЦГ примерно в десять раз выше нормы. Это, в свою очередь, приводит к неравной встречаемости аминокислотных замен. Из всех двадцати аминокислот в человеческих белках самым уязвимым является аргинин. Свыше 16 % всех аминокислотных замен, приводящих к наследственным болезням, – это замены аргинина. Этот факт, на первый взгляд загадочный, объясняется очень просто. Если посмотреть в таблицу генетического кода, легко убедиться, что все четыре кодона, начинающиеся со склонного к мутациям динуклеотида ЦГ, кодируют именно аргинин.
Характер мутагенеза (или, как говорят генетики, “паттерн мутирования”) сам может эволюционировать под действием мутаций, отбора и дрейфа. Он немного различается не только у человека и шимпанзе, но даже у разных человеческих популяций. Например, сравнительно недавно, от 80 до 40 тысяч лет назад, изменился паттерн мутирования у предков нынешних европейцев, которые тогда как раз отделились от предков азиатов. А именно: у европейцев повысился темп возникновения мутаций в тринуклеотидах ТЦЦ. Эти тринуклеотиды стали чаще превращаться в ТТЦ (Harris, 2015).
Известно, что именно такие мутации чаще всего возникают в клетках кожи под действием ультрафиолета. Особенно характерны они для клеток меланомы. У европейцев кожа в ходе эволюции стала прозрачнее для ультрафиолета, чем у других человеческих популяций, поэтому учащение подобных мутаций в клетках кожи легко объяснимо. Но вот как эти мутации проникают в зародышевую линию, точно не известно. Одна из гипотез состоит в том, что ультрафиолет повышает частоту мутаций данного типа и в коже, и в половых клетках одним и тем же косвенным путем, способствуя деградации фолиевой кислоты. Дефицит этого витамина может приводить к сбоям в синтезе ДНК. Так или иначе, данный факт наглядно показывает, что характер мутагенеза в человеческих популяциях действительно подвержен эволюционным изменениям.
Соматические мутации и их медицинское значение. За жизнь человека клетки его тела делятся в общей сложности триллионы раз. Каждое деление сопряжено с риском соматических мутаций, да и в промежутках между репликациями молекулы ДНК могут повреждаться. В тканях, клетки которых делятся особенно интенсивно (например, в кишечном эпителии), к 60 годам должна присутствовать, хотя бы в одной клетке, едва ли не каждая из всех возможных точечных мутаций. Разнообразие соматических мутаций выше, чем наследственных, потому что первым, чтобы не оказаться немедленно отбракованными отбором, достаточно быть совместимыми с жизнью всего-навсего одной клетки, тогда как вторые требуют совместимости с жизнью целого организма.
Хотя соматические мутации не передаются по наследству, их медицинское значение очень велико. Давно известно, что они играют ключевую роль в развитии различных видов онкологических заболеваний. В последние годы стало ясно, что соматические мутации вызывают и многие другие болезни. Например, выяснилось, что соматические мутации в генах PIK3CA, AKT3 и mTOR вызывают гемимегалэнцефалию – одностороннее увеличение и нарушение функций одного из полушарий мозга, что к тому же повышает риск развития эпилепсии. Сравнительно небольшая доля мутантных клеток способна нарушить работу обширных областей коры: у пациентов с дисфункцией целого полушария мутацию могут нести лишь 8–35 % клеток мозга. По-видимому, соматические мутации лежат в основе и многих других патологий центральной нервной системы (Poduri et al., 2013).
На пути к пониманию фенотипических эффектов мутаций. Конечной – и едва ли достижимой в обозримом будущем – целью изучения человеческих мутаций является создание их полного каталога с указанием влияния каждой мутации на фенотип. В идеале хорошо бы еще разобраться во взаимном влиянии разных мутаций друг на друга, но до полного каталога таких взаимодействий пока еще слишком далеко.
Эффекты мутаций изучают на трех уровнях, которые можно условно назвать молекулярным, медицинским и эволюционным. В первом случае речь идет о том, как та или иная мутация влияет на экспрессию гена или функцию белка. Во втором – о том, как она влияет на вероятность развития тех или иных заболеваний. В третьем – как она влияет на приспособленность (репродуктивный успех). Конечно, это взаимосвязанные вещи, но корреляции между ними нестрогие. Скажем, мутации, вызывающие “старческие” болезни, вряд ли будут вредными с эволюционной точки зрения – они не скажутся на репродуктивном успехе. Хотя в определенных социально-экономических условиях могут и сказаться: например, если дети тратят свои ресурсы на уход за немощными родителями вместо того, чтобы растить собственных детей, или если забота бабушек и дедушек заметно повышает выживаемость внуков. Ослабление функции какого-нибудь фермента может отразиться на здоровье человека в одних условиях среды, но никак не проявиться в других, и так далее. Все три типа исследований сталкиваются с большими методологическими трудностями, поэтому пока мы имеем более или менее детальную информацию лишь по небольшому числу мутаций.
Например, выяснение молекулярных эффектов мутаций – это чрезвычайно кропотливая работа, которую, однако, можно проводить в пробирке. В итоге, потратив неимоверное количество сил и средств, можно получить более или менее полный мутационно-функциональный спектр для какого-нибудь белка. На илл. XI (см. цветную вклейку) показаны результаты исследования того, как разные аминокислотные замены отражаются на функции регуляторного белка BRCA1 (Starita et al., 2015). BRCA1, пришивая убиквитин (особый маленький белок) к другим белкам, регулирует репарацию ДНК и играет важную роль в защите от онкологических заболеваний.
Это исследование, с одной стороны, впечатляет своей грандиозностью, с другой – наводит на грустные мысли о том, сколько же сил нужно потратить, чтобы получить хотя бы такие простенькие, одношаговые “адаптивные ландшафты” для всех человеческих белков и всех единичных мутаций, не говоря уж об их комбинациях (см. Исследование № 2). Но эта работа необходима, если мы хотим приблизиться к ответу на ключевой вопрос о соотношении генотипа и фенотипа. Без такого знания мы не сумеем разработать технологии, которые позволят в будущем заменить естественный отбор (на него в современных человеческих популяциях надежда плохая; см. Исследование № 40) целенаправленным редактированием генома, чтобы остановить накопление генетического груза и даже, возможно, улучшить человеческую природу.

