Исследование № 37
Число мутаций у детей зависит от возраста обоих родителей
Для понимания наших эволюционных перспектив важно не только иметь максимально точные оценки скорости мутирования, но и знать, от каких факторов зависит число новых мутаций в геномах разных людей и нельзя ли на него как-то повлиять. В последние годы наконец появилась возможность оценивать темп мутагенеза не косвенными методами (о которых говорилось в Исследовании № 36), а напрямую, сравнивая геномы детей и родителей. В 2017 году исландские генетики выполнили беспрецедентное по масштабу исследование, изучив полные геномы 1548 троек, каждая из которых включала пару родителей и их ребенка. Оказалось, что среднестатистический новорожденный получает 70 новых мутаций, которых не было у родителей, причем 80 % мутаций приносит сперматозоид и только 20 % – яйцеклетка. Подтвердился быстрый рост числа новых мутаций с возрастом отца: каждый год жизни отца прибавляет его потомству в среднем 1,5 мутации. Возраст матери тоже влияет на число мутаций у потомства, но не так сильно: каждый год жизни матери обходится потомству примерно в 0,4 дополнительных мутации. Распределение “материнских” мутаций по геному оказалось неравномерным: в нескольких участках частота их возникновения резко повышена. По-видимому, это связано с тем, что в этих участках чаще всего рвутся хромосомы в стареющих ооцитах. Похожий рисунок распределения “материнских” мутаций характерен для шимпанзе и горилл, но не для орангутанов.


Здоровье и эволюционное будущее человечества во многом зависят от вновь возникающих мутаций, которые в большом количестве присутствуют в геноме каждого новорожденного. Неудивительно, что закономерности мутагенеза у людей привлекают самое пристальное внимание ученых (см. Исследование № 36).
Ранее было показано, что число новых (отсутствующих у родителей) мутаций в геномах новорожденных быстро растет с возрастом отца. Первые оценки, основанные на небольших выборках, показали, что каждый год жизни отца прибавляет его потомству примерно две новые мутации. Причина в том, что клетки-предшественники сперматозоидов (сперматогонии) делятся в течение всей взрослой жизни. Перед каждым делением геном реплицируется, а при репликации всегда с какой-то вероятностью возникают ошибки – мутации.
Напротив, предшественники яйцеклеток (ооциты первого порядка) формируются еще в период внутриутробного развития и затем хранятся, не претерпевая митотических делений. Поэтому с возрастом матери число новых мутаций у детей вроде бы расти не должно.
Связь между возрастом отца и количеством новых мутаций у детей, по-видимому, имеет прямое отношение к выявленной в 2009 году отрицательной корреляции между возрастом отца и нейрокогнитивными показателями детей (Saha et al., 2009). Дети немолодых отцов в среднем имеют более низкие нейрокогнитивные показатели (рис. 37.1). С возрастом матери эти показатели обычно не только не снижаются, но даже растут. Здесь, конечно, нужно иметь в виду, что графики, подобные показанным на рис. 37.1, хотя и строятся с поправками на разные “осложняющие факторы” вроде социоэкономического статуса, не могут учесть их все. Рост нейрокогнитивных показателей детей с возрастом матери, заметный на рис. 37.1, связан не с тем, что у женщин с возрастом становится меньше мутаций в яйцеклетках (это не так), а скорее с тем, что в современных цивилизованных (особо подчеркнем это слово) обществах у женщин, начинающих рожать рано, понижена частота встречаемости аллелей, положительно влияющих на когнитивные показатели, по сравнению с женщинами, начинающими рожать позже. У мужчин такая зависимость тоже есть, но выражена слабее (см. Исследование № 40). Кроме того, можно предположить, что женщины, начинающие рожать рано, в среднем находятся в менее благоприятных социально-экономических условиях. Иными словами, рост когнитивных показателей детей с возрастом матери объясняется не мутагенезом в ооцитах, а скорее обычной наследственностью, а также тем, что слишком юные матери, возможно, не всегда способны обеспечить своим детям полноценное воспитание.
Однако в последнее время стали появляться данные, показывающие, что число новых мутаций у новорожденных все-таки растет с возрастом матери, хотя и не так быстро, как с возрастом отца. Это важное уточнение, как и ряд других, стало возможным благодаря удешевлению полногеномного секвенирования, позволившему многократно увеличить объем исследуемых выборок.
В статье, опубликованной в журнале Nature в 2017 году, исландские генетики сообщили о результатах изучения рекордного числа троек, включающих полные геномы обоих родителей и их потомка (Jónsson et al., 2017). Ученые проанализировали 1548 таких троек, причем все геномы были отсеквенированы довольно качественно (с 35-кратным покрытием). Сравнение полных геномов потомка и обоих его родителей – трудоемкий, зато самый надежный способ определить число новых мутаций. В 225 случаях из 1548 в распоряжении исследователей, помимо геномов двух родителей и потомка, имелся также геном представителя следующего (третьего) поколения, то есть потомка потомка. Такие данные позволяют надежнее устанавливать происхождение (отцовское или материнское) новых мутаций представителя второго поколения, потому что эти мутации наследуются внуком или внучкой в составе фрагмента хромосомы, совпадающего с участком одной из хромосом либо деда, либо бабки.
Исследователи обнаружили в общей сложности 108 778 новых мутаций (из них 101 377 – однонуклеотидные полиморфизмы, остальное – вставки и делеции). Таким образом, получилось в среднем по 108 778/1548 ≈ 70,3 новых мутации на человека (рис. 37.2). Это примерно совпадает с прежними оценками (см. Исследование № 36), но теперь можно уже не сомневаться в точности результата.
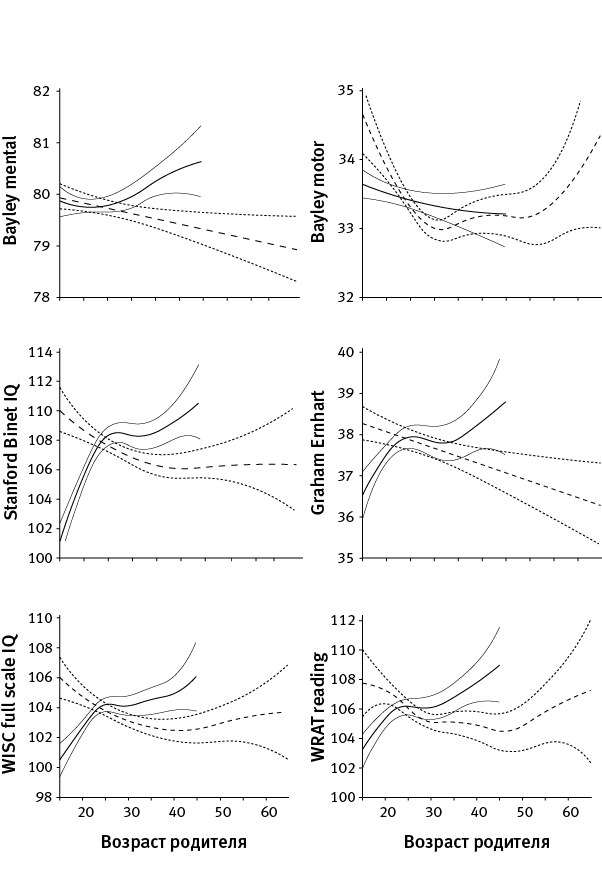
рис. 37.1. Зависимость различных нейрокогнитивных показателей у детей (в возрасте от 8 месяцев до 7 лет) от возраста отца (пунктирные линии) и матери (сплошные линии). По вертикальной оси – нейрокогнитивные показатели, по горизонтальной – возраст родителя в момент рождения ребенка. Графики основаны на данных по 33 437 американским семьям. Внесены поправки на возраст и пол ребенка, возраст второго родителя, расовую принадлежность, социоэкономический статус и другие параметры, которые могли бы исказить искомую зависимость. Видно, что большинство показателей снижается с возрастом отца, но не матери. Bayley mental и Bayley motor – показатели умственного и физического развития детей, оцененные по шкале Бейли. Stanford Binet IQ – коэффициент интеллекта по шкале Стэнфорда – Бине. Graham Ernhart – показатели по тесту на блочную сортировку Грейама – Эрнхарта. WISC full scale IQ – коэффициент интеллекта по шкале Векслера. WRAT reading – показатели по тесту WRAT (Wide Range Achievement Test) на понимание прочитанного. По рисунку из Saha et al., 2009.
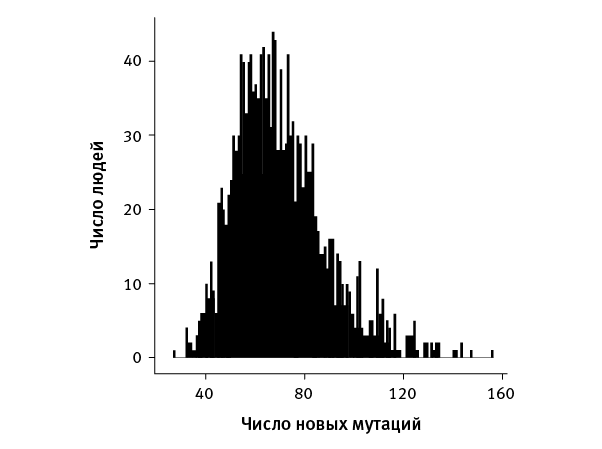
рис. 37.2. Распределение, показывающее, сколько людей имеют то или иное количество новых мутаций. По рисунку из Jónsson et al., 2017.
У 91 “потомка” имелись однояйцевые (монозиготные) близнецы. Их геномы тоже были отсеквенированы, чтобы оценить качество проделанной работы (в идеале все новые мутации, найденные у одного близнеца, должны быть обнаружены и у второго). Проверка показала, что в ходе секвенирования было пропущено или ошибочно идентифицировано не более 3 % от общего числа мутаций.
Отцовское или материнское происхождение удалось с максимальной точностью установить для 15 746 мутаций, зарегистрированных в тех тройках, где были данные по “потомкам потомков”. Оказалось, что 80,4 % новых мутаций имеют отцовское происхождение, то есть люди получают их с геномом сперматозоида. Число таких мутаций быстро растет с возрастом отца (верхняя прямая на рис. 37.3). Каждый год жизни отца прибавляет в среднем по 1,47 новых мутации его потомкам. Это меньше прежних оценок. Число мутаций материнского происхождения тоже увеличивается с возрастом матери, но вчетверо медленнее (нижняя прямая на рис. 37.3) – на 0,37 за год жизни матери.
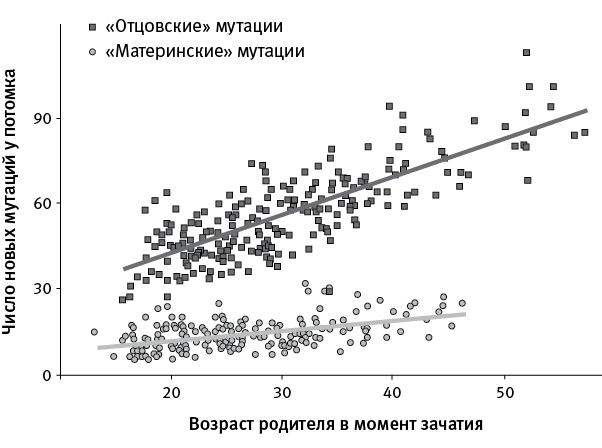
рис. 37.3. Связь числа новых мутаций, полученных от отца или матери, с возрастом родителя. По рисунку из Jónsson et al., 2017.
Ранее уже было замечено, что “отцовские” и “материнские” мутации различаются по своему характеру и распределению по геному. Новое исследование это подтвердило. Так, замены цитозина тимином (Ц→T) в 1,3 раза чаще встречаются среди “материнских” мутаций, чем среди “отцовских”. А замещения тимина гуанином и цитозина аденином (T→Г и Ц→A) примерно во столько же раз чаще встречаются, наоборот, среди “отцовских” мутаций, чем среди “материнских”. Некоторые различия обнаружились также в скоростях, с которыми частоты разных типов мутаций меняются с возрастом родителя.
Один из самых неожиданных результатов состоит в том, что распределение “материнских” мутаций по геному оказалось крайне неравномерным (для “отцовских” это характерно в меньшей степени). В некоторых участках генома частота встречаемости “материнских” мутаций резко повышена. Особенно выделяется участок восьмой хромосомы длиной в 20 млн пар оснований, на котором “материнские” мутации возникают в 4,5 раза чаще, чем в среднем по геному. Особенно сильно (в 12,8 раза) повышена на этом участке частота “материнских” мутаций типа Ц→Г. В некоторых других областях генома частота таких мутаций тоже заметно повышена. И количество замен Ц→Г, и число кластеров (“сгущений”) таких мутаций быстро растут с возрастом матери.
Если эти особенности возникновения “материнских” мутаций появились не вчера, а существуют в течение длительного времени, то это должно было отразиться на накопленном генетическом полиморфизме. А именно: в этих участках генома должна быть повышена частота вариабельных нуклеотидных позиций, где у одних людей стоит нуклеотид Ц, а у других – Г. Исследователи проверили это предположение по имеющимся геномным данным (не только исландским), и оно подтвердилось. Это значит, что повышенная частота мутаций Ц→Г в этих областях генома свойственна нашему виду уже давно. Но насколько давно? Чтобы это выяснить, ученые обратились к геномам обезьян. Оказалось, что шимпанзе и гориллы схожи с человеком по распределению полиморфизмов Ц→Г, а орангутаны и другие обезьяны – нет. По-видимому, это означает, что выявленная особенность – повышенная частота мутаций Ц→Г в нескольких строго определенных участках генома – возникла у наших предков после их отделения от предков орангутанов, но до отделения от предков горилл. Иными словами, она возникла у ранних представителей африканских больших человекообразных обезьян.
Некоторые косвенные признаки указывают на то, что повышенная вероятность “материнских” мутаций Ц→Г характерна для тех участков, где в стареющих ооцитах часто происходят разрывы ДНК. Эти участки по каким-то причинам рвутся чаще других, а мутации Ц→Г появляются в ходе починки (репарации) двойных разрывов. Напомним, что клетки-предшественники сперматозоидов постоянно делятся и большинство мутаций в них – это ошибки репликации ДНК. Напротив, предшественники яйцеклеток не делятся, а на годы и десятилетия “застывают” на определенной стадии (профазе первого деления) мейоза. Поэтому большинство мутаций в них – это результаты повреждений ДНК, не связанных с репликацией. Возможно, дело тут в особенностях конфигурации хромосом в профазе I мейоза, в прочности их разных участков и в “структурном стрессе”, которому подвергаются хромосомы ооцитов в области перекрестов, где происходит кроссинговер.
Итак, данное исследование уточнило наши представления о мутагенезе у людей. При этом оно еще больше запутало и без того сложный вопрос о датировках давних эволюционных событий при помощи “молекулярных часов”. Для надежной работы молекулярных часов желательно, чтобы скорость накопления генетических различий между разошедшимися видами была постоянной. А она, как выясняется, зависит (помимо всего прочего) еще и от того, в каком возрасте отцы и матери заводят детей. Исследователи рассчитали, что увеличение среднего возраста отцовства на 10 лет ускорило бы ход молекулярных часов (то есть накопление генетических различий между популяциями) на 4,7 %. А если на те же 10 лет повысится средний возраст материнства, то молекулярные часы, наоборот, замедлятся на 9,6 %, поскольку небольшое увеличение числа мутаций в старых ооцитах будет с лихвой перекрыто замедлением смены поколений. Таким образом, в уравнение молекулярных часов добавились новые неизвестные.

