Если атомы серы «глядят» в одну сторону
Современные возможности синтетической органической химии таковы, что позволяют получить почти все, что может быть нарисовано на бумаге (конечно, при условии, что нарисовано грамотно). В молекуле рассмотренного выше полимера карбосульфида атомы серы направлены поочередно вверх и вниз относительно вытянутой цепи. Можно ли прикладывать тиофеновые пятиугольники друг к другу так, чтобы атомы серы располагались по одну строну от растущей молекулы? Если прикладывать друг к другу квадраты, получим линейную конструкцию, но если прикладывать пятиугольники так, чтобы атомы серы «глядели» в одну сторону, то простые геометрические соображения подсказывают, что растущая цепь должна замыкаться в кольцо.
К решению этой задачи приступил в 2004 г. профессор С. Райка с коллегами. Для этого было взято соединение, содержащее три тиофенильных фрагмента, расположенных нужным образом; атомы брома, как и в предыдущем примере, нужны были для того, чтобы соединять молекулы. Такое связывание осуществили с помощью бутиллития BuLi, забирающего по одному атому Br от каждой молекулы. Затем действием литийсодержащего амида i-Pr2NLi в образовавшуюся молекулу ввели два атома Li, которые при взаимодействии с бис(фенилсульфонил)сульфидом (PhSO2)2S помогли сформировать сульфидный мостик, и появился новый тиофенильный фрагмент. В полученной молекуле присутствуют еще два атома Br, казалось бы вполне пригодные для того, чтобы с их помощью полностью замкнуть цикл по той же методике, как это было сделано с первыми двумя атомами Br, однако этого сделать не удалось. Собранная из семи тиофенильных фрагментов лента стала закручиваться в спираль (отмечено на рис. 7.11 утолщенной линией), в результате атомы Br далеко отошли друг от друга. Это показано дополнительно с помощью спирально свернутого жгута.
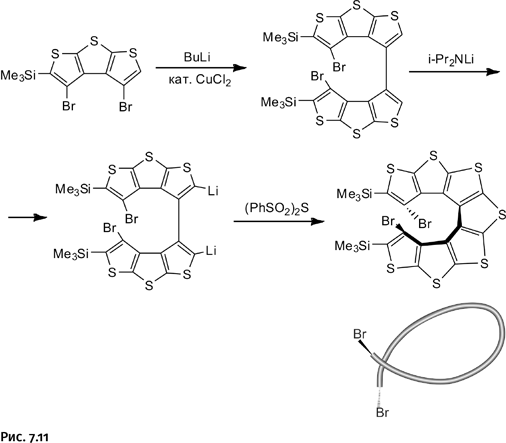
Полученный результат авторы сочли весьма интересным и продолжили достраивать намечающуюся спираль. При этом они учли следующее обстоятельство: соединение, где два тиофенильных фрагмента связаны простой связью 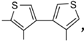 может быть расположено на плоскости, поскольку простая связь допускает поворот связанных с ней фрагментов. Когда же на месте этой связи оказывается сформированный тиофенильный фрагмент, вся молекула немного стягивается, выходит из плоскости и начинает закручиваться в спираль. Это можно условно сравнить с известным приемом, используемым при пошиве одежды. Если на плоском куске ткани сделать вытачку – вырезать треугольный сектор, а затем сшить края разреза, – то плоское изделие приобретает объем.
может быть расположено на плоскости, поскольку простая связь допускает поворот связанных с ней фрагментов. Когда же на месте этой связи оказывается сформированный тиофенильный фрагмент, вся молекула немного стягивается, выходит из плоскости и начинает закручиваться в спираль. Это можно условно сравнить с известным приемом, используемым при пошиве одежды. Если на плоском куске ткани сделать вытачку – вырезать треугольный сектор, а затем сшить края разреза, – то плоское изделие приобретает объем.
Именно идею таких заранее намеченных «вытачек» использовали авторы, создавая тиофеновую спираль. При этом они проявили большую изобретательность, наметив с помощью простых связей «вытачки» в различных местах, что позволило получить две спиральные молекулы, закрученные в правую и левую стороны. На рисунке 7.12 простые связи между тиофеновыми циклами – места будущих «вытачек» – для наглядности отмечены черными кружками, а спиральная изогнутость полученных молекул подчеркнута утолщенными линиями. Поскольку получение таких спиралей воспроизводит последовательность операций, показанных на рисунке 7.11, то схемы синтеза приведены в сокращенном виде – вторая и третья стадия объединены.
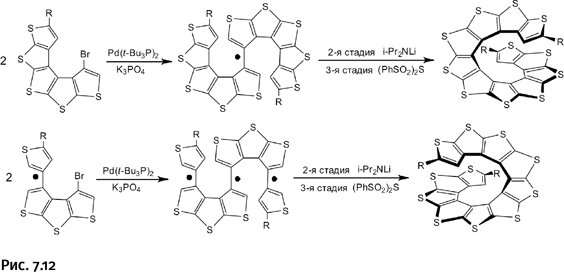
Подобные спиральные молекулы именуют гелиценами (от англ. helix – спираль), они представляют особый интерес для химиков, так как обладают исключительно высокой оптической активностью, т. е. вращают плоскости поляризованного света не на несколько градусов, а на несколько полных поворотов. Верхняя из показанных на рисунке 7.12 спиралей вращает плоскость поляризованного света влево, а нижняя – вправо. Справедливости ради отметим, что даже здесь тиофену не удалось обойти бензол, который умеет делать то же самое. Впервые такие спирали были созданы из спаянных бензольных циклов (рис. 7.13), тем не менее получение тиофеновых гелиценов, безусловно, можно отнести к своеобразному достижению органической химии.
Нельзя не отметить ту изобретательность и разнообразие методов, с помощью которых химики формировали тиофеновые циклы в составе молекулы. Все это вместе замечательная демонстрация возможностей органической химии при решении одной частной задачи.
Тем не менее остается ощущение, что по крайней мере одна, может быть самая интересная, задача пока не решена.
Молекула-подсолнух
Химиков всегда привлекали соединения, которые в определенном смысле возглавляли отдельное направление, символизируя целый класс соединений. Таких соединений, естественно, немного, и они хорошо известны: бензол, ферроцен, карборан, фуллерен (рис. 7.14).
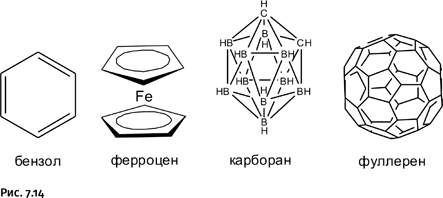
Эти соединения во многом определили развитие химии в ХХ в., за исключением бензола, который начал царствовать еще в середине ХIХ в., но «не померк» и поныне.
Отличительные признаки показанных соединений: молекула стабильна, симметрична, сравнительно просто устроена, изящна и внешне привлекательна. Чисто эстетические аспекты, такие как красота и элегантность молекулярных структур, всегда играли важную роль в развитии химии, чему даже посвящены специальные статьи в серьезных научных журналах. Впрочем, изящная структура не основное качество. Стабильную высокосимметричную молекулу несравненно проще изучать современными методами, и она дает существенно больше информации. Появление такой молекулы сразу привлекает внимание большого числа исследователей, что приводит к появлению потока работ. В результате соединение оказывается всесторонне изученным и его наиболее интересные свойства становятся известными.
Рассматривая тиофеновые спирали вы, скорее всего, догадаетесь, какое именно соединение могло бы достойно символизировать химию тиофена. Естественно, это замкнутый цикл из спаянных молекул тиофена. Получить такое соединение было совсем непросто, это удалось в 2006 г. профессору В.Г. Ненайденко (рис. 7.15) с сотрудниками на химическом факультете МГУ.

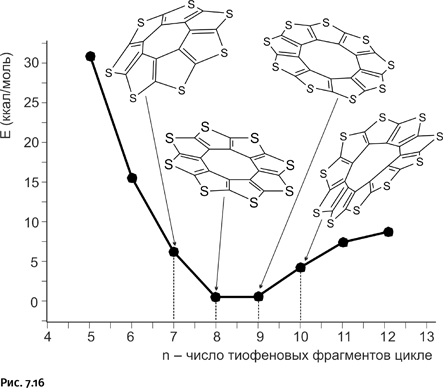
Отличительная черта работы современного химика – сочетание эксперимента и квантовохимических вычислений, определяющих, например, энергетические параметры не полученной пока молекулы. Современные компьютерные программы позволяют проводить такие вычисления химику-экспериментатору самостоятельно, за основу берут нарисованную структурную формулу соединения. Вначале предстояло решить вопрос, из какого количества тиофеновых молекул следует собирать кольцо. Заранее было ясно, что проще всего получить то соединение, которое наиболее устойчиво. Наиболее устойчива та молекула, которая энергетически более выгодна. Авторы провели предварительный расчет для циклов, содержащих от пяти до 12 тиофеновых фрагментов. Выяснилось, что наиболее энергетически выгодны циклы, содержащие восемь и девять фрагментов. Оба эти цикла практически плоские, в отличие от них цикл из семи фрагментов стянут в виде корзины, а десятифрагментный цикл приобретает извитость, т. е. десяти тиофенам в таком цикле «тесновато» (рис. 7.16).
Проведенные расчеты указали, что синтез следует начинать с 8-звенного цикла. Тактика синтеза была выбрана несколько иной, нежели в рассмотренных выше работах, поскольку они вели к получению спиралей, а не циклов. Вместо того чтобы собирать молекулу из нескольких блоков, решено было сразу использовать заготовку, содержащую восемь углеродных атомов (внутренний цикл), а затем достроить внешний цикл, создавая в нужных местах тиофеновые фрагменты. На исходную заготовку, содержащую четыре тиофеновых цикла, подействовали литийсодержащим амидом i-Pr2NLi, чтобы ввести атомы лития. При этом в реакционной смеси находилась также элементарная сера. В результате получилось соединение, обрамленное полисульфидными фрагментами ≈SnH (≈S – S – S – S – H). Затем действие HCl, после чего последовала возгонка при 450–500 °С под вакуумом, в итоге удаляется избыток серы (в виде H2S и элементарной серы) и образуется нужное соединение! Итак, был реализован совершенно иной путь формирования тиофеновых циклов в молекуле (рис. 7.17).
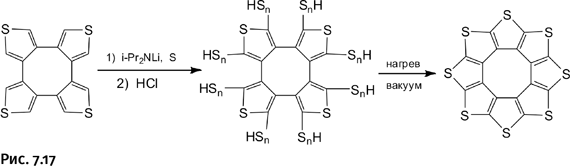
Конечный продукт представлял собой темно-красный порошок. Получена эстетически совершенная структура органического соединения, брутто-формула которого поражает своей простотой – (C2S)8. Примечательно, что это органическое вещество не содержит ни одного атома водорода, кроме того, оно не разлагается вплоть до 500 °С. Авторы предложили для нового соединения замечательное название. Поскольку форма молекулы напоминала цветок подсолнечника (от англ. sunflower – солнечный цветок), они назвали соединение несколько измененным английским словом-гибридом sulflower (серный цветок), объединив слова sulfur (сера) и flower (цветок). Итак, перед нами молекула-подсолнух, или сульфловер.

