Установить строение
Осуществить синтез – половина работы, вторая половина, не менее сложная, – доказать строение полученного соединения. Именно здесь сульфловер проявил коварство – он ни в чем не растворялся, что очень затруднило дальнейшую работу. Впрочем, для нерастворимых веществ существует набор методов, которые позволяют понять строение вещества. По результатам элементного анализа его состав соответствовал атомному отношению C: S = 2:1. Анализ масс-спектров позволил определить молекулярную массу вещества 448 (теоретическое значение 448,69). Ядерно-магнитный спектр показал, что в веществе присутствует два типа углеродных атомов в равном соотношении. Это полностью соответствует структуре сульфловера – восемь атомов С во внутреннем цикле и восемь на периферии. Казалось бы, предложенная структура подтверждена, однако современный уровень исследований предполагает, что строение нового соединения должно быть доказано убедительным способом, т. е. рентгеноструктурным анализом, который позволяет буквально «увидеть» молекулу. Порошкообразное вещество для таких целей не годится, необходим небольшой одиночный кристаллик. Такие кристаллы обычно выращивают из раствора, но, к сожалению, сульфловер ни в чем не растворим.
Не смущаясь тем, что результаты рентгеноструктурного анализа отсутствуют, авторы сочли возможным опубликовать статью в авторитетном научном журнале и, как выяснилось позже, поступили правильно.
К исследованию сульфловера подключилась новая группа химиков: профессор Л.А. Лейтес, профессор К.А. Лысенко и кандидат физико-математических наук С.С. Букалов из ИНЭОС РАН. Они сублимировали полученный сульфловер в высоком вакууме (10–5 мм рт. ст.) и получили нужные для рентгеноструктурного анализа одиночные кристаллы. В результате удалось полностью и окончательно подтвердить, что сульфловер имеет структуру восьмилистного цветка. Однако рентгеноструктурный анализ не только показывает, какие атомы присутствуют в молекуле и как они расположены, он также дает информацию о том, каким образом размещены молекулы в кристаллической ячейке, а в некоторых случаях может показать распределение электронной плотности. Естественно, авторы постарались полностью использовать возможности метода, в результате сведений о новом соединении стало заметно больше.
Две особенности сульфловера особенно заинтересовали ученых – отсутствие растворимости и красный цвет соединения. Казалось бы, такие малозначащие свойства прямого отношения к научному исследованию не имеют, однако внимание именно к этим деталям было не случайным. Два отмеченных свойства четко отличали сульфловер от похожих соединений: рассмотренные ранее тиофеновые спирали были бесцветными и, кроме того, хорошо растворимыми. Окраска вещества, как правило, зависит от электронного строения самой молекулы, но теоретический расчет спектра поглощения (в видимой области), проведенный для одиночной молекулы, показал, что она должна быть бесцветной. Ситуация стала напоминать детективную историю.
Ответ на поставленные вопросы дало внимательное изучение того, как расположены молекулы сульфловера в кристалле. Плоские циклические молекулы расположены в виде наклоненных стопок – колонн. Молекулы в колоннах сдвинуты вбок относительно друг друга таким образом, что наиболее короткими оказались расстояния C∙∙∙S между атомами в молекулах, расположенных друг над другом (рис. 7.18).
Расстояния между молекулами оказались весьма короткими, что приводит к сильным межмолекулярным взаимодействиям и, соответственно, к резкому снижению растворимости, что объясняет, почему вещество возгоняется при такой высокой температуре.
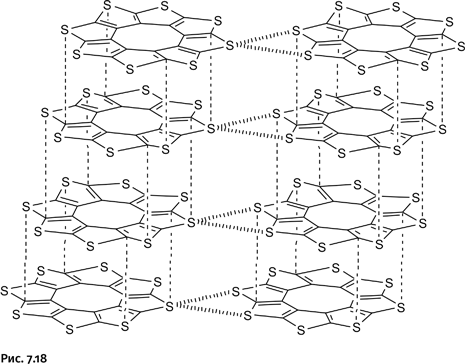
Еще более интересным оказался следующий факт: молекулы, расположенные в соседних колоннах, тесно контактируют друг с другом, причем это контакты между атомами серы (линии с поперечной штриховкой). Анализ электронного строения таких контактов показал, что они сопровождаются частичным переносом заряда, напоминающим тот, который происходит в активированных проводящих полимерах.
Именно эти взаимодействия с переносом заряда приводят к тому, что поглощается определенная часть видимого света (для сульфловера – в области 400–500 нм), и в результате вещество приобретает красный цвет. Несколько необычное явление: сама по себе молекула бесцветна, а окраска возникает только при образовании кристаллической структуры.
Полученные результаты не только позволили объяснить необычное сочетание свойств в веществе, они указали ту область, в которой сульфловер может проявить новые интересные качества. Сильные межмолекулярные контакты и взаимодействия с переносом заряда делают перспективным, прежде всего, изучение электрофизических и электрооптических свойств вещества.
Сульфловер входит в мир
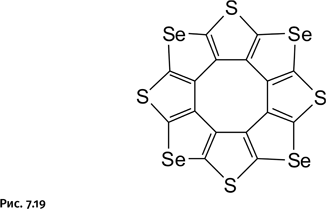
Появление столь эффектного и необычного соединения было отмечено многими: по крайней мере шесть групп ученых начали дальнейшее исследования сульфловера. Диапазон подобных молекул начал расширяться: был получен сульфловер, в котором часть атомов серы заменена селеном, – селеносульфловер (рис. 7.19). Это соединение так же, как и родоначальник сульфловер, обладает полупроводниковыми свойствами в результате контактов S∙∙∙S между колоннами в кристаллической фазе. Квантовохимические расчеты показали, что сульфловер, селеносульфловер и линейный карбосульфид представляют собой новое перспективное семейство материалов для молекулярной электроники. Расчеты также помогли указать иную область применения этих веществ – в качестве материала, адсорбирующего молекулы водорода. Согласно расчетам, между плоскостями молекул сулфловера в кристалле может расположиться до пяти молекул Н2. Это представляет интерес для развивающейся водородной энергетики.