Конфуз привел к открытию
Немецкий химик А. Байер, заложивший основы химии красителей, в 1905 г. был удостоен за свои работы Нобелевской премии. Наиболее яркое его достижение – выяснение строения природного красителя индиго и последующий синтез этого соединения. Один из ранних результатов работы Байера, далеко не самый известный, имел неожиданное продолжение. Изучая в 1879 г. строение индиго, он получил продукт его окисления – изатин, который, как оказалось, обладал интересным свойством – при смешивании с бензолом в присутствии серной кислоты давал интенсивное синее окрашивание. В результате это соединение стали использовать как очень удобный реагент для качественного обнаружения бензола. Это было заблуждением, которое продолжалось сравнительно недолго. В 1883 г. другой немецкий химик, В. Мейер, (рис. 7.4) во время чтения лекции решил показать студентам эффектный опыт, позволяющий обнаружить бензол с помощью цветной качественной реакции, однако у него под руками не оказалось бензола. Не растерявшись, Мейер решил на глазах у студентов вначале получить бензол, а затем подтвердить его наличие, подействовав изатином. Бензол он получил, нагревая бензойную кислоту (рис. 7.5).

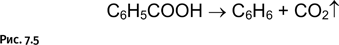
Добавив к свежеполученному бензолу серную кислоту и изатин, он с изумлением убедился, что никакого окрашивания нет. Можно себе представить веселое оживление студентов, увидевших столь неудачный результат. Тем не менее Мейер сумел сделать из этого наблюдения очень интересный и, как оказалось, абсолютно правильный вывод. То, что он получил из бензойной кислоты бензол, сомнения не вызывало. Более того, бензол, полученный таким образом, был абсолютно чистый, а бензол, которой обычно использовали химики для работы, получали из каменноугольной смолы. Следовательно, как предположил Мейер, каменноугольный бензол содержит какую-то примесь, которая дает окрашивание с изатином. Он сумел выделить из каменноугольного бензола это соединение, которое назвал тиофеном. Первая часть названия «тио» происходит от греч. theion – сера, а вторая часть названия – фен – оказалось на редкость удачной, она указывала на родство с бензолом, спутником которого был тиофен (группу, содержащую бензольное ядро С6Н5– называют фенильной). В дальнейшем оказалось, что у них есть более глубокое сходство – ароматичность.
Тиофен – бесцветная жидкость с температурой кипения +84,2 °С, близкая к бензолу. В сыром бензоле, полученном из каменноугольной смолы, его содержание 1,3–1,4 %. Долгое время тиофен рассматривали как «загрязнитель» бензола, мешающий при проведении некоторых спектральных исследований и молекулярно-массовых измерений. В результате изатин стали использовать для оценки того, насколько чист бензол.
Ароматичность и проводимость
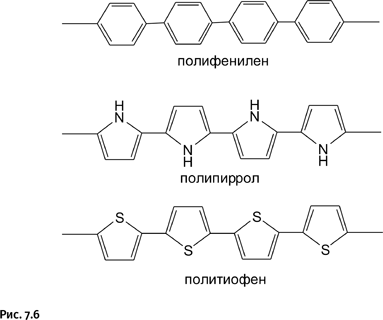
Взаимоперекрывание р-орбиталей приводит к тому, что электроны, находящиеся на этих орбиталях, создают кольцевой ток, который может быть обнаружен с помощью магнитных измерений. Естественно, возникла идея использовать это явление для создания токопроводящих мостиков из подобных молекул, соединенных в цепочку. Замысел удалось реализовать, были созданы проводящие полимеры, цепи которых собраны из циклических ароматических молекул (рис. 7.6).
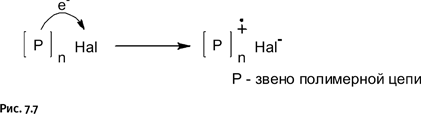
Сами по себе эти полимеры ток не проводят, этому мешают соединяющие перемычки из одинарных связей. Для того чтобы сделать такие соединения токопроводящими, необходима некая активация, цель которой – объединить циклы в единую электронную систему. Этого удалось достичь различными методами. Например, если подействовать на полимер галогеном, то атом галогена, присоединяясь к фрагменту цепи полимера, образует комплекс. Известно, что атом галогена всегда стремится дополнить свою электронную оболочку до восьми электронов, для этого он забирает электрон от полимера. В результате у полимерной молекулы появляется электрон без пары, т. е. она становится радикалом. Исходная полимерная молекула была электронейтральна, но, потеряв один электрон, она приобретает положительный заряд, т. е. становится катионом (а галоген – анионом). В итоге образуется молекула, представляющая собой и катион, и радикал одновременно, такую частицу, естественно, именуют катион-радикалом, его обозначают точкой (неспаренный электрон) и знаком плюс, т. е. катион.
Подобные комплексы, когда заряд переходит с одного атома на другой, так и называют комплексами с переносом заряда (рис. 7.7).
По существу, это окислительно-восстановительная реакция, протекающая в пределах одного комплекса, где полимерный фрагмент окисляется, а галоген – восстанавливается. Окисление полимера можно проводить не только с помощью реагента (галогена), но и электрохимически.
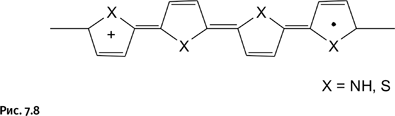
В образовавшемся комплексе простые и двойные связи перестраиваются, возникает иной порядок их чередования, и электрон (обозначен точкой) получает возможность передвигаться вдоль цепи, что и обеспечивает электропроводимость (рис. 7.8).
Электропроводимость этих полимеров почти такая же, как у металлической меди. Интересны воспоминания японского химика Хидэки Сиракавы, получившего в 2000 г. Нобелевскую премию за открытие проводимости в полимерах. Для исследований им был выбран полиацетилен [– CH=CH]n– полимер, в котором чередуются одинарные и двойные связи. Сиракава измерил электропроводность полиацетилена, которая была очень мала, а затем добавил к полимеру бром. В этот самый момент проводимость подпрыгнула так сильно, что ассистент не успел переключить диапазон электрометра и прибор перегорел. Фактически электропроводность оказалась в десять миллионов раз выше, чем до добавления брома. Так удалось обнаружить появление высокой электропроводности в полимерах.
Вернемся к политиофену. Среди проводящих полимеров он сумел проявить свою индивидуальность. В сравнении с остальными проводящими полимерами политиофен имеет ряд достоинств – достаточно стабилен и в течение долгого времени сохраняет проводящие свойства, кроме того, растворим, что позволяет формовать из него пленки и волокна. Это открыло путь к созданию на его основе тонкопленочных электронных устройств, светодиодов, полупроводников, а также элементов для аккумуляторных и солнечных батарей.
Упомянем еще одну область, где тиофен оказался полезен: он входит в состав некоторых лекарственных препаратов (например, антибиотиков – цефалотина, цефалоридина).
Все перечисленные заслуги тиофена пока нельзя отнести к эффектным достижениям; поскольку в той или иной степени подобных результатов сумели достичь и иные соединения. Для того чтобы тиофен или другое соединение стали заметны на фоне миллионов им подобных, необходимы яркие научные результаты. Они часто возникают после того, как накопится обширный экспериментальный материал в результате поисков в самых разных направлениях. Тиофен сумел пройти этот трудный путь.
Достаточно хорошо разработанная химия тиофена позволила исследователям начать поиск необычных структур. Надежды возлагают на политиофен, цепям которого придана дополнительная жесткость за счет невалентных взаимодействий (на рис. 7.9 показаны пунктиром) между фрагментами – О – СН2–СН2–О– и атомами серы.
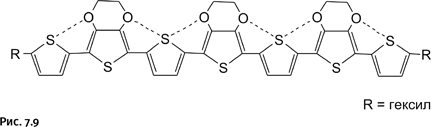
Выпрямленная цепь облегчает перекрывание соседних р-орбиталей, что важно для обеспечения проводимости.
От разобщенных циклов к спаянным
В рассмотренных до этого момента соединениях тиофеновые циклы были соединены между собой мостиком – связью С – С. Из общих соображений было понятно, что циклы тиофена могут быть спаяны, т. е. иметь два общих атома подобно тому, как соединены бензольные циклы в нафталине или антрацене 
Такие циклы называют конденсированными. Наращивать цепочки из конденсированных тиофеновых циклов удалось следующим образом: исходное соединение содержит три спаянных цикла и на одном конце – атом брома. Два атома брома, находящиеся в двух соседних молекулах, превращают в соединяющий сульфидный мостик действием оловосодержащего сульфида (Bu3Sn)2S. В центре получившейся цепочки, между третьим и четвертым тиофеновым циклом, не хватает перемычки. Ее создают, отнимая два атома водорода от двух соседних циклов действием бутиллития BuLi (рис. 7.10).
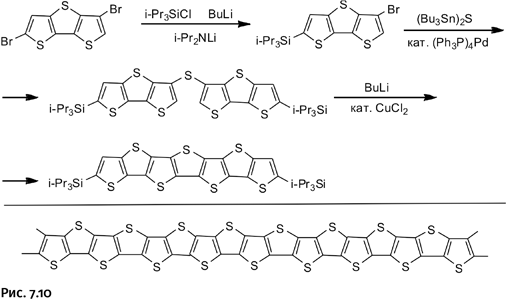
Фактически получен фрагмент будущего полимера поликарбосульфида (показан под чертой), он не содержит атомов водорода и имеет состав [C2S]n. Этот пока не созданный полимер считают многообещающим, поскольку предполагают появление в нем электропроводимости, к тому же он должен обладать повышенной устойчивостью к окислению и благодаря этому сохранять проводниковые свойства.

