7
Шаги современной химии
Войдя на первую ступеньку, на всякий случай погляди, куда ведет лестница.
М. ЦИВЕЛ
Почетные награды и премии, очевидно, ожидают и в будущем многих современных исследователей, но заранее предсказать все это трудно, тем более что всеобщее признание приходит к ученому спустя много лет (иногда десятилетия) после того, как были получены важные результаты. Не будем ждать, когда нас об этом известят средства массовой информации, а просто познакомимся с некоторыми эффектными достижениями современной химии. Иногда это бывает результатом долгого пути, который подготавливает важное событие, но возможен также совершенно неожиданный поворот, открывающий новые горизонты.
Легко ли обойти лидера?
Когда бежишь где-то сзади, хочется верить, что лидер споткнется.
БОРИС ШАПИРО
Бензол и его производные не только создали класс, называемый ароматическими соединениями, но и заняли отчетливое лидирующее место в этой области химии. Соединений, содержащих бензольный цикл, описано огромное количество. А ведь существуют и другие ароматические соединения, но могут ли они соперничать с бензолом? Для этого необходимо проявить некие особые свойства и показать свою полезность.
Вначале выясним, что скрывается за звучным словом «ароматичность». Этот термин ввел Ф. Кекуле, который установил в 1865 г. строение бензола и предложил для него циклическую формулу. Название «ароматический» связано с тем, что некоторые производные бензола – бензальдегид, бензиловый спирт, эфиры бензойной кислоты – были выделены из ароматических масел и бальзамов; кстати, нитробензол имеет запах миндаля. Кекуле обратил внимание на то, что двойные связи в бензоле и в его производных заметно отличаются по свойствам от двойных связей в большинстве ненасыщенных соединений. Для бензола оказались крайне затруднены реакции присоединения по двойным связям, которые в случае ненасыщенных соединений проходят легко.
Говоря иначе, бензол, в отличие от обычных ненасыщенных соединений, в процессе различных реакций старается сохранить свою циклическую форму с чередующимися простыми и двойными связями. Наиболее характерны для бензола реакции не присоединения, а замещения. Для этого могут быть использованы только окружающие атомы водорода, причем их замена на какую-либо группу предсказуемым образом влияет на реакционную способность остальных атомов водорода.
Некоторое время ароматичностью считали набор указанных химических свойств, но постепенно были найдены более точные признаки, основанные на особенностях электронного строения. В современном понимании это выглядит следующим образом: в образовании двойных связей участвуют р-электроны атомов углерода, орбитали (область наиболее вероятного расположения электрона в пространстве) которых имеют форму объемных восьмерок. В случае бензола р-орбитали взаимоперекрываются, образуя кольцевые молекулярные орбитали, на которых и располагаются эти электроны (рис. 7.1).
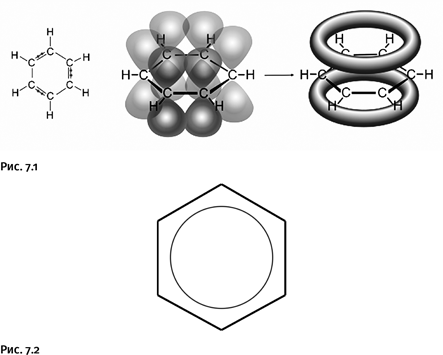
В результате появляется единая замкнутая электронная оболочка, система приобретает высокую стабильность. Фиксированные простые и двойные связи в бензоле отсутствуют, все связи С – С усреднены и эквивалентны, поэтому нередко для обозначения ароматичности используют кольцо, помещенное внутри цикла (атомы водорода часто не показывают) (рис. 7.2). Именно замкнутая электронная оболочка служит причиной того, что заместитель (например, метильная группа или галоген), введенный вместо одного атома водорода, способен передать свое влияние на остальные атомы водорода и изменить их склонность к последующему замещению.
Постепенно были сформулированы общие признаки ароматических соединений: это плоские циклические молекулы, причем количество электронов, объединенных в единую циклическую систему, должно быть строго определенным. Немецкий химик Э. Хюккель на основании квантовохимических расчетов вывел правило, указывающее, сколько электронов должно быть в циклической молекуле, чтобы она стала ароматической. В общем виде количество электронов х, удовлетворяющее правилу Хюккеля, рассчитывают по формуле х = 4n + 2 (где n – число натурального ряда, т. е. 0, 1, 2, 3 и т. д.). Таким образом, циклические молекулы, имеющие 2, 6 (бензол) или 10 электронов, обладают ароматичностью.
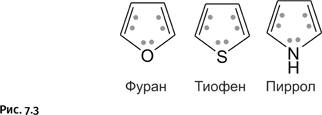
Со временем круг соединений, причисляемых к ароматическим, расширился. Этот термин оказался применимым также к соединениям небензольного типа, обладающим в то же время набором структурных признаков, характерных для бензола, иными словами, это циклические структуры с чередующимися простыми и двойными связями. Кроме того, они удовлетворяют правилу Хюккеля. В состав цикла помимо углерода могут входить атомы O, S или N (гетероциклические соединения), это молекулы фурана, тиофена, пиррола. Так же, как в бензоле, у них устойчивая – в соответствии с правилом Хюккеля – шестиэлектронная замкнутая система. Дело в том, что неподеленная электронная пара у гетероатома O (или S, или N) тоже способна участвовать в образовании замкнутой электронной системы. Четыре р-электрона (показаны точками на рис. 7.3) участвуют в двойных связях цикла, а два р-электрона (точки у соответствующего гетероатома) дают атомы кислорода, серы или азота, имеющие неподеленную пару электронов.
Если основные структурные признаки соблюдены (плоское кольцо и необходимое количество р-электронов), то и появляются соответствующие химические признаки ароматичности: молекула стабильна, реакции присоединения затруднены, но зато легко протекают реакции замещения; замкнутая электронная система при этом сохраняется. Как видим, количество атомов в цикле (5 – у гетероциклов, 6 – у бензола) решающего значения не имеет.
Судьба некоторых молекул необычна: яркое, эффектное появление, затем следует долгое прозябание, иногда даже полное забвение, а потом неожиданный расцвет. Далее речь пойдет об одном из показанных выше соединений – о тиофене.

