Зримые танцы молекул на металлическом паркете
Лауреатом Нобелевской премии 2007 г. по химии стал профессор Герхард Эртль (рис. 5.19), работающий в берлинском Институте Фрица Габера Общества Макса Планка. В формулировке Нобелевского комитета сказано, что премия присуждена за изучение химических процессов на твердых поверхностях. Звучит несколько туманно, однако некоторые, вероятно, обратят внимание на то, что даже в такой краткой формулировке содержится что-то непривычное, поскольку известно, что подавляющее большинство химических реакций протекает в газовой фазе или в растворе, но не в твердой фазе.

Тем не менее процессы, протекающие на твердых поверхностях, известны давно: прежде всего, это гетерогенный катализ, когда реагенты представляют собой жидкости или газы, а катализатор находится в твердой фазе. Напомним, что катализаторы – это вещества, которые добавляют в реакционную систему для ускорения химической реакции, при этом катализатор в состав продуктов реакции не входит. Большинство современных промышленных процессов, например переработка нефти, синтез полимеров и многие другие, основаны на использовании катализаторов.
Для объяснения того, как именно работают гетерогенные катализаторы, предлагали различные умозрительные теоретические схемы, которые удовлетворительно описывали протекающие превращения. Что же касается экспериментального изучения процессов, проходящих на поверхности катализатора, то до последнего времени оно шло с трудом, поскольку реакции, протекающие на твердых поверхностях, существенно отличаются от реакций в жидкостях или газах. Их изучение возможно только в особых условиях: например, в среде исключительно высокого вакуума, в специальных изолированных емкостях и с использованием особо чистых реактивов, что позволяет получить воспроизводимые результаты. Именно все это и удалось осуществить Г. Эртлю.
Успех Эртля был подготовлен стремительным развитием в 60-х гг. ХХ в. новых технологий, прежде всего в производстве микросхем. Чистота поверхности элементарного кремния, используемого для изготовления процессоров, играет решающую роль в его работоспособности. В результате были созданы новые технологические процессы получения сверхчистого кремния и разработаны чувствительные спектральные методы оценки чистоты.
Эртль сумел оценить новые методы и приспособить их для решения химических задач. Фактически он создал новую экспериментальную школу, которая позволила исследовать химию поверхности. Необходимую информацию Эртль получал, облучая изучаемые объекты потоком электронов или фотонов и затем анализируя ответное излучение с помощью современных приборов. Поясним вкратце, о чем идет речь. При использовании фотоэмиссионного электронного микроскопа поверхность освещают ультрафиолетовым светом. При этом возникают фотоэлектроны, т. е. электроны, возбужденные облучением. Те из них, которые обладают наибольшей энергией, отрываются от поверхности. Эти электроны с помощью специальных линз направляются на люминесцентный экран. Картина, возникающая на экране, отражает состояние поверхности и положение находящихся на ней отдельных атомов. При обычном давлении пробег таких электронов очень короткий, поскольку они сталкиваются с молекулами газов, присутствующих в воздухе. Чтобы эти электроны, несущие важную информацию, дошли до экрана, необходим очень высокий вакуум – до 10–9 мбар.
Основная заслуга Герхарда Эртля состоит в том, что он научился наблюдать поведение отдельных атомов и молекул на исключительно чистых металлических поверхностях, комбинируя различные экспериментальные методики. Он сумел зафиксировать явления, происходящие на поверхности катализатора, и объяснил, как все происходит на самом деле.
Проще всего начать знакомство с творчеством Эртля, если взглянуть на предложенную им самим картинку, где представлен суммарный итог его работы – результаты, которые нашли конкретные применения (рис. 5.20). Они условно объединены изображением современного трактора, однако значение этих работ далеко выходит за рамки сельского хозяйства.
А теперь расскажем о том, какое отношение имеет премированная работа к производству удобрений.
Перекличка двух химиков с интервалом в 90 лет
Из школьного курса химии мы знаем, что в состав удобрений непременно входят вещества, содержащие калий, фосфор и азот. С первыми двумя элементами особых сложностей нет, их запасы велики, зато азот долгое время был большой проблемой, к началу ХХ в. все природные запасы химически связанного азота (в основном нитраты) оказались исчерпаны. Острый дефицит азотсодержащих соединений возник потому, что они требовались не только для производства удобрений, но и в индустрии взрывчатых веществ, красителей, медикаментов и во многих других отраслях.
Громадное количество азота содержится в атмосфере, но этот азот чрезвычайно химически инертен и перевести его в какое-либо соединение весьма непросто, хотя, как оказалось, все же возможно. Поскольку речь идет о знаменитой реакции, буквально накормившей человечество, то повторное упоминание о ней не будет лишним.
Итак, крупной победой химии считают созданный немецкими химиками Ф. Габером и К. Бошем процесс, позволяющий превратить атмосферный азот в смеси с водородом в аммиак:
N2 + 3 H2 = 2 NH3.
Процесс проходит в присутствии катализатора – металлического железа с примесями оксидов алюминия и калия – при температуре 400–600 °С и давлении до 1000 атм. Найти катализатор оказалось совсем не просто, для этого Габер испробовал несколько тысяч (!) различных соединений, в результате решение очень остро назревшей проблемы было найдено.
Итак, главная задача – это химически связать атмосферный азот, далее полученный аммиак каталитически окисляют до оксидов азота, в конечном итоге получают азотную кислоту и нитраты, столь необходимые различным производствам.
Несмотря на то что условия каталитического синтеза аммиака за долгие годы были всесторонне изучены, все еще оставалось неясным, как же именно протекает процесс. За решение этой задачи взялся Г. Эртль, который волею судьбы оказался сотрудником института, носящего имя Фрица Габера. Впрочем, такая преемственность в направлении исследований, скорее всего, не случайна, и эстафетная палочка, представляющая собой процесс получения аммиака, спустя почти 90 лет перешла из рук одного нобелевского лауреата к другому.
Вначале Эртль исследовал поведение молекул азота на поверхности чистого железа и обнаружил, что эти молекулы сперва адсорбируются на поверхности (иными словами, прилипают к поверхности), а затем частично распадаются на атомы N2 ⇄ 2N, что происходит крайне медленно. Точно так же на поверхности железа распадаются на атомы молекулы водорода, но это, как установил Эртль, проходит заметно легче; самая медленная стадия, определяющая итоговую скорость процесса, – распад молекул азота на атомы.
Итак, первичная стадия была установлена. Затем Эртль стал изучать эту реакцию на реальном катализаторе – на железе, содержащем в качестве примеси оксид калия. После проведения процесса и удаления образовавшегося аммиака на поверхности катализатора оставались только атомы азота. Оказалось, что чем выше было давление водорода, тем меньше оставалось на поверхности адсорбированных атомов азота N, а вот количество адсорбированных молекул N2 практически не менялось. Эртль сделал вполне логически обоснованный вывод: синтез проходит с участием отдельных атомов N, а не молекул N2 (ранее полагали, что в реакции участвуют двухатомные молекулы).
Если бы водород реагировал не с атомарным, а молекулярным азотом, то неизменным было бы содержание атомарного азота при различных давлениях водорода. Рассуждения простые и достаточно строгие. Чтобы отличить друг от друга находящиеся на поверхности атомарный и молекулярный водород, Эртль использовал современные спектральные методы, позволяющие анализировать излучение, которое испускают возбужденные электроны. Другой способ состоял в бомбардировке поверхности электронами, что позволяло определить текстуру поверхности и, соответственно, «увидеть», где находятся молекулы или атомы. Именно поэтому необходимо было исследовать исключительно чистую исходную поверхность, иначе вся картина оказалась бы сильно искаженной и трудно читаемой.
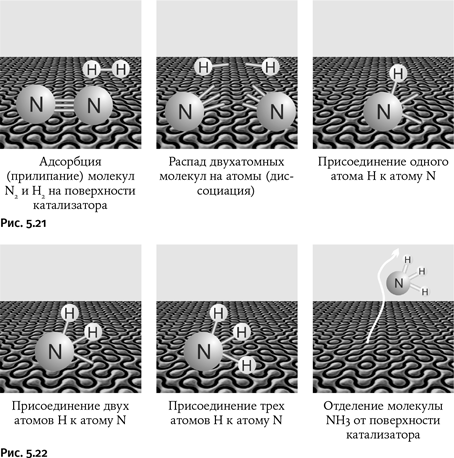
Детально исследуя процесс, он установил, что присоединение атомов водорода проходит ступенчато – вначале присоединяется один атом, затем два, потом три:
N2 ⇄:N ⇄:NH ⇄·NH2 ⇄ NH3.
Сдвоенные стрелки указывают, что стадии обратимы. Точки у атомов азота обозначают неспаренные электроны, т. е. на промежуточных стадиях образуются радикалы – молекулы, содержащие неспаренные электроны. Самая медленная стадия, определяющая общую скорость процесса, – это первая: распад молекулы азота на атомы. Оказалось, что наименее прочно адсорбируется на поверхности катализатора молекула аммиака, это позволяет ей легко отделиться от катализатора, что в конечном итоге вполне устраивает «потребителя», желающего получить готовый продукт ☺. Все описанные стадии изображены на рисунках 5.21 и 5.22.
Эртлю удалось не только качественно описать всю схему, но и определить тепловые эффекты реакции на каждой стадии. При изучении первой стадии (диссоциация молекулы азота на атомы) особых трудностей не возникло, поскольку она протекает сравнительно медленно, но зато остальные стадии протекали столь быстро, что «разглядеть» их не удавалось. Эртль нашел выход – стал изучать эти стадии при их протекании в обратном направлении, такое происходит при понижении давления. Удалось также объяснить «стимулирующую» роль примесей оксида калия в металлическом железе, эта добавка облегчает протекание самой важной стадии – распада молекул азота на атомы, делая процесс энергетически более выгодным.
Итак, Эртль сумел зафиксировать все промежуточные стадии и количественно их охарактеризовать, т. е. определить скорости этих реакций и их энергетические параметры.

