От демонтажа – к сборке
Казалось бы, после того как установлена структура молекулы, синтезировать ее заново не составит большого труда. Если какая-либо деталь собрана на резьбовых соединениях, то разобрать и собрать ее несложно, нужны лишь отвертка или гаечный ключ. Но если изделие представляет собой отливку или это сварное изделие, то разобрать (разрезать или распилить), а затем собрать его вновь совсем не просто. В этом случае разборка и сборка (по способам решения) совершенно разные задачи.
Основная трудность при сборке белковой молекулы – добиться, чтобы необходимые аминокислоты соединялись строго в намеченном порядке. Так как каждая аминокислота может реагировать не только с другой аминокислотой, но и сама с собой, то в итоге может получиться молекула, не имеющая ничего общего с тем, что синтезирует живой организм.
К моменту, когда решался вопрос о синтезе инсулина, было разработано несколько соответствующих методик. Чтобы аминокислота, которую необходимо присоединить к растущей цепи, не реагировала сама с собой, ее реакционноспособные концы (аминогруппу NH2 и карбоксильную группу СООН) блокировали специальным образом: карбоксильную группу переводили в п-нитрофениловый эфир NO2C6H4O–, а со стороны аминогруппы присоединяли карбоксибензильную группу – C(O)CH2C6H5. Такая блокированная с двух сторон молекула не может реагировать сама с собой, но зато она может реагировать со свободной аминогруппой, находящейся на конце растущей цепи, при этом «левая» блокировка удаляется в виде NO2C6H4OН (рис. 5.12).
На схеме (рис. 5.13) показано, что к растущей цепи, имеющей на конце фрагмент аланина (АЛА), присоединяется молекула глицина (ГЛИ), в результате растущая цепь удлиняется на одно звено. Однако теперь на конце цепи разместилась блокирующая карбоксибензильная группа – C(O)CH2C6H5. Из показанной выше схемы следует, что цепь наращивают аминокислотой со стороны «аминного хвоста» этой цепи, который оказался теперь заблокированным. Следовательно, нужно сделать этот «аминный хвост» реакционноспособным, т. е. перевести его в активную форму, что осуществляли обработкой бромоводородом с уксусной кислотой, блокировка при этом удаляется в виде Br-CH2C6H5 по схеме (рис. 5.13).
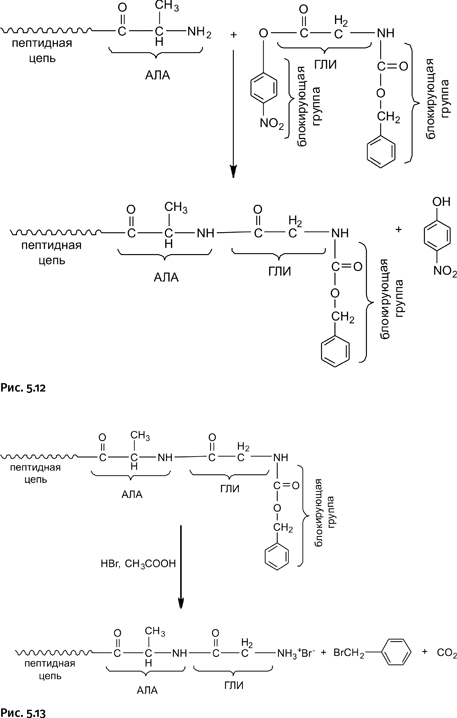
В результате аминогруппа на конце цепи (она показана в виде аммониевой соли с HBr) вновь готова реагировать с очередной аминокислотой (естественно, тоже содержащей блокирующие группы). Параллельно были разработаны и другие методы сборки полиамидных цепей.
Штурм вершины
К полному синтезу инсулина в 1962 г. приступили практически одновременно три группы исследователей: группа Катосоянниса из Питтсбурга, США (рис. 5.14), группа Г. Цана из Аахена, Германия (рис. 5.15), а также группа китайских химиков из Шанхая и Пекина. Все три группы действовали по весьма похожим стратегиям: собрали отдельно короткую и длинную цепь из заготовленных фрагментов, а затем соединяли обе цепи дисульфидными мостиками.

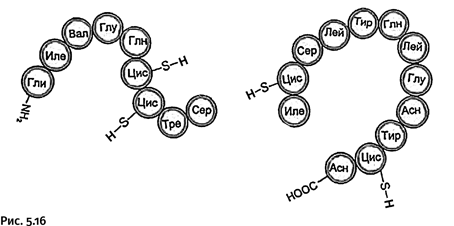
Короткую цепь все три группы химиков монтировали одинаково, из одних и тех же двух блоков (рис. 5.16).
Длинную цепь составляли из четырех фрагментов, однако перед синтезом необходимо было решить, из каких именно блоков ее следует собирать, и потому длинную цепь мысленно «разрезали», но места разреза каждая группа намечала по-своему. Различия возникли из-за того, что неодинаковы были и методы соединения блоков, и методы промежуточной защиты, используемые каждой из групп.
Естественно, на последнем этапе у всех авторов получились одинаковые молекулы. Приблизительно год ушел на создание исходных блоков. Подстегиваемая обстановкой соревнования аахенская группа интенсифицировала работу и в декабре 1963 г. сообщила об успешном синтезе инсулина. Эта группа буквально вырвала первенство у питтсбургских химиков, которые сообщили об успешном результате в марте 1964 г. Окончательный выход чистого продукта колебался в пределах 0,02–0,07 %. У китайских химиков выход был несколько выше (1,2–2,5 %), но, разумеется, о производстве инсулина по таким методикам не могло быть и речи.
Синтез инсулина стал убедительной победой классической синтетической химии. Несмотря на низкий выход продукта, все признавали, что была проделана выдающаяся работа, которая позволила изменить образ мышления химиков, сформулировать новые принципы сборки больших молекул, отработать стратегию синтеза и подобрать оптимальные методики. Все это заметно повысило общий уровень органической химии. Однако истинного триумфа не получилось: почти одновременно с успешным завершением этих работ появилась принципиально иная, более совершенная методика сборки белковых молекул.
Главное – закрепить хвост
Профессор Рокфеллеровского университета из Нью-Йорка Роберт Меррифилд (рис. 5.17), занимаясь химией белков, высказал оригинальную идею: первую аминокислоту можно закрепить одним концом на некой нерастворимой поверхности (носителе). Затем следует присоединить к другому ее концу следующую аминокислоту, при этом нежелательные побочные продукты и промежуточные реагенты, не вступившие в реакцию, можно будет вымывать из реакционного сосуда после каждой стадии, а растущий полипептид, прикрепленный к носителю, останется при этом незатронутым. Молекулы растущих полипептидов будут подвешены «за хвост» к твердой поверхности носителя, а когда процесс синтеза завершится, конечный полипептид можно отделить от носителя.
Меррифилду удалось реализовать эту идею в 1965 г. Первую аминокислоту присоединяют к нерастворимому полимерному гелю (сшитый полистирол) с введенными в него хлорметильными группами – CH2Cl, которые способны реагировать с группами СООН аминокислоты. Чтобы взятая для реакции аминокислота не прореагировала сама с собой и не присоединилась своей H2N-группой к подложке, аминогруппу этой кислоты предварительно блокируют объемистым заместителем – [(С4Н9)3]3ОС(О)-группой. После того как аминокислота присоединилась к полимерной подложке, блокирующую группу удаляют и в реакционную смесь вводят другую аминокислоту, у которой также предварительно заблокирована H2N-группа. В такой системе возможно только взаимодействие H2N-группы первой аминокислоты и группы – СООН второй кислоты, которое проводят в присутствии катализаторов (солей фосфония). Далее всю схему повторяют, вводя третью аминокислоту.

На последней стадии полипептидные цепи отделяют от полистирольной подложки действием HBr в присутствии трифторуксусной кислоты F3CCOOH. Меррифилд не только экспериментально проверил эффективность метода, но и сконструировал аппарат, который практически автоматизировал пептидный синтез. Это устройство представляло собой контейнер для аминокислот и реагентов, а также реакционный сосуд с автоматическими впускным и выпускным клапанами и программным механизмом, который регулировал последовательность процессов и длительность каждой стадии.
Часто иной подход к решению задачи заметно облегчает достижение результата. С помощью сконструированного аппарата Меррифилд и его коллеги синтезировали инсулин всего за 20 дней (притом с выходом в десятки процентов), в то время как «первопроходцы» – аахенская, питтсбургская и шанхайская группы – затратили на это больше года.
В 1984 г. Меррифилд был удостоен Нобелевской премии «За развитие методологии твердофазного химического синтеза».
Призовем на помощь природу
Во время проведения всех описанных выше работ химиков не оставляла мысль, что те задачи, которые ученые решают с таким трудом, природа решает легко и исключительно аккуратно. Синтез белков в живых организмах проходит в мягких условиях, быстро и без образования побочных продуктов. До определенного момента химики могли лишь с удивлением и интересом наблюдать подобные «синтезы», однако стремительное развитие биохимии позволило активно вмешаться в эти процессы, в том числе открыть принципиально новый способ синтеза инсулина.
Вначале отметим, что Ф. Сенгер (установивший структуру инсулина) сумел определить также последовательность фрагментов в структуре знаменитой двойной спирали ДНК, за что и был удостоен второй Нобелевской премии. Эта работа позволила биохимикам перейти к следующему этапу – встраивать в генетический код ДНК заранее намеченные фрагменты. Основная идея состояла в том, чтобы в ДНК некоторых бактерий включать гены высших организмов. В результате бактерии приобретают способность синтезировать соединения, которые прежде могли синтезировать только высшие организмы. Подобную технологию называют «генной инженерией».
В 1981 г. канадский биохимик Майкл Смит (рис. 5.18) был приглашен в научные соучредители новой биотехнологической компании «Зимос». Один из первых контрактов фирмы был заключен с Датской фармацевтической компанией «Ново Нордиск», которая просила разработать технологию процесса производства человеческого инсулина в дрожжевой культуре. В результате совместных усилий способ был разработан, в 1982 г. инсулин, полученный по новой технологии, поступил в продажу. В 1993 г. за цикл работ в этой области М. Смит (совместно с К. Муллисом) удостоился Нобелевской премии. В настоящее время инсулин, получаемый методом генной инженерии, практически вытеснил инсулин животных.

Чьи работы важнее?
Итак, мы познакомились с четырьмя способами получения инсулина: из поджелудочной железы животных (группа Д. Маклеода), многоступенчатым синтезом (группа Г. Цана), автоматизированной сборкой (Р. Меррифилд), методом генной инженерии (М. Смит). Оставим в стороне медицинские проблемы, сосредоточим внимание на химии. У вас могло сложиться впечатление, что работы М. Смита сделали ненужными все предшествующие исследования. На самом деле это не так, все методы неразрывно связаны, ни один из этапов исследований нельзя выбросить. Инсулин, выделенный из поджелудочной железы животных, позволил Ф. Сенгеру определить его структуру, а без этого никакой последующий синтез невозможен. Группа Цана разработала химические приемы сборки цепей и способы промежуточной блокировки функциональных групп, которыми воспользовался Меррифилд при создании автоматической установки синтеза. Работы Смита, по существу, опирались на весь предшествующий опыт, накопленный при изучении инсулина. При синтезе некоторых короткоцепных гормонов автоматическая установка Меррифилда оказалась предпочтительнее генной инженерии. Обобщая, можно сказать, что все этапы, которые мы рассмотрели, – это естественный, традиционный и, если не бояться торжественных слов, величественный путь науки.

