Режем на части
При распиливании бревен на отрезки различной длины было сделано 30 распилов, в итоге образовалось 50 чурбачков. Сколько было распилено бревен?
Подсказка: из каждого бревна получается на один чурбачок больше, чем сделано распилов.
Если подсказка не помогла, смотрите ответ (перевернут и отражен в зеркале).
От медицины – к химии
Ранее упомянутые физиологи Маклеод и Бантинг использовали для лечения больных экстракт поджелудочной железы животных, однако химиков всегда интересовало, как именно устроено то или иное соединение. Впервые инсулин в кристаллическом виде сумел выделить в 1926 г. Дж. Абель, и именно благодаря работам Абеля удалось наладить его промышленное производство. Абель также определил состав инсулина: оказалось, что он представляет собой белковую молекулу. Начиная с этого момента исследования инсулина из медицины переходят в область химии, точнее в руки биохимиков.
Все предыдущие работы подготовили решающий этап, позволивший выяснить, как устроена молекула, привлекавшая внимание столь большого числа исследователей. Решить эту задачу удалось английскому биохимику Фредерику Сенгеру (рис. 5.6), которому в 1958 г. была присуждена Нобелевская премия «За работы по структуре протеинов, особенно инсулина». Вначале он разработал способ, позволявший установить природу концевой группы в белковой молекуле путем обработки в щелочной среде динитрофторбензолом (впоследствии этот метод стал классическим). Далее Сенгер буквально разобрал на части молекулу инсулина и определил состав полученных аминокислот с помощью самых современных методов – электрофореза, разработанного А. Тиселиусом (нобелевский лауреат 1948 г.), и хроматографии, усовершенствованной А. Мартином и Р. Сингом (нобелевские лауреаты 1952 г.). Однако установить, из каких аминокислот собрана белковая молекула, – лишь половина дела, притом менее сложная. Главное – выяснить их последовательность в цепи. Сенгер разработал продуманный план, по которому с помощью специально подобранных ферментов (биологические катализаторы) он проводил расщепление цепи в различных заранее намеченных участках на небольшие отрезки, а потом сопоставлял их состав. Работа представляла собой безупречное сочетание логики и экспериментального мастерства. Свой метод Сенгер довел до совершенства, со временем его методика стала общим принципом при исследовании структуры белков.

Попутно отметим, что Сенгер на этом не остановился. Применив похожие логические построения, а также несколько изменив методику и используемые реагенты, он сумел установить последовательность фрагментов в структуре знаменитой двойной спирали ДНК. За эти исследования в 1980 г. Сенгеру (совместно с У. Гилбертом и П. Бергом) была присуждена Нобелевская премия «За вклад в определение последовательности оснований в нуклеиновых кислотах». Таким образом, на сегодня Сенгер – единственный дважды нобелевский лауреат по химии.
Никто в то время не мог предположить, что эти исследования ДНК позволят со временем открыть новую страницу в химии инсулина, но об этом речь пойдет несколько позже.
Американский биохимик Винсент дю Виньо (рис. 5.7), в течение нескольких лет изучавший инсулин, узнав о работах Сенгера по расшифровке структуры, решил воспользоваться его методикой и пошел дальше: не только установил строение двух гормонов (вазопрессина и окситоцина), но и сумел их синтезировать. Фактически он был первым, кто сумел синтезировать природные полипептиды. Эта его работа была отмечена Нобелевской премией в 1955 г., в итоге он получил премию на три года раньше Сенгера, чьи идеи помогли ему добиться столь великолепного результата. Работы дю Виньо фактически открыли дорогу синтезу инсулина. Впрочем, молекула инсулина была более сложной, чем два полученных им соединения, кроме того, в то время еще не были разработаны способы, позволяющие связать две полипептидные цепи дисульфидными мостиками, т. е. перемычками – S – S–.
Тем временем изучение инсулина продолжалось. Исследование его лечебных свойств позволило установить, что цинковый комплекс из нескольких молекул – Zn-инсулин – обладает более длительным лечебным действием. Строение этого комплекса оказалось очень сложным (он содержит почти 800 атомов), поэтому были привлечены физико-химические методы анализа. В 1972 г. английский биофизик Д. Кроуфут-Ходжкин (рис. 5.8), лауреат Нобелевской премии 1964 г. («За определение с помощью рентгеновых лучей структур биологически активных веществ»), установила структуру этого необычайно сложного комплекса.

Упрощенный язык биохимиков
Прежде чем мы рассмотрим строение молекулы инсулина, познакомимся вкратце с тем, как биохимики изображают молекулы белков. Все белки представляют собой полимеры, цепи которых собраны из фрагментов аминокислот. Аминокислоты – это органические соединения, содержащие в своем составе (в полном соответствии с названием) аминогруппу NH2 и органическую кислотную, т. е. карбоксильную, группу СООН. В образовании белков участвуют только такие аминокислоты, у которых между аминогруппой и карбоксильной группой всего один углеродный атом. В общем виде они могут быть представлены формулой H2N – CH(R) – COOH. Группа R, присоединенная к атому углерода (тому, который находится между аминогруппой и карбоксильной группой), определяет различие между аминокислотами, образующими белки. Эта группа может состоять только из атомов углерода и водорода, но чаще содержит помимо С и Н различные функциональные группы. Из всего многообразия существующих аминокислот (теоретически количество возможных аминокислот не ограничено) в образовании белков участвуют в большинстве случаев только 20 аминокислот, называемых фундаментальными. Для «строительства» инсулина природа использовала 16 аминокислот (из допустимых 20).
Большинство названий сложилось исторически, для их обозначения широко применяют трехбуквенные сокращения: глицин – ГЛИ, аланин – АЛА и т. д. В международной практике их обозначают с помощью латинских трехбуквенных сокращений: например, глицин – Gly, аланин – Ala и др.
Белковая молекула образуется в результате последовательного соединения аминокислот, при этом карбоксильная группа – COOH взаимодействует с аминогруппой – NH2 соседней молекулы, в результате образуется пептидная связь – CO – NH– и выделяется молекула воды. На рисунке 5.9 показано последовательное соединение аланина, валина и глицина.
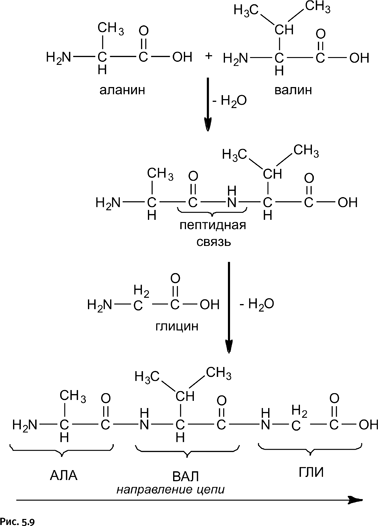
Из этой схемы следует, что при любом количестве соединяемых аминокислот на одном конце возникшей цепочки обязательно будет находиться аминогруппа – NH2, а на другом – карбоксильная группа – C(O)OH. Таким образом, вместо структурной формулы мы можем использовать сокращенное обозначение получившегося соединения: АЛА-ВАЛ-ГЛИ. Поскольку количество аминокислот, используемых природой, всего 20, то подобные сокращения позволяют компактно записать формулу любого белка и никакой неясности при этом не возникает.
Молекула инсулина, как установил Ф. Сенгер, состоит из 51 аминокислотного остатка (это один из самых короткоцепных белков) и представляет собой две соединенные между собой цепи неодинаковой длины. На рисунке 5.10 показан порядок чередования аминокислотных фрагментов, обозначенных трехбуквенными сокращениями.
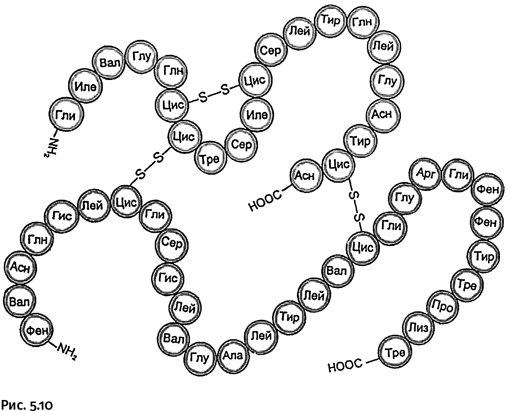
Обратите внимание: содержащиеся в цепи остатки аминокислоты цистеина (сокращенное обозначение ЦИС) образуют дисульфидные мостики – S – S–, которые связывают две полимерные молекулы и, кроме того, образуют перемычку внутри одной цепи. При таком компактном изображении белковой молекулы символы химических элементов используют только для обозначения дисульфидных мостиков и концевых групп (NH2 и COOH).
Для сравнения рассмотрите структурную формулу инсулина в виде объемной шаростержневой модели (рис. 5.11).