Диалог с атомом
Спорить умеют многие,
мало кто умеет просто беседовать.
АМОС БРОНСОН ОЛКОТТ
Смысл любого исследования – задавать вопросы природе, и если они поставлены удачно, то природа, скорее всего, сумеет по достоинству оценить проявленный к ней интерес. Такой диалог всегда имеет продолжение: завершенное исследование заканчивается не только готовыми результатами, но и появлением новых вопросов, что делает сам процесс исследования еще более увлекательным. Прежде чем начать беседу с атомом, проведем небольшую разминку.
Зримое решение
Кирпич весит полкирпича плюс 1 кг. Сколько весит кирпич (естественно, в килограммах)? Большинство отвечает сразу, не задумываясь: 1,5 кг, проверьте это на своих знакомых. Ответ неправильный, а решить задачу без ошибки проще всего зрительно. Поставьте мысленно на одну чашку весов кирпич, а на другую – полкирпича и гирю в 1 кг (как по условию задачи). Теперь так же мысленно уберите гирю. Что надо поставить вместо нее, чтобы весы остались в равновесии?
Разумеется, еще полкирпича (рис. 3.21).
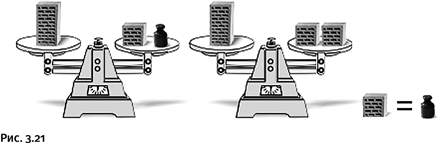
Такая замена нас убедит, что полкирпича имеет ту же массу, что и килограммовая гиря. Если полкирпича весит 1 кг, то целый кирпич – 2 кг.
Не самые удобные запасы
Основой промышленного синтеза громадного числа органического соединений, а также базой для производства полимеров служит главный сырьевой источник – нефть, не менее значим также природный газ, использование которого для процессов органического синтеза предпочтительнее, но пока менее развито. Третий широко известный источник углерода – каменный уголь.
К сожалению, следует признать, что природа заготовила для нас запасы углерода не в самом удобном виде. Известно, что чем инертнее вещество, тем оно лучше сохраняется, и именно потому существуют большие запасы нефти в земной коре. Нефть почти на 80 % состоит из насыщенных углеводородов – парафинов (в их названии содержится указание на химическую инертность: parum affinis – лишенный сродства) и нафтенов (циклических углеводородов).
Возможно, некоторые полагают, что нефть и газ не такие уж инертные вещества, они же очень легко сгорают. Этот процесс полезен с точки зрения энергетика, но химик считает, что сжигание – это разрушение, а не созидание полезных веществ.
Если мы хотим использовать нефть и газ как сырье для синтеза, то должны научиться превращать исходные углеводороды в соединения с реакционноспособными группами. Для этого необходимо уметь разрывать связи С – Н и С – С (рис. 3.22).
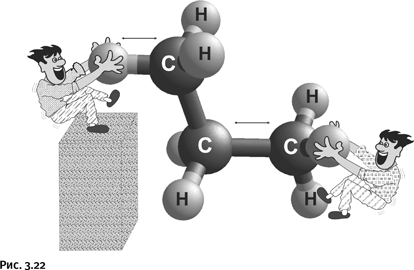
На сегодня существуют достаточно хорошо разработанные методы таких превращений, однако большинство из них, такие, например, как крекинг (разрыв связи С – С) или галогенирование (разрыв связи С – Н), очень энергоемки и неселективны (неизбирательны), они дают широкий набор различных продуктов.
Итак, существует потребность в деликатной и селективной переработке углеводородов в различные полезные продукты. Решить проблему может катализ, который в химии сравним с современными хирургическими инструментами в медицине. Речь идет не о скальпеле, а скорее об эндохирургических методах, позволяющих проводить операцию, не вскрывая брюшную полость, а подводя инструмент к нужному месту по кровеносным сосудам.
Удачный выбор объекта – половина успеха
Исследования прежних лет показали, что каталитическое расщепление связи С – Н можно осуществить в присутствии комплексов благородных металлов, и потому до определенного момента ученые полагали, что справляться со столь трудной задачей могут только соединения подобных металлов (родий, рутений, платина).
Интенсивные исследования комплексов переходных металлов косвенно указывали на то, что в первую очередь интересны в этом отношении элементы IV группы Ti, Zr и Hf, однако их каталитическая активность должна проявиться только в том случае, если они находятся в низкой степени окисления (ниже четырех). Основная трудность состоит в том, что в низких степенях окисления эти металлы крайне нестабильны. Опыт работы с благородными металлами в этом случае использовать не удастся, поскольку у элементов IV группы химия несколько иная.
Конструирование нужной молекулы – процесс увлекательный, требующий знаний, воображения и настойчивости. Познакомимся с тем, как решал поставленную задачу профессор Д.А. Леменовский (рис. 3.24), работающий на химическом факультете МГУ.

Вначале были получены циклические лиганды С5Н5, содержащие нужные хелатные «хвосты», на концах которых расположены O, N, S, или P, они должны координировать центральный атом металла и тем самым защитить его. Получение таких молекул было результатом заранее тщательно продуманных трех- или четырехстадийных синтезов.
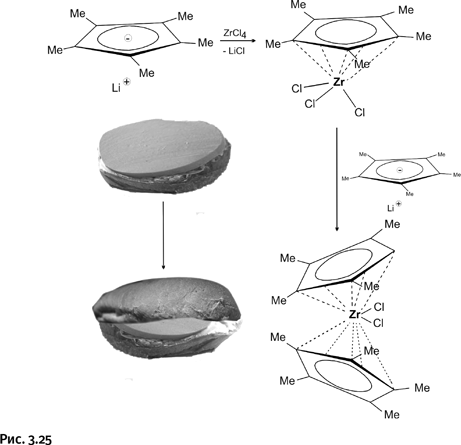
В качестве каталитического центра был выбран цирконий, поскольку в этом случае можно было ожидать более высокую активность, что, впрочем, не означает, что исследования Ti и Hf менее интересны. Присоединение лиганда к атому металла традиционное – взаимодействием литийпроизводного цикла С5Н5 с галогенидом металла ZrCl4. При замещении одного атома Cl у Zr происходит образование полусэндвича (однослойный бутерброд), а при замещении следующего – полный сэндвич (двухслойный бутерброд) (рис. 3.25).
Именно такая простая реакция приводит к сэндвичевым соединениям, где атом металла связан не с конкретным углеродным атомом в лиганде, а со всем циклом сразу; в данном случае все определяет химическая природа лиганда. Обратите внимание, циклопентадиенильные циклы расположены у атома циркония не параллельно, они приоткрывают металл «с одного бока», приглашая к цирконию хелатные группы или иные реагенты.
Поскольку речь идет о новых соединениях, то невозможно заранее угадать, насколько плотно следует укрывать атом Zr, чтобы защитить его от возможного окисления, вполне вероятно, что одной хелатирующей группы будет вполне достаточно, а потому следовало запланировать различные варианты. Можно, например, синтезировать полусэндвич с одним C5H5-циклом, а из полусэндвича можно также получить «полные» сэндвичи, причем с одной или двумя хелатирующими ветвями (рис. 3.26).
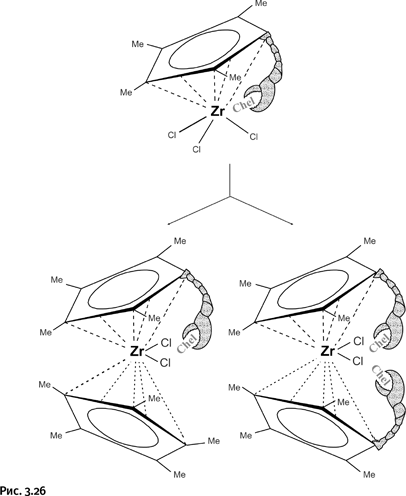
Далее в рисунках будем обозначать метильные группы у циклического лиганда упрощенно, в виде валентных черточек (не указывая символ Ме).
«Примерив» разнообразное облачение, цирконий обнаружил особенности своего характера. В полностью завершенных сэндвичах (с двумя циклическими лигандами) цирконий чувствовал себя вполне комфортно и не проявлял интереса к хелатирующим группам, двух присоединенных атомов хлора ему было вполне достаточно.

