Заблуждение известного химика
Немецкий химик Юстус Либих (рис. 3.8) в середине XIX в. возглавлял крупнейшую в Европе научную школу химиков. Среди его учеников были видные российские химики: А.А. Воскресенский, Н.Н. Зинин и др. Основным направлением его исследований было получение и изучение новых химических соединений: он впервые описал хлороформ (1831), уксусный альдегид (1835), открыл молочную и другие карбоновые кислоты. Помимо этого, он изучал химию физиологических процессов: например, выдвинул химическую теорию брожения и гниения. Одна из его работ, доставившая много неприятностей, оказалась позже весьма значимой.

Анализируя золу сожженных растений, он установил, что в ее состав входят калий, фосфор, кальций и другие элементы. Рассуждения Либиха были просты и логичны: единственный источник этих элементов для растения – почва, которая постепенно обедняется после многократно собранных урожаев. Следовательно, нужные элементы необходимо добавлять в почву для увеличения ее плодородия. Основные взгляды он изложил в книге «Органическая химия в приложении к земледелию и физиологии» (1840).
Истины, которые нам теперь кажутся совершенно очевидными, вызвали в то время у ряда ученых резкий протест и возмущение. «Это самая бесстыдная книга из всех, которые когда-либо попадали мне в руки», – писал о ней профессор ботаники Тюбингенского университета Г. Моль. «Совершенно бессмысленная книга», – вторил ему известный немецкий писатель Ф. Рейтер, занимавшийся некоторое время сельским хозяйством. Немецкие газеты начали помещать оскорбительные письма и карикатуры на Либиха и на его теорию минерального питания растений. Ситуация осложнялась тем, что ожидаемой эффективности калийно-фосфатные удобрения, предложенные Либихом, во многих случаях не показали. Дело в том, что эти удобрения не содержали еще одного очень важного элемента – азота. Вначале Либих полагал, что азот растения усваивают из воздуха так же, как кислород и углерод (в виде СО2).
К чести Либиха следует сказать, что у него хватило мужества признать свою ошибку, он сумел ее обнаружить и впоследствии исправить. Постепенно взгляды Либиха стали общепризнанными, что вскоре привело к появлению заводов по производству минеральных удобрений.
Воздадим должное Юстусу Либиху: история химии ко всем его многочисленным заслугам причисляет также создание им новой науки – агрохимии, в основе которой лежит необходимость применения удобрений.
Интересно, что ошибка Либиха была в некоторой степени частичной, поскольку существуют растения (например, горох, клевер, соя), которые могут усваивать атмосферный азот с помощью микроорганизмов, развивающихся в особых клубеньках на корнях этих растений. Такие бактерии, называемые азотофиксирующими, умеют в мягких условиях при обычной температуре и давлении превращать атмосферный азот в химические соединения.
Второй, не менее важный процесс связывания атмосферного азота – это электрические разряды в молниях. Каждую секунду по всему миру в землю ударяют до 100 молний, при высоких температурах в электрическом разряде (в канале молнии температура достигает 20 000 °С) азот взаимодействует с кислородом воздуха, образует оксид азота NO, который далее окисляется атмосферным кислородом до диоксида: 2NO + O2 → 2 NO2. Затем оксиды, соединяясь с водой и солями в почве, переходят в нитриты и нитраты. Ежегодно молнии дают несколько миллионов тонн азотистых удобрений – четверть всего образующегося в природе химически связанного азота.
Именно эти два источника связанного азота – азотфиксирующие бактерии и молнии – позволяют растениям существовать и развиваться. Кроме того, опадающие листья и ветви образуют перегной, в котором сохраняется запасенный азот. Благодаря этому леса могут существовать неограниченно долго без дополнительных удобрений.
Ситуация меняется, когда урожай вывозят с полей. По приблизительным подсчетам, ежегодно на земном шаре вместе с сельскохозяйственной продукцией вывозят около 100 млн т связанного азота. Столь громадный дефицит не могут восполнить природные процессы.
Азот – это жизнь!
Напомним, что в растениях азот находится в составе белковых молекул, которые содержат в среднем 17 % связанного азота. Из белков в растениях он далее переходит в белки травоядных животных, а далее поступает в организм млекопитающих. В состав молекул ДНК тоже входит азот. Поскольку белки и ДНК – основа всех живых организмов, то можно утверждать, что от возможности образовывать химические соединения азота зависит существование жизни на Земле.
Ранее было сказано, что биологическая фиксация атмосферного азота возможна с помощью некоторых бактерий. Этот процесс живой природы не менее важен, чем дыхание и фотосинтез (образование органических соединений из СО2 и Н2О). В результате деятельности азотфиксирующих бактерий громадные запасы атмосферного молекулярного азота превращаются в аминокислоты и белки.
Недавние исследования показали, что азотфиксирующие бактерии могут находиться не только на корнях растений, но и в кишечнике некоторых животных, что было воспринято как нечто необычное. Обнаружено это было в результате решения одной интересной задачи: термиты – насекомые тропических стран, напоминающие европейских тараканов, – питаются исключительно целлюлозой древесины, в которой азота нет. Долгое время было непонятно, как же они синтезируют белки, из которых состоит организм любого животного. Японские биохимики установили, что в кишечнике термитов живут простейшие организмы – жгутиконосцы, а в клетках этих организмов находятся особые бактерии. В ДНК этих бактерий обнаружены гены, которые синтезируют специальный фермент, способный связывать атмосферный азот (все это напоминает матрешку).
Попутно отметим, что «азот» в переводе с греческого означает «безжизненный» (а – приставка, указывающая на отрицание, зоэ – значит жизнь, тот же корень в слове «зоология»). Такое название предложил для него А. Лавуазье, который, исследуя процессы горения, установил, что в состав атмосферы входит некое инертное вещество, не поддерживающее окислительные процессы. Однако теперь, учитывая все вышесказанное, мы можем утверждать, что азот – это жизнь. Благодаря этим знаниям много лет назад появилась статья на ту же тему со своеобразным броским заголовком: «Азот? Нет, Зот!»
Запасенный ранее азот
С калием и фосфором, столь необходимыми растениям, особых проблем нет – запасы минеральных соединений, содержащих эти элементы, велики. Естественно, стали искать природные запасы связанного азота, и они были найдены. В первую очередь это нитрат калия KNO3, его единственным источником был минерал, называемый индийской селитрой. Ее в больших количествах стали вывозить из Индии, и довольно быстро запасы были исчерпаны. Кроме того, основное количество этого сырья использовали не в качестве удобрения, а для производства пороха.
Позже был найден другой источник селитры – гуано (от исп. guano), слово, по звучанию очень похожее на русский синоним, означающий испражнения ☺. Это результат тысячелетних процессов разложения растительных и животных органических остатков, в том числе и птичьего помета – гуано, содержащих смесь кальциевых, натриевых и аммонийных солей фосфорной, азотной и некоторых органических кислот. Громадные запасы гуано находились в пустыне Атакама (Чили), расположенной в предгорьях Кордильер. Полагают также, что эти запасы были дополнены вулканическими выбросами аммиака и солей аммония. Поскольку в этом районе почти не бывает дождей, запасы гуано накапливалось в течение многих веков, образовав в некоторых местах залежи длиной около 200 км и шириной 3 км при толщине пласта от 30 см до 3 м. Спрос на гуано постоянно возрастал, потребность в нем достигла такого размаха, что в начале XX в. его экспорт составлял миллионы тонн и запасы стали быстро истощаться. Необходимо было найти способ связывать атмосферный азот. Естественно, человечество в поисках промышленных способов производства азотсодержащих соединений не могло рассчитывать только на бактерии, впрочем, природа дала подсказку – молнии.
Норвежские химики решили воспроизвести природный процесс – молнии – и связать азот с помощью электрического разряда. Для этого они продували влажный воздух через электрическую дугу. Такой возможностью в начале ХХ в. обладала, пожалуй, только Норвегия, поскольку в ней много гидростанций и электроэнергия была сравнительно дешевой. Образующуюся азотную кислоту переводили в нитрат кальция Ca(NO3)2 (получивший название норвежской селитры), который использовали в качестве удобрения. Процесс был исключительно энергоемкий, выход азотной кислоты невелик и не мог покрыть возрастающую во всем мире потребность в азотных удобрениях. Поэтому химики искали и нашли иной путь связывания азота.
Крупная победа химии
Важным событием стал созданный немецкими химиками Ф. Габером (рис. 3.9) и К. Бошем (рис. 3.10) процесс, позволяющий превратить атмосферный азот в смеси с водородом в аммиак (рис. 3.11).
Катализирует процесс металлическое железо с примесями оксидов алюминия и калия при температуре 400–600 °С и давлении до 1000 атмосфер. Найти катализатор оказалось совсем не просто, для этого Габер испробовал несколько тысяч (!) различных соединений, в результате решение остро стоявшей проблемы было найдено. За создание этого процесса Ф. Габер был удостоен в 1918 г. Нобелевской премии (К. Бош получил Нобелевскую премию позже, в 1931 г., за развитие методов высокого давления в химии).

Скромная экспериментальная установка Габера (рис. 3.12) со временем превратилась в крупные заводы по производству аммиака (3.13).
Условия, в которых происходит синтез аммиака (высокие температура и давление), весьма жесткие, все дело в высокой химической инертности азота. Каковы же причины этого? Два атома азота связаны тройной связью, однако она заметно отличается от тройной связи между атомами углерода. Труднее всего разорвать в азоте первую связь из трех, для этого требуется заметная затрата энергии – 523 кДж/моль. Интересно, что разрыв первой связи в азоте наиболее труден, вторая связь раскрывается заметно легче (263 кДж/моль) и еще легче – третья связь (155 кДж/моль). Поэтому в реакциях с участием молекулярного азота обычно раскрываются все три связи. Главное – расшевелить самую прочную связь, т. е. первую, а остальные сами «покатятся под горку» (рис. 3.14).

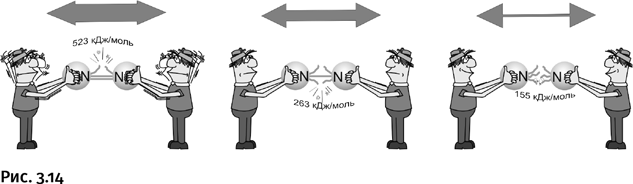
Совсем иначе обстоит дело с тройной связью между атомами углерода (например, в ацетилене). Первую связь из трех разорвать нетрудно, необходимо всего 222 кДж/моль. Зато прочность второй связи заметно выше, а третьей – еще выше. Поэтому из ацетилена и его производных можно получить соединение с двойной или одинарной связью, а полное разъединение атомов углерода обычно не происходит.
Итак, главную задачу удалось решить – химически связать атмосферный азот с помощью процесса Габера – Боша. Дотошный химик обязательно спросит, а где же брать водород для синтеза аммиака: в отличие от азота, земная атмосфера не может нам его предоставить. С водородом особых трудностей нет, поскольку существует промышленный процесс его получения из метана и воды. Процесс проводят в две стадии в присутствии оксидов железа, меди и цинка, играющих роль катализаторов, на каждой из двух стадий образуется водород (рис. 3.15).
Громадное количество современных заводов синтезируют аммиак по способу Габера – Боша. Далее полученный аммиак каталитически окисляют до оксидов азота, в конечном итоге получают азотную кислоту и нитраты (соли азотной кислоты), которые необходимы не только в сельском хозяйстве и при изготовлении взрывчатых веществ, но и в производстве красителей, медикаментов и в химической промышленности.

Промышленное получение аммиака – процесс исключительно энергоемкий, и проводят его в весьма жестких условиях, поэтому химики решили найти способы фиксации азота, проходящие в мягких условиях, близких к тем, которые наблюдаются в живой природе.
Не обязательно копировать природу
Было совершенно очевидно, что искусственно синтезировать сложные белковые комплексы, которые содержатся в азотфиксирующих бактериях, не имеет смысла: подобный синтез исключительно сложный, трудоемкий, кроме того, химики обычно не стараются копировать природу, а используют только те подсказки, которые дает изучение природных процессов, а далее ищут свои, более эффективные пути.
Как это часто бывает в химии, решение задачи было подсказано предыдущими исследованиями. Одна из подсказок в скрытом виде содержалась в идеях, лежащих в основе промышленного синтеза аммиака. В те времена, когда Ф. Габер создавал свой процесс, представления о механизме катализа были развиты весьма слабо, поэтому в поисках катализатора Габер использовал метод сплошного перебора. Во второй половине ХХ в. наука о катализе весьма усовершенствовалась. Например, было уже понятно, что при синтезе аммиака с участием металлического железа (в роли катализатора) молекулы азота вначале «садятся» на поверхность металла, а затем металл оттягивает на себя электронные облака, связывающие два атома азота, и связь ослабляется. Далее «ослабевшая» молекула может участвовать в различных превращениях.
Пожалуй, наиболее важными наблюдениями были следующие: существуют случаи, когда молекула азота может быть зафиксирована на атоме переходного металла. Например, при взаимодействии хлорида рутения с гидразином H2N-NH2 образуется комплекс, в котором гидразин превращается в аммиак и молекулярный азот, и оба образовавшихся соединения, в том числе нейтральная молекула азота N2, «садятся» на металл (рис. 3.16).
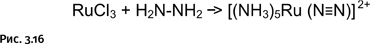
На самом деле в этом случае решена обратная задача: химически связанный азот (в гидразине) переходит в молекулярный азот N2. Результат интересен тем, что показывает, что молекулу азота можно зафиксировать на атоме металла. Были и другие подобные наблюдения. Таким образом, ожидать нужный результат – активировать молекулярный азот N2 – можно будет в том случае, если азот, во-первых, сумеет образовать комплекс с соединением переходного металла, а во-вторых, станет при этом достаточно активным (рис. 3.17).

Далее будут часто упоминаться π-комплексы переходных металлов – поясним, о чем идет речь. Это прямые «потомки» ферроцена – выдающегося соединения ХХ в. Такие комплексы имеют сэндвичевое строение (наподобие бутерброда), где атом металла зажат между двумя плоскими органическими циклами. Чаще всего это циклопентадиенильные циклы С5Н5, их обычно изображают в виде плоского пятиугольника с кружком посередине – признак ароматичности. Химия таких соединений на сегодня хорошо разработана и открывает исключительные возможности для конструирования разнообразных комплексов.
В 1964 г. российские ученые М.Е. Вольпин (рис. 3.18) и В.Б. Шур (рис. 3.19) из Института элементоорганических соединений Российской академии наук опубликовали статью, в которой сообщили, что они нашли возможность восстанавливать молекулярный азот до аммиака в мягких условиях. Основной «козырь» этой работы – специально разработанные катализаторы, процесс получил название «реакция Вольпина – Шура».

Авторы установили, что катализировать такую реакцию может довольно широкий круг веществ – соединения Ti, V, Cr, Mo, W. Однако «расшевелить» тройную связь между атомами азота недостаточно, необходимо предложить этой ослабленной связи то направление, в котором должна идти реакция. Кажется вполне естественным, что это должно быть восстановление, приводящее к образованию связи N – H (наиболее простой вариант – образование аммиака). Таким образом, в реагирующую систему вводится также и восстановитель: например, широко применяемый в лабораторной практике в качестве восстановителя литийалюминийгидрид LiAlH4. Кроме того, можно использовать и другие восстановители: например, натрийборгидрид NaBH4 либо смесь Mg + Mg2.
Авторы пропускали азот через раствор, содержащий каталитическую систему – комплексное соединение титана (C5H5)2TiCl2 с восстановителем (магнийорганическим соединением C2H5MgBr), в результате из азота получался аммиак NH3.
Полученный результат был абсолютно новым и исключительно важным, поэтому авторы приложили специальные усилия, чтобы доказать его истинность. Необходимо было снять подозрение, что источником образующегося аммиака могли оказаться различные азотсодержащие примеси в используемых реактивах. Были проведены специальные опыты, в которых использовали исходный молекулярный азот N2, содержащий изотоп 15N. Такая изотопная метка, которую специальными методами можно обнаружить в соединениях, позволяет «проследить» за перемещением атомов азота из одного соединения в другое. Эксперименты показали, что в полученном аммиаке практически то же количество изотопа 15N, что и у введенного в реакцию молекулярного азота.
Позже удалось более детально описать этот процесс. В реакционной смеси образуется промежуточное соединение – комплекс титана, в котором атом металла окружен двумя циклическими молекулами (С5Н5) и алифатической группой – СН(СН3)2. Молекула азота встраивается между двумя такими молекулами, полученный «агрегат» даже удалось зафиксировать при низкой температуре. Далее, в зависимости от условий, полученное соединение в результате гидролиза образует гидразин H2N – NH2 либо аммиак NH3.
Напомним, что катализатор должен работать в небольших количествах, обеспечивая превращение большого количества реагентов. Все рассмотренные выше системы позволяли получать аммиак при соотношении одна молекула NH3 на один атом T1. Практически это не катализ, а обычная реакция, поскольку соединение титана участвует как рядовой реагент. Авторам работы удалось найти каталитическую систему ТiСl4 – АlВг3 – Аl, которая при давлении 10 МПа и 130 °С дает почти 300 молей аммиака на 1 моль ТiСI4. Такое соотношение можно уже рассматривать как истинный катализ.
Изучая возможности найденных каталитических систем, авторы установили, что если в состав восстанавливающего компонента ввести фенильную группу, то в результате можно получить из молекулярного азота анилин. Такой результат производит впечатление: фактически это получение промышленно важной органической молекулы непосредственно из азота N2. Каталитическая система представляет собой композицию из комплекса титана (C5H5)2ТiСl2 и фениллития РhLi. На первой стадии возникает фенилпроизводное титана (фенильная группа переходит к титану от лития), затем молекула азота внедряется по связи Ti – Ph. Образовавшееся соединение при действии восстановителя и кислоты (Н+) образует анилин и аммиак.
Открытие фиксации молекулярного азота в мягких условиях стало заметным этапом в науке о катализе и привело к появлению целого потока исследований. Например, были найдены каталитические системы, которые работают даже в водной среде, таким образом, исследователи решили проблему не менее эффективно, чем это делают азотфиксирующие бактерии. Впрочем, химия постоянно демонстрирует свое могущество, предлагая замечательные новые композиции и материалы, не существующие в природе.
Интересно, что открытие фиксации азота вышло за рамки химической науки и, по-видимому, произвело впечатление на многих, в том числе и на деятелей искусства. В 1981 г. на экраны вышел фильм Леонида Марягина «Незваный друг». В фильме есть эпизод: молодой ученый (исполнитель – Олег Даль) кладет на стол научному руководителю (его играет Олег Табаков) свою диссертацию, тема диссертации – фиксация азота (рис. 3.20).

С некоторой долей уверенности можно полагать, что прообразами этих героев послужили первооткрыватели процесса М.Е. Вольпин и В.Б. Шур.

