Расплющить углеродную пирамидку
Чрезмерная теснота
не только сближает,
но и плющит.
ЮРИЙ ТАТАРКИН
Если атом углерода имеет четыре заместителя, то его химические связи направлены к вершинам мысленного тетраэдра (четырехгранная пирамида), причем сам он находится в центре этой пирамиды. Все углы Н – С – Н одинаковы – 109°28’. На рисунке 2.15 изображены молекулы метана CH4 и этана С2Н6, ребра тетраэдров показаны пунктирными линиями. Это именно то, что называют тетраэдрическим углеродом.
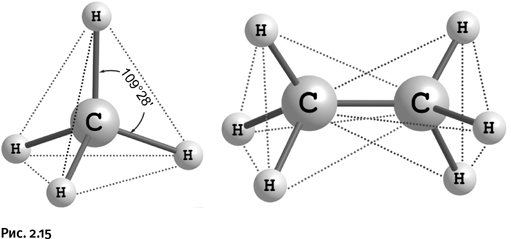
Заместители у атома углерода могут быть различными, не только Н, но и, например, галогены или другие группы, тетраэдрическая конструкция при этом сохраняется. С того момента, когда первый лауреат Нобелевской премии по химии за 1901 г. Я. Вант-Гофф (рис. 2.16) предложил конструкцию тетраэдра, где четырехзамещенный углерод находится в центре мысленной пирамиды, этот факт оставался непреложной истиной. Исследования второй половины ХХ в. показали, что небольшие отклонения от тетраэдра можно наблюдать в тех случаях, когда атом углерода входит в состав напряженных трех- или четырехчленных циклов. Постепенно химиков стала привлекать идея – расплющить такой тетраэдр и получить соединение, у которого все четыре связи атома С лежат в одной плоскости. Современная химия достигла такого уровня, когда исследователи не только изучают закономерности природы, но и пытаются их преодолеть, иными словами, стараются научиться «управлять» веществом.

Вставим атом в оконный переплет
Если в некоторых циклах происходит небольшая деформация тетраэдра, то надо поместить атом углерода внутрь такого цикла, в котором у него не останется иного выбора, как стать «плоским». Так созрела идея получить конструкцию, напоминающую оконный переплет, где в центре находится плоская крестовина. Эти предполагаемые соединения назвали фенестранами (от лат. fenestre – окно).
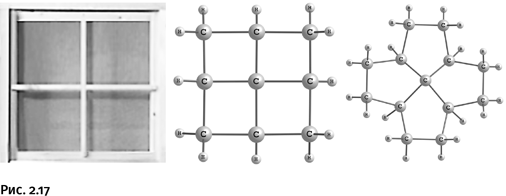
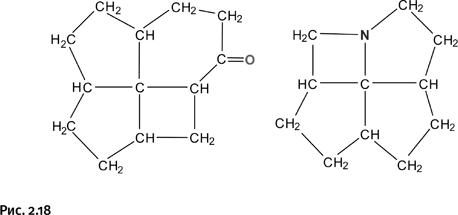
Соединения, показанные на рисунке 2.17, получить не удалось, однако близкие к ним по строению молекулы, содержащие узел «оконного переплета», были синтезированы (рис. 2.18).
Это результаты сложного многостадийного синтеза; полученные молекулы оказались напряженными и потому весьма нестабильными, к тому же валентности центрального атома углерода не располагались в одной плоскости. Таким образом, чисто геометрический подход, основанный на формировании определенной жесткой конструкции, к успеху не привел. Решение следовало искать иным путем.
Плоский углерод существует, но…
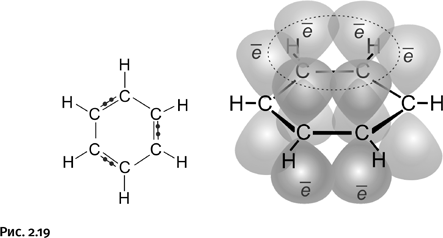
Примеров, когда валентности углерода лежат в одной плоскости, много, но это не четырехзамещенный атом, а трехзамещенный. Атом углерода имеет «плоское» окружение в молекулах этилена и бензола, именно на последнем упомянутом соединении и сосредоточим внимание. В бензоле все атомы, в том числе и атомы водорода, расположены в одной плоскости, это результат сочетания двух условий: необходимо, во-первых, взаимоперекрывание соседних орбиталей в циклической молекуле и, во-вторых, участие «нужного» количества электронов (в случае бензола их шесть). Напомним, что орбиталь – это область наиболее вероятного расположения электрона в пространстве. Одинарные связи бензола рассматривать не будем, сосредоточим внимание на двойных, которые образуются с участием р-электронов, их орбитали имеют форму объемных восьмерок. Электрон на такой орбитали «осваивает» весь объем, располагаясь как в «верхней», так и в «нижней» части восьмерки. Эти орбитали перекрываются, простые и двойные связи усредняются и становятся одинаковыми, молекула приобретает дополнительную устойчивость – такие соединения называют ароматическими (рис. 2.19).
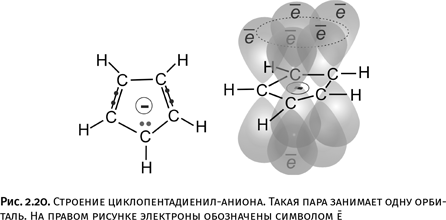
Существуют ароматические циклы и с меньшим количеством атомов: например, циклопентадиенил-анион (анион, полученный из циклопентадиена С5Н6). У него пять атомов в цикле, но главное, что молекула циклическая и участвуют в перекрывании тоже шесть электронов. Одна из точек в центре структуры на рис. 2.20 – это электрон, который оставил атому С ушедший протон Н+. Поэтому вся молекула приобрела отрицательный заряд, т. е. стала анионом, но поскольку соблюдены два упомянутых условия, то соединение тоже ароматическое. У ароматических соединений и сами циклы, и отходящие от них связи всегда лежат в одной плоскости.
Количество электронов, необходимое для образования циклической ароматической системы, определяется правилом Хюккеля: необходимо участие 4n + 2 электронов, где n – число натурального ряда (0, 1, 2, 3 и т. д.). Но если n = 0, то получается, что для образования ароматического цикла достаточно всего двух электронов. Такая молекула существует, это циклопропенил-катион. Если от хлорзамещенного циклопропена отщепить анион Cl– (например, действием SbCl5), то образуется нужный циклический катион, содержащий всего два р-электрона (те, которые образуют двойную связь).
В циклопропенил-катионе имеются две р-орбитали, каждая содержит по одному электрону, и еще освободившаяся пустая орбиталь у «нижнего» углерода, от которого Cl– унес электрон. Три орбитали циклической молекулы перекрываются, и главное, что на них два электрона, т. е. именно столько, сколько требует правило Хюккеля. Трехчленный цикл становится ароматическим, все связи усредняются, молекула стабилизируется, а заряд (+) располагается не на конкретном атоме, а равномерно распределяется по всей молекуле (рис. 2.21).
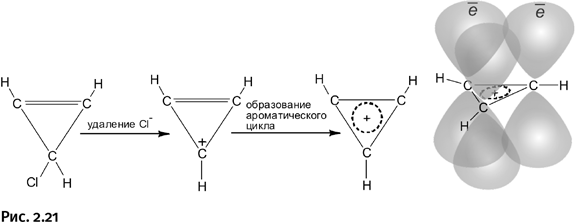
Вновь получился плоский углерод, но не четырехзамещенный, а трехзамещенный: это означает, что у каждого атома С три соседа – два атома углерода и один атом водорода.
Этот катион и навел химиков на мысль, что можно получить ароматический трехчленный цикл, заменив два из трех атомов углерода другими элементами, которые вполне могут быть и не связаны между собой простой химической связью (ароматичность их потом объединит в цикл). В таком случае надо брать элементы, которые образуют только одну химическую связь, т. е. щелочные металлы. Перечисленным условиям удовлетворяет дилитийметан H2CL3.
Именно такое соединение выбрал в 70-е гг. ХХ в. Пол фон Шлейер (Университет Джорджии, США) для теоретических расчетов. В результате он выяснил, что предполагаемый линейный вариант строения молекулы Li-CH2-Li менее энергетически выгоден, нежели угловой, т. е. треугольная форма предпочтительнее (рис. 2.22).
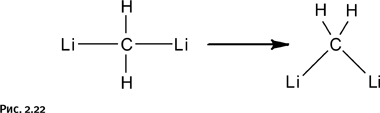
Если это треугольник, то, следовательно, возможно образование ароматического цикла, только, в отличие от рассмотренного циклопропенил-катиона, это не ион, а нейтральная молекула. Впрочем, это не так существенно, важно лишь, чтобы три перекрывающиеся р-орбитали содержали нужное количество электронов, т. е. два. Дилитийметан этим условиям полностью удовлетворяет: каждый из двух атомов лития, образуя связь, отдает по одному электрону атому углерода, в результате р-орбитали атомов лития становятся пустыми, а р-орбиталь атома углерода с двумя полученными электронами перекрывается с этими пустыми (вакантными) орбиталями двух атомов лития и возникает циклическая ароматическая система. Ранее было сказано, что все атомы ароматических циклов и отходящие от них связи всегда лежат в одной плоскости, следовательно, атомы Н и атомы Li, связанные с углеродом (т. е. все четыре валентных штриха), тоже должны лежать в одной плоскости (рис. 2.23).
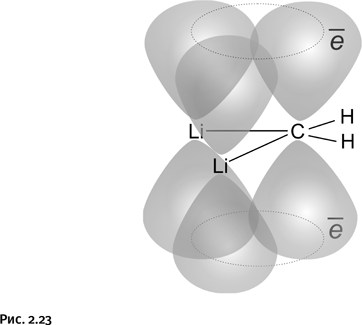
Таким образом, в дилитийметане находится долгожданный плоский углерод.
Напомним, что это итоги теоретических расчетов, которые желательно было подтвердить экспериментально. Химики, естественно, сразу обратили внимание на это соединение, после чего дилитийметан был получен по простой схеме (рис. 2.24).
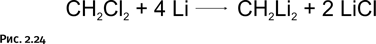
Однако синтезированное соединение образовывало агрегаты из многих молекул [CH2Li2]n, и получить какие-либо экспериментальные подтверждения его структуры не удалось. Тем не менее современные химики уже не сомневаются, что все связи атома С в этом соединении лежат в одной плоскости.
Важная примета современной химии – теоретические расчеты – указали химикам-синтетикам направление поисков.


