Книга: От атомов к древу. Введение в современную науку о жизни
Назад: 11. энергия
Дальше: 12. вирусы
Источники углерода
Мы хорошо знаем, что жизнь на Земле построена на основе соединений углерода. Любому живому организму необходимы как минимум аминокислоты, сахара, азотистые основания и липиды, иначе он просто не сможет существовать. Откуда все эти молекулы берутся? Очевидно, что их можно получить с пищей, а можно синтезировать самостоятельно. По типу питания живые организмы делятся на две большие группы, границу между которыми принято проводить (как мы сейчас понимаем) достаточно произвольно. Организмы, которые нуждаются только в углекислом газе (CO2) и могут самостоятельно синтезировать все остальные углеродные соединения из него, называются автотрофами. А организмы, которым надо дополнительно получать из внешней среды еще какие-нибудь углеродные соединения, называются гетеротрофами. (Тут есть одно исключение, до которого мы скоро дойдем, но пока примем эти понятия как данность.)
Если с автотрофностью все более-менее ясно, то степень гетеротрофности бывает очень разной. С одной стороны, некоторым бактериям-паразитам жизненно необходимо получать из внешней среды полный набор аминокислот, нуклеотиды и даже целые белки. А с другой стороны, есть и такие бактерии, которым хватает ровно одного органического источника углерода. Этим источником может быть, например, глюкоза, или мочевая кислота (соединение, родственное аденину), или какой-нибудь спирт, а все другие углеродные соединения такие организмы умеют синтезировать сами. Но в любом случае они гетеротрофы, раз уж нуждаются во внешнем источнике органики.
То, что граница между автотрофами и гетеротрофами по своей сути несколько искусственна, становится очень наглядным, если взглянуть на используемые микробами одноуглеродные соединения. Дело в том, что есть достаточно большой набор молекул, содержащих только один углеродный атом, любая из которых реально служит единственным источником углерода для какой-нибудь группы бактерий или архей. Примеры таких молекул — углекислый газ (CO2), угарный газ (CO), муравьиная кислота (HCOOH), формальдегид (НСНО), метиловый спирт (CH3OH), метиламин (CH3NH2) и метан (CH4). Помимо бактерий, использующих углекислый газ, к автотрофам можно отнести еще и тех, кто использует угарный газ CO (редкий пример соединения, где валентность углерода равна не 4, а 2). Это и есть то исключение, о котором говорилось выше. А все остальные номинально относятся к гетеротрофам, поскольку муравьиная кислота, формальдегид, метиловый спирт, метиламин и метан принято считать органическими веществами. Хотя реальная биохимическая разница между автотрофами и гетеротрофами, живущими на одноуглеродных субстратах, может быть совсем невелика.
Деление живых существ на автотрофов и гетеротрофов сложилось в XIX веке, когда в поле зрения биологов были в основном растения и животные. Растения — типичные автотрофы, животные — типичные гетеротрофы, ну а промежуточные случаи тогда были просто неизвестны. Что ж, такое деление по крайней мере наглядно. В любой современной экосистеме автотрофы создают органическое вещество, а гетеротрофы разлагают его, превращая обратно в углекислый газ и выдыхая (если, конечно, у них есть дыхание). Это картина, привычная жителю современной Земли. С более объективной точки зрения — например, с точки зрения исследователя из другой галактики, которому любая разновидность углеродной биохимии одинаково чужда, — было бы, возможно, правильнее классифицировать типы обмена не по отношению к углекислому газу, а по наличию или отсутствию в источнике углерода химических связей между углеродными атомами (C–C). Очевидно, что ни в каких одноуглеродных молекулах этих связей нет, и столь же очевидно, что для создания биологически активных соединений они абсолютно необходимы.
Впрочем, есть особое понятие, объединяющее всех микробов, которые питаются восстановленными одноуглеродными субстратами (то есть любыми одноуглеродными молекулами, кроме углекислого и угарного газов). Такие микробы называются метилотрофами. Потребители муравьиной кислоты, формальдегида, метилового спирта, метана — все это типичные примеры метилотрофов. Существует старая, но подтверждаемая данными современной биохимии гипотеза, что древние живые организмы освоили потребление муравьиной кислоты и формальдегида раньше, чем связывание углекислоты. Причем способность связывать CO2, вероятно, появилась несколько раз независимо в разных эволюционных ветвях. Если все это верно — значит, автотрофность исторически развилась на основе метилотрофности. Иное дело, что сейчас все многочисленные разновидности метилотрофности отошли на второй план, вытесненные гораздо более выгодным, как показали события последних трех миллиардов лет, усвоением углекислого газа.
Формы жизни
В 1907 году известный революционер и ученый Николай Александрович Морозов опубликовал удивительно интересный рассказ под названием “Эры жизни”. Жанр рассказа обозначен автором как “научная полуфантазия”, а его действие происходит в XIX столетии, в царствование Александра II. Герой рассказа — безымянный ученый, арестованный властями за участие в политической деятельности, — сидит в одиночной камере Петропавловской крепости и размышляет об отдаленном будущем земного шара. По его представлениям (общепринятым для того времени), через много тысячелетий Земля остынет, вся вода на ней замерзнет и жизнь исчезнет. Но ученый задается вопросом — что будет дальше? — и приходит к выводу, что на ледяной Земле может возникнуть новый океан, состоящий из жидкой углекислоты (CO2). Обращаясь затем к далекому прошлому, он предполагает, что на древней раскаленной Земле, где вода была только в виде пара, мог существовать океан из расплавленного кварца (SiO2), то есть в буквальном смысле из стекла. В итоге перед мысленным взором героя проходит целая последовательность грандиозных эпох, за время которой континенты и океаны возникали на Земле много раз, при разных температурах и на разной химической основе. Стеклянный океан, водный океан, углекислотный океан — звенья этой последовательности. И почему бы в любую из этих эр не существовать жизни, в том числе и разумной, конечно, основанной не на белках, а на их химических аналогах, приспособленных к совершенно другим условиям?
Взволнованный этими мыслями, герой рассказа прикладывает ладонь к холодной каменной стене своей комнаты, расположенной в печально знаменитом Алексеевском равелине.
“И эти твердые камни, — тихо прошептал он, — когда-то бушевали могучими волнами и грозно били в давно минувшие берега. И неужели из всей этой бесконечной цепи океанов лишь один наш водный океан населен живыми существами? Неужели только азотисто-углеводородные соединения, всецело приспособленные лишь к современной эре земной жизни, одни способны к построению живого, чувствующего и разумного существа, когда та же единая и вечная материя, прибавив или убавив в каждой их частице несколько атомов, может образовать другие вещества, совершенно аналогичные им и способные к той же функции создания жизни и физиологического обмена, но при других температурах и стихиях?”
Николай Александрович Морозов был исключительно самостоятельно мыслящим человеком. Он прожил долгую насыщенную жизнь, в которой 25-летнее заключение в Шлиссельбургской крепости за терроризм оказалось лишь эпизодом, и всегда непрерывно пополнял свои знания, генерируя “на выходе” весьма оригинальные идеи. Его самый известный научный труд — это многотомная ревизия всемирной истории с поистине невероятными выводами, которые многим сейчас знакомы по работам последователя Морозова, академика Анатолия Тимофеевича Фоменко. Нечего и говорить, что, с точки зрения специалистов-историков (которые, конечно, абсолютно правы), эти построения несерьезны. Однако именно Морозов одним из первых высказал и обосновал совершенно верную мысль, что атомы не являются неделимыми единицами материи, а имеют способную к перестройкам внутреннюю структуру. Что касается рассказа “Эры жизни”, то мнения о нем разделились даже среди личных знакомых автора. Революционерка Вера Николаевна Фигнер отозвалась об этом рассказе как о “настоящей галлюцинации сумасшедшего” и усомнилась, в своем ли уме был Морозов, когда его писал. Сейчас, через 100 лет, поддержать такой резкий отзыв никак невозможно. Наоборот, многие рассуждения Морозова выглядят в начале XXI века удивительно современными. Например, возможность жизни в углекислотном океане рассматривается нынешними учеными вполне всерьез, она не противоречит никаким известным фактам или законам (см. главу 2). Правда, описанная Морозовым грандиозная последовательность “эр жизни” все-таки малореальна — но не по фундаментальным причинам, а потому, что для нее, как мы сейчас понимаем, скорее всего, просто-напросто не хватит времени существования Земли как планеты.
В любом случае Морозов и его литературный герой с редкой проницательностью оценили размах, до которого многообразие проявлений жизни может доходить. Реальные формы жизни, существующие на Земле прямо сейчас, почти так же разнообразны, как морозовские “эры жизни”; если это и преувеличение, то не слишком большое. Разные формы жизни совершенно по-разному взаимодействуют и с энергией, и с веществом. Чтобы наглядно убедиться в этом, достаточно сравнить, например, человека и дерево. Но даже различия между животными и растениями — это всего лишь краешек огромного многообразия обменных процессов, большая часть которого относится к невидимому простым глазом миру микробов.
Совокупность химических реакций, идущих в организме для поддержания жизни, называется метаболизмом. Термины “метаболизм” и “обмен веществ” часто используют как синонимы. Нечего и говорить, что любой метаболизм очень сложен. Для удобства его делят на две группы процессов, которые в некотором приближении можно рассматривать отдельно друг от друга:
* энергетический метаболизм, результатом которого является получение энергии, пригодной для превращения в работу;* конструктивный метаболизм, результатом которого является синтез сложных молекул — белков, нуклеиновых кислот, углеводов и липидов.
Конечно, энергетический и конструктивный метаболизм связаны между собой и иногда очень тесно (бывает, например, что исходным субстратом для них служит одно и то же вещество). Но деление все равно полезное. Обо всех главных разновидностях этих уровней метаболизма мы на самом деле уже говорили. По типу энергетического метаболизма все живые организмы делятся на фототрофов и хемотрофов, а по типу конструктивного метаболизма — на автотрофов и гетеротрофов. Фототрофы синтезируют АТФ за счет энергии света, хемотрофы — за счет энергии окислительно-восстановительных химических реакций. Автотрофы получают углерод из углекислого газа (или иногда из угарного), гетеротрофы — из более сложных углеродных соединений, которые люди называют органическими. Захват углекислого газа или любой другой простой молекулы для включения в более сложные соединения принято называть фиксацией, так что автотрофы — это те, кто живет за счет фиксации CO2 или CO. Скомбинировав оба деления друг с другом, мы тут же получаем четыре возможных типа жизненных форм:
1 Фотоавтотрофы, которые (1) синтезируют АТФ за счет энергии света и (2) не нуждаются ни в каких источниках углерода, кроме углекислого газа. Энергия света посредством некоторого достаточно сложного механизма переводится в энергию АТФ и попутно используется для фиксации углекислоты. Весь этот процесс принято называть фотосинтезом. На Земле сейчас особенно распространен кислородный фотосинтез, в ходе которого расходуется вода (H2O). Отобранный у нее водород восстанавливает углекислоту, а оставшийся кислород выводится в атмосферу как побочный продукт. Этим типом фотосинтеза обладают цианобактерии и растения. Бывает и бескислородный фотосинтез, в котором расходуется не вода, а другие восстановители — например, сероводород (H2S), молекулярный водород (H2) или некоторые соединения железа. Выделением кислорода он не сопровождается. Если кислородным фотосинтезом пользуются цианобактерии и растения, то бескислородным — пурпурные, зеленые и некоторые другие бактерии. У эукариот бескислородного фотосинтеза нет.
2 Хемоавтотрофы, которые (1) синтезируют АТФ за счет энергии неорганических химических реакций и (2) не нуждаются ни в каких источниках углерода, кроме углекислого или угарного газа. В самом простом случае такие организмы могут использовать одно и то же вещество и для получения энергии, и для синтеза органики. Например, это осуществили уже упоминавшиеся метаногены, которые получают энергию, восстанавливая углекислый газ до метана, и из продуктов фиксации того же углекислого газа синтезируют абсолютно все нужные им органические вещества. Метаногенам не нужны никакие источники углерода и энергии, кроме углекислого газа и водорода. В свете они не нуждаются, а перерабатывать внешнюю органику все равно не умеют, даже живя прямо в ее гуще (например, в чьих-нибудь кишках).
К этой же категории относятся довольно разнообразные бактерии, окисляющие или восстанавливающие соединения серы, азота, железа (из них мы упоминали серобактерий, получающих энергию путем окисления сероводорода). За счет полученной в ходе неорганических реакций энергии эти бактерии фиксируют углекислый газ, который нужен им только для конструктивного метаболизма, то есть для синтеза собственной органики. То же самое делают водородные бактерии, способные жить за счет окисления молекулярного водорода. И наконец, к этой же категории приходится отнести карбокситрофов, которые питаются угарным газом. Они получают энергию, окисляя угарный газ до углекислого, а образующийся углекислый газ фиксируют и используют в конструктивном метаболизме. Окислительно-восстановительная реакция, на которой основана жизнь карбокситрофных бактерий, выглядит так:
СO + H2O → CO2 + H2.
Этим бактериям не нужны никакие источники углерода и энергии, кроме угарного газа и воды. Обратим внимание, что в качестве побочного продукта они выделяют водород, который вполне могут потом использовать другие организмы — например, те же метаногены и водородные бактерии. Так образуются микробные сообщества.
3 Хемогетеротрофы, которые (1) синтезируют АТФ за счет энергии окисления органических молекул и (2) нуждаются во внешних источниках этих молекул, потому что синтезировать всю нужную им органику из углекислого газа не могут. Под “окислением органических молекул” мы сейчас подразумеваем окисление входящего в них углерода, то есть, говоря более предметно, уменьшение электронной плотности на этом углероде. Этот процесс дает энергию очень многим живым организмам, в том числе и людям.
Хемогетеротрофы — группа огромная и сборная. В нее входит большинство прокариот и все эукариоты, кроме фотосинтезирующих. Прежде всего, к хемогетеротрофам по определению должны быть отнесены метилотрофы, окисляющие одноуглеродные субстраты — муравьиную кислоту, формальдегид, метиловый спирт, метан, метиламин и т.п. Надо еще раз подчеркнуть, что бактерии, питающиеся угарным газом, по сути своей делают то же самое, что и метилотрофы: окисляют частично восстановленный одноуглеродный субстрат до углекислоты. То, что им приписывается иной тип питания, есть чистейший формализм, вызванный людскими привычками.
Кроме того, многие хемогетеротрофы (включая нас) питаются гораздо более сложными веществами, содержащими целые цепочки атомов углерода. Это могут быть сахара, спирты, карбоновые кислоты, аминокислоты или азотистые основания. При окислении такие вещества распадаются на более простые молекулы с разрывом углерод-углеродных связей (C–C).
Есть два способа переработки сложных органических веществ: брожение и дыхание. Брожение не требует участия молекулярного кислорода (для многих бродильщиков он даже ядовит) и может от начала до конца идти в обычном растворе, где нет никаких мембран и связанных с ними переносчиков протонов. В отличие от брожения, дыхание требует непосредственного участия кислорода (или хотя бы богатых им окислителей вроде нитратов или сульфатов) и обязательно включает этап переноса протонов через мембрану, сопровождаемого синтезом АТФ. В ходе дыхания протоны, отобранные у молекул субстрата, сначала скапливаются по одну сторону непроницаемой для них мембраны, а потом образовавшийся протонный потенциал разряжается с помощью протонной АТФ-синтазы: ∆μH → АТФ.
Конечные продукты брожения разнообразны, но это всегда вещества, в которых углерод окислен не до конца: молочная кислота (C3H6O3), этиловый спирт (C2H5OH), пропионовая кислота (CH3CH2COOH), ацетон (CH3–СO–CH3) или некоторые другие. А конечным продуктом дыхания является углекислый газ (CO2), в котором углерод окислен до крайнего предела, дозволенного законами химии. Организмы, владеющие дыханием, всегда владеют и брожением, но не наоборот.
Можно для наглядности сравнить суммарные уравнения реакций распада глюкозы путем широко распространенного молочнокислого брожения (при котором глюкоза распадается на две молекулы молочной кислоты) и путем классического кислородного дыхания:
C6H12O6 → 2C3H6O3
C6H12O6 + 6O2 → 6CO2 + 6H2O
Для первой реакции ∆G = –197 кДж/моль, а для второй ∆G = –2870 кДж/моль. Это означает, что дыхание примерно в 15 раз энергетически выгоднее.
4 Фотогетеротрофы, которые (1) получают энергию в виде света, но (2) при этом все-таки нуждаются во внешнем источнике органического углерода. Этот удивительный для нас тип метаболизма возникает в случае, если фотосинтез используется для синтеза АТФ, а вот механизма фиксации углекислоты при этом нет. Такой неполноценный фотосинтез обязательно сочетается с брожением. Типичные обладатели фотогетеротрофности — гелиобактерии, живущие в почве, в болотах или на заливаемых водой рисовых полях.
Помимо прочего, гелиобактерии известны своим умением фиксировать азот, то есть брать прямо из атмосферы молекулы чистого азота (N2) и включать этот азот в состав органических соединений. Эта способность не уникальна для гелиобактерий, но у них она очень хорошо развита, и именно от нее в большой степени зависит плодородие рисовых полей. Как известно, азот составляет 78% современной атмосферы Земли, и примерно так же было более-менее во все известные времена. Наша атмосфера — в первую очередь азотная. Казалось бы, это прекрасно: ведь азот необходим для синтеза любой аминокислоты и любого нуклеотида, а вот и его источник “под боком”. Но, к сожалению, азот в форме молекулы N2 почти недоступен для использования живыми существами. Дело в том, что в этой молекуле атомы соединены тройной связью (N≡N), которую очень трудно разорвать. Поэтому фиксация азота — чрезвычайно энергоемкий процесс. Для усвоения одной молекулы азота надо потратить энергию 12 молекул АТФ. Так что гелиобактериям есть на что расходовать АТФ, заработанный путем фотосинтеза. Добавим, что никакие эукариоты самостоятельно фиксировать азот не умеют: в этом плане они полностью зависят от бактерий.
Классификация, с которой мы только что познакомились, — почти всеобъемлющая.
Она охватывает все живые организмы, кроме вирусов, у которых вообще нет собственного метаболизма (во всяком случае, независимого от метаболизма зараженных ими клеток; см. об этом главу 12). Иначе говоря, эта классификация относится к любым клеточным организмам. Все они делятся на фотоавтотрофов, фотогетеротрофов, хемоавтотрофов и хемогетеротрофов.
Однако нетрудно заметить, что эти четыре типа обмена веществ распределены по древу жизни очень неравномерно. Например, все типы обмена, которыми владеют эукариоты, — это кислородный фотосинтез, брожение (причем далеко не все его разновидности) и дыхание. Больше эукариоты не умеют ничего — по крайней мере, без помощи бактериальных симбионтов, которые иногда встречаются в их телах. А вот у бактерий и архей способов метаболизма, принципиально отличающихся друг от друга, можно насчитать десятки. Например, никакие эукариоты не могут питаться метаном или угарным газом, или чистым водородом, или муравьиной кислотой, или железом. Зато бактерии или археи — иначе говоря, прокариоты — все это умеют. На уровне простой прокариотной клетки жизнь невероятно пластична. И это, кстати говоря, дает нам немалые шансы найти хотя бы прокариотную жизнь (или ее аналоги) на других планетах, пусть даже условия там и сильно отличаются от земных.
Три закона биоэнергетики
В конце XX века биохимик Владимир Петрович Скулачев сформулировал — во многом на основе своих собственных открытий — серию обобщений, которые он назвал законами биоэнергетики. Нелишне будет сказать, что на момент написания этих строк (февраль 2017 года) Владимир Петрович жив и активно работает — в частности, он остается деканом им же основанного факультета биоинженерии и биоинформатики МГУ; это к вопросу о том, что далеко не все классики уже умерли и существуют только в виде пыльных портретов на стенах. Само название “биоэнергетика”, означающее изучение преобразований энергии в живых организмах, стало общепринятым именно благодаря Скулачеву, который посвятил этой науке полвека своей жизни. Протонные и натриевые потенциалы, связь синтеза АТФ с окислительно-восстановительными реакциями, механизмы фотосинтеза и дыхания — все это типичные предметы биоэнергетики. Как и азимовских законов роботехники, законов биоэнергетики по Скулачеву насчитывается ровно три. Давайте же их сформулируем, благо все нужные для этого понятия нам теперь уже знакомы.
Первый закон биоэнергетики: живая клетка избегает прямого использования энергии внешних ресурсов (света или химических реакций) для совершения полезной работы. Она сначала превращает их в одну из трех конвертируемых форм энергии (“энергетических валют”), а именно в АТФ, ∆μH или ∆μNa, и уже эти “валюты” расходуются на разные энергоемкие процессы.
Примером такого энергоемкого процесса может послужить самая обыкновенная механическая работа. Чаще всего на нее тратится АТФ: например, именно за счет расщепления АТФ сокращаются мышцы. Между прочим, когда в 1939 году Энгельгардт и Любимова открыли АТФазную активность миозина (см. главу 10), то многие коллеги вначале не хотели им верить: ну не может же вся мышечная клетка быть набита расщепляющим АТФ ферментом! Оказалось, вполне может. Жгутик какой-нибудь эвглены (или любого другого жгутиконосца) тоже работает за счет распада АТФ.
Правда, это относится только к эукариотному жгутику, который представляет собой покрытый плазматической мембраной вырост клетки с проходящим внутри пучком микротрубочек. Бактериальный жгутик устроен совершенно иначе (см. рис. 11.5). Это тонкая жесткая трубка из белка флагеллина, изогнутое основание которой (в его состав входит еще несколько разных белков) вмонтировано в клеточную стенку бактерии таким образом, что может относительно нее свободно вращаться. Если бактерию поймать за жгутик (например, если она им за что-нибудь зацепится), она станет вращаться относительно жгутика сама. В нормальной же ситуации жгутик обеспечивает бактериям очень быстрое движение, хотя ни с какими белками, расщепляющими АТФ, он не связан. Проще говоря, на вращение бактериального жгутика АТФ не тратится. Его вращение происходит не за счет энергии АТФ, а за счет протонного потенциала ∆μH, который преобразуется в работу без всякого химического посредника. Механизм этого оказался относительно простым. Основание бактериального жгутика связано с клеточной мембраной, на которой поддерживается разность концентраций протонов — снаружи их гораздо больше. Когда открываются протонные каналы, протоны текут внутрь клетки и попутно действуют на специальные моторные белки таким образом, что заставляют вставленный в мембрану диск крутиться. А вместе с ним крутится и жгутик. Установлено, что на один оборот жгутика расходуется энергия примерно 1000 протонов.
Стоит добавить, что если бактерия грамотрицательная, то все рассказанное относится к ее внутренней мембране, а не к наружной (см. главу 5). Через наружную мембрану жгутик проходит насквозь (там тоже для этого есть специальные белки), но в генерации движения она не участвует.
Самое интересное, что существуют и такие бактерии, у которых жгутик работает не на протонах, а на ионах натрия. Энергия натриевого потенциала может точно так же переходить в механическую работу и вращать жгутик, механизм там очень схожий. Более того, есть морские бактерии, которые имеют сразу два типа жгутиков — с протонными “моторами” и с натриевыми, и пользуются теми или другими в зависимости от солености окружающей среды, благо жгутики можно по мере надобности собирать и разбирать. В морской воде, где снаружи много натрия, выгоднее пользоваться натриевым движителем, а вне моря можно перейти на протонный. Эта история очень наглядно показывает, что протонный и натриевый потенциалы взаимозаменяемы.
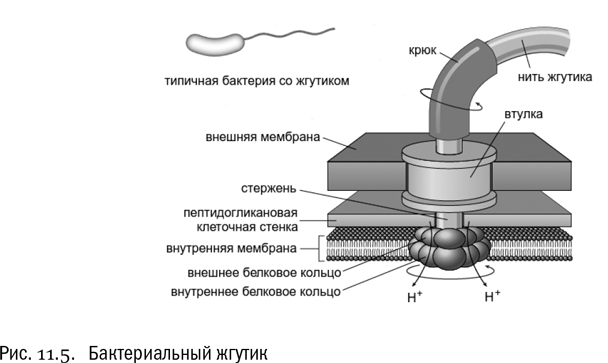
Жгутик архей по своей конструкции похож на бактериальный, хотя и показано, что он сформировался независимо на основе других белков. У общего предка бактерий и архей никакого жгутика не было. Но при этом архейный жгутик тоже вращается и тоже работает на протонном потенциале. Это означает, что механизм вращения жгутика за счет потока протонов возник в ходе эволюции по меньшей мере дважды — у бактерий и у архей.
Второй закон биоэнергетики: любая живая клетка располагает как минимум двумя основными “энергетическими валютами”. Одна из них — всегда АТФ, вторая — или ∆μH, или ∆μNa.
Нередко бывает, что у одной и той же бактерии в клетке есть все три “валюты” — и АТФ, и ∆μH, и ∆μNa (с возможностью между ними переключаться). Впрочем, это зависит от среды: например, у пресноводных бактерий ∆μNa обычно не используется, потому что натрия в среде обитания просто маловато. Все три “валюты” есть и в животной клетке. Там они разделены в пространстве: на внешней (плазматической) мембране энергетика натриевая, а на внутриклеточных мембранах протонная. У животных натриевая энергетика очень активно используется и для транспорта веществ, и для обеспечения работы нервных клеток. У растений значение натриевой энергетики меньше, но нередко она тоже есть (а сочетание протонной энергетики и АТФ есть всегда). Живых организмов, обходящихся только одной энергетической валютой, по-видимому, просто не существует. Этих валют всегда не меньше двух. Исключение — только вирусы, у которых нет собственных энергетических систем.
Третий закон биоэнергетики: все три “энергетические валюты” могут свободно конвертироваться друг в друга. Поэтому одной из них (любой) в принципе достаточно для поддержания жизнедеятельности.
Например, при фотосинтезе за счет энергии захваченных квантов света сначала образуется протонный потенциал (∆μH) на специально предназначенной для этого мембране, а потом уже с помощью протонной АТФ-синтазы энергия этого потенциала трансформируется в энергию связей АТФ. То же самое происходит и при дыхании. Но есть морские бактерии, у которых в процессе дыхания генерируется не протонный потенциал (как у большинства других дышащих бактерий и у всех эукариот), а натриевый. Тут мы снова видим, насколько эти потенциалы взаимозаменяемы.
Благодаря ионным АТФ-синтазам и ∆μH, и ∆μNa могут свободно конвертироваться в энергию АТФ. И наоборот — тоже; если, например, клетке выгодно “инвестировать” энергию АТФ в протонный потенциал, она всегда может это сделать. Дело в том, что роторный механизм любой АТФ-синтазы можно раскрутить в другую сторону, и тогда она будет делать строго обратное тому, что делает “штатно”: расщеплять АТФ, перекачивая ионы против градиента концентрации. Так что с переводом энергии протонного (или натриевого) потенциала в энергию АТФ или обратно нет никаких трудностей. И наконец, ∆μH и ∆μNa могут свободно конвертироваться друг в друга вообще без всяких посредников, с помощью уже упоминавшегося натрий-протонного антипортера.
Загадка дыхания
Теперь мы в общих чертах представляем себе, насколько многообразны биохимические пути (то есть цепочки реакций), служащие живым существам для превращений энергии. И тут будет уместно задаться вопросом: есть ли у этого многообразия какие-нибудь пределы?
В 1960-х годов, на волне впечатлений от открытого тогда единства генетического кода, среди биологов распространилось убеждение, что и все другие важные биологические механизмы столь же едины: “То, что верно для бактерии, верно и для слона”. В этот период Джеймс Уотсон — тот самый, который прославился открытием двойной спирали ДНК, — регулярно говорил на лекциях своим студентам, что, по его мнению, на текущем этапе развития науки биологам вообще не следует изучать никакие многоклеточные организмы: ведь все интересующие нас молекулярные основы жизни есть и у бактерий, экспериментировать с которыми гораздо проще. (Уотсон продолжал твердить это студентам, несмотря на недовольство многих коллег. Всяческих зоологов, ботаников и эмбриологов он в те годы откровенно считал биологами второго сорта.)
Но первые свидетельства того, что на самом деле не все так просто, появились очень быстро. По словам некоторых генетиков, уже в 1970-х годах было бы гораздо правильнее сказать: “То, что верно для бактерии, неверно даже для дрожжей”. А с тех пор данных о разнообразии механизмов жизни накопилось еще больше. Где же истина?
Здесь может помочь вот какая аналогия. Знаменитый лингвист Ноам Хомский сумел убедить большинство своих коллег, что все земные языки объединены одной и той же универсальной грамматикой, основы которой “встроены” в мозг человека. По Хомскому, если бы на Землю попал марсианский ученый, он наверняка решил бы, что все земляне говорят на диалектах одного языка. Так вот, в этом смысле с разнообразием живых организмов дело обстоит примерно так же, как и с разнообразием языков. У живых организмов есть своя “универсальная грамматика”, роль которой исполняет единство набора аминокислот, генетического кода и аппарата трансляции. А уже на ее основе развились бесчисленные варианты и формы — “бесконечное число самых прекрасных форм”, как сказал когда-то Чарльз Дарвин; но сама “универсальная грамматика” при этом осталась незыблема. Правда, живые организмы (в противоположность языкам) явно отличаются друг от друга по сложности, так что для корректности нам лучше ограничить сравнение биохимическими механизмами. В этом случае тут же окажется, что биохимия человека отличается от биохимии какой-нибудь водородной бактерии примерно так же, как, например, китайский язык от алгонкинского, — не больше и не меньше.
В этой книге у нас нет ни возможности, ни цели подробно рассмотреть все многочисленные биохимические пути, снабжающие жизнь энергией. Некоторые из них, правда, мы уже мимоходом упомянули. А сейчас обсудим (очень кратко и бегло) только один выбранный в качестве примера путь, который называется кислородным дыханием. Есть целых три причины, чтобы особо его выделить. Во-первых, так уж сложилось, что мы, люди, относимся к тем формам жизни, для которых кислородное дыхание — вещь исключительно важная. Во-вторых, механизм дыхания сам по себе очень интересен; даже марсианский ученый с этим, скорее всего, согласился бы. И в-третьих, дыхание как бы венчает собой несколько других важных биохимических путей: оно служит продолжением как брожения (вернее, его начального этапа), так и фотосинтеза.
Природа процесса дыхания долго оставалась для ученых полной загадкой. Сейчас-то мы понимаем, что вопрос об этой природе было невозможно не то что решить, но даже адекватно поставить, пока не возникла полноценная научная химия. Базовая идея, что при дыхании организм поглощает и усваивает некоторую составную часть воздуха, отвергая другие его части, была впервые четко сформулирована только в XVI веке — ее автором считается Парацельс, который вообще ратовал за химический подход к жизненным явлениям. Но что это за составные части воздуха, Парацельс выяснить не мог. Это выяснил больше чем через 200 лет после него Антуан Лоран Лавуазье, к тому времени уже знавший, что такое кислород. Лавуазье опытным путем установил, что “чистый воздух, войдя в легкие, выходит из них частично в виде связываемого воздуха или меловой кислоты. Следовательно, чистый воздух, проходя через легкие, претерпевает такое разложение, которое имеет место при горении угля”. Меловой кислотой Лавуазье называл не что иное, как хорошо знакомый нам углекислый газ. Растворяясь в воде, он и правда моментально превращается в кислоту, которая сейчас называется угольной (H2CO3) и соли которой действительно составляют основу мела. Таким образом Лавуазье фактически сказал, что дыхание — это процесс, с химической точки зрения строго тождественный горению. И он был прав. В процессе дыхания глюкоза (C6H12O6) с помощью кислорода (O2) превращается в углекислый газ (CO2) и воду (H2O). Точно такой же результат получится, если эту глюкозу просто сжечь. И в самом деле, люди испокон веку жгут для обогрева древесину, которая (если она сухая) представляет собой массу пустых растительных клеточных стенок. А главный материал, из которого состоят растительные клеточные стенки, — это целлюлоза, полимер глюкозы, о котором мы говорили в главе 6.
Разница между дыханием и горением в том, что при горении энергия выделяется сразу, а при дыхании — постепенно, маленькими порциями, в процессе, состоящем из ряда регулируемых этапов. Именно эта разбивка на порции позволяет захватывать выделяемую энергию и запасать ее в молекулах АТФ. Это было бы невозможно, если бы выделение энергии происходило бурно, как при горении или тем более при взрыве.
Дыхание — это окислительно-восстановительная реакция. Как мы уже знаем, окислительно-восстановительными называются такие реакции, в которых происходит перенос электронов от некоего донора (восстановителя) к некоему акцептору (окислителю). Окислительно-восстановительные реакции, идущие в живых организмах, катализируются ферментами, которые называются оксидоредуктазами. Таких ферментов очень много. Само собой разумеется, что каждая оксидоредуктаза катализирует только одну реакцию — ту, для которой она предназначена.
Дыхание используется гетеротрофными организмами. Значит, исходным субстратом для него всегда будет органическое вещество. Как вообще может выглядеть окисление органических молекул? Например, можно отобрать атомы водорода у двух соседних атомов углерода, вынудив последние образовать между собой двойную связь. Есть и другой широко распространенный вариант: отнятие водорода у спиртовой группы (C–OH), на месте которой в результате образуется альдегидная или кетонная группа (C=O). Вот уравнения соответствующих реакций:
–CH2–CH2– → –CH=CH– + 2H+ + 2e––CHOH– → –CO– + 2H+ + 2e–
Обратим особое внимание на правую часть этих уравнений, где значится отобранный у органических молекул водород. Мы знаем, что атом водорода состоит из одного протона (H+) и одного электрона (e–). Сейчас в наших уравнениях эти частицы записаны по отдельности. И не случайно: их дальнейшая судьба может быть разной.
Итак, куда же деваются частицы, отобранные у окисленной органической молекулы (H+ и e–)? С протонами все просто: их всегда можно сбросить в водный раствор, где они прекрасно себя чувствуют (другими словами, для них энергетически выгодно нахождение там). При надобности их легко можно будет оттуда же и взять. Реакция диссоциации воды (H2O ⇌ H+ + OH–) идет постоянно, поэтому любой водный раствор в любой момент содержит практически неограниченный запас протонов.
А вот электроны в свободном виде в водном растворе существовать не могут. Для них нужен специальный переносчик. Любой фермент, отнимающий у кого-то водород, должен обязательно содержать в себе ловушку для электронов. Причем в реальности такими ловушками служат не аминокислоты, входящие в состав фермента (как можно было бы подумать), а особые молекулы, связанные с ферментом, однако сами имеющие небелковую природу. Их называют коферментами или кофакторами. Любой белок, катализирующий окислительно-восстановительную реакцию, обязательно содержит тот или иной кофактор, который сам может обратимо окисляться и восстанавливаться. По химической структуре кофакторы очень разнообразны — они бывают даже неорганическими; но чаще всего это небелковая органика. Многие кофакторы связаны с белками постоянно и настолько прочно, что не отделяются от них никогда (во всяком случае, пока не развалится сам белок). Но бывают и свободные кофакторы, которые взаимодействуют с ферментами только непосредственно в ходе реакций, а остальное время просто плавают в растворе. Познакомимся для начала с одним связанным кофактором и с одним свободным.
Самый распространенный связанный кофактор называется гемом (см. рис. 11.6А). Это органическая молекула, представляющая собой довольно-таки сложную конструкцию: четыре пятичленных кольца с четырьмя атомами углерода и одним атомом азота в каждом, соединенные перемычками с двойными связями и имеющие вдобавок несколько разнообразных боковых цепочек (с метильными, карбоксильными и прочими группами — их точный набор зависит от разновидности гема). Иногда гем связан со своим белком ковалентно, а иногда другими способами, но все равно очень прочно. А в центре гема обязательно находится атом железа (Fe). Это — сердце гема. Дело в том, что железо, как и любой металл, достаточно легко превращается в положительно заряженный ион, но при этом оно является элементом с переменной валентностью: ионы железа бывают двухвалентными (Fe2+), а бывают и трехвалентными (Fe3+). Присоединяя электрон, ион железа переходит из трехвалентной формы в двухвалентную, а отдав его — наоборот. Кстати, это тоже окислительно-восстановительная реакция, хоть и очень простая:
Fe3+ + e– ⇌ Fe2+
Именно за счет этой реакции гем и служит отличным переносчиком электронов. Когда надо, он присоединяет электрон, когда надо — отдает.
Самый распространенный свободный кофактор — никотинамидадениндинуклеотид, сокращенно НАД (см. рис. 11.6Б). Эта молекула не так сложна, как гем. Вот из каких компонентов она состоит:
* рибоза (две штуки);* фосфат (две штуки);* аденин;* амид никотиновой кислоты, он же просто никотинамид.
Фактически молекула НАД — это два нуклеотида, соединенных друг с другом через свои фосфатные группы фосфоангидридной связью. В одном из этих нуклеотидов азотистым основанием служит обыкновенный аденин. А вот во втором азотистое основание необычное. Представим себе замкнутое кольцо, состоящее из пяти атомов углерода и одного атома азота, с такой же системой двойных связей, как в бензоле (см. главу 1). Эта молекула будет называться пиридином (см. главу 7). Теперь представим себе, что к одному из атомов углерода в пиридине (но не к соседнему с азотом, а через один) присоединена карбоксильная группа. Вот это и будет молекула, которая называется никотиновой кислотой. Она была когда-то впервые получена при окислении известного растительного яда никотина — того самого, что содержится в табаке. А теперь представим себе, что от карбоксильной группы никотиновой кислоты (–COOH) оторвали гидроксил (–OH) и присоединили взамен него аминогруппу (–NH2). Тогда вместо карбоксила получится группа –CONH2. Производное кислоты, образовавшееся в результате такой операции, называется амидом.
В молекуле НАД никотинамид связан с сахаром через атом азота, находящийся в пиридиновом кольце. В результате этот азот становится четырехвалентным — ничего удивительного здесь нет, мы можем сейчас вспомнить, что уже видели подобное в ионе аммония NH4+ (см. главу 1). В этих молекулах четырехвалентный азот образует структуру, очень похожую на четырехвалентный углерод, но с другим зарядом ядра центрального атома. А в результате молекула никотинамида, оказавшаяся в составе НАД, приобретает положительный заряд в области атома азота. Это ее характерная особенность. Поэтому если молекула НАД находится в состоянии покоя (то есть никого не присоединила), то ее сокращенное название обычно пишут с указанием заряда: НАД+.
Именно остаток никотинамида служит в молекуле НАД+ коллектором электронов, способным восстанавливаться и окисляться (см. рис. 11.6В). Когда он восстанавливается, в пиридиновом кольце становится на одну двойную связь меньше и на один атом водорода больше, а положительный заряд исчезает. Уравнение этой реакции выглядит вот как:
НАД+ + 2H ⇌ HAДH + H+
Молекула НАД+ присоединяет один атом водорода целиком (электрон и протон), а от второго — только электрон. Оставшийся от второго атома протон уходит в окружающий раствор. Это, как мы уже знаем, не беда, поскольку протон из раствора можно в любой момент взять обратно.
В названии восстановленной формы никотинамидадениндинуклеотида — НАДH — первая буква — это русская Н, а последняя — латинская “аш”, их не надо путать. И НАД+, и HAДH хорошо растворяются в воде, так что использовать их во всевозможных реакциях очень удобно. В общем, молекула НАД+ отлично подходит для приема электронов, отобранных у окисленного субстрата.
В некоторых биохимических реакциях (не в дыхании) вместо НАД+ участвует его фосфорилированное производное, носящее еще более замечательное название никотинамид-адениндинуклеотидфосфат (НАДФ+). На самом деле это тот же НАД+, в состав которого вместо обычной рибозы входит рибозо-2-фосфат. Иными словами, НАД+ и НАДФ+ не отличаются ничем, кроме одной фосфатной группы. Обычно НАДФ+ принимает участие в конструктивном метаболизме, то есть во всевозможных синтезах. На свойства молекулы, касающиеся переноса электронов, наличие “пришитой” к сахару фосфатной группы никак не влияет. Скорее всего, она нужна просто затем, чтобы ферменты не путали НАД+ и НАДФ+ между собой, а использовали их в разных реакциях. А это, в свою очередь, нужно для того, чтобы энергетический и конструктивный метаболизм не были связаны друг с другом через общий кофактор, а были разделены: тогда их будет легче независимо регулировать.
Многие кофакторы синтезируются из содержащихся в нашей пище биологически активных веществ, которые называются витаминами. Собственно говоря, большинство витаминов — это и есть либо кофакторы, либо их прямые химические предшественники. Время жизни молекул кофакторов велико, так что они могут использоваться в реакциях огромное число раз повторно. Поэтому организму они нужны в довольно малом количестве. И по этой же причине человеку требуется лишь очень небольшое количество витаминов. Но если того или иного витамина в пище нет совсем, могут начаться серьезные проблемы. Например, никотиновая кислота, без которой невозможен синтез НАД+, организмом человека не синтезируется. Она должна поступать в него с пищей. А если никотиновой кислоты в пище не хватает, начинается серьезная болезнь — пеллагра. Вылечить ее можно, если давать больному никотиновую кислоту или даже прямо никотинамид. Неудивительно, что никотиновая кислота иначе называется витамином PP, что значит “предотвращающий пеллагру” (pellagra preventing).
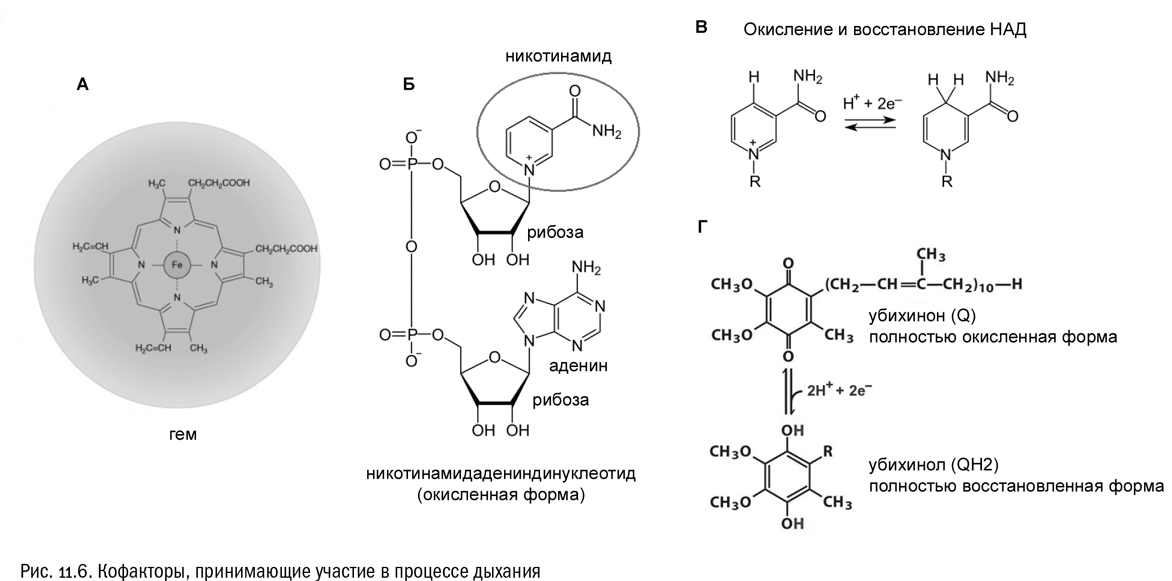
Еще один важный свободный кофактор называется убихиноном, или коферментом Q (см. рис. 11.6Г). Его структура несложна, но по-своему интересна. Представим себе бензольное кольцо (с соответствующей системой двойных связей), к которому друг против друга присоединены две гидроксильные группы (–OH). Это будет спирт. Теперь представим, что у каждой гидроксильной группы отобрали по атому водорода. Это типичная окислительно-восстановительная реакция, в результате которой кислороду бывшего гидроксила ничего не останется, кроме как образовать с углеродом двойную связь. А поскольку валентность углерода в органике всегда равна 4, то система двойных связей в бывшем бензольном кольце вынужденно перестроится: их станет две вместо трех. И получится молекула, которая называется хиноном. Так вот, убихинон — это типичный хинон, к ядру которого добавлено несколько боковых цепей, а именно метильная группа, две группы –O–CH3 и (это самое главное) длинная углеводородная цепочка, которая может включать несколько десятков атомов углерода. Присоединив к себе два атома водорода, убихинон может легко восстановиться и превратиться в спирт:
убихинон (окисленная форма) + 2H+ + 2e– ⇌ убихинол (восстановленная форма)
Вот на этой реакции и основано использование убихинона в качестве кофактора. Однако убихинон отличается от НАД+ тем, что он из-за своей длинной углеводородной боковой цепи совершенно нерастворим в воде. Растворяться он может только в гидрофобных веществах, то есть в липидах. Это тоже иногда бывает нужно. Убихинон действует как кофактор прямо внутри мембраны, в ее гидрофобной фазе.
Убихинон в норме синтезируется организмом человека, но при некоторых заболеваниях его может там не хватать. Поэтому к витаминам его можно отнести только с оговорками (витаминами принято называть молекулы, которые не синтезируются организмом человека вовсе). Но иногда убихинон все-таки считают витамином и тогда обозначают его как витамин Q. Это жирорастворимый витамин, в отличие от никотиновой кислоты, которая относится к водорастворимым витаминам.
Ну а теперь поговорим о дыхании.
От глюкозы до пирувата
Первый этап процесса дыхания — гликолиз — представляет собой цепочку из 10 последовательных реакций, в результате которых молекула глюкозы (C6H12O6) превращается в две молекулы пировиноградной кислоты, или пирувата (C3H4O3). Это замечательное вещество с красивым названием открыл в 1835 году великий шведский химик Йенс Якоб Берцелиус, автор терминов “протеин”, “органическая химия” и многих других (см. главу 3). Пировиноградная кислота — это трехуглеродная кислота, состоящая из карбоксильной группы, кетогруппы и метильной группы (см. главу 1 и рис. 1.8). Вот суммарное уравнение гликолиза:
C6H12O6 + 2НАД+ + 2АДФ + 2H3PO4 → 2C3H4O3 + 2НАДH + 2H+ + 2АТФ + H2O
Здесь мы на самом деле видим сразу три сопряженных процесса. Первый из них — распад глюкозы (C6H12O6) до пирувата (C3H4O3); еще раз напомним, что в биохимии различие между кислотами и их анионами часто игнорируется, так что пировиноградная кислота и пируват для нас одно и то же. Второй процесс — восстановление двух молекул НАД+ до состояния “НАДH + H+”. Разумеется, это произошло за счет водорода, отнятого у глюкозы. (Если быть точным, атомы водорода отбираются не прямо у глюкозы, а у одного из промежуточных продуктов ее распада, и происходит это во время шестой по счету из составляющих гликолиз десяти реакций.) Ну а третий процесс, ради которого все, вообще говоря, и затевалось, — это синтез двух молекул АТФ. Уравнение показывает, что АТФ синтезируется из АДФ и фосфорной кислоты (H3PO4) с выделением воды (H2O). На уровне начальных и конечных продуктов так и есть, хотя реальный механизм тут гораздо сложнее. Но в любом случае образовавшиеся молекулы АТФ захватили свободную энергию, выделившуюся при распаде глюкозы и частичном окислении продуктов этого распада. Именно ради их синтеза вся эта система реакций и была нужна.
Гликолиз хорош тем, что абсолютно не требует участия молекулярного кислорода (O2). Поэтому, если кислородное дыхание по какой-то причине невозможно, гликолиз в принципе можно превратить в единственный способ получения энергии. И некоторые живые организмы на это действительно способны. В том случае, если гликолиз не предполагает продолжения в виде кислородного дыхания, к нему добавляется еще одна реакция, а именно восстановление пировиноградной кислоты (пирувата) до молочной кислоты (лактата):
C3H4O3 (пируват) + НАДH + H+ → С3H6O3 (лактат) + НАД+
Как ни странно, смысл этой реакции вовсе не в пирувате и не в лактате. Ее истинный главный продукт — это кофактор НАД+. Дело в том, что запасы кофакторов в клетках обычно очень малы: мы уже говорили, что их молекулы оборачиваются в одних и тех же реакциях несчетное число раз. Но если молекулы НАД+ уже загружены водородом (то есть перешли в состояние НАДH), то использовать их для новых актов гликолиза невозможно. Чтобы продолжить переработку поступающей в клетку глюкозы, нужно сначала окислить НАДH до НАД+, вернув кофактор в рабочее состояние. На ученом языке это называют регенерацией НАД+. Вот именно для этого реакция образования лактата и нужна. Сам лактат является тут только побочным продуктом. А гликолиз вместе с реакцией образования лактата складывается в процесс, который называется молочнокислым брожением.
Надо учитывать, что гликолиз и молочнокислое брожение не синонимы, но в них совпадают 10 из 11 реакций (то есть все, кроме последней). Есть и другие типы брожения, основу которых тоже составляет гликолиз, но с иными “надставками”.
Достойно внимания, что биохимический путь молочнокислого брожения одинаков у молочнокислых бактерий, с помощью которых мы получаем кисломолочные продукты, и у многих эукариот, включая человека. Открытие этого биохимического пути было в свое время, пожалуй, исторически первой полученной наглядной иллюстрацией фундаментального единства жизни на Земле. Человек, конечно, не способен полностью перейти на брожение, но тем не менее наши клетки могут на него временно переключаться в случаях, когда дыхательные ферменты не успевают до конца окислять глюкозу — например, при очень сильных мышечных нагрузках. Это та самая ситуация, когда молочная кислота накапливается в мышцах. После прекращения нагрузки накопившуюся молочную кислоту приходится все-таки метаболизировать: с кровью она поступает в печень и там вновь превращается в пируват, который уже можно использовать в кислородном дыхании.
Нельзя не сказать, что у биохимического пути гликолиза есть второе красивое название: путь Эмбдена — Мейергофа — Парнаса. Это имена трех биохимиков, каждый из которых посвятил десятки лет своей жизни изучению обмена углеводов. Густав Георг Эмбден и Отто Фриц Мейергоф были блестящими представителями классической немецкой биохимии. Эмбден умер в 1933 году, не успев получить Нобелевскую премию, хотя несколько раз номинировался на нее. Мейергоф получил свою Нобелевскую премию еще в 1922 году, а в 1938-м эмигрировал из Германии, спасаясь от нацистов, и закончил свою жизнь профессором в Пенсильвании. И наконец, судьба последнего из этой тройки оказалась еще более сложной. Якуб Кароль Парнас, он же Яков Оскарович Парнас, родился в Западной Украине, которая тогда входила в состав Австро-Венгрии. Высшее образование он получил в Германии, затем в роли самостоятельного исследователя сотрудничал с университетами Кембриджа, Неаполя, Страсбурга, Гента и Цюриха, но в качестве основного места работы выбрал Львов, к тому времени уже принадлежавший независимой Польше. При Львовском университете Парнас создал целый Институт медицинской химии с группировавшейся вокруг него мощной научной школой. В сентябре 1939 года Польша рухнула, и ее бывшая восточная часть — то есть Западная Украина и Западная Белоруссия — была присоединена к СССР. Парнас мог бы попытаться эмигрировать, но предпочел остаться во Львове и продолжить свою работу. Советская власть поначалу приняла его очень хорошо, он — к тому времени уже всемирно известный ученый — стал академиком АН СССР. В конце июня 1941 года Парнас успел эвакуироваться из Львова за считаные сутки, если не часы, до вступления в город немецких войск; если бы он задержался, то, скорее всего, был бы убит нацистами, как десятки оставшихся во Львове польских профессоров и тысячи простых евреев. Парнас переехал в Москву, где стал первым директором созданного в 1944 году Института биологической и медицинской химии (этот институт существует до сих пор под названием ИБМХ РАН). Однако в начале 1949 года он был арестован советским министерством государственной безопасности по надуманному обвинению в шпионаже и умер в тюрьме прямо в день ареста то ли от инфаркта, то ли от диабетической комы. Никаких подтверждений обвинения против Парнаса в дальнейшем не получили — причины его ареста явно были чисто политическими, возможно, связанными с тем, что он, как и Мейергоф, был евреем по национальности. Это одна из многих трагических судеб ученых в страшную “эру разобщенного мира” первой половины XX века.
Цикл лимонной кислоты
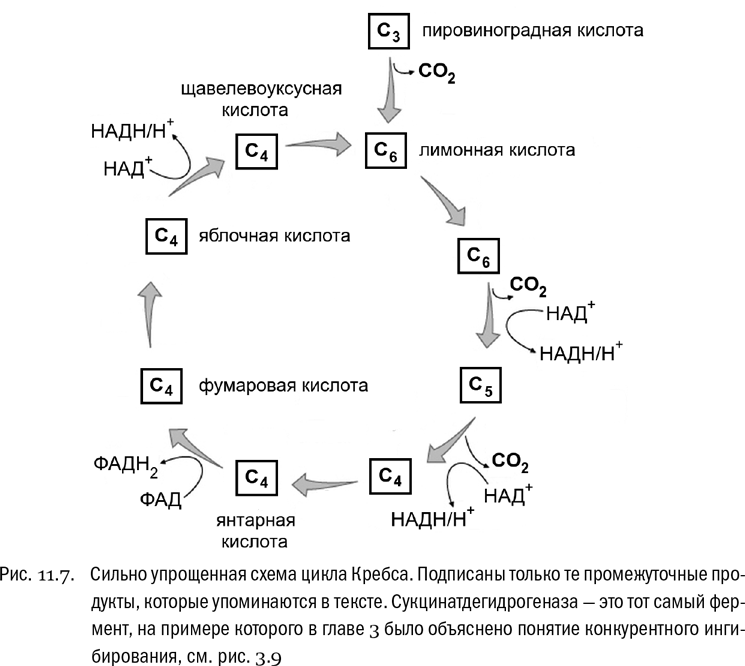
Итак, мы остановились на том, что молекула глюкозы распалась до двух молекул пирувата, то есть пировиноградной кислоты. Ее формула нам уже давно знакома, и сейчас достаточно просто напомнить, что это — молекула с тремя атомами углерода. Если к пировиноградной кислоте добавить вторую карбоксильную группу, она превратится в молекулу, которая называется щавелевоуксусной кислотой (ЩУК). Это соединение с четырьмя атомами углерода, двумя карбоксильными группами и кетогруппой. А из щавелевой кислоты можно при желании получить еще более великолепную на вид молекулу, которая называется лимонной кислотой: соединение с шестью атомами углерода, тремя карбоксильными группами и одной гидроксильной группой в придачу (см. главу 1 и рис. 1.8). В дальнейших биохимических событиях эти вещества принимают самое активное участие. Итак, запомним, что пировиноградная кислота — это трехуглеродная молекула, щавелевоуксусная — четырехуглеродная, а лимонная — шестиуглеродная.
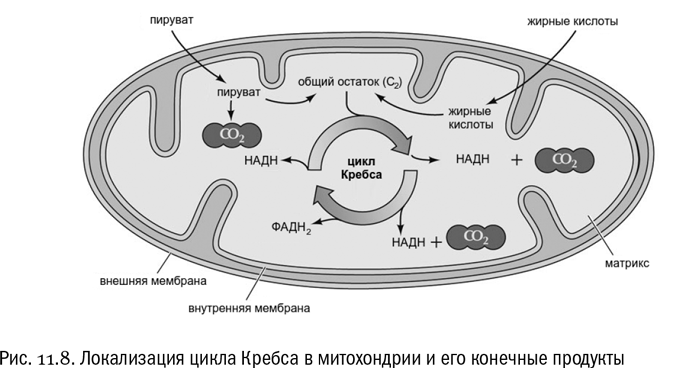
Местом “приключений” всех этих веществ служит митохондрия. Если гликолиз происходит в обычной цитоплазме, то все дальнейшие процессы, составляющие дыхание, могут идти только внутри митохондрий (если мы говорим об эукариотной клетке, конечно). Поэтому именно сейчас есть смысл рассмотреть митохондрии чуть детальнее, чем мы делали это до сих пор.
Митохондрии были открыты с помощью микроскопа еще в XIX веке В то время их описывали как находящиеся внутри клеток палочки или зерна. На самом деле форма митохондрий весьма разнообразна. В некоторых клетках митохондрии вообще сливаются друг с другом, образуя сложные ветвящиеся структуры. Кроме того, митохондрии обычно связаны с цитоскелетом (точнее, с микротрубочками). Это помогает им занимать фиксированное положение, а когда нужно, то и перемещаться по клетке.
Любая митохондрия имеет две мембраны — наружную и внутреннюю. Промежуток между ними называется межмембранным пространством. Это типичный пример компартментализации — разделения клетки на мембранные отсеки (см. главу 10). В наружную мембрану митохондрии в изобилии встроены каналообразующие интегральные белки (порины), которые пропускают туда и обратно практически все не слишком крупные молекулы. Грубо говоря, наружная мембрана митохондрии похожа на сито. Поэтому химический состав межмембранного пространства примерно такой же, как у окружающей митохондрию цитоплазмы, то есть у обычного содержимого клетки.
Наоборот, внутренняя мембрана митохондрии очень мало проницаема для молекул и особенно для ионов (свойства липидного состава этой мембраны таковы, что ее проницаемость уменьшена до предела). Пространство, ограниченное внутренней мембраной митохондрии, называется матриксом. Кроме того, внутренняя мембрана митохондрии всегда имеет множество складок, которые принято называть кристами. Это нужно для увеличения ее поверхности. Переход молекул из межмембранного пространства в матрикс возможен только с помощью особых мембранных белков, часто использующих сопряженный транспорт. Именно в матриксе и происходят дальнейшие превращения пирувата.
Превращения эти, прямо скажем, довольно сложны. Мы сейчас ограничимся предельно упрощенным описанием, в котором будем обращать внимание в основном на судьбу атомов углерода. В конечном итоге путь этих атомов всегда завершается тем, что они окисляются до углекислого газа (CO2). Углекислый газ — бесполезный для дышащих существ конечный продукт, из которого вся энергия уже извлечена; дальше его можно только выдохнуть. Помня об этом, дальнейшую судьбу пировиноградной кислоты (то есть пирувата) легко разбить на четыре стадии.
* Вначале пировиноградная кислота декарбоксилируется. Это означает, что от нее отрывается карбоксильная группа, остаток которой в данном случае сразу же окисляется до углекислого газа (CO2).* Фрагмент, оставшийся от пировиноградной кислоты и содержащий теперь только два атома углерода, уносится специальным кофактором и присоединяется к щавелево-уксусной кислоте (четырехуглеродной), которая превращается тем самым в лимонную кислоту (шестиуглеродную).* Молекула лимонной кислоты еще дважды декарбоксилируется, попутно перестраиваясь. Последнее означает, что во всех реакциях, кроме первой, на самом деле фигурирует уже не сама лимонная кислота, а ее производные, но мы не будем их тут перечислять, а удовольствуемся конечным результатом. Важно то, что на этой стадии в итоге образуется еще две молекулы углекислоты (CO2). Таким образом, все три атома углерода, которые были в пировиноградной кислоте, теперь окислены до предела. Эти реакции требуют расхода воды (H2O), потому что кислорода, содержащегося в самой пировиноградной кислоте, на такое полное окисление не хватит.* В конечном счете четырехуглеродный фрагмент, оставшийся от лимонной кислоты после реакций декарбоксилирования, превращается обратно в щавелевоуксусную кислоту. Тем самым цепочка реакций замыкается в цикл, который называют циклом лимонной кислоты, или циклом Кребса (см. рис. 11.7).
Большинство реакций, входящих в цикл Кребса, являются окислительно-восстановительными. Вот типичный пример такой реакции:
HOOC–CH2–CHOH–COOH + НАД+ → HOOC–CH2–CO–COOH + НАДH + H+
Здесь перед нами окисление яблочной кислоты (слева) до щавелевоуксусной (справа). Между этими двумя кислотами есть одно-единственное различие: там, где в яблочной кислоте находится гидроксильная группа (–CHOH–), в щавелевоуксусной кислоте на ее месте кетогруппа (–CO–). Чтобы превратить гидроксильную группу в кетогруппу, нужно отнять у молекулы два атома водорода (H). Именно это и делает фермент под названием малатдегидрогеназа. Это название легко расшифровать: малат — анион яблочной кислоты, а дегидрогеназы — общее название всех ферментов, отнимающих водород. Ферменты-дегидрогеназы — это одна из подгрупп ферментов-оксидоредуктаз, о которых мы говорили выше. Как и во многих других подобных реакциях, отобранные у яблочной кислоты два атома водорода тут же захватывает кофермент НАД+, который превращается при этом в НАДН (плюс протон в растворе).
Итак, в матриксе митохондрий идет целая серия окислительно-восстановительных реакций, конечные продукты которых, во-первых, углекислый газ и, во-вторых, отобранный у субстрата водород (см. рис. 11.8). Углекислый газ — это отход, который просто выдыхается (его молекулы так малы, что даже внутренняя мембрана митохондрии для них проницаема). Теперь от исходного субстрата, то есть от глюкозы, ничего не осталось, кроме отобранных атомов водорода, судьба которых совершенно особая.
Дыхательная цепь
Итак, молекула глюкозы, с которой мы начали разговор о дыхании, наконец-то полностью распалась. И произошло это в ходе цикла лимонной кислоты. Давайте посмотрим на главные особенности этого процесса.
Во-первых, он идет в матриксе митохондрий (то есть в замкнутом пространстве, ограниченном внутренней мембраной митохондрии), и только там.
Во-вторых, он не требует молекулярного кислорода (O2).
В-третьих, он хотя и сопровождается синтезом АТФ, но в очень малом количестве (всего одна молекула на каждый оборот цикла).
Главный продукт цикла лимонной кислоты — восстановленные формы свободных кофакторов. “Восстановленные” в данном случае, конечно, значит “нагруженные водородом”. Кофакторов с такой функцией, фигурирующих на выходе из цикла лимонной кислоты, существует два. Первый из них — это уже хорошо знакомый нам НАД+. Со вторым же мы еще не сталкивались. Не будем вникать в его молекулярную структуру, а ограничимся названием, благо оно красивое: флавинадениндинуклеотид, сокращенно ФАД. Химический предшественник ФАД хорошо известен медикам как водорастворимый витамин B2. Молекула ФАД может присоединить к себе два атома водорода, перейдя в восстановленную форму, а может и отдать их обратно:
ФАД + 2H ⇌ ФAДH2
В грубом приближении (которого мы и будем тут придерживаться) можно вообще игнорировать ФАД и свести весь “окислительно-восстановительный сюжет” к обороту НАД, вклад которого все равно существенно больше. Если говорить точно, в результате каждого оборота цикла лимонной кислоты восстанавливаются три молекулы НАД+ и одна молекула ФАД. Легко сосчитать, что вместе они поглощают восемь атомов водорода.
Проблема в том, что никакой механизм регенерации этих кофакторов в цикле лимонной кислоты не предусмотрен. А это должно означать, что использовать их можно только один раз. Дальше они нагружаются водородом и в рамках самого цикла лимонной кислоты разгружены быть не могут. Что же с ними делать?
Вот тут-то и начинается самое интересное. Но чтобы оценить, насколько это интересно, нужно (в который уже раз) небольшое вступление.
Начать тут лучше всего с немецкого биохимика Эдуарда Бухнера. В 1880-х годах, когда Бухнер начинал работать, химики и биологи вовсю спорили о природе брожения. Имело место противостояние двух мнений. Одни ученые были уверены, что брожение есть физиологический акт, неотделимый от живой материи по самой своей природе, и воспроизвести его вне живой клетки принципиально невозможно. Другие же считали, что брожение — это чисто химический процесс, требующий, конечно, определенных катализаторов, но потенциально вполне способный протекать и без всяких клеток, в любом растворе, где эти катализаторы есть. Обе точки зрения имели своих яростных защитников, и спор растянулся на несколько десятилетий. В 1897 году Бухнеру удалось наконец-то однозначно решить эту проблему. Он превратил клетки дрожжей в бесклеточный экстракт, растерев их в ступке с песком, и показал, что если добавить этот экстракт в раствор сахара, то там произойдет брожение, абсолютно идентичное естественному (в данном случае это было спиртовое брожение, конечными продуктами которого являются углекислый газ и этиловый спирт). Между прочим, это отличный пример того, как биолог вынужденно разрушает живое тело, превращая его в неживое, чтобы выяснить действующие там механизмы, а потом мысленно воссоздать живой объект, уже понимая, как он устроен. Такая аналитическая наука, как биохимия, основана на этом подходе практически целиком. А историю современной биохимии часто отсчитывают именно от работы Бухнера, экспериментально доказавшего, что брожение — это обычный химический процесс, в котором ферменты играют роль катализаторов.
Сам Бухнер сразу понял огромное значение своего открытия. Зная высочайшую требовательность немецких химиков (как-никак лучших в то время в мире), он потратил еще месяц на тщательное проведение повторных опытов и только потом опубликовал сообщение о них. И оно произвело сенсацию. Теперь Бухнеру была обеспечена блестящая профессорская карьера, а в 1907 году он получил одну из первых Нобелевских премий по химии. К сожалению, жизнь Бухнера оказалась не слишком долгой из-за того, что он, как и многие другие немецкие интеллектуалы кайзеровской эпохи, был настроен довольно милитаристски. В момент начала Первой мировой войны ему было уже 54 года, но он все равно вступил в армию, где через некоторое время получил Железный крест и чин майора. В 1917 году он погиб от ранения на второстепенном и, по сути, не нужном никому из участников этой войны Румынском фронте.
Почему все это для нас важно? А вот почему. После открытия Бухнера у биохимиков сложилось стойкое убеждение, что живая клетка — это в общем-то просто мешок с ферментами. В 1901 году австриец Франц Хофмейстер, известный исследователь белков, выступил с четким предсказанием: для любой жизненно важной химической реакции должен найтись специфический внутриклеточный фермент. Буквально за считаные годы эта позиция стала общепринятой. Теперь для посвященных клетка выглядела не таинственным вместилищем жизни, а просто неким объемом с раствором, где идут реакции, вызываемые набором довольно сложных, но вполне поддающихся обычному химическому исследованию белковых катализаторов (то есть ферментов). И это, конечно, была правда. Но вот беда — не вся.
Дело тут вот в чем. И гликолиз, и брожение, и цикл лимонной кислоты — это цепочки химических реакций, идущих в однородной (гомогенной) жидкой среде, в которой ферменты просто растворены. Вопрос о направлении такой реакции в пространстве не только не имеет ответа, но и вообще лишен смысла (как и для подавляющего большинства реакций, изучаемых “обычной” химией). А вот дальше нам придется иметь дело с реакциями, организация которых в пространстве имеет важнейшее значение, потому что в них происходят строго направленные переходы молекул между разными фазами. Среду, где идут такие реакции, уже невозможно рассматривать как простой мешок с раствором ферментов. Это система с внутренней структурой, где есть направления, границы, поверхности раздела. И первым, кто это понял, был гениальный Питер Митчелл. Однако давайте обо всем по порядку.
Согласно общепринятому определению, фаза — это часть объема системы, однородная по составу и свойствам и отделенная от других частей той же системы поверхностью раздела. Последнее очень важно. Там, где никакой поверхности раздела нет, говорить о разных фазах нельзя. Например, если растворить в воде поваренную соль, получится система, не разделенная на фазы (обычный раствор). Но если насыпать в воду столько соли, чтобы она начала выпадать в осадок, то получится уже система с двумя фазами — жидкой (раствор) и твердой (кристаллы соли). Еще более простой пример системы c жидкой и твердой фазами — обычная вода, в которой плавают куски льда.
Система с двумя жидкими фазами тоже вполне возможна. Например, вода и бензол не растворяются друг в друге, потому что бензол — ярко выраженное гидрофобное вещество (см. главы 1 и 2). Если попытаться их смешать, в сосуде образуется два слоя: сверху бензол (он легче), снизу вода. И между ними будет четкая поверхность раздела.
Давно известно, что и клеточную мембрану можно в неплохом приближении рассматривать как гидрофобную жидкость, зажатую в очень тонком слое. И таким образом, на арене, где происходит дыхание (то есть внутри митохондрии), мы видим систему из трех жидких либо полужидких фаз: (1) матрикс, (2) внутренняя мембрана митохондрии и (3) межмембранное пространство. Первая и третья из этих фаз — гидрофильные, а вот вторая — гидрофобная. И она тут никак не менее важна, чем остальные две. Мы уже видели, что есть специальные кофакторы, способные работать только в гидрофобных условиях, то есть внутри мембраны: например, убихинон, который нерастворим в воде, зато хорошо растворяется в “жирных” средах. Но главное, прямо в мембране находится несколько ферментов-оксидоредуктаз, называемых вместе дыхательной цепью. И эти ферменты могут не только присоединять к себе остатки атомов водорода (то есть электроны), но и передавать их друг другу по цепочке — потому они так и названы.
Ферменты дыхательной цепи сами по себе очень интересны. Они были открыты еще в XIX веке и активно изучаются биохимиками до сих пор. Это огромные белки со сложнейшей четвертичной структурой, дрейфующие в фосфолипидном море мембраны, подобно айсбергам, верхушки которых высовываются наружу — в водную фазу. Каждый фермент дыхательной цепи обязательно связан со своим кофактором, который, собственно, и захватывает электроны (это может быть упоминавшийся выше гем, но могут быть и другие кофакторы, которые мы не обсуждали, потому что “нельзя объять необъятное”). Поскольку мембрана по своим физическим свойствам близка к жидкости, ферменты и кофакторы могут в ней перемещаться, сталкиваясь друг с другом и передавая электроны по цепи. Причем один из этапов этого переноса электронов внутри мембраны осуществляет даже не белок, а гораздо более простой свободный кофактор — уже знакомый нам убихинон.
Ну а теперь вернемся к тому, что происходит дальше с конечными продуктами цикла лимонной кислоты.
Главный из этих продуктов — конечно, НАДH. Напомним, что это восстановленный вариант НАД+, присоединивший к себе два электрона (e–) и один протон (H+). При наличии желания и возможности молекулу НАДH можно разложить на составные части:
НАДH ⇌ НАД+ + H+ + 2e–
Именно это разложение ферменты дыхательной цепи и осуществляют. Молекуле НАДH, плавающей в матриксе, нужно только приблизиться к мембране, чтобы соответствующий фермент дыхательной цепи (он называется комплексом I) отобрал у нее оба электрона. А пройдя всю цепь, электроны доходят до комплекса IV, который тут же захватывает молекулярный кислород — только сейчас он наконец-то понадобился! — и объединяет его с электронами и протонами (последних, как мы знаем, всегда хватает в окружающем растворе). В результате два электрона, один атом кислорода и два протона монтируются в молекулу воды:
½O2 + 2H+ + 2e– → H2O
Теперь глюкоза “сгорела” окончательно — до углекислого газа и воды. Процесс дыхания завершен.
А заодно произошла регенерация НАД+. Его теперь можно заново использовать в цикле лимонной кислоты или в любых других реакциях, в каких только захочется. Мы видим, что в данном случае именно кислород забрал у восстановленного НАДH атомы водорода, которыми тот был нагружен. Вот зачем, собственно, и нужен кислород при дыхании: чтобы послужить окислителем, отбирающим электроны у НАДH. Суммарное уравнение этого процесса выглядит так:
НАДH + H+ + ½O2 → НАД+ + H2O
Справа у нас тут восстановленный НАДH (с протоном) и кислород, а слева — окисленный НАД+ и вода. Таким образом, мы имеем полное формальное право сказать, что НАДH окисляется кислородом. Хотя физически молекула НАДH вообще не взаимодействует с молекулой O2: они разделены целой цепочкой ферментов, передающих электроны.
Осталось выяснить, каким же, собственно говоря, способом организм получает при этом энергию. Ведь к моменту окончания цикла лимонной кислоты молекул АТФ у нас пока еще мало, в несколько раз меньше, чем могло бы синтезироваться за счет полного сгорания глюкозы, если исходить из свободной энергии этого процесса. Чтобы понять, откуда в дыхательной цепи берется энергия, нужно обратить внимание на обмен протонов.
Зубчатые колеса
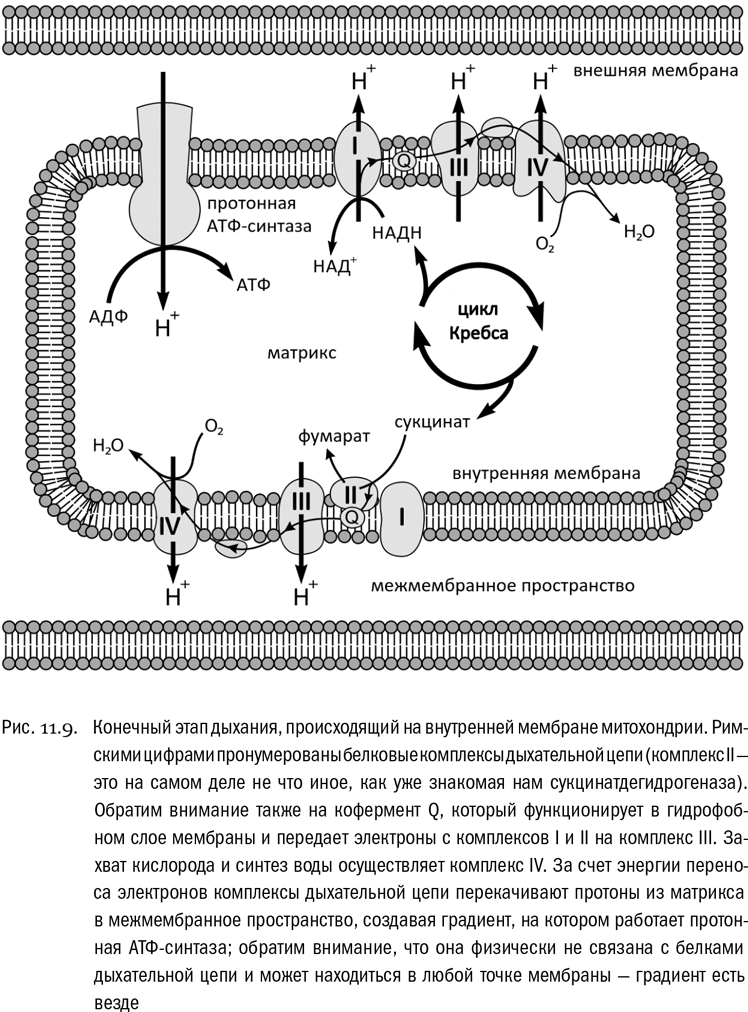
Что происходит с протонами, пока во внутренней мембране митохондрии работает дыхательная цепь (она же цепь переноса электронов)?
Дать ответ на этот вопрос нам сейчас уже не составит особого труда. Но, прежде чем к нему перейти, отметим несколько важных фактов, которые мы на самом-то деле уже знаем.
Во-первых, из-за того, что вода постоянно диссоциирует (Н2О ⇌ H+ + OH–, см. главу 1), запас протонов в водных растворах неограничен. С точки зрения подавляющего большинства реакций они там всегда в избытке. Но — внимание! — этот избыток отнюдь не означает, что концентрации протонов всюду равны. Их вполне может быть где-то больше, а где-то меньше.
Во-вторых, внутренняя мембрана митохондрии практически непроницаема для всех ионов, не исключая и протоны (особенности ее состава таковы, что она даже более непроницаема для них, чем другие мембраны в той же клетке).
В-третьих, внутренняя мембрана митохондрии строго асимметрична: две ее стороны обладают разными свойствами. Белки дыхательной цепи “высовываются” из мембраны в окружающий водный раствор, но каждый — только в свою сторону, в согласии с той функцией, которую он выполняет. А нередко и разные части одного и того же белкового комплекса бывают направлены в разные стороны, причем каждая — в точном соответствии со своим предназначением. Например, белковый комплекс I, который отбирает электроны у НАДH, имеет два совершенно разных активных центра, один из которых “высовывается” из мембраны в матрикс, а другой — совсем наоборот, в сторону межмембранного пространства. Это типичная ситуация.
В-четвертых, давайте вспомним о завершающем дыхательную цепь белковом комплексе IV, который захватывает кислород и соединяет его с электронами и протонами, образуя воду. Электрон и протон в сумме дают атом водорода. На одну молекулу кислорода (O2) тратится четыре электрона (e–) и четыре протона (H+), давая в результате две молекулы воды (H2O). Электроны приходят по мембранной цепи, их переносящей, а протоны захватываются из водного раствора. Так вот, активный центр этого комплекса обращен на внутреннюю сторону мембраны, то есть в матрикс. Где, таким образом, протонов по ходу его работы становится меньше.
И наконец, последний важнейший момент. Перенос электронов с НАДH на конечный окислитель, в данном случае на кислород, — это энергетически очень выгодный процесс. Количество свободной энергии, которая в нем выделяется, вполне сравнимо с количеством свободной энергии, выделяемой в настоящем пламени. Весь смысл процесса дыхания в том и состоит, чтобы, захватив эту энергию, конвертировать ее в форму, подходящую для дальнейшего использования.
Что же это за форма такая? Мы уже давно знаем, что самый популярный в современной живой природе способ запасания энергии — это обратить ее в энергию связей АТФ. Что ж, ничто не мешает нам вообразить встроенную в мембрану молекулярную машину в виде белка, конвертирующего энергию переноса электронов прямо в АТФ. Такое вполне, что называется, мыслимо. В наглядных образах эту “машину” можно было бы представить как две сцепленные шестеренки, одна из которых вертится под напором текущих электронов, а вторая автоматически пришивает фосфаты к АДФ, превращая его в АТФ.
Однако, хотя ничего принципиально невозможного в существовании такого белка нет, эволюция его почему-то не создала. Наша аналогия не совсем фантастична: некоторые (отдаленные, конечно) аналоги сцепленных шестеренок в белках дыхательной цепи и в самом деле присутствуют. Но энергию потока электронов они используют не для синтеза АТФ, а для транспорта протонов. Это типичный активный транспорт: протоны принудительно переносятся из матрикса (где их и так меньше) в межмембранное пространство (где их и так больше). Причем такие встроенные системы сопряженного транспорта есть подряд в нескольких белках дыхательной цепи, через которые последовательно проходят переносимые электроны. В результате изнутри наружу суммарно выбрасывается 64 протона на каждую исходную молекулу глюкозы. И таким образом, снаружи от мембраны становится не просто больше, а намного больше протонов, чем внутри:
[H+]out ≫ [H+]in
Теперь дело сделано. Ведь разность концентраций протонов, она же протонный потенциал (∆μH), — это не что иное, как еще один универсальный способ хранения энергии. Уж это мы теперь прекрасно знаем. Согласно законам биоэнергетики, энергию протонного потенциала всегда можно конвертировать в энергию АТФ:
∆μH ⇌ АТФ
Именно это и делает встроенная во внутреннюю мембрану митохондрии протонная АТФ-синтаза. С белками дыхательной цепи она не связана. Она просто пропускает накопившиеся протоны снаружи (где их больше) внутрь (где их меньше), а за счет высвобожденной при этом энергии синтезирует АТФ. Тот самый АТФ, благодаря которому мы живем. Подсчеты показывают, что из 38 молекул АТФ, которые синтезируются в результате полного окисления одной молекулы глюкозы, 34 синтезирует протонная АТФ-синтаза. Последней всего-то и остается, что открыть протонный канал да позволить крутиться своей “водяной (вернее, протонной) мельнице” (см. рис. 11.9). Вот этот завершающий процесс и открыл в свое время Питер Митчелл, получив в результате Нобелевскую премию.
Интересно, а могла бы дыхательная цепь обойтись вообще без переходного звена, каковым тут является активный транспорт протонов? Что мешает перевести энергию переноса электронов на окислитель прямо в энергию АТФ, отказавшись от ее промежуточного запасания в виде протонного (или, у некоторых бактерий, натриевого) потенциала? Чисто физически, видимо, ничто не мешает. О белках дыхательной цепи известно, что они могут отвечать серьезными конформационными изменениями даже на присоединение одного-единственного электрона. Тогда почему бы и не создать электронную АТФ-синтазу? Но за четыре миллиарда лет биологической эволюции этого так и не произошло. Может быть, вариант с протонным потенциалом чем-то выгоднее (например, тем, что протонный потенциал автоматически распределяется по всей протяженности сколь угодно длинной и разветвленной митохондрии — в некоторых клетках митохондрии даже специально сливаются друг с другом, чтобы использовать эту возможность). А может быть, дело в том, что это наследие очень древнего эволюционного прошлого, отказ от которого потребовал бы столь серьезной перестройки обмена веществ, что лучше уж было оставить все как есть. Вероятно, мы поймем это несколько лучше, когда разберемся в том, какой из способов запасания энергии эволюционно первичен.
Поэма начала
В этой главе мы уже говорили о том, насколько разными способами живые существа получают энергию. Теперь нам осталось сузить эту проблему до предела и обсудить способы синтеза АТФ, которых насчитывается всего-то навсего два (причем чаще всего они наблюдаются одновременно у одних и тех же организмов).
Первый способ называется субстратным фосфорилированием. В этом случае по ходу предназначенного для поставки энергии биохимического пути создается некоторая молекула, включающая в себя фосфат с макроэргической связью (X~Ф). А потом этот фосфат переносится на АДФ. В результате получается молекула АТФ, содержащая новую макроэргическую связь и запасающая энергию в себе:
X~Ф + АДФ → X + АТФ
Именно так генерируется энергия в процессе гликолиза (веществом, которое мы обозначили как X~Ф, там служит фосфоенолпируват). Подобные реакции идут просто в растворе, никакая сложная структура среды с выделенными направлениями и границами для них не нужна. А это означает, что субстратное фосфорилирование вполне соответствует бухнеровскому представлению о клетке как простом мешке с растворенными ферментами.
Второй способ — мембранное фосфорилирование — представляет собой уже хорошо знакомое нам обращение энергии протонного (или натриевого) потенциала в энергию АТФ с помощью соответствующей ионной АТФ-синтазы. Ясно, что для мембранного фосфорилирования необходима замкнутая мембрана, сквозь которую протоны (или ионы натрия) будут проходить только с помощью особых белков и только в одну сторону. Этот способ получения АТФ — основной и в дыхании, и в фотосинтезе. В ходу он и у обладателей многих других типов метаболизма. Например, метаногенные археи (которые живут за счет восстановления углекислого газа до метана) тоже пользуются мембранным фосфорилированием как главным источником энергии. Они создают на своей внешней мембране протонный потенциал, а потом конвертируют его в энергию связей АТФ.
А теперь зададимся вопросом, который наверняка покажется самым интересным во всей этой истории многим биологам независимо от того, связаны ли они с биохимией (хочется надеяться, что и многим небиологам тоже): какое фосфорилирование появилось раньше — субстратное или мембранное?
Сразу признаемся, что это вопрос исключительно сложный (даже сама возможность его поставить появилась считаные десятилетия назад) и никакого окончательного ответа на него нет. Как раз наоборот, на эту тему прямо сейчас идет активная полемика. И чтобы разобраться в ее предмете, нам придется обратиться к самым истокам жизни.
В 1929 году английский биолог Джон Холдейн опубликовал статью о происхождении жизни, в которой бегло, вовсе не претендуя на окончательную истину, попытался обрисовать свои тогдашние представления об этом процессе. Холдейн всегда отличался ясностью и смелостью мыcли. Предложенный им сценарий происхождения жизни оказался невероятно убедительным — до такой степени, что вошел в школьные учебники и породил многочисленные мемы (вроде, например, изображений консервных банок с надписью “Haldane’s Primordial Soup” — “Первичный бульон Холдейна”). Сводится этот сценарий вот к чему. Изначально древняя Земля, разумеется, была совершенно безжизненной. Она имела водный океан и атмосферу, состоявшую в основном из углекислого газа (CO2), аммиака (NH3) и водяного пара. Свободного кислорода в атмосфере не было и озонового слоя, соответственно, тоже. Поэтому ультрафиолетовый компонент солнечных лучей свободно достигал поверхности воды. Ультрафиолетовые лучи несли вполне достаточно энергии, чтобы вызывать спонтанные превращения углекислого газа, аммиака и воды в органические молекулы, которыми постепенно заполнялся океан. Так и возник знаменитый “первичный бульон”: целый океан, представлявший собой теплый разбавленный раствор уже довольно разнообразной органики. Идеальная питательная среда для жизни, которой на тот момент еще не было. В этой-то среде и появились первые живые существа — очень простые, возможно (говорит Холдейн) похожие на вирусы: ведь те и по сей день проявляют активность, только оказавшись в богатой питательной среде, внутри чужой клетки. Во всяком случае, Холдейн был уверен, что первые на Земле живые организмы были гетеротрофами, и считал, что их способом питания, скорее всего, было брожение (тут он цитирует великого французского биолога Луи Пастера: “Брожение — это жизнь без кислорода”). Вот в таком виде гипотеза Холдейна и обрела огромную популярность, которой он, возможно, и сам не ожидал.
Почему эта гипотеза важна для нас? А вот почему. Брожение — это способ получения энергии, полностью основанный на субстратном фосфорилировании. В брожении не участвуют никакие мембранные белки, оно от начала до конца протекает в растворе, и с этой точки зрения его механизм выглядит очень примитивным. Казалось бы, все отлично соответствует гипотезе Холдейна. Однако со времен Холдейна накопилось много фактов, заставляющих серьезно усомниться в том, что первые живые организмы на Земле могли быть бродильщиками.
Прежде всего, брожение попросту малоэффективно. Его реакции идут в общем-то на грани энергетической выгоды и дают очень мало АТФ (две молекулы на одну молекулу глюкозы, как мы уже знаем). А вот биохимическая “машинерия” брожения, хоть и не требующая мембранных белков, на самом деле весьма сложна. Для молочнокислого или спиртового брожения нужно примерно 12 ферментов, катализирующих последовательные реакции, причем каждый из этих ферментов представляет собой довольно сложный белок, кодируемый особым геном. А ведь любой из этих белков и генов сам должен быть продуктом долгой эволюции. Трудно поверить, что подобный тип обмена возник самым первым. Гораздо вероятнее, что он появился позже, как пристройка к неким более простым и в то же время более эффективным энергетическим механизмам. У современных специализированных бродильщиков эти древние механизмы исчезли, а брожение осталось. В общем, из того, что брожение обходится без мембранного фосфорилирования, никак не следует, что этот способ добычи энергии очень прост, и уж тем более не следует, что он был исходным для всех живых существ.
Современная молекулярная биология подтверждает эти мысли. На эволюционных деревьях видно, что все бродильщики относятся к производным эволюционным ветвям, достаточно далеким от общего предка всех клеточных организмов. К тому же показано, что ферменты гликолиза у бактерий и у архей не имеют между собой ничего общего. Все это означает, что брожение — довольно позднее приобретение, появлявшееся в ходе эволюции независимо несколько раз. Ничего невероятного в таком выводе нет, мы знаем и другие примеры, когда достаточно сложные механизмы неоднократно независимо “изобретались” разными эволюционными ветвями; по всей видимости, это относится к фотосинтезу и даже к репликации ДНК (см. главу 9). Вот и с брожением та же история.
Сравнивая друг с другом современные живые организмы, легко убедиться, что мембранное фосфорилирование гораздо более универсально, чем субстратное. Оно есть и у бактерий, и у архей, и у эукариот. На мембранном фосфорилировании основана система получения энергии у всех без исключения организмов, использующих фотосинтез или дыхание, а также у метаногенов, карбокситрофов, метилотрофов, водородных бактерий и серобактерий. И ведь это еще неполный список: надо учитывать, что некоторые типы метаболизма мы тут просто не обсуждали (хотя в знакомую нам теперь классификацию все они, конечно, так или иначе входят). Специализированные бродильщики — вообще единственные в современном мире, кто получает энергию просто из реакций, идущих в растворе внутри клетки, без всякой генерации потенциала на плазматической мембране этой клетки.
К этому можно добавить, что и у бродильщиков ионный потенциал на мембране обычно все-таки есть. Если он и не служит для получения энергии, то служит для других целей, в первую очередь для сопряженного транспорта. Всевозможные симпорты и антипорты очень удобно осуществлять, когда на мембране постоянно поддерживается разность концентраций каких-нибудь ионов.
Английский биохимик Ник Лейн считает, что все эти факты не оставляют сомнений в огромной древности ионных потенциалов вообще и мембранного фосфорилирования в частности. По мнению Лейна, для утверждения, что у общего предка всех современных живых клеток было мембранное фосфорилирование, есть примерно столько же оснований, сколько и для утверждения, что у него были, например, рибосомы (в чем давно уже никто не сомневается). Тогда получается, что у него была мембрана, уже способная “держать” либо протонный, либо натриевый потенциал и пригодная для выработки полезной энергии.
Тут надо сказать пару слов о самом Нике Лейне. Он не только биохимик, но и известный популяризатор науки; четыре его книги уже вышли на русском языке (они называются “Лестница жизни. Десять величайших изобретений эволюции”, “Энергия, секс и самоубийство. Митохондрии и смысл жизни”, “Кислород. Молекула, изменившая мир” и “Вопрос жизни”). А его любимая узкая специальность — биоэнергетика. Неудивительно, что сквозь многие работы Лейна, что называется, красной нитью проходит одна и та же мысль: современная биология уделяет слишком много внимания проблеме информации в ущерб проблеме энергии. Давайте присмотримся к этой мысли.
Не кто иной, как Джон Холдейн, в свое время определил жизнь как способ существования самовоспроизводящихся структур за счет притока энергии извне. В этом определении важны обе части. Основу живых самовоспроизводящихся структур образуют носители наследственной информации, то есть у большинства живых организмов молекулы ДНК; процесс их копирования хорошо нам знаком, он называется репликацией (см. главу 9). А теперь подумаем о том, что в ходе репликации любая цепочка ДНК собирается из большого количества — от тысяч до миллионов — отдельных плавающих в растворе мономеров-нуклеотидов, которые специальные ферменты должны сначала захватить, потом расположить в необходимом порядке, примерно как типографские литеры при наборе текста, потом сшить фосфатными мостиками, а потом еще придать получившейся молекуле строго определенную пространственную укладку. Нечего и говорить, что этот сложный процесс, без которого земная жизнь немыслима, требует огромных (по молекулярным меркам) затрат энергии. Откуда эта энергия берется? И откуда она бралась, когда жизнь только-только возникала?
На этот вопрос Лейн дает вот какой общий ответ. Пусть мы и не знаем точно, в какой именно природной системе появилась жизнь, но из общих соображений следует ожидать, что эта система была, выражаясь научным языком, термодинамически неравновесной. Это означает, что в ней наверняка существовал какой-нибудь устойчивый перепад или поток, к которому новорожденная жизнь могла бы, грубо говоря, “присосаться”. Древний океан, освещенный Солнцем, подходит на роль такой системы очень плохо. Во-первых, он слишком однороден. Во-вторых, ультрафиолетовое излучение, служащее в этих условиях главным поставщиком энергии (его кванты мощнее, чем кванты видимого света), разрушает примерно столько же химических связей, сколько создает. Использовать его как источник энергии для синтеза сложных молекул очень трудно. И таким образом, Мировой океан, постепенно превращающийся в полный питательной органики первичный бульон, — вещь малореальная.
А что, если жизнь возникла на границе двух растворов, резко отличавшихся друг от друга содержанием каких-то важных ионов? Это не только сразу решает вопрос об источнике энергии (любая разность концентраций ионов — готовый потенциал, который можно превратить в работу), но и объясняет, почему мембранные потенциалы настолько широко распространены: да потому, что именно на создающей их поверхности раздела жизнь когда-то и началась.
Есть, например, остроумная идея, что подходящие для этого условия вполне могли бы предоставить бьющие на океанском дне, на окраинах рифтовых зон, щелочные гидротермальные источники. Они в меру горячи (достаточно для ускорения большинства реакций, но не настолько, чтобы в них разрушались органические молекулы), отличаются высоким содержанием молекулярного водорода (H2) и, что для нас сейчас особенно важно, чрезвычайно низкой кислотностью. А важно это вот почему. Древняя атмосфера Земли, скорее всего, содержала колоссальную долю углекислого газа (тут очень показательно, что атмосферы двух других планет земного типа — Венеры и Марса — по сей день состоят преимущественно из углекислоты). Растворяясь в воде, углекислый газ (CO2) превращается в угольную кислоту (H2CO3), которая тут же диссоциирует, распадаясь на анионы и протоны. А это с неизбежностью означает, что океан древней Земли был очень кислым. И получается, что внутри геотермального источника среда была щелочная и восстановительная (там много ионов OH– и молекул H2), а снаружи от него в то же время — кислая и окислительная (там много ионов H+ и молекул CO2). Просто идеальные условия, чтобы использовать перепад концентрации протонов для получения энергии. Особенно если теплый источник и окружающая его океанская толща были чем-то разделены — ну, для начала хотя бы перегородкой или трубкой из отложенных водой пористых минералов (а это уж точно вполне реально, такие перегородки и трубки при источниках подобного типа образуются сами). Тогда сразу возникает система из двух компартментов с естественной протондвижущей силой между ними. Вот эту-то силу зарождающаяся жизнь и может “оседлать”.
Добавим, что направление протонного градиента во всех клетках, использующих его для получения энергии, именно таково, как предсказывается этой моделью. Снаружи протонов гораздо больше, чем внутри. Это относится и к бактериям, у которых синтез АТФ идет прямо на плазматической мембране клетки, и к потомкам бактерий — митохондриям, где синтез АТФ идет на внутренней мембране (вероятно, происходящей из плазматической мембраны бывшей бактерии). Во всех этих случаях энергетически выгодный поток протонов направлен снаружи внутрь.
На сегодняшний день существует подробно разработанная модель, описывающая возможные первые шаги возникновения жизни в горячих щелочных источниках. Главный энтузиаст этой модели — биохимик Уильям Мартин. Недавно при его участии было проведено исследование, на основании сравнений прочитанных геномов восстановившее несколько вероятных признаков общего предка всех живых клеток. Получилось там следующее. Общий предок бактерий, архей и эукариот, скорее всего, был анаэробом (жил в отсутствие кислорода) и термофилом (жил при довольно высокой по нынешним меркам температуре). По типу метаболизма он был или метаногеном (восстанавливающим углекислый газ до метана), или ацетогеном (восстанавливающим углекислый газ до уксусной кислоты). И наконец, у него не было протонных насосов, зато были протонные АТФ-синтазы. Последнее означает, что он не умел самостоятельно создавать трансмембранную разность концентраций протонов, зато умел использовать уже существующую разность для генерации энергии. И весь этот набор признаков отлично согласуется с идеей, что наш далекий предок жил на границе щелочного горячего источника.
Тут, однако, нужно притормозить, чтобы четко разделить статусы обсуждаемых утверждений. Например, широчайшая распространенность мембранных потенциалов у самых разных живых организмов — это просто факт. Первичность мембранного фосфорилирования по отношению к субстратному — гипотеза, хотя и довольно правдоподобная. А происхождение жизни в щелочных геотермальных источниках — это сценарий, основанный на целом наборе допущений и, к сожалению, по самой своей природе трудно поддающийся проверке. Как говорит сам же Уильям Мартин, даже если мы построим в лаборатории реактор, в который с одного конца подаются водород, углекислый газ и азот, а с другого конца выходят готовые бактерии, это будет доказательством того, что жизнь в принципе может возникнуть таким образом, но не того, что она действительно возникла именно так в реальной истории планеты Земля. Хотя и первое, конечно, тоже было бы очень интересно, тем более что попытки создать такой реактор уже предпринимаются.
Сделаем еще одно отступление. В 1952 году американский фантаст Рэймонд Джоунс опубликовал замечательный рассказ под названием “Уровень шума”, сюжет которого следующий. Некая чрезвычайно солидная государственная организация приглашает крупных физиков и сообщает им, что один молодой изобретатель недавно построил антигравитационную машину. К сожалению, при испытании машины изобретатель погиб, и никаких записей после него не осталось. Но то, что машина работала, — факт. Это подтверждается снятым во время испытаний фильмом и, главное, свидетельствами авторитетных ученых и военных, которые видели работу антигравитационного устройства своими глазами. Ставится задача воссоздать это достижение. Приглашенные физики сперва заходят в тупик, но убеждают себя: кто-то же это сделал, значит, и мы можем! — и в конце концов действительно создают антигравитационную машину, хотя совершенно не такую, как можно было бы ожидать, исходя из полученной в начале работы информации. После чего физикам объясняют, что вся эта информация была вымышленной: никакой антигравитационной машины на самом деле не было. Они создали ее первыми. Беда в том, что изначально все грамотные физики были убеждены в невозможности антигравитации и не стали бы по своей воле даже пытаться ее открыть. Трюк с правдоподобным сообщением о постройке вымышленной машины был специально придуман, чтобы снять этот мысленный фильтр. “Внутреннее решение относительно того, можно ли найти ответ на проблему, принимается обычно еще до начала поисков ответа”, — говорит руководивший этим проектом психолог.
В рассказе Джоунса есть и другие интересные мысли, не вошедшие в этот краткий пересказ. Но нам сейчас главное — отметить, что положение реальных современных биохимиков, исследующих происхождение жизни, на самом деле довольно похоже на положение описанных в рассказе физиков, пытающихся открыть антигравитацию. Правда, одно важное отличие все-таки есть. Биохимики-то уж совершенно точно знают, что возникновение живой материи из неживой по крайней мере один раз действительно произошло. Значит, это потенциально можно повторить. И не обязательно тем же способом, какой сработал на Земле четыре с лишним миллиарда лет назад. Здесь у науки появляются не только исследовательские, но и творческие возможности.
Гипотеза происхождения жизни в щелочных источниках порождает много неизбежных вопросов. Прежде всего: какая у общего предка всех живых организмов была мембрана? Очевидно, что обойтись без полноценной внешней мембраны (или ее аналога) этот предок не мог — иначе ему было бы не на чем поддерживать устойчивую разность концентраций протонов, от которой, согласно обсуждаемой теории, должен был зависеть весь его метаболизм. Между тем в разных эволюционных стволах, а именно у бактерий и у архей, состав клеточных мембран различается настолько серьезно, что между ними трудно представить переходное состояние (см. главу 5). Эволюционное превращение бактериальной мембраны в архейную (или наоборот) чисто биохимически выглядит маловероятным, гораздо проще допустить, что бактерии и археи “оделись” мембранами независимо друг от друга. Но как тогда их общий предок мог поддерживать протонный потенциал? Значит, какой-то аналог мембраны у него все-таки был? Но какой же?
В ранних работах Ника Лейна никаких убедительных ответов на эти вопросы нет, хотя автор там и подчеркивает, что прекрасно понимает саму проблему. Однако, поломав голову несколько лет, он с помощью своих коллег из Лондонского университетского колледжа нашел возможное объяснение. Шанс расставить все по своим местам появляется, если предположить, что “изобретением”, которое независимо совершили бактерии и археи, была не мембрана как таковая, а мембрана, непроницаемая для протонов. Ведь протон — это очень маленькая частица. Сделать мембрану непроницаемой для протонов трудно, и нет ничего удивительного, что в ходе эволюции этого удалось достичь не сразу. Между тем расчеты Лейна и его коллег показывают, что самые древние формы жизни могли обойтись и более простой мембраной, сквозь которую протоны “протекали”. Правда, при одном добавочном условии. В эту мембрану должен был быть встроен натрий-протонный антипортер — белок, обменивающий протоны на ионы натрия, то есть, иными словами, превращающий градиент протонов в градиент натрия или наоборот (∆μH ⇌ ∆μNa). Показано, что при прочих равных условиях проницаемость липидной мембраны для натрия на шесть порядков величины, то есть примерно в миллион раз, ниже, чем проницаемость той же самой мембраны для протонов. Поэтому, если достаточно быстро (чтобы протоны не успевали утечь) постоянно заменять градиент протонов градиентом натрия, этот последний можно будет уже спокойно использовать для мембранного фосфорилирования, то есть для перевода энергии запасенных ионов в энергию химических связей. Остроумное решение.
Если это решение еще и соответствует тому, что реально случилось в истории жизни на Земле, то получается, что мембрана общего предка всех современных живых клеток была какой-то очень простой (вполне вероятно, что даже неорганической). И только уже после того, как древо жизни разделилось на две крупные ветви, представители этих ветвей — бактерии и археи — независимо друг от друга “изобрели” чисто протонную мембранную энергетику. Для этого было необходимо создать мембрану, не пропускающую протоны. Бактерии и археи решили эту задачу примерно в одно и то же время, но несколько разными способами, в результате чего их мембраны стали отличаться.
Надо сказать, что эта новая гипотеза имеет как минимум одно вполне проверяемое следствие. Согласно ей, натрий-протонный антипортер должен быть не “новоделом”, а чрезвычайно древним белком, имевшимся уже у общего предка всех современных живых клеток. Это можно проверить методами биоинформатики, сравнивая последовательности соответствующих белков (и генов, которые их кодируют) у разных живых организмов. Данные на эту тему, имеющиеся сейчас, вроде бы не противоречат гипотезе Лейна, но это еще надо выверить и уточнить.
В целом у Лейна и его коллег получается, что система переработки энергии развивалась ступенчато. Первым важнейшим ключевым новшеством было случившееся в очень глубокой древности “изобретение” натрий-протонного антипортера, которое сразу позволило эффективно генерировать энергию на примитивной мембране. А вторым новшеством, причем “изобретенным” в двух эволюционных ветвях параллельно, стала мембрана, не пропускающая протоны. Это дополнительно увеличило эффективность систем переработки энергии, заодно сделав их более универсальными: например, в пресной воде удобнее пользоваться протонными АТФ-синтазами, чем натриевыми, а в морской —наоборот.
Возвращаясь к обсуждению гипотезы возникновения жизни в щелочных источниках, надо сказать, что в ней, при всем ее изяществе, есть несколько слабых мест.
Во-первых, предполагаемая этой гипотезой химическая среда с точки зрения современных взглядов на возникновение жизни не является идеальной. По Мартину, щелочная полость гидротермального источника соответствует цитоплазме готовой клетки, а слабокислая морская вода — внешней среде. Проблема в том, что РНК — судя по всему, ключевой для ранней жизни полимер — в щелочной среде неустойчива, а устойчива как раз в слабокислой. Это явное противоречие, и можно ли его снять, пока неизвестно.
Во-вторых, расчеты некоторых биофизиков приводят к выводу, что для работы ионной АТФ-синтазы любого типа нужен достаточно мощный мембранный потенциал, который можно поддерживать только на мембране, уже близкой по структуре к мембранам современных организмов. Это может означать, что мембранное фосфорилирование появилось в эволюции все-таки позже, чем субстратное . Как Лейн и его коллеги справятся с этим возражением, покажет время.
В-третьих, биохимики уже достаточно давно показали (в том числе и экспериментально), что конденсация органических молекул в сложные полимеры, потенциально способные стать основой живых клеток, гораздо легче происходит на фоне колебаний влажности, чем в стабильно-водных условиях. Это сильный довод против происхождения жизни в глубоководных горячих источниках, как по умолчанию предполагает гипотеза Мартина. Иное дело, что горячие источники могут быть и мелководными — или вообще находиться на суше. В последнее время появляются палеонтологические данные, достоверно показывающие, что во времена, когда жизнь (судя по всему) недавно возникла, древние бактерии жили в горячих источниках, располагавшихся именно на суше, в окрестностях наземных вулканов. Само по себе это не опровергает и не подтверждает ни одну из гипотез возникновения жизни, но заставляет серьезно задуматься.
В-четвертых, мы до сих пор исходили — невольно и неявно — из того, что древнейшая форма жизни была или счастливым обладателем мембранного фосфорилирования, или же бродильщиком. Третьего варианта на современной Земле нет. Но ведь интересующие нас события происходили в эпоху, очень далекую от современности. Многие процессы тогда могли идти по-другому. На современной Земле действует скулачевский первый закон биоэнергетики, согласно которому энергия из внешних источников не используется живыми организмами напрямую: они сначала обязательно должны “конвертировать” ее или в энергию связей АТФ, или в один из двух ионных потенциалов (протонный или натриевый). Но на древней Земле первый закон биоэнергетики мог и нарушаться. Первые живые организмы как раз вполне могли напрямую использовать в биохимических процессах небольшие порции энергии из внешней среды — например, в виде молекул пирофосфата или квантов света, запускающих самопроизвольное фосфорилирование органики (уже упоминавшийся эффект, который называется фотофосфорилированием). Есть и другие варианты. Древняя жизнь отнюдь не стояла перед выбором “или мембранное фосфорилирование — или брожение”, на самом деле у нее было гораздо больше возможностей.
В любом случае мы теперь понимаем, что история жизни на Земле — это история взаимодействия живых систем не только с информацией, но и с энергией. Проведя рискованную аналогию, можно сказать, что сводить все биологические явления к информационным процессам — все равно что сводить всю историю Европы к биографиям королевских особ. К тому же надо иметь в виду, что биоэнергетика — существенно более молодая наука, чем сосредоточенная на наследственной информации генетика. Например, свое нынешнее название биоэнергетика получила только в 1969 году (генетика — в 1905 году). И сейчас у биоэнергетики еще многое впереди.
Назад: 11. энергия
Дальше: 12. вирусы

