Книга: От атомов к древу. Введение в современную науку о жизни
Назад: 10. эукариотная клетка
Дальше: Источники углерода
11. энергия
Огонь — это нечто глубоко личное и универсальное. Он живет в сердце. Он живет в небесах. Он вырывается из глубин вещества наружу, как дар любви. Он прячется в недрах материи, тлея под спудом, как затаенная ненависть и жажда мести. Из всех явлений он один столь очевидно наделен свойством принимать противоположные значения — добра и зла.Гастон Башляр. Психоанализ огня
Из всех понятий, порожденных наукой, энергия упоминается в обыденной речи едва ли не чаще всего. Пожалуй, разве что про информацию современные люди говорят еще чаще (но в этой главе тема информации нас, для разнообразия, интересовать не будет). Слово “энергия” вызывает ассоциации со светом, теплом, электричеством, огнем, пищей, распадом атомных ядер, нефтью и природным газом, с ветром, полетом, потоками и взрывами, бурей и натиском и, наконец, просто с любым движением. Что же это такое?
Простое определение, в то же время не слишком далекое от истины, можно сформулировать вот как: энергия — это способность совершать работу, то есть осуществлять любое движение или превращение, требующее приложения силы. Ее можно хранить, накапливать, передавать или тратить с разной степенью полезности. В отличие, например, от света (кванты которого называются фотонами), энергия не связана ни с каким особым видом частиц. Но тем не менее она вполне измерима, то есть может быть точно выражена в числах. Общепринятой единицей энергии является джоуль. А ее оборот во Вселенной ограничивается законом сохранения энергии, он же первый закон термодинамики. Этот закон гласит, что энергия никогда не появляется и не исчезает. Она может сколько угодно переходить из одной формы в другую, но не может ни возникнуть из ничего, ни пропасть бесследно. Альберт Эйнштейн показал, что у любого тела, имеющего массу, есть определенная энергия покоя, которая при разрушении тела может высвободиться. Поэтому закон сохранения энергии иногда переименовывают в закон сохранения массы и энергии. Суть дела от этого не меняется.
Представление об энергии имеет очень древние истоки. О том, что за любыми процессами движения скрывается вездесущий невидимый огонь, говорили еще античные философы, например Гераклит Эфесский. Последний очень точно сформулировал идею энергии как универсального эквивалента движения: “На огонь обменивается все, и огонь — на все, как на золото — товары и на товары — золото”. Но охарактеризовать этот “огонь” как-то поточнее, а тем более соотнести его с какой-нибудь величиной, поддающейся измерению на практике, у исследователей долго не получалось.
В конце XVII века Готфрид Вильгельм Лейбниц ввел в физику понятие “живая сила” (vis viva), уже очень близкое к тому, что мы сейчас называем энергией. В современных терминах “живая сила” Лейбница — это не что иное, как кинетическая энергия, которой обладает любое движущееся тело просто в силу факта своего движения (в состоянии покоя она равна нулю). Но распространить это понятие на другие виды энергии Лейбницу не удалось, слишком уж мало было в его время про все это известно.
Между тем разновидностей энергии во Вселенной достаточно. Энергия бывает механическая, электромагнитная, ядерная, тепловая, химическая и так далее. К счастью, в этой главе нас будут интересовать исключительно те виды энергии, которыми могут пользоваться в своих интересах живые организмы. А их, как мы увидим, не так уж и много.
Две валюты
Любой живой клетке постоянно нужна энергия — примерно так же, как она нужна, например, холодильнику или всякому другому непрерывно работающему электроприбору (самая простая и понятная для современного человека аналогия). Эту энергию нужно, во-первых, откуда-то получать, во-вторых, где-то хранить и, в-третьих, иметь налаженную технологию ее использования. Надо сразу отметить, что последний пункт тут не менее важен, чем первые два. От энергии, которую невозможно высвободить, нет никакого проку. А с другой стороны, если слишком много энергии высвободится беспорядочно, то она скорее разрушит все вокруг, чем принесет какую-нибудь пользу.
Итак, начнем с пункта первого. Откуда энергию можно взять? Большинство природных видов энергии по тем или иным причинам не подходят для того, чтобы живые организмы — не считая, конечно, человека — использовали их как внешние ресурсы. Например, это относится к тепловой и ядерной энергии. Чтобы полезным источником энергии служила теплота, нужен очень большой перепад температур, который в живых организмах (в отличие от искусственных тепловых машин) практически невозможен. А чтобы таким источником служили ядерные реакции, нужны очень изощренные и опасные механизмы их проведения, которых ни у кого, кроме человека, просто нет. (В прекрасном рассказе Айзека Азимова “Паштет из гусиной печенки” фигурирует гусыня, в буквальном смысле несущая золотые яйца, и ученые приходят к выводу, что в ее организме есть ферменты, катализирующие ядерные реакции. К сожалению, такое пока бывает только в научной фантастике.) В общем, на практике земные живые существа могут утилизировать энергию всего лишь двух видов: энергию электромагнитных волн (как правило, световую) и химическую энергию. Световая энергия идет от Солнца, а химическая выделяется при перестройках молекул во время химических реакций.
Способы утилизации энергии света, довольно разнообразные по своей биохимической природе, объединяются под общим названием “фотосинтез”. Способы утилизации химической энергии еще разнообразнее, один из них — это знакомое нам по собственному опыту дыхание. Но в любом случае каждый живой организм так или иначе получает свою энергию. А что он делает с ней дальше? Ясно, что использует, но как?
Тут возникает вот какая проблема. Дело в том, что энергоемких биологических процессов — великое множество. Даже в самой простой бактериальной клетке одновременно идет несколько десятков таких процессов, причем совершенно разных по своей природе. Все они, естественно, требуют обеспечения энергией, которая именно для этого и усваивается организмом. Но очевидно, что при таком разнообразии конечных потребителей энергия, откуда бы она ни поступала, должна храниться в клетках в какой-то универсальной форме. Тогда она будет “свободно конвертируемой” и сможет пригодиться для чего угодно.
Долгое время биологи думали, что есть только одна — абсолютно универсальная — разновидность такой “свободно конвертируемой энергетической валюты”. Это молекулы аденозинтрифосфата, сокращенно АТФ (см. главу 7 и рис. 11.1). При распаде этих молекул выделяется энергия, которую очень удобно использовать в других химических реакциях. Действительно, значение АТФ для жизни на Земле колоссально. Но на самом деле есть не одна универсальная “энергетическая валюта”, а как минимум две. Первая — это АТФ (и некоторые аналогичные ему молекулы), а вот вторая вовсе не имеет химической природы — по крайней мере в энергии химических связей там ничего не запасается. Второй тип “энергетической валюты” — это ионные потенциалы на мембранах. Что это такое, мы узнаем чуть ниже. Сначала разберемся с уже более-менее знакомым нам АТФ, а потом — с ионными потенциалами.
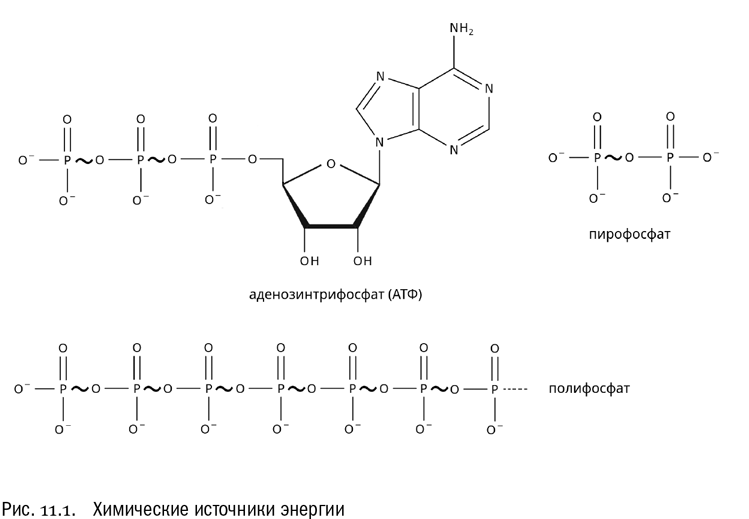
АТФ и полифосфат
Мы уже знаем, что молекула АТФ состоит из пяти частей (см. главу 7):
* аденин;* рибоза;* фосфатные группы (три штуки).
Энергия, пригодная для использования в живых клетках, выделяется при разрыве связей между фосфатными группами. Обратим внимание, что фосфатных групп в АТФ три, а вот связей между ними две. Если забыть про все подробности, структуру молекулы АТФ можно записать так: А–Р–Ф~Ф~Ф. Здесь А — аденин, Р — рибоза, Ф — фосфат, а волнистыми линиями по принятой традиции обозначены те самые связи, которые соединяют фосфаты между собой. Как мы уже знаем, эти связи называются макроэргическими. Именно разрыв макроэргической связи служит источником энергии, когда молекула АТФ используется по назначению. “Макроэргические” — буквально значит высокоэнергетические. На языке обычной химии связь данного типа, возникающая между двумя фосфатами с отщеплением воды, называется фосфоангидридной. На самом деле бывают и другие типы макроэргических связей, фосфоангидридная просто самая распространенная из них.
Теперь обратим внимание еще вот на что. Источником энергии в АТФ служат фосфоангидридные связи между фосфатами, и только они. К чему эти фосфаты прикреплены — не так уж важно (по крайней мере, с точки зрения получаемой энергии). Их носителем может быть рибоза в комплекте с аденином, а может быть и что-то другое. И действительно, существуют биохимические реакции, в которых источником энергии вместо АТФ (аденозинтрифосфата) служит ГТФ (гуанозинтрифосфат) или даже УТФ (уридинтрифосфат). Энергетический выход от них примерно такой же. Например, ГТФ используется как “топливо” при синтезе белка и при сборке микротрубочек, а УТФ — при создании бактериальной клеточной стенки.
А не может ли послужить источником энергии просто цепочка фосфатных групп? Оказывается, может. Без органического носителя тут вполне удается обойтись. Биохимики уже давно обнаружили, что в живых клетках довольно часто накапливается полифосфат — полимер, состоящий из множества фосфатов, соединенных друг с другом теми самыми фосфоангидридными связями. В молекуле полифосфата может быть до тысячи фосфатных остатков. Первое время биохимики думали, что это просто запасы фосфорной кислоты, и ничего больше. Возможно, у большинства организмов так и есть. Но еще в середине XX века польский биохимик Мариан Шимона обнаружил, что существуют бактерии, у которых полифосфат участвует в обмене углеводов точно так же, как АТФ. Значит, эти соединения в принципе взаимозаменяемы.
Реакцией, которую подробно изучил Шимона, было фосфорилирование глюкозы (см. главы 6 и 7). Именно с этой реакции обычно начинается усвоение глюкозы в энергетическом обмене. К молекуле глюкозы “пришивается” фосфат, и получается соединение, которое называется глюкозо-6-фосфат (цифра во всех подобных названиях относится к номеру углеродного атома в сахаре). У подавляющего большинства живых организмов источником фосфата для этой реакции всегда служит АТФ. Полифосфат используется вместо АТФ только у некоторых бактерий.
Что же это за бактерии? Заинтересовавшись этим вопросом, ученые из Института биохимии и физиологии микроорганизмов в городе Пущино провели серию сравнительных исследований (“мозгом” и руководителем этой группы был профессор Игорь Степанович Кулаев). Оказалось, что полифосфат используется вместо АТФ всего у нескольких близких друг к другу групп бактерий. Это пропионовые бактерии, микрококки, тетракокки, микобактерии и еще некоторые. Все они грамположительные, и все входят в одну достаточно компактную эволюционную ветвь, которая в современной систематике называется актинобактериями. Молекулярно-биологические данные подтверждают, что эта ветвь находится не слишком далеко от общего корня эволюционного древа клеточных организмов.
Это позволило Кулаеву высказать следующую гипотезу. Фосфорилирование глюкозы с помощью полифосфатов — это “ископаемая” биохимическая реакция, которая, возможно, была свойственна очень древним формам жизни. Актинобактерии — единственная эволюционная ветвь, где она до сих пор сохранилась. А вот все остальные живые существа вместо полифосфата стали использовать АТФ.
Отсюда один шаг до предположения, что полифосфаты вообще были главными макроэргическими соединениями на заре жизни. В конце концов, они гораздо более распространены в обычной неживой природе, чем АТФ, который синтезируется практически только живыми организмами. И ведь должен же был энергетический обмен с чего-то начаться! Кулаев считал, что начаться он мог именно с полифосфатов, а уже потом переключиться на АТФ, оборот которого значительно легче регулировать.
Есть и еще одна молекула, служащая у некоторых бактерий источником энергии. Это пирофосфат, или пирофосфорная кислота (H4P2O7). Ее молекула — это два фосфата, соединенных уже хорошо знакомой нам фосфоангидридной связью. Естественно, при разрыве этой связи выделяется энергия. Известный биохимик Фриц Липман — тот самый, с именем которого связаны понятия “макроэргическая связь” и “макроэргическое соединение”, — еще в 1960-х годах говорил, что первичным для земной жизни источником энергии, вероятно, был именно пирофосфат. Потом его заменили полифосфаты, которых на древней Земле наверняка было много. И только после этого на смену полифосфатам пришел АТФ. Одним словом, Липман считал, что главные энергоносители жизни замещали друг друга в такой последовательности:
пирофосфат → полифосфат → АТФ
Надо учитывать, что пирофосфат — это ведь, по сути, просто маленький обрывок полифосфата. А полифосфатов на древней Земле, по всем данным, хватало. Геологи говорят, что в них легко конденсировались летучие соединения фосфора, содержавшиеся в вулканических газах, — а вулканическая активность в те времена, когда возникала жизнь, была очень высока. Так что в качестве внешнего источника фосфатных групп полифосфаты наверняка пригодились первым живым существам. Вот в какой мере они служили энергетическими посредниками во внутреннем обмене — тут еще надо разбираться. Но, во всяком случае, невероятными гипотезы Кулаева и Липмана не выглядят.
АТФ и прочие молекулы
Итак, в ходе биологической эволюции цепочка фосфатных групп с высокоэнергетическими связями была посажена на органический носитель. И этим носителем оказалась рибоза с присоединенным к ней аденином. В результате получился АТФ, который и стал самым универсальным энергоносителем во всей живой природе. Естественно задать вопрос: чем же эта молекула так хороша?
Признаемся честно, на данный момент мы вряд ли сможем обосновать дедуктивным методом (то есть идя от общего к частному) утверждение, что АТФ в этой роли лучше любой другой молекулы. В конце концов, это может оказаться просто неверно. В состоявшемся выборе могла сыграть роль и обыкновенная случайность. Но перечислить несколько — если так можно выразиться — параметров оптимизации, по которым АТФ в этой роли лучше некоторых других молекул, вполне можно уже прямо сейчас.
Прежде всего, АТФ — это молекула, далеко не чуждая клетке и сама по себе, то есть независимо от своей энергетической функции. Она служит одним из четырех “кирпичиков”, из которых в обязательном порядке собирается любая РНК. А РНК — это, судя по всему, основа основ древней жизни (см. главу 8). Тогда, однако, сразу возникает следующий вопрос: почему в качестве главного энергоносителя была выбрана именно молекула АТФ, а не ГТФ, ЦТФ или УТФ? Ведь для синтеза РНК они имеют точно такое же значение.
Одна из причин может быть в том, что аденин — единственное из широко распространенных азотистых оснований, в котором нет атомов кислорода. Можно поэтому предположить, что на древней Земле, где свободного кислорода в атмосфере практически не было, аденин самопроизвольно синтезировался особенно легко (см. главу 7). Но есть и другой фактор. Широко известно, что в современной атмосфере Земли есть озоновый слой, который отражает ультрафиолетовую составляющую солнечных лучей. Озон — это молекула, состоящая из трех атомов кислорода (O3), и образуется он из обычного молекулярного кислорода (O2). Но в эпоху, когда жизнь на Земле только возникла, кислорода в атмосфере не было. И озона, соответственно, тоже. Ультрафиолетовые лучи свободно достигали поверхности Земли. Так вот, показано, что аденин в силу структуры своей молекулы прекрасно эти лучи улавливает. А если квант ультрафиолетового излучения будет “пойман” молекулой АДФ, то она с заметной вероятностью может спонтанно присоединить еще один фосфат и превратиться в АТФ. Это явление называется фотофосфорилированием. То, что так бывает, проверено экспериментально, и попутно показано, что нуклеотиды, содержащие другие азотистые основания, этим свойством не обладают. Получается, что именно особенности взаимодействия с ультрафиолетовыми лучами могли создать на заре жизни небольшой избыток АТФ и в результате, так сказать, дать этому веществу “преимущество на старте”, которое и сделало главным источником энергии именно его, а не какую-нибудь другую аналогичную молекулу.
Чисто энергетические характеристики АТФ тоже по-своему интересны. Но чтобы их понять, надо предварительно сказать несколько слов о том, от чего зависят направления химических реакций.
Начнем с того, что любая материальная система обладает некоторой внутренней энергией. И эта внутренняя энергия может уменьшаться, а может прирастать. При этом известно, что в природе есть два способа передачи энергии: работа (упорядоченное движение любого рода) и теплота (хаотичное движение отдельных частиц). Часть внутренней энергии системы, которую можно превратить в работу, называется свободной энергией. Любой процесс, и в том числе химическая реакция, может идти самопроизвольно только в том случае, если суммарная свободная энергия системы в результате уменьшается. Это следует из второго закона термодинамики, вникать в который мы сейчас не будем, но который, безусловно, является одним из фундаментальных законов природы.
Свободную энергию системы можно вычислять разными способами. В химии, в том числе и биологической, чаще всего используют свободную энергию Гиббса, которая рассчитывается для условий с постоянной температурой и давлением. Ее принято обозначать буквой G. Химическая реакция может протекать самопроизвольно, если энергия Гиббса в результате уменьшается, и не может, если она увеличивается. В естественных науках принято обозначать изменение какого-либо параметра греческой буквой Δ (“дельта”). Итак, любая химическая реакция может самопроизвольно пойти, если ΔG<0, и не может, если ΔG>0. Повторим, что ΔG — это происходящее в результате данной реакции изменение свободной энергии Гиббса той системы, где реакция идет.
Надо учитывать, что свободная энергия всегда рассчитывается для строго определенного количества вещества и для строго определенных условий, принятых за стандартные. Единица ее измерения — килоджоуль на моль (кДж/моль). Килоджоуль — это единица энергии (1 килоджоуль = 1000 джоулей), а моль — это принятая в химии единица количества вещества, характеризующая число молекул или любых других частиц просто в штуках. Без остальных подробностей мы сейчас можем обойтись.
Как же это работает? Возьмем для примера какую-нибудь химическую реакцию, прекрасно идущую самопроизвольно, например реакцию водорода (H2) с кислородом (O2). Если эти газы смешать и нагреть, произойдет весьма впечатляющий взрыв, в результате которого водород с кислородом соединятся, образовав воду (H2O). Вот уравнение этой реакции:
H2 + ½O2 → H2O
Коэффициент ½ перед кислородом тут означает, что для образования любого данного количества воды нужно вдвое меньше молекул кислорода, чем молекул водорода. Ну а изменение энергии Гиббса для этой реакции будет следующим:
ΔG = –237,6 кДж/моль
Поскольку это намного меньше нуля, то самопроизвольное протекание реакции вполне возможно, что, собственно, и будет наблюдать каждый, кто умудрится поджечь водород. Между прочим, именно из-за большого отрицательного изменения энергии Гиббса в этой реакции происходили все пожары и взрывы водородных дирижаблей, в том числе знаменитая катастрофа германского дирижабля “Гинденбург”, погибшего над Северной Америкой в 1937 году. Если уж летать на дирижаблях, то гораздо лучше наполнять их гелием, который с кислородом не реагирует. “Гинденбург” погиб потому, что немцам в 1930-х годах добыча промышленных количеств гелия была недоступна: на Земле, в отличие от космического пространства, это очень редкий газ.
Ну а теперь вернемся к АТФ. Вернее, не только к нему. Дело в том, что кроме полифосфатов и нуклеозидтрифосфатов (АТФ, ГТФ, УТФ, ЦТФ...) в биохимии встречается и много других молекул, содержащих фосфатные группы. Как правило, фосфат может отрываться от такой молекулы с участием воды, то есть путем гидролиза (разрыв фосфоангидридной связи в АТФ — это и есть типичный пример гидролиза). И эта реакция сопровождается снижением свободной энергии, а значит, может идти самопроизвольно. Но точная величина ΔG тут будет для каждого соединения своя.
Рассмотрим еще две молекулы, содержащие фосфат, но совсем не родственные АТФ по структуре. Первая из них — фосфоенолпируват, трехуглеродная молекула с карбоксильной группой и двойной связью (производное пировиноградной кислоты). Вторая — глицерофосфат, трехуглеродная молекула с двумя гидроксильными группами и без двойных связей (производное спирта глицерина). Обе эти молекулы могут отдавать фосфат путем гидролиза, точно так же, как и АТФ. Вот упрощенные уравнения этих реакций:
АТФ + H2O → АДФ + фосфат
глицерофосфат + H2O → глицерин + фосфат
фосфоенолпируват + H2O → пируват + фосфат
Во всех этих реакциях происходит один и тот же процесс, а именно отрыв фосфата. Изменение свободной энергии, однако, в этих трех случаях будет совершенно разным. Давайте посмотрим на цифры.
Для гидролиза глицерофосфата ΔG = –9,2 кДж/моль.
Для гидролиза АТФ ΔG = –31,8 кДж/моль.
И наконец, для гидролиза фосфоенолпирувата ΔG = –58,2 кДж/моль.
Что мы тут видим? Во-первых, все три значения меньше нуля, то есть реакции, бесспорно, самопроизвольные. Во-вторых (это тоже важно), можно заметить, что все три значения по численной величине намного меньше, чем ΔG реакции сгорания водорода (см. выше), которую можно назвать более-менее типичной для “обычной” неорганической химии. Отсюда мы видим, что перепады энергии в биохимических реакциях на самом-то деле обычно не так уж и велики. Потому что слишком большие могли бы стать разрушительными.
И главное: из приведенных цифр хорошо видно, что АТФ далеко не самое высокоэнергетическое соединение из тех, что доступны обычной земной биохимии. Например, от распада фосфоенолпирувата энергетический выход гораздо больше. Видимо, от вещества-энергоносителя вовсе не требуется, чтобы порция энергии, которую несет его молекула, была огромной. Гораздо важнее, чтобы эта порция подходила для как можно большего числа процессов-потребителей и могла быть ими сразу усвоена (тогда никакая часть энергии не будет пропадать зря). Вот этому условию АТФ, надо думать, и отвечает. Как и во многих других случаях, тут выбрано не максимальное, а оптимальное значение ключевого параметра.
Протоны и энергия
Представим себе два водных объема, разделенных мембраной. Это вполне может быть обычная липидная мембрана, изолирующая от внешней среды живую клетку или любой компартмент внутри нее (см. главы 5, 10). Нам сейчас абсолютно неважно, что по какую сторону, важно только, что мембрана отделяет друг от друга два заполненных водой “отсека”.
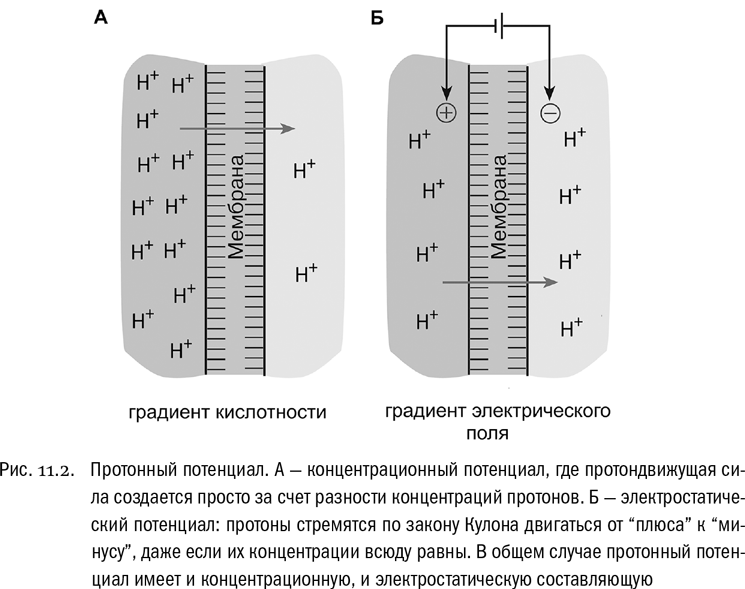
Теперь представим, что в один из “отсеков” добавили кислоту. Кислота — это любая молекула, которая в водном растворе распадается с выделением иона водорода H+, то есть, иначе говоря, протона (см. главу 1). В результате по одну сторону мембраны станет намного больше ионов H+, чем по другую (см. рис. 11.2А). Клеточная мембрана практически непроницаема для ионов H+, если только в ней нет специальных каналов для них. Итак, по разные стороны мембраны возникнет устойчивая разность концентраций ионов H+.
Между тем известно, что при отсутствии препятствий концентрация любого вещества в любом объеме всегда стремится выравняться. Этот процесс выравнивания называется диффузией. Диффузия всегда идет самопроизвольно: любое вещество как бы само собой стремится занять весь отведенный ему объем. Это относится и к газу, который перемешали с другим газом, и к сахару, растворенному в чашке чая, и к кислоте, которая попала в воду.
Но в нашем случае на пути диффузии стоит преграда. По одну сторону мембраны концентрация ионов H+ намного выше, чем по другую, и при этом пройти сквозь мембрану они не могут. Точнее, они бы еще как прошли, если бы их пропустили! И в результате существующая разность концентраций протонов обращается в запас потенциальной энергии, которую, в свою очередь, вполне можно превратить в работу.
Сделать это очень просто. Нужно создать в мембране каналы, через которые протоны смогут свободно проходить. Тогда они тут же сами собой потекут с той стороны мембраны, где их больше, на ту, где их меньше. И вот энергию этого движения протонов вполне можно будет использовать для работы — для любой работы, в том числе и для синтеза АТФ. Для этого понадобится “всего лишь” ухитриться совместить протонный канал с молекулярным аналогом старинной водяной мельницы, которая будет крутиться под напором протонов, переводя их энергию в какую-нибудь другую, более полезную форму. Сама мембрана в этом случае играет роль плотины, с которой водяная мельница связана. А разность концентраций протонов аналогична разности уровня воды выше и ниже этой плотины.
Внимание: мы только что познакомились с принципом работы реально существующего и очень важного белка, который называется протонная АТФ-синтаза (см. рис. 11.3). Это огромный белок со сложнейшей четвертичной структурой, то есть собранный из целого набора отдельных субъединиц. Строго говоря, это даже целый комплекс белков, работающих как единое целое. Этакая “супермолекула”. Единым белком ее называют только ради простоты. На электронной микрофотографии протонная АТФ-синтаза выглядит как грибовидная структура, вставленная в мембрану. Активный центр, синтезирующий АТФ, находится в “шляпке гриба” (она всегда обращена на ту сторону мембраны, где протонов меньше). А в “ножке гриба” проходит протонный канал, пропускающий протоны с одной стороны мембраны на другую.
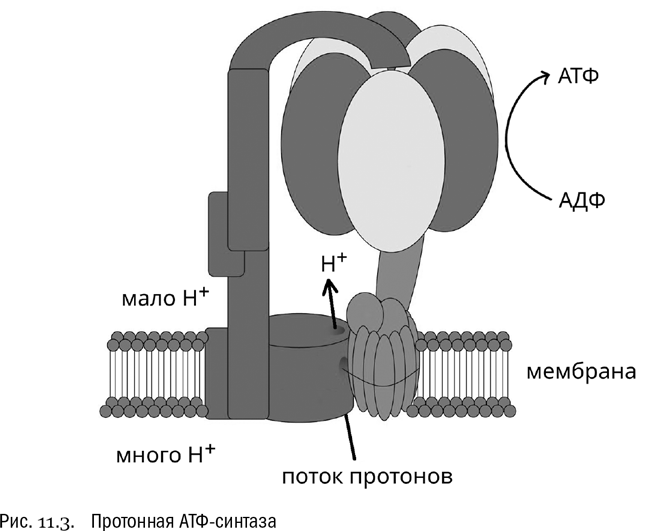
Как и многие другие белки, молекула АТФ-синтазы представляет собой полноценную механическую машину, вполне сравнимую по сложности с настоящей мельницей или, скажем, с каким-нибудь револьвером (если отвлечься от тонких деталей субатомного уровня). Активных центров, которые синтезируют АТФ, в типичной протонной АТФ-синтазе на самом деле три. Все они расположены в “шляпке”. Под действием протонов, текущих сквозь находящийся в “ножке” канал, “шляпка” вращается, как барабан трехзарядного револьвера, и в ней происходят конформационные изменения активных центров, превращающие АДФ в АТФ. Причем “спусковым крючком”, запускающим это вращение, служит протонирование карбоксильной группы в боковой цепи определенного остатка аминокислоты аспартата — тем самым отрицательный заряд этой аминокислоты меняется на нулевой (см. главу 3). На всякий случай вспомним, что протонирование — это переход карбоксильной группы из формы –COO– в форму –COOH, происходящий, если в окружающем растворе много протонов (H+). Уж где-где, а в открытом протонном канале, по которому протоны сами текут, это условие выполняется.
Протонная АТФ-синтаза — великолепный образец того, что биофизики называют молекулярными машинами. Фактически молекула протонной АТФ-синтазы представляет собой самый настоящий электродвигатель с роторным механизмом. Это один из высших примеров сложности, которой могут достигать белковые молекулы. В 1997 году два биохимика, англичанин Джон Уокер и американец Пол Бойер, получили за открытие роторного механизма АТФ-синтазы Нобелевскую премию по химии. Одна известная обзорная статья на эту тему прямо так и называется: “АТФ-синтаза — чудесный роторный двигатель клетки”.
А теперь следует сказать вот что. Есть огромное количество живых организмов, у которых основным источником АТФ является именно работа протонных АТФ-синтаз (по крайней мере, с большим отрывом от любых других поставляющих энергию процессов). В частности, именно протонные АТФ-синтазы создают большую часть тех нескольких десятков килограммов АТФ, которые ежесуточно синтезируются в организме человека (см. главу 7). Это уже достаточная причина, чтобы присмотреться к роли протонных АТФ-синтаз повнимательнее.
Великая протонная альтернатива
Все началось в 1929 году, когда немецкий биохимик Карл Ломан открыл АТФ. Сначала ему удалось выделить из тканевых экстрактов некое доселе неизвестное бесцветное вещество, содержащее азот и фосфор и явно принимающее участие в энергетическом обмене. Потом Ломан показал, что гидролиз этого вещества (то есть его распад с участием воды) дает две части фосфорной кислоты, одну часть аденина и одну часть рибозо-5-фосфата. Мысленно собрав все эти части вместе, как элементы конструктора, Ломан в итоге совершенно правильно установил структуру исходной молекулы, которая и оказалась аденозинтрифосфатом.
После этого стали очень быстро накапливаться разнообразные данные, показывающие, что АТФ служит в живых организмах универсальным резервуаром химической энергии. Стало ясно, что он активно участвует и в дыхании, и в мышечном сокращении, и во многих других жизненно важных процессах. Вывод, что АТФ является всеобщей “энергетической валютой”, был сделан биохимиками уже к началу 1940-х годов. Именно тогда Фриц Липман (кстати, работавший некоторое время в одной лаборатории с Карлом Ломаном) предложил уже знакомое нам понятие макроэргической связи, подразумевая, конечно, в первую очередь связи между фосфатами в АТФ.
Следующий важный вопрос возник при изучении дыхания, то есть производимого живыми организмами окисления глюкозы до углекислого газа и воды. В результате дыхания синтезируется очень много АТФ — это было ясно. Проблема была в том, что ученым никак не удавалось найти химическую реакцию, непосредственно “привязывающую” окончательный распад глюкозы к синтезу АТФ из АДФ и фосфата. В конце концов им пришлось предположить, что между этими этапами дыхания есть какой-то добавочный макроэргический посредник: энергия, высвобожденная в результате распада глюкозы, сначала передается на этот посредник, а потом уже с него на АТФ. Но и молекулу-посредник найти тоже никак не удавалось. Как раз наоборот, чем тщательнее биохимики исследовали процесс дыхания, тем более неуловимым этот загадочный посредник начинал выглядеть.
Проблему решил английский биохимик Питер Митчелл. Он сначала предположил, а потом и сумел строго доказать, что никакой молекулы-посредника вообще не существует. Хотя промежуточное энергетическое звено действительно есть. Но это не молекула (какая бы то ни было), а всего лишь разность концентраций протонов по разные стороны мембраны. Именно разность концентраций протонов создает так называемую протондвижущую силу, действие которой, в свою очередь, приводит к синтезу АТФ. Получается, что в живых организмах есть еще один — альтернативный — резервуар энергии, не имеющий ни с какими макроэргическими связями ничего общего. Неудивительно, что, когда открытие Митчелла подтвердилось, он получил за него Нобелевскую премию — правда, почему-то по химии (в 1978 году). Кстати, это один из немногих примеров, когда Нобелевская премия за экспериментальное исследование получена в одиночку. Митчелл был очень самостоятельным гением. В науке XX века такие фигуры редки, но Митчелл был именно таков.
Ну а теперь подведем итог тому, что мы уже знаем, с помощью строгих определений. Потенциальная энергия ионов H+, скопившихся по одну сторону непроницаемой для них мембраны, называется протонным потенциалом. (Уточним, что потенциальной энергией мы называем — если можно так выразиться — запас способности произвести работу, связанный с расположением неких объектов в пространстве относительно друг друга. Потенциальная энергия может превратиться в работу, если эти объекты получат возможность переместиться. С точки зрения такой почтенной науки, как физика, это пояснение довольно-таки неуклюже, но нам здесь его хватит.) В общем случае величина протонного потенциала зависит, во-первых, от концентрации самих протонов и, во-вторых, от того, как по разные стороны мембраны распределены электрические заряды (созданные самими протонами или любыми другими частицами независимо от них). Мы ведь помним, что протоны заряжены положительно, поэтому при прочих равных условиях они будут сильнее стремиться туда, где преобладает отрицательный заряд. По этому поводу ученые говорят, что протонный потенциал имеет две составляющие — концентрационную и электростатическую (см. рис. 11.2А, Б).
Разность протонных потенциалов между двумя мембранными отсеками обозначается ∆μH (“дельта-мю-аш”). Здесь ∆ — символ разности, H означает водород, а буквой μ принято обозначать величину, которая называется химическим потенциалом и является, по сути, химической разновидностью потенциальной энергии. Протонный потенциал — это очень простой частный случай химического потенциала. В реальных задачах всегда, без исключений, обсуждается только разность протонных потенциалов между некоторыми двумя точками или отсеками (например, между наружной и внутренней сторонами клеточной мембраны). Поэтому протонный потенциал и ∆μH — это фактически одно и то же, слово “разность” тут сплошь и рядом опускают.
Итак, мы теперь знаем, что в клетке есть по меньшей мере две совершенно разные “энергетические валюты” — концентрация АТФ и протонный потенциал, — которые могут достаточно свободно “конвертироваться” друг в друга:
∆μH ⇌ АТФ
Задачей уже знакомой нам протонной АТФ-синтазы является (в этих терминах) не что иное, как “конвертирование” энергии протонного потенциала в энергию связей АТФ. Впрочем, обратная операция тоже вполне возможна. Белок, способный с затратой АТФ переносить протоны через мембрану против разности потенциалов (то есть туда, где их и так больше), называется протонной АТФазой, или протонным насосом. Очевидно, что протонный насос, наоборот, превращает энергию связей АТФ в энергию протонного потенциала. Бывают ситуации, когда это нужно.
Третий резерв
Есть еще и третья разновидность широко распространенной “энергетической валюты”. Это натриевый потенциал, устроенный точно так же, как протонный.
Натрий — это металл. Он обозначается химическим символом Na, а в водном растворе образует положительно заряженные ионы Na+. Наиболее широко известное соединение натрия — поваренная соль NaCl, кристаллы которой состоят из положительно заряженных ионов натрия (Na+) и отрицательно заряженных ионов хлора (Cl–).
Ионы натрия, как и протоны, практически не проходят через клеточную мембрану. (Оговорка насчет “практически” тут добавлена не просто так. Она означает, что подтекать сквозь мембрану ионы на самом деле все-таки могут, но по сравнению с типичными скоростями внутриклеточных процессов это происходит настолько медленно, что в большинстве случаев может вовсе не учитываться. С протонами ситуация точно такая же. В нужном нам сейчас приближении клеточная мембрана практически непроницаема как для натрия, так и для протонов.) Поэтому, если по одну сторону мембраны скопилось много ионов натрия, а по другую сторону их нет (или мало), разность концентраций надолго останется устойчивой. И в результате возникнет натриевый потенциал ∆μNa. Как и протонный потенциал, он включает в себя не только концентрационную составляющую, но и электростатическую. Это означает, что, если концентрации окажутся одинаковыми, натрий, дай ему волю, будет течь туда, где электрический заряд отрицательный, а не положительный, в полном соответствии с законом Кулона (см. главу 1).
Энергию натриевого потенциала можно перевести в энергию связей АТФ, если дать натрию протечь через специально предназначенные для него каналы. Роль биохимической “водяной мельницы” при этом исполнит белок, родственный протонной АТФ-синтазе, — натриевая АТФ-синтаза. Можно и создать натриевый потенциал с нуля, если, наоборот, потратить энергию АТФ на перекачку натрия. Для этого служат натриевые насосы. В общем, тут, как и в случае с протонным потенциалом, возможно “конвертирование” энергии в обе стороны:
∆μNa ⇌ АТФ
Можно утверждать, что протонный и натриевый потенциалы взаимозаменяемы — по крайней мере, у микроорганизмов. Служить источником энергии может и тот и другой. В клетках эта энергия извлекается одинаковыми способами, хотя оба варианта имеют свои мелкие достоинства и недостатки. В целом натриевая энергетика служит полноценной альтернативой по отношению к протонной. В условиях, которые распространены на Земле сейчас, протонный потенциал, как правило, производительнее, поэтому у современных бактерий и архей он используется гораздо чаще. Но бывают и ситуации, когда натриевая энергетика становится выгоднее протонной. Это происходит или при очень низкой кислотности (иными словами, в щелочном растворе), или при очень высокой, по меркам живых организмов, температуре, например около 60 °С. В щелочном растворе протонов просто слишком мало. А при высокой температуре клеточные мембраны начинают пропускать протоны, в то время как натрий они все еще “держат”. В этих случаях может дойти и до полного отказа от протонного потенциала в пользу натриевого.
Современных микробов с чисто натриевой мембранной энергетикой относительно немного. Большинство из них приспособлены или к щелочной среде (алкалофилы), или к жизни в горячей воде (гипертермофилы). Но не все. Исследования последних десятилетий показали, что натриевая энергетика распространена у микробов гораздо шире, чем думали раньше. Возможно, это связано с тем, что данный тип обмена эволюционно очень древний. Более того, есть основанная на сравнительном исследовании разных АТФ-синтаз гипотеза, что натриевая энергетика древнее протонной. Это означает, что когда в глубине веков первый микроб “научился” синтезировать АТФ, пропуская сквозь мембрану ионы, то это были именно ионы натрия. Аналогичный механизм, использующий протоны, возник позже. Если эти выводы подтвердятся, они, в свою очередь, могут подсказать нам много интересного о самых ранних этапах биологической эволюции и о среде, в которой возникла жизнь. Чуть ниже мы об этом еще поговорим.
Натриевые и протонные потенциалы важны для многих областей биологии, вплоть до физиологии человека и животных. У животных (в том числе, разумеется, и у человека) внешняя клеточная мембрана относительно плохо “держит” протоны, поэтому протонный потенциал на ней не используется в качестве источника энергии. А вот натриевый — используется. Правда, там это реализуется не путем синтеза АТФ, а некоторыми другими способами, с которыми мы тоже сейчас познакомимся.
Мембраны и транспорт
Хорошо известно, что одной из главных задач, постоянно решаемых любым живым организмом, является поддержание так называемой внутренней среды (которая противопоставляется внешней, или окружающей, среде и в идеале никогда не должна с ней смешиваться). Это относится и к отдельной клетке. Внутриклеточная жидкость и внеклеточная среда отличаются друг от друга содержанием практически всех молекул, включая самые простые. Например, цитоплазма абсолютного большинства живых клеток содержит гораздо больше ионов калия (K+), чем ионов натрия (Na+), хотя и в пресной, и в морской воде соотношение обратное: там солей натрия больше, чем солей калия. А уж по части более сложных молекул различия между клеткой и внешней средой еще сильнее. Как же эти различия создаются?
Ответ нам известен. Границей между любой живой клеткой и окружающей средой служит мембрана (в данном случае — внешняя, или плазматическая). Она всегда замкнутая. Внешняя мембрана есть даже у некоторых вирусов, а уж клетка без нее немыслима вовсе. В 1940-е некоторые биологи считали, что клетка — это безмембранный компартмент, поддерживающий свою структуру за счет физических свойств полужидкой цитоплазмы, а вовсе не благодаря мембране, существование которой эти ученые отрицали. Споры на эту тему закончились, когда мембрану удалось воочию увидеть под электронным микроскопом. С тех пор никто не сомневается, что любая живая клетка просто по определению ограничена мембраной.
Самое важное с точки зрения живого организма свойство мембраны называется избирательной проницаемостью. Попросту говоря, это значит, что одни молекулы сквозь нее проходят, а другие нет. Например, вода проходит через мембрану очень хорошо (хотя все равно с некоторыми ограничениями), а вот белки не проходят совсем, потому что их молекулы для этого слишком велики. Что касается молекул среднего размера, то с ними все бывает по-разному. Относительно хорошо сквозь мембрану проходят гидрофобные молекулы, которые несут очень мало локальных электрических зарядов (см. главу 2). Именно таковы, например, молекулы стероидных гормонов, которые могут поэтому проникать прямо в клеточное ядро (см. главу 5). И наоборот, гидрофильные молекулы, где локальных электрических зарядов много, проходят сквозь мембрану с трудом.
Но ведь при всем этом любая живая клетка является открытой системой. А это значит, что она должна постоянно обмениваться с внешней средой не только энергией, но и веществом. (Система, способная обмениваться с внешней средой только энергией, называется закрытой, но в биологии таких систем практически не бывает.) Короче говоря, клетка должна получать нужные вещества и выводить ненужные. Само собой разумеется, что весь этот обмен идет через мембрану.
Молекулы любого вещества, во-первых, находятся в непрерывном хаотическом движении и, во-вторых, всегда стремятся переходить из области с более высокой концентрацией этого вещества в ту область, где его концентрация ниже. Мы уже знаем, что этот процесс называется диффузией. Принято говорить, что диффузия идет по градиенту концентрации. (Словом “градиент” в естественных науках называют направленное изменение некоторого параметра в пространстве. Например, бывают градиенты концентрации, температуры, плотности, солености, освещенности.) Движение молекул по градиенту концентрации идет самопроизвольно, с уменьшением свободной энергии. А вот движение молекул против градиента (то есть от низкой концентрации к высокой) не может быть самопроизвольным ни при каких условиях. Для этого нужна энергия, подводимая извне.
Однако ясно, что и движение молекул по градиенту, энергетически “разрешенное” и даже выгодное, не сможет осуществиться, если для него есть непреодолимая преграда. Вот такой преградой и служит клеточная мембрана. Например, ионы натрия, которых снаружи клетки обычно гораздо больше, чем внутри, “стремятся” попасть внутрь, но при замкнутой мембране сделать этого не могут.
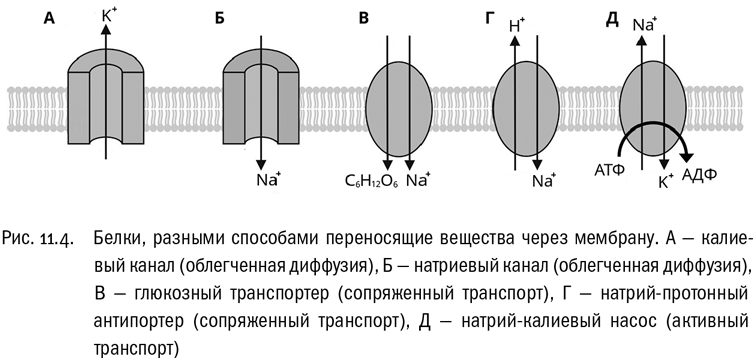
Для молекул, которые с трудом преодолевают мембрану, но при этом нужны клетке (или, наоборот, совершенно не нужны и должны быть из нее выведены), существуют специальные переносчики. Обычно таким переносчиком служит встроенный в мембрану интегральный белок (см. главу 5). Молекула этого белка захватывает ту молекулу, которую нужно перенести, на одной стороне мембраны и высвобождает ее на другой. Никакой энергии, кроме той, что потребовалась на создание переносчика и его встраивание в мембрану, клетка при этом не тратит. Белок-переносчик просто облегчает молекулам путь сквозь мембрану, который они в принципе могли бы пройти и сами, но гораздо медленнее. Это называется облегченной диффузией.
Белки, производящие облегченную диффузию, принято называть каналами (рис. 11.4А, Б). Молекула белка-канала часто бывает устроена как вставленный в мембрану колодец (обычно со створкой, которая может открываться и закрываться). Очень важное свойство белков-каналов — селективность, то есть избирательность. Как правило, каждый из них предназначен только для одной молекулы или иона. Например, натриевый канал плохо пропускает калий и наоборот. Ионные каналы — натриевые, калиевые, протонные, хлорные — очень широко распространены в природе, их разнообразие просто огромно.
В отличие от облегченной диффузии активный транспорт — это перемещение молекул против градиента концентрации (см. рис. 11.4Д). При активном транспорте молекулы переходят оттуда, где их концентрация низка, туда, где она и без того уже высока, и на это тратится энергия. Мембранные белки, производящие активный транспорт, называются насосами. Широко известен, например, натрий-калиевый насос, который одновременно переносит ионы натрия изнутри клетки наружу, а ионы калия снаружи внутрь — и то и другое против градиента концентрации. Нечего и говорить, что энергии на это нужно немало. На самом деле для многих клеток именно работа мембранных насосов образует одну из главных “статей расхода”, на которую тратится огромное количество АТФ. Насос устроен сложнее, чем канал. Селективность у него ничуть не хуже: любой мембранный насос, как правило, переносит только ту молекулу, для которой он изначально предназначен.
Кроме того, существует сопряженный транспорт, когда один и тот же белок-переносчик одновременно переносит через мембрану разные молекулы — одну по градиенту концентрации, а другую — против. Тут есть как минимум два разных варианта.
Сопряженный транспорт, при котором две молекулы (или ионы) переносятся белком-переносчиком в одну и ту же сторону, называется симпортом. Какая от него может быть польза? Вот, например, представим себе животную клетку, которой нужна глюкоза (то есть в общем-то любую животную клетку). Глюкоза — важнейший промежуточный продукт обмена веществ, ее концентрация в любой клетке заведомо гораздо выше, чем во внеклеточной среде. Тем не менее переправить ее из этой среды внутрь клетки как-то нужно. Конечно, эту задачу можно было бы решить, просто потратив АТФ. Но есть и обходной путь, причем очень удобный. Мы уже говорили, что в любой живой клетке, в том числе и животной, обычно очень мало натрия. Снаружи от клетки — в крови, в тканевой жидкости, где угодно — его намного больше. Сам по себе натрий клетке не нужен. Но если все-таки дать ему в нее войти, это будет диффузия, приводящая к снижению свободной энергии, попросту говоря, энергетически выгодный процесс. Так вот, существует белок-переносчик, который одновременно пропускает внутрь клетки ионы натрия и молекулы глюкозы (рис. 11.4, В). В результате перенос глюкозы энергетически “оплачивается” ценой переноса натрия — без всякой траты АТФ! Именно с помощью такого глюкозного транспортера происходит, например, всасывание глюкозы клетками нашего кишечника.
Сопряженный транспорт, при котором молекулы или ионы переносятся одним и тем же белком-переносчиком в разные стороны, называется антипортом. Тут возможно точно такое же энергетическое сопряжение, как и в симпорте: одна молекула переносится по градиенту, вторая — против градиента, и перенос первой “оплачивает” перенос второй. Например, допустим, что из животной клетки нужно вывести накопившиеся там лишние ионы H+, при том что в жидкости снаружи от клетки их еще больше. Белок, способный решить эту задачу, называется натрий-протонным антипортером (рис. 11.4, Г). Он впустит в клетку некоторое количество ионов натрия (которых снаружи всегда больше, поэтому их вход энергетически выгоден) и в обмен на них выведет из клетки протоны. Этот механизм действует, например, в наших почках: именно с помощью натрий-протонного антипортера ненужные протоны выбрасываются в мочу, чтобы быть окончательно удаленными из организма.
Очень широко используют натрий-протонный антипорт бактерии. Обменивая протоны на ионы натрия, они фактически конвертируют натриевый мембранный потенциал в протонный (или, с тем же успехом, наоборот):
∆μNa ⇌ ∆μH.
Это позволяет одной и той же бактерии использовать в качестве запасов энергии и протонный, и натриевый потенциалы, переходя от одного к другому в зависимости от условий внешней среды. Раз уж такая возможность есть, почему бы ею не пользоваться? Вот бактерии и пользуются, для них это полезный инструмент адаптации.
Как видим, транспорт через клеточную мембрану занимает в энергетическом обмене важнейшее место. Настолько важное, что впору задать вопрос: не началась ли жизнь как таковая именно с мембранной энергетики? И в самом деле, такую мысль иногда высказывают. Мы еще вернемся к ней.
Окислительно-восстановительные реакции
В зависимости от того, откуда живые организмы берут энергию, их можно разделить всего на две главные категории: фототрофы, для которых источником энергии является свет, и хемотрофы, для которых источником энергии являются окислительно-восстановительные химические реакции. В отношении света нам вполне достаточно понимать, что это разновидность электромагнитных волн. А вот что такое окислительно-восстановительные реакции — придется пояснить, благо все необходимые для этого понятия мы из предыдущих глав уже знаем.
Итак, представим себе любое вещество, состоящее из молекул. Атомы в типичной молекуле соединены между собой ковалентными связями, каждая из которых образована парой электронов. Число ковалентных связей, которые может образовать данный атом, называется его валентностью (см. главу 1). Валентность водорода равна 1, кислорода 2, азота 3, углерода 4 и фосфора 5. В соединениях с ионными связями, где электроны целиком переходят от одного атома к другому, валентность каждого иона приравнивается к величине его заряда.
Ковалентные связи делятся на полярные и неполярные (см. главу 2). В неполярной ковалентной связи электроны, условно говоря, расположены точно посредине, а в полярной они смещены в сторону одного из атомов. Сила, с которой этот атом оттягивает на себя электроны, называется его электроотрицательностью. На самом-то деле правильнее говорить, что смещаются не целые электроны, а максимум плотности электронного облака. Но так или иначе из-за этого частичного смещения электронов атомы, участвующие в полярной ковалентной связи, приобретают маленькие (намного меньше единицы) электрические заряды. На одном атоме этот заряд положительный, на другом отрицательный. Например, на кислороде он обычно отрицательный, потому что электроотрицательность кислорода очень высока. Это означает, что он почти во всех своих соединениях оттягивает электроны на себя.
Еще древние философы знали, что человеческому уму гораздо удобнее работать с дискретными единицами, чем с непрерывными совокупностями. Вот поэтому химики и придумали чисто формальное, зато достаточно емкое понятие под названием “степень окисления”. Степень окисления — это условный заряд данного атома, вычисленный исходя из предположения, что все его связи являются ионными (независимо от того, так ли это на самом деле). Неполярные ковалентные связи, в которых партнеры строго равноправны, в рамках этого определения игнорируются. А вот любую полярную ковалентную связь мы мысленно заменяем на ионную и воображаем, что каждый участвующий в ней электрон целиком захвачен каким-нибудь из атомов. Каким именно — зависит от электроотрицательности. Но в любом случае степень окисления может быть только целым числом. Например, молекула воды (H2O) состоит из одного атома кислорода (O) и двух атомов водорода (H), каждый из которых соединен с атомом кислорода одинарной ковалентной связью. Электроотрицательность кислорода больше, чем у водорода, поэтому электроны, образующие ковалентные связи, он оттягивает на себя. Это означает, что в молекуле воды атом кислорода имеет степень окисления –2, а каждый из атомов водорода +1. Молекула углекислого газа (CO2) состоит из атома углерода и двух атомов кислорода, соединенных с ним двойными ковалентными связями. В этой молекуле атом углерода имеет степень окисления +4, а каждый из атомов кислорода –2. Сумма степеней окисления всех атомов в любой частице равна ее полному электрическому заряду. Если эта частица — незаряженная молекула, то сумма степеней окисления всех атомов равна нулю. На примере углекислого газа и воды мы видим, что это действительно так.
Теперь посмотрим на вещи чуть шире. Некоторые химические реакции приводят к тому, что распределение электронной плотности у атомов существенно меняется. Попросту говоря, это означает, что около каких-то атомных ядер электронов становится меньше, а около каких-то больше. Понижение электронной плотности у данного атома называется окислением, а ее повышение — восстановлением. Говоря формально, окисление — это потеря электронов, а восстановление — приобретение электронов. Если атом, степень окисления которого до реакции была равна нулю, в результате реакции окислился, то его степень окисления становится положительной, а если восстановился, то отрицательной (поскольку заряд электрона равен –1). В реальных химических реакциях электроны могут только переходить от одних атомов к другим, поэтому процессы окисления и восстановления всегда идут одновременно. Вот те реакции, в которых они идут, и называются окислительно-восстановительными. Особо подчеркнем, что к этой категории относятся не все химические реакции, а только некоторые.
Например, уже знакомая нам реакция взаимодействия водорода и кислорода с образованием воды является типично окислительно-восстановительной. Посмотрим еще раз на уравнение этой реакции:
H2 + ½O2 → H2O.
В левой части этого уравнения степени окисления водорода и кислорода по определению равны нулю. В правой же части мы видим, что водород окислился, а кислород восстановился. Иначе говоря, произошло перераспределение электронной плотности: у водорода она уменьшилась, а у кислорода увеличилась. Эта реакция (как мы уже знаем) энергетически выгодна. И неудивительно, что есть бактерии, способные реально использовать ее как источник энергии, — они называются водородными бактериями.
Вот еще один пример окислительно-восстановительной реакции, используемой некоторыми живыми существами для получения энергии:
CO2 + 4H2 → CH4 + 2H2O.
Здесь происходит превращение углекислого газа (CO2) в метан (CH4), в результате которого атом углерода восстанавливается. В подобных случаях часто говорят попросту: углекислый газ восстанавливается до метана. Агентом-восстановителем в данном случае служит водород, который сам при этом окисляется. (Водород вообще часто бывает восстановителем, а его отнятие, наоборот, во многих реакциях равносильно окислению.) И это дает энергию, которую можно запасти в виде АТФ. Восстановление углекислого газа до метана — реакция, на которой основана вся жизнь метанообразующих архей, для краткости называемых метаногенами. Это очень древние и широко распространенные микробы, живущие в самых разных средах — от болот и горячих источников до кишечника млекопитающих.
Окислительно-восстановительные реакции, которыми пользуются живые организмы как источниками энергии, довольно разнообразны. Например, дыхание — это тоже окислительно-восстановительная реакция. В ходе нее углерод не восстанавливается, как у метаногенов, а, наоборот, окисляется до состояния углекислого газа (CO2). Эта реакция исключительно энергетически выгодна, так что АТФ в ходе нее получается очень много.
Для некоторых живых существ источниками энергии могут служить и неорганические окислительно-восстановительные реакции, идущие без всякого участия углерода. Простой пример такой реакции — окисление сероводорода (H2S) до чистой серы (S), степень окисления которой при этом меняется с отрицательной на нулевую:
H2S + ½O2 → H2O + S.
Микроорганизмы, владеющие этим способом получения энергии, называются серобактериями (в данном случае это именно бактерии, а не археи). Энергетический обмен бактерий вообще очень многообразен. Есть, например, бактерии, которые не окисляют, а восстанавливают серу. А есть и такие, которые используют для получения энергии неорганические реакции с участием других элементов, например железа или азота. Кроме того, многие бактерии умеют получать энергию сразу несколькими способами, переключаясь с одного на другой в зависимости от внешних условий. Например, зеленые серобактерии владеют одновременно и окислением сероводорода, и фотосинтезом, то есть могут получать энергию просто из света. Надо еще раз оговорить, что под энергией мы сейчас фактически подразумеваем АТФ. “Способ получения энергии” — это любой процесс, позволяющий его синтезировать.
Интересно, что есть некоторое количество бактерий, вообще не умеющих (или почти не умеющих) самостоятельно синтезировать АТФ. Это — внутриклеточные паразиты, которые ухитряются довольствоваться готовым АТФ, синтезируемым клеткой хозяина. Их часто называют “энергетическими паразитами”. Весь их механизм получения энергии может сводиться к АТФ-транспортерам, встроенным во внешнюю мембрану. Судя по современным данным, такими транспортерами служат в основном белки-антипортеры, одновременно переправляющие ненужный АДФ наружу и полезный АТФ внутрь.
Назад: 10. эукариотная клетка
Дальше: Источники углерода

