Книга: От атомов к древу. Введение в современную науку о жизни
Назад: 6. углеводы
Дальше: 8. нуклеиновые кислоты
7. нуклеотиды
— Как вообще может анаэроб развиться в сложный многоклеточный организм и тем более — двигаться настолько быстро, как эта тварь? Подобный уровень активности жрет массу АТФ.— Может, они не используют АТФ, — предположила Бейтс, пока я полез за справкой в КонСенсус: аденозинтрифосфат, источник энергии для клетки.Питер Уоттс. Ложная слепота
Вспомним, как устроена молекула бензола. Она состоит из шести атомов углерода, соединенных в кольцо таким образом, что одинарные углерод-углеродные связи чередуются с двойными (см. главу 1). Свободные связи в бензоле, как и всюду, заняты атомами водорода. го краткая формула — C6H6. Именно эта молекула когда-то напомнила Фридриху Августу Кекуле кольцо из переплетающихся змей. Молекула бензола прекрасна и самодостаточна — казалось бы, что в ней можно поменять?
Кое-что можно. Например, заменить один из атомов углерода на атом азота. Азот трехвалентен, и это вполне позволяет ему встроиться в бензольное кольцо (только без водорода при нем). Тогда получается кольцевая молекула с пятью атомами углерода, одним атомом азота и тремя двойными связями, которая называется пиридин.
Можно заменить атомами азота и два атома углерода (не соседних, а через один). Получится кольцо с тремя двойными связями, четырьмя атомами углерода и двумя атомами азота. Эта молекула называется пиримидин (см. рис. 7.1). И вот она в биологии очень важна.
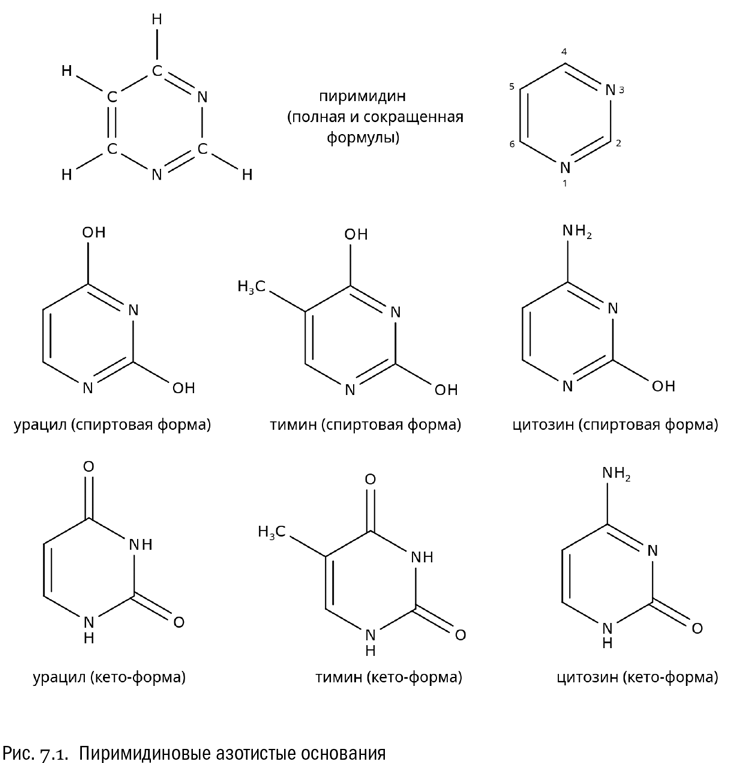
Присоединив к пиримидиновому ядру две гидроксильные группы (–OH), мы получим соединение, которое называется урацил. Полное химическое название урацила — 2,4-дигидроксипиримидин. Члены пиримидинового кольца принято нумеровать, считая от одного из атомов азота.
Если дополнительно присоединить к урацилу еще и метильную группу (–СH3), получится новое соединение — тимин. А если заменить в урациле одну из гидроксильных групп на аминогруппу (–NH2), то получится цитозин. Полное название тимина — 5-метил-2,4-дигидроксипиримидин. А полное название цитозина — 2-гидрокси-4-аминопиримидин. Запоминать эти названия (как и нумерацию, на которой они основаны) ни в коем случае не надо. Но они полезны тем, что в случае надобности позволяют безошибочно восстановить всю формулу нужного вещества. Честно говоря, сомнительно, что любой биолог помнит формулы урацила, тимина и цитозина наизусть. Но вот о том, что такие вещества существуют, знает абсолютно каждый, кто имеет к биологии хоть какое-то отношение. Знаем теперь и мы.
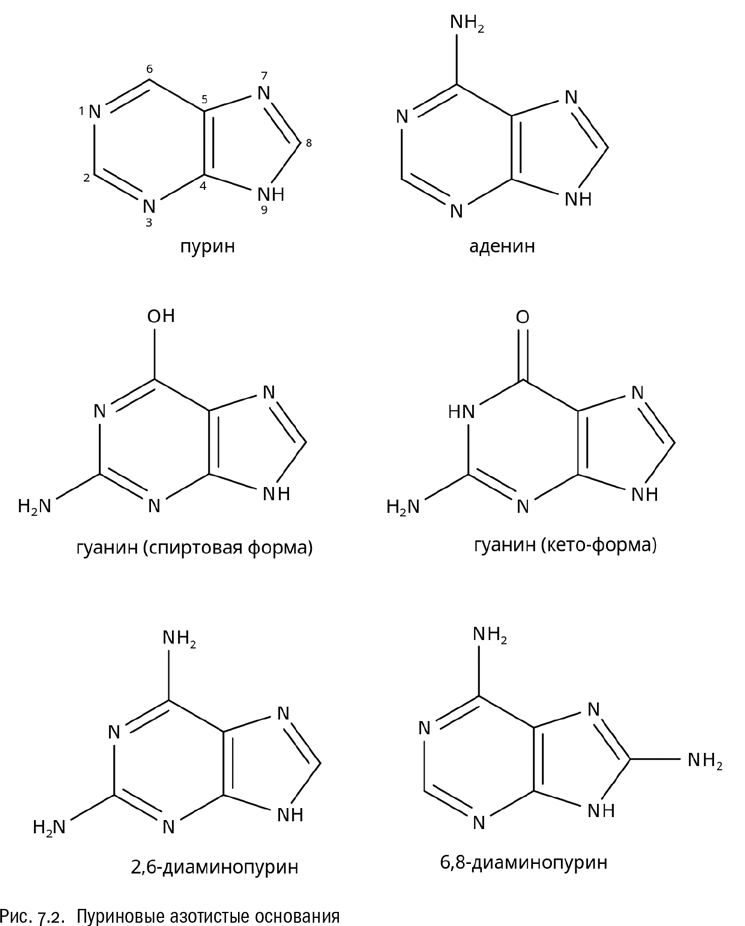
Возможна и другая, более сложная молекула, где к пиримидиновому шестичленному циклу добавлено еще одно кольцо — пятичленное, с двумя атомами азота. Такое соединение называется пурином (см. рис. 7.2). Молекула пурина включает в общей сложности пять атомов углерода и четыре атома азота.
Есть довольно много соединений, где к пуриновому ядру присоединяются различные боковые цепи. Например, именно к производным пурина относится такое популярнейшее вещество, как кофеин. В молекуле кофеина к пуриновому ядру присоединены две гидроксильные группы и три метильные.
Но для биологов гораздо важнее два других пуриновых соединения. Одно из них — аденин, молекула которого состоит из пуринового ядра с присоединенной к нему аминогруппой. Второе — гуанин, в котором есть аминогруппа (не там, где у аденина) и гидроксильная группа.
Полные названия аденина и гуанина, соответственно, 6-аминопурин и 2-амино-6-гидроксипурин. Повторимся, что эти названия даются тут не для того, чтобы кто-нибудь пытался их запомнить, а просто ради общего представления о том, как этой номенклатурой в принципе можно пользоваться. Дальше нам это еще пригодится.
Пуриновые и пиримидиновые молекулы только что описанного типа называют азотистыми основаниями, потому что входящий в них азот проявляет основные свойства, подобно аммиаку (см. главу 1). Урацил, тимин, цитозин, аденин и гуанин — это азотистые основания. Урацил, тимин и цитозин — пиримидиновые азотистые основания, а аденин и гуанин — пуриновые. Вообще-то химикам известны десятки азотистых оснований, но для понимания основ биологии вполне хватит этих пяти. Другие азотистые основания встречаются в живых организмах реже, и значение их там гораздо меньше.
Завершая знакомство с азотистыми основаниями, совершенно необходимо добавить, что у них — да, и у них тоже! — есть одна особая разновидность изомерии. Состоит она в следующем. Входящая в состав азотистого основания гидроксильная группа (вместе с углеродом, к которому она присоединена, имеющая вид С–OH) может потерять водород и превратиться в кетогруппу (C=O). Система двойных связей в пиримидиновом или пуриновом ядре при этом перестраивается, а потерянный гидроксилом водород переходит на ближайший атом азота. В живых организмах азотистые основания всегда находятся не в спиртовой форме (с гидроксильными группами), а именно в кето-форме. Это распространяется на все важнейшие азотистые основания, кроме аденина, который выглядит всегда одинаково: у него гидроксильной группы просто нет.
По ту сторону рассвета
Пять азотистых оснований, с которыми мы познакомились, с биологической точки зрения — самые главные. Не секрет, что они используются земными живыми организмами для хранения и передачи генетической информации. Как именно это происходит, мы пока что “не знаем”, хотя уже довольно скоро узнаем (в главах 8 и 9). Но вот почему главными оказались именно эти пять оснований, а не какие-то другие родственные им? Ведь разных азотистых оснований, и пиримидиновых, и пуриновых, можно придумать очень много.
Ответ на этот вопрос надо, как всегда, искать в прошлом. И в данном случае это будет очень далекое прошлое. Сейчас точно известно, что химическая эволюция азотистых оснований началась задолго до возникновения жизни, а скорее всего, даже и до возникновения планеты Земля. Тут дело обстоит точно так же, как и с аминокислотами (см. главу 3). В большинстве углеродсодержащих (так называемых углистых) метеоритов при тщательном химическом анализе были найдены азотистые основания. В общей сложности их там не меньше десятка, и по структуре молекул они довольно разнообразны. Очевидно, синтез этих веществ шел прямо на частицах протопланетного облака.
Например, если по-разному присоединять к пурину аминогруппы, то можно получить аденин (у него аминогруппа одна), а можно и основания с двумя аминогруппами — например, 2,6-диаминопурин или 6,8-диаминопурин (см. рис. 7.2Б). Главное же здесь вот что. Ни 2,6-диаминопурин, ни 6,8-диаминопурин не встречаются в земных живых организмах, а вот в углистых метеоритах они обнаруживаются легко. Причем их присутствие там никак нельзя объяснить биогенным загрязнением метеорита, уже упавшего на Землю, потому что на Земле этих соединений просто нет. Это — остатки добиологического разнообразия сложных молекул, которые синтезировались на ранних этапах эволюции Солнечной системы. Углистые метеориты, никогда не входившие в состав планет, служат “заповедниками” этого разнообразия — точно так же, как в случае с аминокислотами. Разных азотистых оснований там вполне могли быть десятки.
При возникновении жизни и аминокислоты, и азотистые основания подверглись процессу, подобному естественному отбору. Одни основания оказались удачными и вошли в состав живых систем, а другие — большинство — были отсеяны и в состав живых систем не вошли. В итоге начальное высокое химическое разнообразие исчезло. Остались несколько широко распространенных соединений, с которыми мы сейчас в основном и имеем дело. Причем они были выбраны отнюдь не случайно. Предполагается, например, что одним из критериев стала устойчивость оснований к ультрафиолетовому излучению Солнца, которое на древней Земле было очень серьезным фактором риска. Одна из научных работ, написанных на эту тему, прямо так и озаглавлена — “Выживание наиболее приспособленных до начала жизни”.
Нуклеозиды
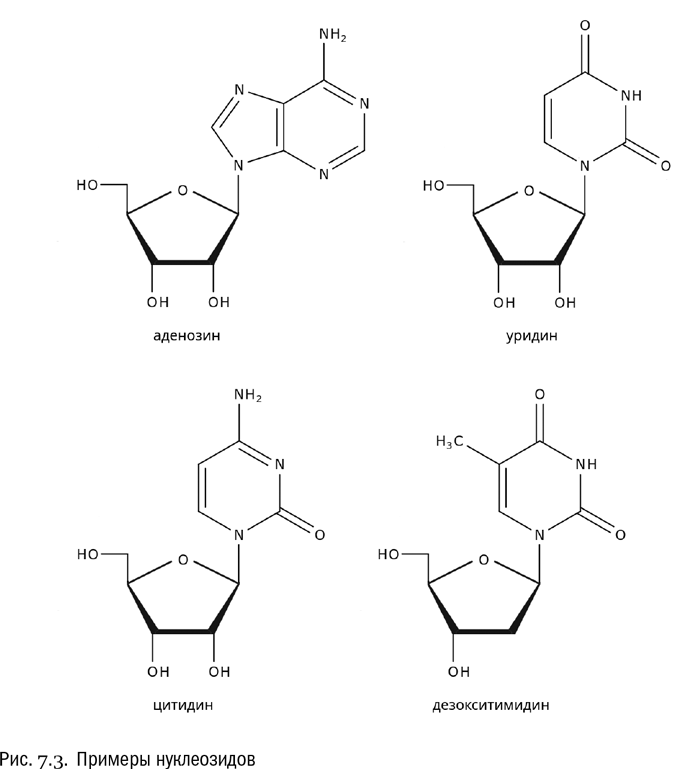
Молекула, состоящая из остатков азотистого основания и сахара, называется нуклеозидом (см. рис. 7.3). Сахаром, входящим в нуклеозиды, по умолчанию является рибоза, но иногда — дезоксирибоза. Как мы помним, они отличаются друг от друга всего на один атом кислорода. Азотистое основание присоединяется к первому по счету углеродному атому сахара, который здесь принято обозначать единицей со штрихом (1'). От этого атома отщепляется гидроксил (–OH), а от одного из атомов азота, входящих в азотистое основание, одновременно отщепляется водород (–H). В результате выделяется вода, а между азотистым основанием и сахаром замыкается ковалентная связь. Так нуклеозид и получается.
Названия нуклеозидов являются производными от названий входящих в них азотистых оснований. Пять нуклеозидов, с которыми в основном имеют дело биологи, — уридин, тимидин, цитидин, аденозин и гуанозин. Если в качестве сахара в данный нуклеозид входит не рибоза, а дезоксирибоза, то к его названию прибавляется приставка “дезокси-”. Но иногда ее опускают, если по контексту и так понятно, о чем идет речь.
Теперь мы наконец знаем, почему атомы углерода в составе рибозы и дезоксирибозы обозначаются не просто цифрами, а цифрами со штрихами (см. главу 6). Дело как раз в том, что эти два сахара входят в состав нуклеозидов. А в любом нуклеозиде есть еще и азотистое основание, атомы которого имеют свою собственную нумерацию. Штрихи нужны, чтобы никто не спутал номера атомов сахара с номерами атомов азотистого основания.
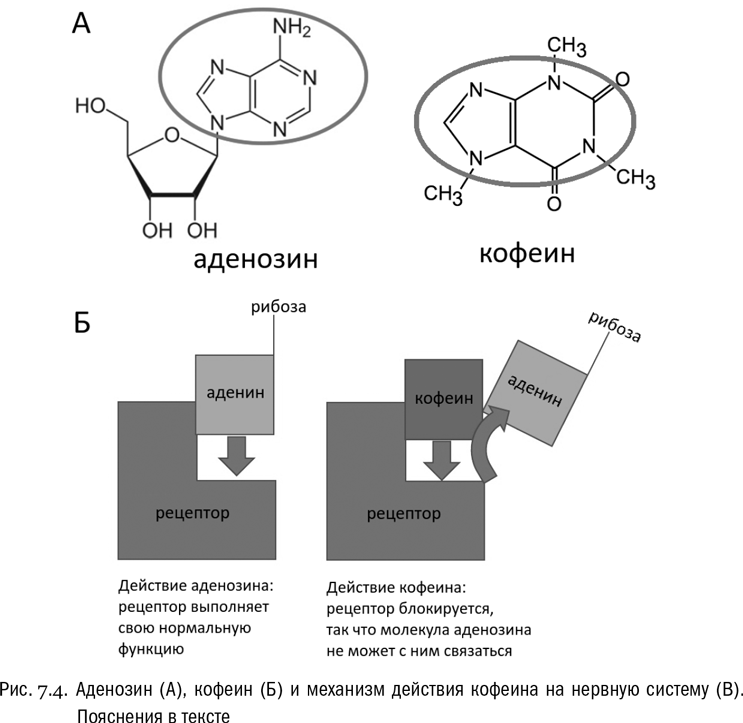
Нуклеозиды могут делать многое. Например, аденозин интересен тем, что является одним из нейротрансмиттеров, то есть веществ, передающих сигналы между нервными клетками. Именно на передачу этих сигналов действует кофеин — вещество, тоже относящееся к группе пуринов (см. рис. 7.4А). И сейчас у нас уже вполне достаточно знаний, чтобы разобраться, в чем тут дело.
Кофеин является блокатором аденозиновых рецепторов. Что это значит? К любому сигнальному веществу есть специальные рецепторы, то есть воспринимающие элементы. В данном случае это интегральные белки (см. главу 5), которые сидят в наружной мембране нервной клетки и узнают молекулы аденозина по принципу ключа и замка, то есть примерно так же, как ферменты узнают свой субстрат (см. главу 3). Что же касается кофеина, то его молекула похожа на молекулу аденина — ключевой составной части аденозина. Молекула кофеина связывается с тем же участком белка-рецептора, с которым должен связаться адениновый остаток аденозина, и застревает в нем, после чего никакой аденозин уже не может туда войти (см. рис. 7.4Б). По такому принципу действуют очень многие лекарства, яды и психоактивные вещества, в том числе и наркотики — они ведь обычно тоже связываются с рецепторами, предназначенными для нейротрансмиттеров, либо блокируя, либо активируя их.
Сам аденозин как сигнальное вещество обладает преимущественно тормозным действием, то есть, попросту говоря, успокаивающим. Выделение аденозина обычно является сигналом усталости, знаком, что активность пора приостановить. От него, например, уменьшается частота сердечных сокращений и снижается артериальное давление. Блокируя действие аденозина, кофеин снимает все эти эффекты, а вместе с ними и чувство утомления. Но никакой дополнительной энергии он не дает — просто помогает перераспределить имеющиеся силы.
Можно ли считать кофеин наркотиком? Пожалуй, все-таки нельзя. Ведь тут недостаточно общего с типичными наркотиками механизма действия. Для отнесения вещества к категории наркотиков есть четкий набор критериев, большинству из которых кофеин не соответствует. Нет толерантности (это когда для достижения одного и того же эффекта требуется постепенное повышение дозы), нет вызываемой употреблением вещества социальной дезадаптации, нет жесткой “ломки”, то есть болезненного синдрома отмены, ну и так далее.
Справедливости ради надо сказать, что в 2013 году Американская психиатрическая ассоциация после долгих колебаний все-таки отнесла кофеиновую зависимость к психическим расстройствам, но только в том случае, если она явно вызывает утомляемость, сонливость, повышенную возбудимость, мышечные судороги, тахикардию, аритмию и (или) другие подобные последствия (см. Diagnostic and Statistical Manual of Mental Disorders, сокращенно DSM-5). Чтобы добиться таких эффектов, надо пить кофе буквально литрами, да еще и с предрасположенностью должно не повезти. Если же их нет, то волноваться, скорее всего, не о чем.
Так называемый аддиктивный потенциал у кофеина, по всем данным, довольно низкий. Например, у никотина (который действует очень похожим способом на рецепторы к другому нейротрансмиттеру, ацетилхолину) аддиктивность гораздо выше и синдром отмены тяжелее — это знает каждый, кто привыкал и к кофе, и к курению. Мы сейчас не касаемся вопроса о вреде курения для здоровья, потому что это, как ни странно, не имеет прямого отношения к нашей теме. Дело в том, что практически все вредные последствия курения вызываются не никотином (он-то как раз относительно безвреден), а многочисленными сопутствующими веществами, образующимися при сгорании табака. На нервную систему эти вещества почти не действуют, а вот на другие системы — очень даже. В кофе подобного набора вредных сопутствующих веществ и близко нет.
В общем, на данный момент от науки не приходится ждать никаких однозначных рекомендаций по вопросу, пить или не пить кофе. Для здорового человека это дело личного выбора, и только. Так ведь тоже бывает.
Знакомство с нуклеотидами
Теперь отвлечемся на время от нуклеозидов и познакомимся поближе с одним важным понятием, которое мы, в общем-то, уже знаем.
Существует химическая реакция под названием фосфорилирование: присоединение фосфата к любому соединению, в котором есть гидроксильная группа, с образованием сложного эфира фосфорной кислоты. Мы уже встречались с этой реакцией, когда говорили о фосфолипидах: там фосфорилированию подвергался глицерин и получался глицерофосфат (см. главу 5). Фосфолипиды, из которых состоит клеточная мембрана, образуются как раз этим путем.
На самом деле объектами фосфорилирования бывают самые разнообразные молекулы, несущие гидроксильные группы. Это могут быть белки (особенно такие, где есть серин, треонин или тирозин — фосфат присоединяется именно к этим аминокислотным остаткам), могут быть спирты (например, тот же глицерин), а могут быть и сахара, благо уж в них-то гидроксильных групп сколько угодно. Фосфорилирование — это универсальный биохимический “оператор”, способный предсказуемо менять свойства разных молекул. Есть специальная большая группа ферментов, занимающихся только фосфорилированием, — они называются киназами.
Напомним еще раз, что “фосфорная кислота” и “фосфат” — в биохимии практически одно и то же. Фосфорная кислота в водном растворе всегда диссоциирует, то есть отдает протоны, превращаясь в анион. Но в формулы ее часто вписывают в недиссоциированном виде — просто для удобства, чтобы не обозначать заряды. Кроме того, при реальном фосфорилировании, происходящем в живой клетке, остаток фосфата чаще всего не приходит в свободном виде из раствора, а передается от специального переносчика. Но в упрощенных записях реакций это может и не отображаться.
Нуклеозид, фосфорилированный по сахару, называется нуклеотидом (см. рис. 7.5). Фосфорилирование нуклеозидов, как правило, идет по пятому углеродному атому сахара, через присоединенную к этому атому гидроксильную группу. Итак, нуклеотид — это молекула, состоящая из азотистого основания, пятиуглеродного сахара (рибозы или дезоксирибозы) и фосфата.
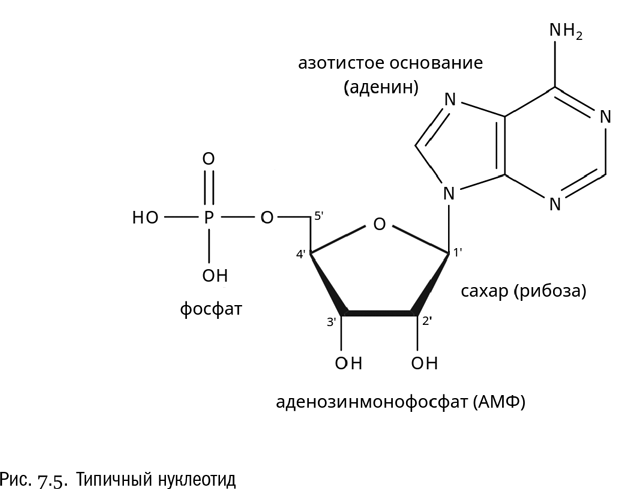
Правило образования названий нуклеотидов таково: название нуклеотида = название нуклеозида + числительное + фосфат. Числительное нужно обязательно, потому что к фосфату могут присоединяться еще фосфаты, как бы последовательно фосфорилирующие друг друга, — всего их бывает до трех штук. Если фосфат один, то числительное — “моно”, если два — “ди”, если три — соответственно “три”. Например, если один раз фосфорилировать аденозин, то получится аденозинмонофосфат (АМФ). Кроме того, если входящий в состав нуклеотида сахар не рибоза, а дезоксирибоза, то ко всему названию добавляется приставка “дезокси”.
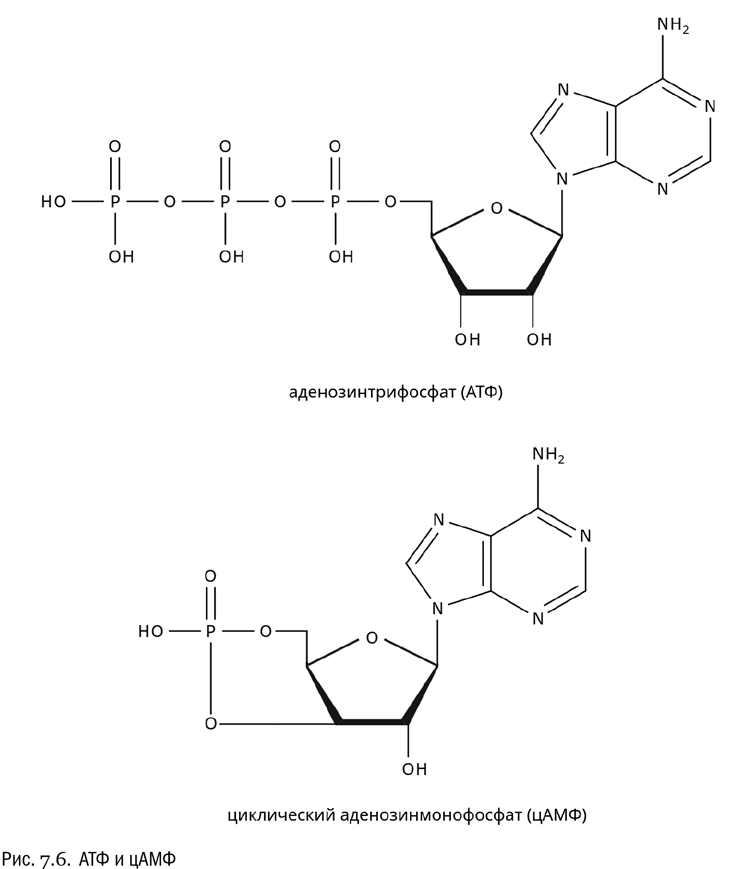
Один из самых интересных нуклеотидов — аденозинтрифосфат (АТФ, см. рис. 7.6). Иногда его называют аденозинтрифосфорной кислотой, но название “аденозинтрифосфат” используется чаще. В растворе, заполняющем клетку, АТФ находится в виде аниона, так что фактически это не кислота, а соль. Как видно из названия, эта молекула состоит из аденина, рибозы и трех остатков фосфата.
АТФ может распадаться с участием воды на аденозиндифосфат (АДФ) и обычную фосфорную кислоту. При этом высвобождается довольно много энергии, которая может быть использована для любых внутриклеточных процессов — таких, например, как синтез полимеров, транспорт веществ или мышечное сокращение. При превращении АДФ в АТФ энергия, наоборот, поглощается молекулой последнего и запасается в ней. В целом получается обратимая реакция, которую можно записать очень просто:
АТФ + H2O (вода) ⇌ АДФ + H3PO4 (фосфат) + энергия
Это и есть простейшая схема оборота АТФ в живой клетке. И это — процесс, от которого напрямую зависит все наше существование.
Фермент, превращающий АДФ в АТФ и тем самым запасающий в молекуле АТФ энергию, называется АТФ-синтазой. Фермент, расщепляющий АТФ до АДФ и использующий высвобожденную энергию для какой-нибудь работы, называется АТФазой. Эти названия ни в коем случае не надо путать — они относятся к строго противоположным процессам. За сутки в организме человека синтезируется, по разным подсчетам, от 40 до 75 килограммов химически чистого АТФ. Но он не накапливается, а почти сразу расщепляется обратно до АДФ, расходуясь в качестве “топлива”. Как запасное вещество АТФ не используется, потому что его слишком неудобно хранить. Среднее время жизни отдельно взятой молекулы АТФ — меньше одной минуты. С другой стороны, запаса АТФ, имеющегося в каждый данный момент, любой живой клетке хватит не больше чем на несколько секунд, так что он должен постоянно синтезироваться заново. Именно синтез АТФ является главным конечным результатом процессов получения энергии — таких, например, как дыхание.
В 1939 году известные биохимики Владимир Александрович Энгельгардт и Милица Николаевна Любимова совершили поразительное открытие. Их интересовала биохимия мышечного сокращения, и они сумели выделить из клеток мышечный белок — миозин, — конденсированный в виде нитей. Дальше оказалось, что если поместить эти нити в раствор АТФ, то происходят одновременно два процесса. Во-первых, АТФ расщепляется до АДФ и фосфата, надо полагать — под действием миозина. А во-вторых, нити миозина при этом... укорачиваются. Во всяком случае, существенно уменьшается максимальная длина, до которой их можно растянуть.
Так была открыта АТФазная активность миозина. И заодно было очень наглядно показано, что энергия, высвобожденная при расщеплении АТФ, может тут же “конвертироваться” в механическую работу. Правда, на самом деле чистого миозина для этого недостаточно, нужен как минимум еще один белок — актин. Но в принципе Энгельгардт и Любимова все поняли абсолютно верно. Их открытие, кстати, было сразу же оценено современниками: в 1943 году авторы получили за него высшую тогда в СССР награду — Сталинскую премию.
Любая АТФаза является белком, который, расщепляя АТФ, за счет высвобожденной при этом энергии одновременно совершает работу (не обязательно механическую: с тем же успехом это может быть перенос веществ через клеточную мембрану или какой-нибудь энергоемкий синтез). Если белки-АТФазы — аналоги маленьких двигателей, то АТФ служит для клетки самым настоящим топливом.
Иногда связи между остатками фосфата в формуле АТФ обозначают не прямой черточкой, как обычные ковалентные связи, а волнистой (~). Это предложенное немецким биохимиком Фрицем Липманом обозначение тех связей, при разрыве которых, собственно, и выделяется достаточно большая по биохимическим меркам энергия. Такие связи называются высокоэнергетическими или макроэргическими. АТФ — не единственное вещество с макроэргическими связями, но, безусловно, самое распространенное. Это энергетическая “разменная монета” живой клетки.
Во избежание недоразумений надо сказать, что количество энергии, высвобождаемое при разрыве макроэргической связи в АТФ, на самом деле вовсе не является каким-то потрясающе огромным. Как раз наоборот, по меркам обычной химии, особенно неорганической, оно скорее невелико. Это объясняется очень просто: слишком большую разовую порцию энергии клетке было бы труднее пустить в дело.
Фермент аденилатциклаза может превратить АТФ в другое интересное соединение — циклический аденозинмонофосфат (цАМФ). Это довольно странно выглядящая молекула, где один и тот же фосфат связан сразу с двумя гидроксилами рибозы (третьим и пятым). Ни для переноса энергии, ни для построения каких-либо более сложных соединений цАМФ не годится. Зато это важное сигнальное вещество, служащее посредником при передаче информации внутри клеток, а иногда и между клетками.
Например, цАМФ может через цепочку посредников запустить процесс распада нерастворимого гликогена до растворимой глюкозы — это существенно ускоряет обмен веществ (см. главу 6). Для того чтобы этот эффект не длился слишком долго, существует фермент фосфодиэстераза, который разрывает в молекуле цАМФ фосфатный мостик и превращает его в безобидный обычный АМФ, лишенный сигнальных функций. Благодаря этому ферменту молекулы цАМФ в клетках быстро расщепляются, и мы избегаем перерасхода энергии. А самым распространенным блокатором фосфодиэстеразы является не что иное, как уже знакомый нам кофеин. Это еще один способ, которым кофеин может действовать на организм. Тут мы имеем дело с типичным случаем конкурентного ингибирования, когда активный центр фермента “запирается” молекулой, близкой по структуре к нормальному субстрату этого фермента, но слегка отличающейся от него (см. главу 3). Именно такой молекулой кофеин и служит. Правда, на фосфодиэстеразу кофеин действует только в огромных концентрациях, которые в организме достигаются редко. Так что развенчивать кофеин, лишая его статуса психоактивного вещества, не стоит: в первую очередь он действует все-таки на аденозиновые рецепторы, которые сидят на нервных клетках.
Назад: 6. углеводы
Дальше: 8. нуклеиновые кислоты

