Книга: Медицинская микробиология, иммунология и вирусология
Назад: Глава 30 Главная система гистосовместимости
Дальше: Глава 32 Другие формы иммунного ответа. Реакции повышенной чувствительности
Глава 31
Приобретенный иммунитет. Формы иммунного ответа. Антитела
Возможны следующие формы иммунного ответа на проникновение антигена в организм: биосинтез антител, образование клеток иммунной памяти, реакция гиперчувствительности немедленного типа, реакция гиперчувствительности замедленного типа (в том числе трансплантационный иммунитет), иммунологическая толерантность, идиотип-антиидиотипические отношения.
Антитела являются уникальными сывороточными белками – глобулинами, которые вырабатываются в ответ на поступление в организм антигена и способны с ним специфически взаимодействовать. При электрофорезе сыворотки антитела мигрируют в составе γ-глобулинов, поэтому ранее их называли гамма-глобулинами. В соответствии с международной классификацией, ныне совокупность сывороточных белков, обладающих свойствами антител, называют иммуноглобулинами и обозначают символом Ig.
Уникальность антител заключается в том, что они способны взаимодействовать только с тем антигеном, который индуцировал их образование. Практически антитела могут быть получены к любому антигену. Число возможных специфичностей антител, вероятно, составляет не менее 109.
Молекулярная структура антител
Важная роль антител в формировании иммунитета и их исключительная специфичность стимулировали огромный интерес к изучению молекулярной структуры иммуноглобулинов, без этого было просто невозможно понять природу антител. В результате было установлено, что существует пять различных классов иммуноглобулинов: IgG, IgM, IgA, IgE, IgD. Они различаются по молекулярной массе, содержанию углеводов, составу полипептидных цепей, коэффициентам седиментации и другим характеристикам (табл. 12).
Основная структурная единица молекулы иммуноглобулина состоит из двух идентичных полипептидных L-цепей (англ. light – легкий) и двух идентичных H-цепей (англ. heavy – тяжелый). Эти четыре цепи ковалентно связаны дисульфидными связями. Молекулярная масса легких цепей составляет около 23 кД, и они состоят примерно из 214 – 220 аминокислотных остатков. Существуют легкие цепи двух типов, один из них обозначается греческой буквой каппа (χ), а другой – лямбда (λ). Соотношение каппа/лямбда у человека равно 70: 30. Каппа– и лямбда-цепи обладают одинаковой способностью связываться с любой тяжелой цепью.
Таблица 12
Свойства классов иммуноглобулинов человека (по: Д. Джеске, Дж. Капре, 1987)
Молекулярная масса тяжелых цепей варьирует в пределах 50 – 73 кД. Идентифицировано пять классов тяжелых цепей, их обозначают греческими буквами: альфа (α), гамма (γ), эпсилон (ε), мю (μ) и дельта (δ). Соответственно обозначению тяжелой цепи обозначается и класс молекул иммуноглобулинов. У человека класс IgG в соответствии с подклассами гамма-цепи (γ1, γ2, γ3 и γ4) делится на 4 подкласса: IgG1, IgG2, IgG3 и IgG4. Класс IgA делится на 2 подкласса: IgA1 и IgA2, в соответствии с двумя подклассами альфа-цепи (α1 и α2).
На тяжелых цепях в зависимости от класса иммуноглобулинов может быть различное число углеводных остатков.
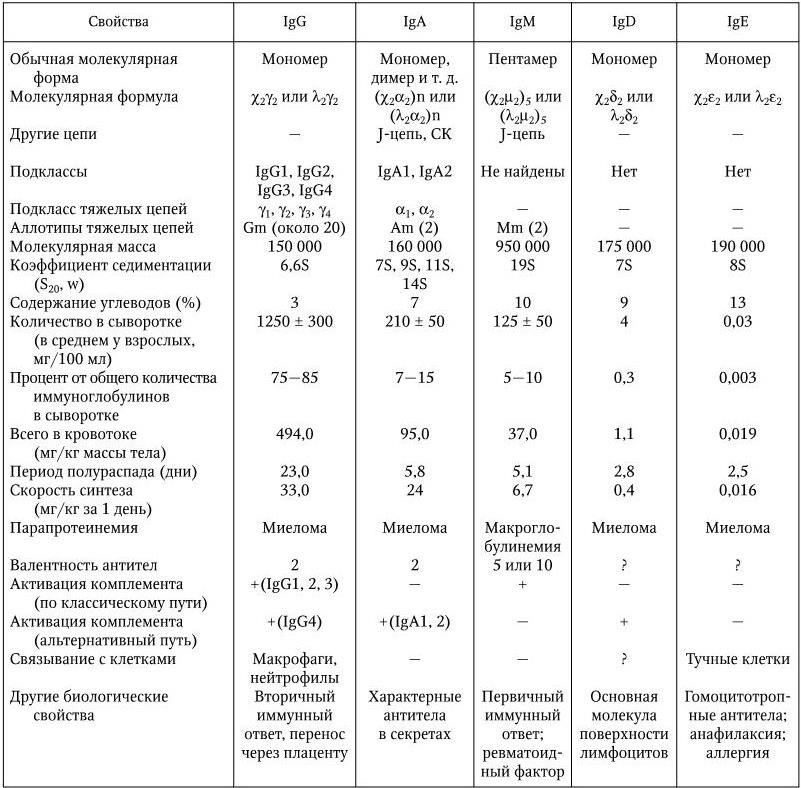
Крупным шагом на пути выяснения структуры молекулы антитела явились опыты Р. Портера и Г. Эдельмана. Р. Портер показал, что при обработке папаином молекула IgG распадается на 3 фрагмента (рис. 64). Два из них оказались одинаковыми;
каждый из них имел молекулярную массу около 45 кД и состоял из легкой цепи и половины тяжелой цепи и обладал способностью соединяться с антигеном. Поэтому эти два фрагмента обозначены как F(ab)1 и F(ab)2, т. е. фрагменты, связывающие антитела (англ. antigen binding). При этом каждый из них обладал только одним активным центром и поэтому связывание с антигеном не сопровождалось образованием крупных конгломератов. Таким образом было установлено, что Fab-фрагменты определяют антительную специфичность иммуноглобулина. Третий фрагмент имел молекулярную массу около 55 кД и состоял из других половин H-цепей. В связи с тем, что он характеризовался постоянством аминокислотного состава, его обозначили как Fc-фрагмент (англ. constant – постоянный). Fc-фрагмент не обладает способностью связывать антиген, но определяет ряд других важных видов биологической активности, необходимых для полного проявления всех функций антител. С Fc-фрагментом связана способность антител проходить через плаценту, усиливать фагоцитоз, нейтрализовать вирусы, связывать комплемент, фиксироваться на клетках кожи и пр.
Г. Эдельман для разрушения дисульфидных связей в молекулах антител обрабатывал их меркаптоэтанолом в концентрированном растворе мочевины. Это приводило к распаду молекул антител на две пары полипептидных цепей. Оказалось, что в полной мере активностью антител не обладает ни одна из цепей. Активные центры антител образуются только при совместном участии N-концевых половин тяжелой и легкой полипептидных цепей. Специфичность же активного центра определяется первичной структурой той и другой полипептидной цепи, т. е. генетически предопределена. Это подтверждается следующим опытом. Если поместить IgG в концентрированный раствор гуанидинхлорида, то это приведет к полному развертыванию полипептидных цепей из-за разрушения вторичной и третичной структуры и к утрате антительных свойств. Однако после длительного диализа и удаления таким путем гуанидинхлорида иммуноглобулин вновь приобретает первоначальную структуру и восстанавливает антительную активность.
Для выяснения природы специфичности антител большое значение имело изучение аминокислотной последовательности L– и Н-цепей. Как было установлено, все легкие цепи состоят из двух почти равных областей, по 110 – 112 аминокислотных остатков каждая. Первые 110 аминокислотных остатков очень изменчивы, т. е. составляют вариабельную (V) область, а остальные 110 остатков у данного вида всегда постоянны, составляя константную (C) область L-цепи. Тяжелая цепь также состоит из вариабельной области (VH), включающей около 110 аминокислотных остатков, и константной части (CH), на долю которой у молекул IgG приходится около 330 аминокислотных остатков. При более детальном исследовании аминокислотного состава в вариабельных участках L– и Н-цепей установлено наличие в них основных каркасных последовательностей и трех (у L-цепи) и четырех (у Н-цепи) коротких гипервариабельных участков:
у L-цепи – 24 – 34; 50 – 56; 89 – 97;
у Н-цепи – 31 – 37; 51 – 68; 84 – 91; 101 – 110.
Каркасная последовательность состоит из четырех постоянных участков, которые определяют аллотип цепей. Гипервариабельные последовательности определяют структуру активного центра. Он представляет собой своеобразную щель, которая обладает структурной дополнительностью к детерминантной группе «своего» антигена. Антитело только тогда свяжет соответствующий антиген, когда его детерминантная группа полностью вместится в щель активного центра, подобно тому, как ключ полностью входит в замочную скважину. Поскольку активный центр для каждого возможного антигена предопределен первичной структурой L– и Н-цепей, это обстоятельство свидетельствует об уникальном механизме генетического контроля биосинтеза антител. Легкие и тяжелые цепи иммуноглобулинов состоят из отдельных блоков – доменов (см. рис. 64). Каждый домен – это пептид, образованный из 100 – 110 аминокислотных остатков и содержащий одну внутрицепочечную петлю, которая возникает вследствие замыкания дисульфидного мостика внутри цепи. В легких цепях имеется два домена: один вариабельный и один константный; в тяжелых – один вариабельный и три или четыре (в зависимости от класса иммуноглобулина) константных. Активные центры антител образуются доменами вариабельных участков обеих цепей. Домены константных участков ответственны за другие функции молекул антител: домены CL и CH1 определяют изоантигенные различия антител; в области доменов CH2 и CH3 расположены рецепторы, ответственные за связывание C1q компонента комплемента, фиксацию антител на клетках и другие свойства (табл. 13).
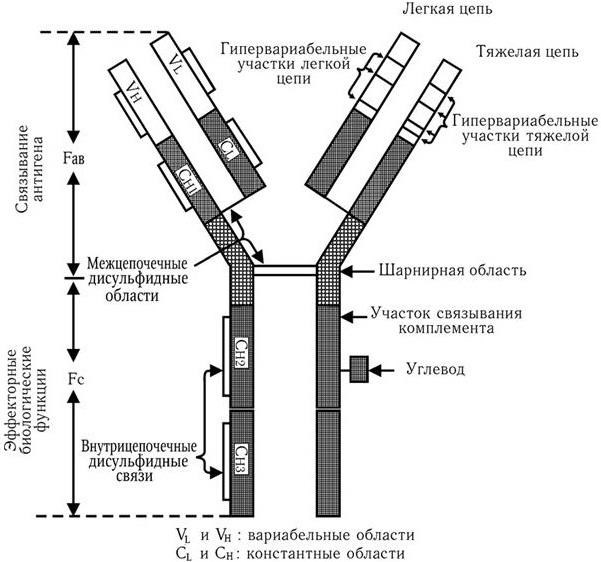
Рис. 64. Структура молекулы IgG. Показана локализация участков, ответственных за различные функции (по: Д. Джеске, Дж. Капре, 1987)
С доменом CH2 связаны также цепочки углеводов. Иммуноглобулины различных классов значительно отличаются по числу и локализации углеводных групп, хотя ряд олигосахаридов располагается в гомологичных положениях – между доменами или на их поверхности. Углеводные компоненты иммуноглобулинов имеют сходное строение. Они состоят из постоянного ядра (внутренняя часть олигосахаридной цепи) и вариабельной наружной части, определяющей специфичность углеводов. Углеводные компоненты влияют на реализацию биологических свойств антител в норме и обусловливают необычные свойства молекул при различных заболеваниях.
В молекуле IgG имеется единственный участок гликозилирования на Н-цепи, к которому могут присоединяться более 30 типов N-гликозилсахаров, что обусловливает микрогетерогенность молекул IgG. Наружные участки сахаров молекул иммуноглобулинов выступают в роли участков связывания с различными клеточными и белковыми рецепторами. Роль углеводов заключается, очевидно, в том, что они участвуют в транспорте и секреции гликозилированных белков молекул антител. Кроме того, они поддерживают конформацию доменов, необходимую для их функций, и защищают антитела от разрушения, прикрывая места, чувствительные к протеолизу.
Участок тяжелых цепей, соединяющий СН1 с Fc-фрагментом молекулы антитела, называется шарнирной областью; они у γ-, α– и δ-цепей не похожи на домены. У каждого класса тяжелых цепей шарнирная область имеет своеобразное строение, они представляют наиболее вариабельную часть тяжелых цепей и в связи с этим обусловливают различия между классами иммуноглобулинов по аминокислотной последовательности и варьированию сегментной гибкости.
Антитела, будучи сложными гликопротеидными молекулами, сами по себе также являются антигенами. В их составе различают три типа антигенных детерминантов (эпитипов): изотипы, аллотипы и идиотипы.
Таблица 13
Биологические функции доменов иммуноглобулинов человека

Изотипы – детерминанты, по которым различаются классы и подклассы тяжелых цепей и варианты каппа– и лямбда– легких цепей.
Аллотипы – детерминанты, кодируемые аллелями данного иммуноглобулинового гена.
Идиотипы – антигенные детерминанты, образуемые активными центрами молекул антител.
Полное схематическое изображение структуры молекулы IgG представлено на рис. 64. На долю этого класса приходится около 75 % общего количества всех иммуноглобулинов сыворотки крови человека.
Электронно-микроскопические исследования показали, что антитела класса IgG – гибкие молекулы, имеющие Y-форму, в которой две «руки» представлены Fab-фрагментами, а «талия» – Fc-фрагментом. Молекула IgG имеет размеры 240 × 57 × 19. Иммуноглобулины других классов характеризуются таким же типом строения, имеются лишь некоторые различия в дополнительной организации их функциональных единиц.
IgM – иммуноглобулины класса М
На поверхности зрелых В-лимфоцитов молекулы IgM располагаются в виде мономеров. Однако в сыворотке они существуют в форме пентамеров: молекула IgM состоит из пяти структурных единиц, аналогичных IgG, которые соединены между собой дисульфидными связями и J-цепью. Пять мономерных субъединиц в молекуле располагаются радиально, их Fc-фрагменты обращены к центру, а Fab-фрагменты – кнаружи (рис. 65).
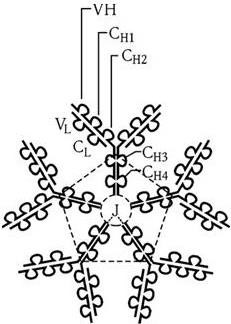
Рис. 65. Схема пентамерной молекулы IgM (по Д. Джеске, Дж. Капре, 1987)
Тяжелая цепь IgM (μ-цепь) состоит из 576 аминокислотных остатков, 124 из них образуют вариабельный домен, а 452 – четыре константных домена. Эта тяжелая цепь не имеет шарнирной области, ее роль выполняет домен СμН2, обладающий некоторой конформационной лабильностью. J-цепь (англ. join – соединять) представляет собой особый полипептид, необходимый для полимеризации IgM и IgA. Он имеет молекулярную массу 15 кД и состоит из 129 аминокислотных остатков и одного сложного углеводного компонента. Синтез J-цепи кодируется особым геном, расположенным в хромосоме, не содержащей генов иммуноглобулинов.
IgA – иммуноглобулины класса А
Иммуноглобулин А может иметь одну из трех форм: обычную, димерную или тримерную. В организме имеется два вида молекул IgA – сывороточные и секреторные. Сывороточные IgA составляют 10 – 15 % всех иммуноглобулинов. Секреторные IgA (IgAs), которые находятся в слюне, слизи, пищеварительных соках, секретах слизистой носа, в молозиве и обеспечивают местный иммунитет всех слизистых оболочек, состоят из двух Ig-мономеров, J-цепи и гликопротеина, или секреторного компонента (рис. 66).
У человека имеется два изотипа этого иммуноглобулина – IgA1 и IgA2, причем в сыворотке преобладает подкласс IgA1, а в экстраваскулярных секретах несколько больше содержится изотипа IgA2. Все α-цепи состоят из одного вариабельного домена, трех С-доменов и шарнирной области, домены Сα2 и Сα3 содержат по одной добавочной дисульфидной связи, которых нет у других классов иммуноглобулинов. Секреторный компонент вырабатывается эпителиальными клетками слизистых оболочек и присоединяется к молекуле IgA в момент прохождения последней через эпителиальные клетки. Секреторный компонент повышает устойчивость молекул IgAs к действию протеолитических ферментов. Иммуноглобулины А обладают следующими свойствами: 1) препятствуют связыванию антигенов со слизистыми оболочками; 2) осуществляют транспорт полимерных иммунных комплексов, содержащих IgA; 3) в процессе транспорта через эпителиальные клетки они нейтрализуют находящиеся в них вирусы. Значение иммуноглобулинов класса А в обеспечении местного иммунитета исключительно велико, так как общая площадь поверхности слизистой оболочки составляет несколько сот квадратных метров. Через нее происходит интенсивное экзогенное воздействие на иммунную систему. Но и сама слизистая активно участвует в формировании иммунитета. В ней содержится большое количество антителообразующих клеток. Лимфоциты слизистой оболочки синтезируют различные интерлейкины (IL-2, IL-4, IL-6), γ-интерферон. Клетки кишечного эпителия индуцируют пролиферацию супрессорных CD8-лимфоцитов, а респираторного – хелперных CD4-лимфоцитов.
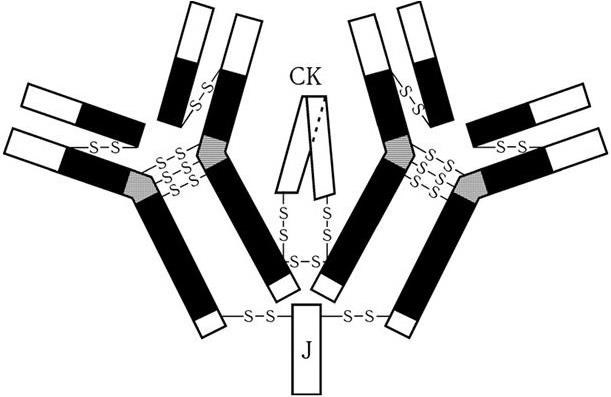
Рис. 66. Схема строения секреторного IgA человека. Соотношение размеров цепей соответствует истинному:
J – J-цепь; CK – секреторный компонент (по: Д. Джеске, Дж. Капре, 1987)
IgE – иммуноглобулины класса Е
Антитела этого класса содержатся в сыворотке крови в очень незначительных количествах. Молекулярная масса IgE составляет 190 кД, они содержат около 12 % углеводов. Тяжелая цепь (ε-цепь) состоит из 550 аминокислотных остатков, имеет один вариабельный и четыре константных домена. Основная роль антител этого класса заключается в том, что они своими Fc-фрагментами прикрепляются к мастоцитам и базофилам и опосредуют реакции гиперчувствительности немедленного типа.
IgD – иммуноглобулины класса D
IgD наряду с IgM являются главными мембранными рецепторами зрелых В-лимфоцитов. Тяжелая цепь (δ-цепь) состоит из вариабельного и трех константных доменов. Константная область δ-цепи человека построена из 383 аминокислотных остатков, следовательно, ее домены длиннее С-доменов γ– и α-цепей, но короче С-доменов ε– и μ-цепей. Шарнирная область δ-цепи – самая длинная, она состоит из 64 аминокислотных остатков, локализация углеводов в δ-цепи также необычна. Все это, возможно, имеет большое значение для функции IgD.
Валентность антител
Под валентностью антител понимают количество способных реагировать с антигеном активных центров. В соответствии с указанными различиями молекулярной организации, иммуноглобулины разных классов бывают двухвалентными (IgG) или поливалентными (IgM). Являясь пентамерами, молекулы IgM имеют десять активных центров. Это свойство антител выявляется при взаимодействии их с антигенами: связываясь с аналогичными антигенными детерминантами, расположенными на разных, например бактериальных клетках, IgG и IgM вызывают их видимую агрегацию. Мономерные же молекулы IgA, хотя и имеют два активных центра, не осаждают антигены, так как их активные центры настолько сближены, что IgA не может выполнять роль связующего мостика.
Наряду с двухвалентными, или полными, антителами, при некоторых заболеваниях в организме человека накапливаются так называемые неполные, или моновалентные антитела. Соединяясь с антигеном, они не могут вызвать его агрегацию, так как связь между ними происходит только в одном из двух активных центров, а лишь блокируют его. Это не значит, что второй активный центр в таких антителах отсутствует. По неизвестным причинам он замаскирован, не проявляется. Присутствие неполных (блокирующих) антител выявляют с помощью антиглобулиновой реакции Кумбса (см. главу 42).
Особенности генетического контроля биосинтеза антител
Антитела могут быть получены к любому возможному антигену, общее количество которых превышает 107. Какие же механизмы обеспечивают появление огромного разнообразия иммуноглобулинов с различной антительной специфичностью? Антитела – это белки, а синтез каждого белка запрограммирован соответствующим геном. Генотип человека составляет около 100 000 генов. Поэтому долгое время вопрос о том, как осуществляется генетический контроль синтеза антител, оставался неясным, так как господствовал принцип: один ген – один белок. В 1965 г. У. Дрейер и Дж. Беннетт высказали предположение о том, что синтез иммуноглобулинов контролирует один для каждого класса С-ген и множество V-генов, расположенных отдельно от С-гена. Эта гипотеза нашла подтверждение в 1977 г. Используя набор рестриктаз, С. Тонегава с сотрудниками установили, что в эмбриональных клетках мышей участки ДНК, кодирующие V– и С-домены легкой цепи λ, находятся на далеком расстоянии друг от друга, а в зрелых клетках – значительно ближе. Клонирование этих генов показало, что в них отсутствуют нуклеотиды для 13 аминокислот. Они были обнаружены на расстоянии в несколько тысяч нуклеотидных пар от остальной части V-гена и получили название J-сегмента. Последний располагается около С-гена. Было установлено, что ген, кодирующий λ-цепь, имеет следующую экзон-интронную структуру: L (область, кодирующая лидерный пептид, необходимый для секреции иммуноглобулинов из клетки) – интрон – V-ген – интрон – J-ген – интрон – С-ген. В ДНК людей обнаружены шесть С-генов для λ-цепи, перед каждым из них имеется свой J-ген. Позднее было показано, что синтез γ-цепи контролируется 300 вариантами V-гена и 4 вариантами J-гена. Рекомбинации этих генов позволяют получить 1200 (300 × 4) вариантов различающихся по своей специфичности L-цепей.
Организация генов Н-цепи также имеет особенности:
1. Существует 9 разных С-генов, кодирующих С-домены Н-цепей различных изотипов (γ1, γ2, γ3, γ4, α1, α2, μ, ε, δ).
2. V-гены тяжелой цепи состоят не из двух сегментов, а из трех: V-, D-, J-. D-сегмент (англ. diversity – разнообразие) кодирует от 1 до 9 аминокислотных остатков.
3. Любой из V-генов тяжелой цепи может соединяться с любым из С-генов.
4. Все С-гены, как и V-гены, имеют экзон-интронную структуру. Каждый домен кодируется отдельным экзоном, между последними расположены интроны.
5. В ходе иммунного ответа V-гены тяжелой цепи могут переключаться с С-гена одного класса на С-гены другого класса, что приводит к появлению антител одной и той же антительной специфичности, но принадлежащих к разным классам (IgM, IgG, IgA, IgE, IgD).
В общей сложности синтез Н-цепей иммуноглобулинов контролируют 200 вариантов V-генов, 20 вариантов D-генов, 4 варианта J-генов и 9 вариантов С-генов. Схематически полный ген Н-цепи иммуноглобулинов выглядит таким образом: L-ген – интрон – V-ген – интрон – D-ген – интрон – J-ген – интрон – С-ген.
Организация генов иммуноглобулинов в эмбриональном и соматическом геномах различна. В эмбриональном геноме зародышевые V-гены (как L-цепи, так и Н-цепи) отделены от участков С-генов, D– и J-сегментов многими тысячами пар нуклеотидов. В соматических клетках эти сегменты сближаются, хотя по-прежнему сохраняют экзон-интронную структуру. Сборка V-генов и сближение их с D-, J– и С-генами происходят с помощью особых сигнальных последовательностей, которые расположены на 3'-концах всех зародышевых V-генов и в инвертированном виде – на 5'-концах всех зародышевых J-генов. У D-сегментов сигнальные последовательности располагаются и на 5'-, и на 3'-концах.
Формирование полного гена L-цепи молекулы иммуноглобулина происходит следующим образом. Путем рекомбинации вначале лидерный сегмент с его интроном сливается с одним из V– и с одним из J-генов. Одновременно при этом происходит их сближение с С-геном. Образующийся блок из экзонов и интронов транскрибируется в единую мРНК. После этого все интроны из нее вырезаются и формируется с помощью механизма сплайсинга зрелая мРНК, представленная только генами V, J, C, которая и транслируется в единую цепь.
Благодаря избирательному соединению одного из V-генов с одним из J-генов подавляется выражение остальных V– и J-генов в данной лимфоидной клетке. Таким же образом происходит формирование гена и для Н-цепи, только в нем участвует и D-сегмент. Кроме того, в случае образования Н-цепи имеется дополнительная рекомбинация, с помощью которой происходит переключение синтеза тяжелой цепи одного класса на синтез тяжелой цепи другого класса. Обычно вначале синтезируются иммуноглобулины класса IgM, а затем происходит переключение на синтез иммуноглобулинов класса IgG или других классов.
Таким образом, существует три системы генов иммуноглобулинов: две – для L-цепи (одна – для λ, другая – для χ) и одна – для Н-цепи.
Общее число возможных рекомбинаций для Н-цепей иммуноглобулинов составляет:
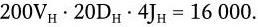
Общее же число возможных рекомбинаций для всех иммуноглобулинов составляет:
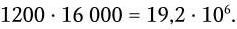
Точки объединения зародышевых генов строго не фиксированы. Это увеличивает количество возможных вариантов полипептидных цепей, а в том случае, когда они участвуют в формировании активных центров, то и их разнообразия. Кроме того, в период созревания В-лимфоцитов в V-генах происходят точечные соматические мутации, которые окончательно подгоняют структуру активного центра антитела к структуре детерминанта антигена. Считается, что общее количество вариантов антител возрастает за счет неточности сплайсинга и соматических мутаций еще в 100 раз и составляет около 2 млрд:

Таким образом, приобретенный иммунитет может быть обеспечен к любому возбудителю, к любому возможному чужеродному антигену. Решающий вклад в обеспечение многообразия иммуноглобулинов (специфичности антител) вносят следующие факторы:
1) наличие множества зародышевых генов иммуноглобулинов;
2) внутригенные рекомбинации, обусловленные экзон-интронной структурой V-, D-, J-, C-генов;
3) ассоциация различных L-цепей с различными Н-цепями;
4) неточность сплайсинга;
5) соматические мутации V-генов в зрелых В-лимфоцитах.
Роль антител в формировании иммунитета
Благодаря своей способности специфически взаимодействовать с бактериальными клетками и продуктами их жизнедеятельности, в том числе с токсинами и ферментами, а также с другими микроорганизмами, антитела играют важную роль в формировании приобретенного постинфекционного, поствакцинального и пассивного иммунитета. Эта их роль заключается в том, что связываясь с токсинами, они нейтрализуют их действие и обеспечивают формирование антитоксического иммунитета. Связываясь с вирусами, особенно блокируя рецепторы, с помощью которых они адсорбируются на клетках, антитела создают иммунитет против вирусов. Образование комплекса антитело + антиген запускает классический путь активации системы комплемента со всеми его эффекторными последствиями (лизис бактерий, опсонизация, формирование очага воспаления, стимуляция системы макрофагов). Антитела, взаимодействуя с бактериями, опсонизируют их, т. е. делают их фагоцитоз более эффективным. В результате взаимодействия антител с растворимыми антигенами, выделяющимися в кровь, образуются так называемые циркулирующие иммунные комплексы, с помощью которых антигены выводятся из организма, в основном, желчью и мочой.
Следовательно, специфически распознавая антигены и связываясь с ними, антитела стимулируют активность всех систем иммунитета и тем самым способствуют освобождению организма от чужеродных агентов.
Разные классы иммуноглобулинов в неодинаковой степени участвуют в различных иммунологических реакциях.
Высокая нейтрализующая активность антител, принадлежащих к IgG, свидетельствует о важной роли их в антитоксическом иммунитете. Антитела IgM особенно активны в реакциях фагоцитоза с корпускулярными антигенами и поэтому играют существенную роль в антимикробном иммунитете. В реакциях нейтрализации вирусов особенно активны антитела IgA, следовательно, им принадлежит большая роль в противовирусном иммунитете. Кроме того, секреторные IgAs обусловливают местный иммунитет слизистых оболочек. Наконец, антитела IgE, обладающие гомоцитотропностью, опосредуют реакции гиперчувствительности немедленного типа.
Выработка антител по первичному и вторичному иммунному ответу
Различают два варианта выдачи иммунного ответа в форме биосинтеза антител: первичный ответ – после первой встречи организма с данным антигеном, и вторичный ответ – при повторном контакте его с одним и тем же антигеном спустя 2 – 3 недели. Внешне первичный и вторичный иммунный ответ различаются по следующим признакам (рис. 67): продолжительность латентного периода, скорость нарастания титра антител, общее количество синтезируемых антител, последовательность синтеза иммуноглобулинов различных классов. Клеточные механизмы первичного и вторичного иммунного ответа, как будет показано ниже, также отличаются.
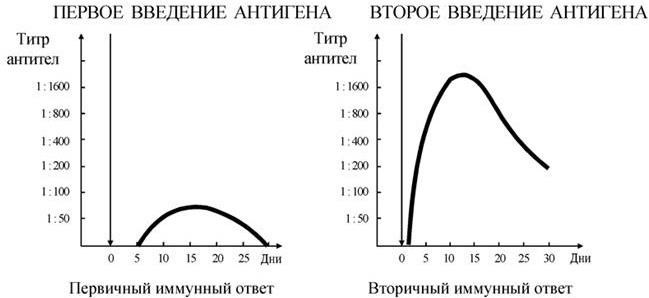
Рис. 67. Выработка антител при первичном и вторичном иммунном ответе
Первичный иммунный ответ. 1) Биосинтез антител начинается не сразу после контакта с антигеном, а после некоторого латентного периода, продолжающегося 3 – 5 дней. В течение этого периода происходит процесс распознавания антигена и формирования клеток, которые способны синтезировать антитела к нему; 2) скорость синтеза антител относительно невелика; 3) титры синтезируемых антител не достигают максимальных значений; 4) первыми синтезируются антитела, относящиеся к иммуноглобулинам класса IgM, затем IgG. Позже всех появляются, да и то не во всех случаях, IgA и IgE.
Вторичный иммунный ответ. 1) Латентный период очень непродолжительный, в пределах нескольких часов; 2) кривая, характеризующая скорость накопления антител, идет значительно круче вверх, чем при первичном ответе, и имеет логарифмический характер; 3) титры антител достигают максимальных значений; 4) синтезируются сразу антитела, относящиеся к классу IgG.
Вторичный иммунный ответ обусловлен формированием клеток иммунной памяти.
Регуляция продукции антител
Существуют по крайней мере три системы регуляции продукции антител, или, в более широком плане, силы иммунного ответа. Одна из них действует на генетическом уровне, другая – на нейрогуморальном. Не исключено, что вторая подчинена первой. Давно было замечено, что введение одного и того же антигена индуцирует у разных индивидуумов данного вида появление различного количества антител: от нуля до высокого уровня. Исследование детей с наследственными иммунодефицитами позволило установить, что существуют разные генетические системы контроля иммунного ответа. Организм человека может быть неполноценным в отношении синтеза антител к определенному антигену или антител определенного класса иммуноглобулинов и в то же время выдавать нормальный иммунный ответ на другие антигены. Гены Ir, ответственные за силу иммунного ответа, тесно сцеплены с локусами главной системы гистосовместимости человека. Описано более 20 генов иммунного ответа.
Вместе с тем продукция антител регулируется и симпатико-адреналовой системой. Показано, что генерализованное возбуждение медиальных зон гипоталамуса ведет к резкому усилению продукции антител. Такой же эффект вызывает гормон роста, образуемый гипофизом. Наоборот, воздействие на симпатическую систему, ведущее к ослаблению адренергического звена регуляции, сопровождается сильным угнетением продукции антител вплоть до полного исчезновения их из сыворотки.
Третья система регуляции содержания антител связана с идиотип-антиидиотипическими отношениями.
Образование клеток иммунной памяти
Иммунная память – одна из форм иммунного ответа. Она означает способность организма человека или животного реагировать на повторное введение того антигена, которым он был иммунизирован ранее, быстрее и с большей силой. Иммунная память на клеточном уровне – это результат генерации особых антигенспецифических популяций T– и B-клеток памяти (Tп и Bп). Она проявляется как в отношении выработки антител, так и в отношении других форм иммунного ответа и может сохраняться долгое время.
Клетки памяти представляют собой ту часть Т– и В-антигенстимулированных лимфоцитов, которые после 2 – 3 делений переходят в покоящееся состояние и длительное время рециркулируют в организме. Таким образом, они служат своеобразным резервом иммунокомпетентных клеток, способных при повторной встрече с соответствующим антигеном быстро превращаться в клетки-эффекторы иммунного ответа. В-лимфоциты в этом случае быстро трансформируются в антителообразующие клетки, и выработка антител происходит по вторичному типу. В свою очередь антигенстимулированные Т-лимфоциты, циркулируя в организме, готовы в любой момент распознать антиген, который их сенсибилизировал, и немедленно включиться в иммунный ответ.
Следовательно, возникновение и поддержание популяции клеток иммунной памяти – одно из главных условий длительного сохранения приобретенного иммунитета. Состояние иммунной памяти обусловлено не столько присутствием долгоживущих клеток памяти, сколько постоянной стимуляцией их образования антигенами, которые длительно сохраняются в организме. Антигены могут долгое время сохраняться на поверхности фолликулярных дендритных клеток и в различных других клетках вне лимфоидной системы, постоянно воздействуя на иммунокомпетентные клетки.
Предполагается, что процесс дифференциации зрелых В-лимфоцитов в клетки памяти происходит на ранних стадиях иммунного ответа в зародышевых центрах, формирующихся в фолликулах лимфоидной ткани. Он зависит от сигнала, который получает митогенный рецептор В-клетки (мембранный белок CD40) от Т-хелпера. Этот сигнал и «разрешает» В-лимфоциту пойти по пути генерации клеток памяти. Сигнал В-лимфоциту передает мембранный рецептор Т-хелпера – гликопротеин gp39, который служит лигандом, т. е. связывающей молекулой, для белка CD40. Следовательно, формирование клеток памяти требует кооперативного участия В-клеток, Т-хелперов и фолликулярных дендритных клеток.
Антигензависимые неспецифические иммуноглобулины
У неиммунизированных людей и животных в сыворотке крови содержится около 2,5 – 7,0 % иммуноглобулинов, значительную часть которых составляют так называемые неспецифические иммуноглобулины (НИГ), т. е. иммуноглобулины с неустановленной антительной специфичностью. Поскольку их синтез также индуцируется данным антигеном, они получили название антигензависимых НИГ. Существует тесный параллелизм между образованием специфических и неспецифических иммуноглобулинов. Установлено, что антитела (специфические иммуноглобулины) и НИГ синтезируются клетками разных субпопуляций B-лимфоцитов. Количество НИГ при первичном иммунном ответе может превышать количество специфических антител в 10–100 раз. Синтез НИГ может быть индуцирован и в покоящихся B-клетках, но только при условии прямого контакта T– и B-клеток за счет антигенспецифического взаимодействия. У B-лимфоцитов есть маркер Ly-1 (СД5). По этому маркеру различают B-1a-лимфоциты (СД5+) и B-1b-лимфоциты (СД5–). Синтез антигенспецифических антител осуществляют лимфоциты B-2 («обычные» лимфоциты).
СД5 – типичный мембраносвязанный белок-рецептор. Он есть у большинства тимоцитов, всех зрелых Т-лимфоцитов и других клеток. Лиганды СД5 имеют разные клетки: лимфоидного, миелоидного и эпителиального происхождения, поэтому СД5+ B– и T-клетки взаимодействуют не только друг с другом, но и с другими клеточными популяциями. В отличие от B-2-лимфоцитов клетки B-1 используют ограниченный набор Ig-генов, поэтому они обладают специфическим антительным рецептором, главным образом IgM-изотипа, а их переключения на IgG-изотип практически не происходит, вследствие чего клетки B-1 продуцируют только IgM антитела, т. е. НИГ. Считается, что НИГ выполняют функции первой линии защиты от микробных и вирусных патогенов. Однако активация B-1a– и B-1b-клеток под действием микробных антигенов может быть и вредной. Установлено, что СД5+ B-клетки играют существенную роль в образовании аутоантител. Количество СД5+ B-клеток заметно увеличивается при ряде аутоиммунных заболеваний.
Моноклональные антитела
Моноклональные антитела – антитела, синтезируемые и секретируемые одним клоном антителообразующих клеток, т. е. клеток, генетически идентичных, происходящих из одного и того же зрелого В-лимфоцита. Поэтому все свойства моноклональных антител: класс иммуноглобулина, структура полипептидных цепей и активных центров, т. е. антительная специфичность, – идентичны. Они распознают только один антиген и взаимодействуют только с ним. В связи с этим значительно повышается и специфичность всех иммунологических реакций, протекающих с участием моноклональных антител. Образование в организме моноклональных антител было обнаружено давно, в частности при плазмоцитомах – при развитии лимфоидных опухолей. В этом случае в организме больного происходит размножение какого-то одного клона лимфоцитов. Синтезируемые ими миелоидные иммуноглобулины представляют собой моноклональные антитела, обладая одной и той же антительной специфичностью. Вместе с тем плазмоцитомные клетки способны, подобно другим раковым клеткам, бесконечно размножаться in vitro.
Искусственное получение клеток-продуцентов моноклональных антител оказалось возможным после того, как в 1975 г. Г. Кёлер и К. Мильштейн разработали методику получения клеточных гибридов – гибридоmм. Они осуществили слияние лимфоцитов селезенки мыши, иммунизированной бараньими эритроцитами, с культивируемыми клетками миеломы и установили, что некоторые из полученных гибридоmм секретируют антитела к бараньим эритроцитам. Для получения гибридmом были использованы такие штаммы миеломных клеток, которые не содержат фермента гипоксантинфосфорибозилтрансферазы и поэтому гибнут в селективной питательной среде – ГАТ (содержащей гипоксантин, аминоптерин и тимидин); лимфоциты в такой среде не погибают. Для слияния лимфоцитов с миеломными клетками был использован полиэтиленгликоль, так как под его влиянием сливаются преимущественно размножающиеся или активированные с помощью антигена В-лимфоциты. Возникающие при слиянии клеток гибридомы наследуют от иммунных В-лимфоцитов способность синтезировать иммуноглобулины только одной антительной специфичности и способность размножаться в селективной среде с ГАТ, а от миеломной клетки – способность к бесконечному размножению.
Процесс получения гибридmом довольно сложен и включает в себя следующие основные стадии:
1. Получение линии миеломных клеток. Чаще всего с этой целью применяют мышиные или крысиные клеточные линии.
2. Получение иммунных В-лимфоцитов (антителообразующих клеток) из селезенки иммунизированного соответствующим антигеном животного.
3. Создание таких условий в культурах смешанных клеток, при которых хотя бы некоторые клетки той и другой популяции могли осуществить слияние. Частота слияния относительно невелика: одна гибридома образуется примерно на 104 клеток.
4. Выделение гибридmом и отбор из них интересующего клона.
5. Накопление клеток полученного клона для его практического использования.
Образующиеся на всех стадиях клетки консервируют в жидком азоте, чтобы в любой момент можно было возвратиться на соответствующую стадию и сохранить нужные клоны. Отбор клеток интересующего клона, т. е. продуцирующих антитела заданной специфичности, – наиболее важная стадия гибридомной технологии, так как новообразованные гибридомы нередко являются нестабильными в отношении синтеза антител. Обнаруженные клоны антителообразующих гибридоmм должны быть немедленно реклонированы. Это связано с тем, что после слияния многие гибридные клетки начинают выбрасывать «лишние» хромосомы, пока число их не окажется равным диплоидному набору, поэтому существует опасность утраты той хромосомы, которая несет гены иммуноглобулинов. Путем клонирования полученных гибридоmм возможно разделить моноклональные антитела, специфичные в отношении одних и тех же или различных эпитопов одного антигена, т. е. получить набор моноклональных антител против различных, фактически любых, эпитопов определенной молекулы, или иммуногена. Одно из преимуществ гибридоmм заключается в том, что с их помощью можно получить неограниченное количество антител, которые сохраняют свою высочайшую специфичность и чувствительность. Моноклональные антитела используют для исследования структуры и функций разных частей молекул, а также различных типов клеток, например деталей строения рецепторов Т– и В-лимфоцитов.
Гибридомы можно создавать не только на основе В-лимфоцитов с целью получения моноклональных антител, но и на основе Т-лимфоцитов для получения клонов гибридmом, избирательно синтезирующих те или иные лимфокины. Этим термином обозначают не относящиеся к иммуноглобулинам белки и полипептиды, синтезируемые и секретируемые активированными Т-лимфоцитами. Идентифицированные лимфокины называют интерлейкинами.
Назад: Глава 30 Главная система гистосовместимости
Дальше: Глава 32 Другие формы иммунного ответа. Реакции повышенной чувствительности

