Книга: Медицинская микробиология, иммунология и вирусология
Назад: Глава 29 Приобретенный иммунитет. Антигены
Дальше: Глава 31 Приобретенный иммунитет. Формы иммунного ответа. Антитела
Глава 30 Главная система гистосовместимости
В зависимости от степени генетического родства организмов различают ткани и, соответственно, трансплантаты сингенные, аллогенные и ксеногенные. Сингенные трансплантаты (изотрансплантаты) приживаются хорошо, так как иммунная система реципиента не распознает их как чужеродные. На пересадку аллогенной, отличающейся по изоантигенам, а тем более ксеногенной ткани индивидуумов разных видов организм отвечает трансплантационным иммунитетом, т. е. реакциями, направленными на отторжение генетически чужеродной ткани. Материальным субстратом несовместимости являются внутривидовые различия тканевых антигенов, т. е. изоантигены и их комбинации. Начало изучению изоантигенов положил К. Ландштейнер в 1901 г. Он описал изоантигены эритроцитов системы АВ0. Изоантигены эритроцитов человека изучены достаточно хорошо, их известно уже более 70.
Эритроцитарные изоантигены играют определенную роль в трансплантационном иммунитете, хотя значимость различных систем их в определении тканевой несовместимости неодинакова и антигенная дифференцировка тканей связана не только с ними. Существуют и другие системы изоантигенов ткани, в том числе и такие, которые главным образом ответственны за отторжение аллогенных трансплантатов. Они получили название трансплантационных антигенов, или антигенов гистосовместимости; гены, определяющие их синтез, называются Н-генами, или Н-локусами (англ. histocompatibility – тканевая совместимость). Трансплантационные антигены во многом определяют индивидуальную антигенную специфичность организма, в том числе и человека. Совокупность генов, определяющих синтез трансплантационных антигенов, получила название главной системы гистосовместимости, или кратко – системы МНС (англ. major histocompatibility complex). Общий план строения ее одинаков у всех млекопитающих. Он включает в себя несколько локусов, которые определяют синтез основных антигенов гистосовместимости, а также гены, контролирующие силу иммунного ответа, и некоторые другие.
У человека главная система гистосовместимости имеет второе название – система HLA (англ. human leucocyte antigens) в связи с тем, что контролируемые ею трансплантационные антигены HLA хорошо представлены на лейкоцитах. Гены системы МНС (HLA) у человека расположены на коротком плече хромосомы С6. В соответствии с решением Номенклатурной комиссии по лейкоцитарным антигенам (1985 г.) HLA-система включает в себя 7 генетических локусов, которые, помимо того что контролируют иммунный ответ на аллотрансплантаты, играют важнейшую роль в контроле клеточных взаимодействий, лежащих в основе иммунных реакций, а также синтезе некоторых компонентов системы комплемента. Эти локусы поделены на 3 класса.
К классу I относятся три локуса HLA – A, B и С. Они контролируют синтез антигенов (белков) МНС класса I: HLA-A включает 23 аллеля (нем. Allele – альтернативные варианты генов одного и того же локуса), определяющих синтез 23 антигенов класса I; HLA-B включает 49 аллелей, котoрые контролируют синтез 49 белков класса I; HLA-C включает 8 аллелей, контролирующих синтез 8 антигенов класса I.
К классу II относится область HLA-D, которая состоит из трех локусов: HLA-DR, HLA-DQ и HLA-DP. Эти гены контролируют синтез антигенов МНС класса II.
С областью HLA связаны также гены, контролирующие компоненты С2, С4А, С4В и Вf (фактор В пропердина) системы комплемента. Они обозначаются как белки класса III. Такое деление антигенов системы МНС на классы основано на различиях в их химической структуре и функциональных свойствах. Антигены класса I имеются на поверхности всех ядросодержащих клеток организма, но, по-видимому, в различном количестве.
Антигены класса II несут главным образом макрофаги и В-лимфоциты, в меньшем количестве они содержатся на некоторых активированных Т-лимфоцитах.
Антигены класса III (компоненты комплемента) встречаются только в крови, их нет на мембранах клеток. К системе МНС относятся и гены, контролирующие активность иммунной системы: гены Ir – силы иммунного ответа (англ. immune response) и гены Is – супрессии иммунного ответа (англ. immune suppress); они также сцеплены с областью HLA-D. Весь комплекс HLA состоит из 2 – 3 млн пар нуклеотидов.
Структура антигенов МНС класса I такова (рис. 63). Они представляют собой димерные гликопротеиды, которые состоят из тяжелой и легкой полипептидных цепей. Тяжелая цепь (45 кД) состоит из трех глобулярных внеклеточных (α1, α2, α3), гидрофобного трансмембранного и цитоплазматического доменов. К домену α1 с помощью N-гликозидной связи присоединяется короткая боковая углеводная цепочка. Домены α2 и α3 зафиксированы дисульфидными связями. С доменом α3 нековалентно связана легкая полипептидная цепь β-микроглобулин (11,6 кД), она кодируется геном, расположенным вне МНС. Детерминанты (эпитопы), распознаваемые антителами к антигенам класса I, расположены на внеклеточных доменах.
Антигены МНС класса II (Iα-антигены) состоят из двух пересекающихся полипептидных цепей: a (35 кД) и β (25 кД). Каждая цепь имеет два внеклеточных, гидрофобный трансмембранный и цитоплазматический домены. С помощью гидрофобных трансмембранных доменов полипептидные цепи «заякориваются» в мембране. В составе полипептидных цепей антигенов класса II и a-цепи антигенов класса I имеются константные домены (т. е. домены с постоянными аминокислотными последовательностями) и вариабельные (т. е. с вариабельными аминокислотными последовательностями) домены. Распознавание и связывание ими чужеродных антигенов, которые они затем представляют иммунокомпетентным клеткам, осуществляются особыми активными центрами, которые формируются за счет вариабельных доменов (один – от α-цепи, а другой – от β-цепи), соединенных на дне «щели» неспирализованной области, которая образуется сегментами обеих цепей. Антигены МНС класса I определяют индивидуальную антигенную специфичность, и они представляют любые чужеродные антигены Т-цитотоксическим лимфоцитам.
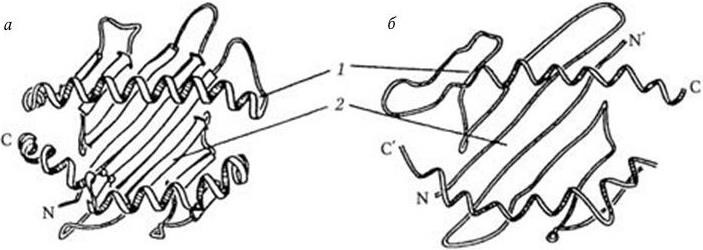
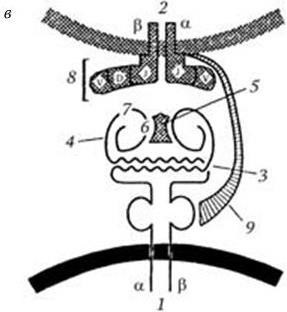
Рис. 63. Структура антигенсвязывающих участков молекул HLA класса I (а) и класса II (б) по Бьоркману (1987) и схема строения тримолекулярного комплекса (в), с дополнениями к схеме в обзоре Нельсон (1990):
а, б: 1 – альфа-спирали; 2 – платформа из восьми полос, образованная бета-складками дистальных доменов молекул HLA; в: 1 – антигенпредставляющая клетка; 2 – Т-лимфоцит; 3 – платформа антигенсвязывающего участка молекулы HLA класса II, образованная бета-складками ее дистальных доменов; 4 – альфа-спиральные структуры дистальных доменов молекулы HLA класса II, образующие боковые стенки углубления, в котором помещается антиген – 5; 6 – дезетоп; 7 – гистотоп; 8 – Т-клеточный рецептор; 9 – CD4-молекула (из обзора Сартаковой М. Л., Коненкова В. И., Успехи соврем. биол., 1997, т. 117, вып. 5, с. 568)
Назначение антигенов МНС класса II заключается в том, что они обеспечивают взаимодействие между макрофагами и В-лимфоцитами. Эти антигены необходимы на всех стадиях иммунологического процесса: на стадии представления антигена макрофагами Т-лимфоцитам, на стадии межклеточного иммунологического взаимодействия между макрофагами, Т– и В-лимфоцитами и на стадии дифференцировки иммунокомпетентных клеток. Антигены МНС класса II участвуют в формировании всех видов иммунного ответа: противомикробного, противоопухолевого, трансплантационного и др. На мембранах клеток-носителей антигены класса II располагаются независимо от антигенов класса I, рецепторных иммуноглобулинов и Fc-рецепторов. Количество антигенов класса II на мембранах фагоцитов возрастает при их активировании и в результате действия лимфокинов.
Структуры, с помощью которых белки МНС класса II и класса I связывают антигены, по уровню специфичности уступают только активным центрам антител.
Для обнаружения и типирования антигенов системы HLA вначале использовали метод агглютинации лейкоцитов, а сейчас используют в основном метод комплементзависимой цитотоксичности. С этой целью вначале лимфоидные клетки инкубируют с различными разведениями аллоиммунных сывороток, а затем с комплементом. Если искомый антиген присутствует на поверхности клетки, то произойдет ее лизис и гибель, опосредованная комплементом. Гибель клеток определяют либо биоскопически (по включению витального красителя), либо по выходу из предварительно меченных клеток изотопа.
С системой МНС связаны следующие иммунологические свойства:
1. Интенсивное отторжение трансплантатов тканей.
2. Стимуляция образования антител.
3. Стимуляция реакции в смешанной культуре лимфоцитов (стимуляция бласттрансформации).
4. Реакция «трансплантат против хозяина».
5. Клеточная реакция лимфолиза.
6. Контроль силы иммунного ответа (Ir-гены) и супрессия иммунного ответа (Is-гены).
7. Контроль синтеза некоторых компонентов системы комплемента (С2, С4А, С4В, В7).
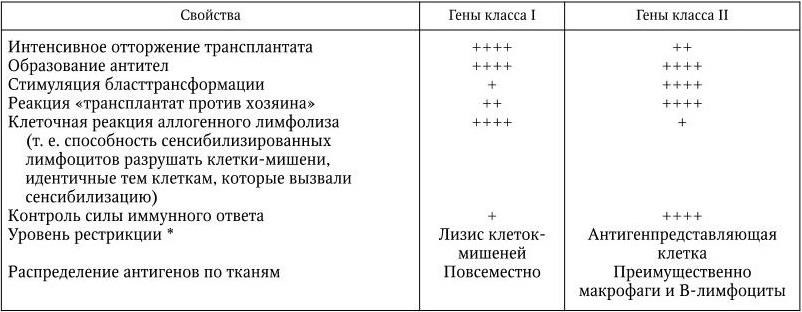
Проявление этих свойств определяется генами класса I и класса II в неодинаковой степени (табл. 10). В общей сложности аллели локусов HLA-A и HLA-B определяют синтез более 70 различных по специфичности трансплантационных антигенов. Однако гаплотип, то есть набор локусов МНС, наследуемый от одного из родителей, всегда представлен одним из локусов HLA-A и одним из локусов HLA-B. Поэтому в парной хромосоме каждого человека может быть не менее двух (если гаплотипы обоих родителей идентичны) и не более четырех (если гаплотипы различаются по всем четырем локусам) трансплантационных антигенов HLA-A и HLA-B. Из-за большого количества аллелей изоантигенов МНС вероятность подбора двух людей с одинаковыми трансплантационными антигенами крайне незначительна. В случае редких гаплотипов вероятность обнаружения двух людей с одинаковым фенотипом, согласно расчетам А. Данссета, равна 1: 7000.
Определение антигенов гистосовместимости имеет первостепенное значение при пересадке тканей. Чем больше совпадение донора и реципиента по системе HLA, тем лучше приживается и дольше сохраняется трансплантат. Поэтому создаются специальные банки, содержащие сведения о генотипах трансплантационных антигенов у тех лиц, которые нуждаются в пересадке тканей и органов.
Изучение антигенов гистосовместимости представляет большой интерес также и потому, что обнаружена статистически достоверная корреляция между некоторыми антигенами HLA и наклонностью лиц, у которых они имеются, к определенным болезням (табл. 11).
Таблица 10
Связь между свойствами МНС и классами генов
* Рестрикция (англ. restriction – ограничение) – способность продуктов генов МНС ограничивать функции Т-лимфоцитов в индукции, межклеточной кооперации и эффекторных механизмах иммунного ответа. Элементами рестрикции Т-цитотоксических лимфоцитов являются белки МНС класса I, Т-хелперов – белки МНС класса II.
Таблица 11
Взаимосвязь между некоторыми типами аллелей HLA и предрасположенностью их носителей к определенным болезням
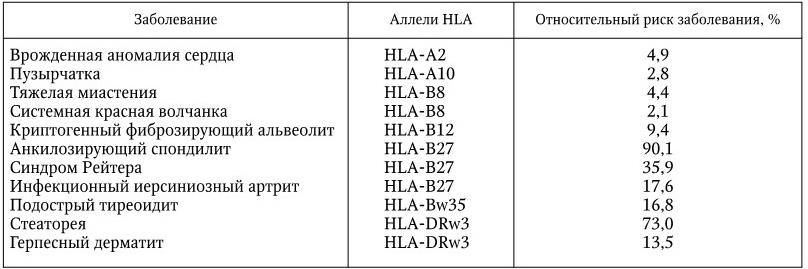
Например, 88 – 96 % людей, страдающих анкилозирующим спондилитом, имеют аллель HLA-B27. Хотя людей с такими аллелями встречается немного (8 – 12 % здоровых европейцев), но степень риска заболеть этой болезнью у них составляет 90 %. У лиц, имеющих аллели HLA-A3, выявляется иммунологическая дефектность в отношении некоторых вирусов. Причины такой связи между типами аллелей HLA и наклонностью их носителей к тем или иным заболеваниям в настоящее время интенсивно изучаются. Очевидно, у таких людей существует какая-то генетически обусловленная предрасположенность к возникновению таких болезней.
Назад: Глава 29 Приобретенный иммунитет. Антигены
Дальше: Глава 31 Приобретенный иммунитет. Формы иммунного ответа. Антитела

