19. Диалог генов и синапсов
В 1985 году представления, к которым я пришел в ходе занятий ночной наукой – многомесячных раздумий о белках, регулирующих экспрессию генов, – наконец нашли применение в моей дневной работе, посвященной экспрессии генов и долговременной памяти. Эти представления стали отчетливее после того, как в Колумбийский университет пришел Филип Гелет, постдок, учившийся в Англии у Сиднея Бреннера в Лаборатории Медицинского исследовательского совета в Кембридже. Мы с Гелетом рассуждали следующим образом: долговременная память требует кодирования новой информации и консолидации, то есть перевода на более постоянное хранение. Установив, что для долговременной памяти требуется отрастание новых синаптических связей, мы получили некоторое представление о том, какую форму имеет это более постоянное хранение. Но мы по‑прежнему не разобрались в промежуточных молекулярно-генетических этапах, то есть в самой природе консолидации памяти. Как мимолетные кратковременные воспоминания преобразуются в устойчивые долговременные?
Согласно модели Жакоба и Моно, сигналы из среды, окружающей клетку, могут активировать гены регуляторных белков, которые включают гены, кодирующие определенные структурные белки. Поэтому мы с Гелетом решили узнать, не задействованы ли в ключевом этапе перехода памяти из кратковременной в долговременную при сенсибилизации какие‑то аналогичные сигналы и аналогичные регуляторные белки. Мы хотели знать, не потому ли для долговременной памяти при сенсибилизации важно повторение, что оно обеспечивает передачу сигналов в ядро, вызывая активацию генов, кодирующих регуляторные белки, которые, в свою очередь, включают структурные гены, необходимые для отрастания новых синаптических связей. Если так, то консолидационная фаза работы памяти могла оказаться тем интервалом, который требуется регуляторным белкам для включения структурных генов. Тем самым мы предлагали генетическое объяснение того, что блокировка синтеза новых белков на определенном критическом промежутке времени (во время и вскоре после обучения) блокирует и отрастание новых синаптических связей, и преобразование кратковременной памяти в долговременную. Мы предположили, что, блокируя синтез белков, мы препятствуем экспрессии генов, кодирующих белки, необходимые для роста синаптических связей и тем самым для формирования долговременной памяти.
Мы обобщили свои представления в теоретической обзорной статье “Вкратце о долговременной памяти”, опубликованной в 1986 году в журнале Nature. В этой статье мы высказали предположение, что если для преобразования связанной с определенным синапсом кратковременной памяти в долговременную требуется экспрессия генов, то синапс в ходе обучения должен посылать в ядро клетки какой‑то сигнал, вызывающий включение определенных регуляторных генов. При формировании кратковременной памяти в синапсах используются циклический АМФ и протеинкиназа A, действующие внутри клетки и передающие сигнал, который вызывает выделение бльшего количества нейромедиатора. Мы с Гелетом выдвинули гипотезу, что при формировании долговременной памяти эта киназа проходит путь от синапса до ядра, где каким‑то образом активирует белки, регулирующие экспрессию генов.
Чтобы проверить гипотезу, нам нужно было определить, какой сигнал поступает от синапса в ядро, найти регуляторные гены, которые этот сигнал активирует, и затем определить, какие структурные гены включаются этими регуляторными генами, то есть какие гены отвечают за отрастание новых синапсов, лежащее в основе формирования долговременной памяти.
Упрощенные нейронные цепи, которые мы получили в тканевой культуре (единственный сенсорный нейрон, связанный с единственным мотонейроном), давали нам биологическую систему, вполне подходящую для проверки наших идей. В чашках с этой культурой мы использовали серотонин в качестве возбуждающего сигнала, поступающего на сенсорный нейрон при сенсибилизации. Однократное введение серотонина (соответствующее однократному удару током в ходе обучения) говорило клетке о том, что раздражитель имеет сиюминутное, кратковременное значение, а пятикратное введение (соответствующее пятикратному повторению удара в ходе обучения) предупреждало о длительном, долговременном значении раздражителя. Мы установили, что введение в сенсорный нейрон циклического АМФ в высокой концентрации вызывает не только кратковременное, но и долговременное повышение силы синапса. В нашей работе принял участие Роджер Цянь из Калифорнийского университета в Сан-Диего, и мы воспользовались разработанным им методом, который позволял увидеть, где в пределах нейрона сосредоточены циклический АМФ и протеинкиназа A. Мы обнаружили, что однократное введение серотонина повышает концентрацию циклического АМФ и протеинкиназы A преимущественно в районе синапса, а многократное приводит к еще более высоким концентрациям циклического АМФ, которые вызывают поступление протеинкиназы A в ядро, где она обеспечивает активацию генов. Последующие исследования показали, что активация генов осуществляется протеинкиназой A с помощью другой киназы, так называемой MAP-киназы, которая тоже связана с ростом синапсов и тоже поступает в ядро.
Тем самым мы подтвердили нашу гипотезу: для того чтобы многократное обучение вызвало долговременную сенсибилизацию (показывающую, что повторение – мать учения), необходимо, чтобы в ядро поступили соответствующие сигналы в форме киназ. Что делают эти киназы, оказавшись в ядре? Из опубликованных незадолго до того работ, выполненных на клетках, не относящихся к нервной системе, мы знали, что протеинкиназа A может активировать регуляторный белок CREB (cyclic AMP response element-binding protein – белок, связывающий элемент, реагирующий на циклический АМФ), который связывается с промотором (элементом, реагирующим на циклический АМФ). Это заставило нас предположить, что CREB может быть ключевым компонентом переключения, переводящего кратковременное усиление синаптической связи в долговременное и обеспечивающего отрастание новых связей.
В 1990 году, после того как к нам присоединились два постдока, Прамод Даш и Бенджамин Хохнер, нам удалось установить, что CREB присутствует в сенсорных нейронах аплизии и действительно необходим для долговременного усиления синаптических связей, лежащих в основе долговременной сенсибилизации. Блокируя работу CREB в ядре сенсорного нейрона в культуре, мы препятствовали долговременному, но не кратковременному усилению связей. Это был поразительный результат: блокируя единственный регуляторный белок, мы блокировали весь процесс долговременных синаптических изменений! Впоследствии наш постдок Душан Барч, творческий человек и блестящий экспериментатор, обнаружил, что простого введения в ядро сенсорного нейрона CREB, фосфорилированного протеинкиназой A, достаточно для того, чтобы включить гены, производящие долговременное усиление этих связей.
Таким образом, хотя меня давно учили, что гены нервной системы управляют поведением и безраздельно властвуют над нашей судьбой, исследования показали, что в нервной системе, как и в клетках бактерий, гены подчиняются среде. Их работой управляют события, происходящие в окружающем мире. Внешний раздражитель, такой как удар тока в заднюю часть тела животного, вызывает активацию модуляторных интернейронов, выделяющих серотонин. Этот серотонин действует на сенсорные нейроны, повышая в них концентрацию циклического АМФ, в результате чего протеинкиназа A и MAP-киназа поступают в ядро и активируют белок CREB. Активация CREB, в свою очередь, вызывает экспрессию генов, которая меняет клетку в структурном и функциональном отношении.
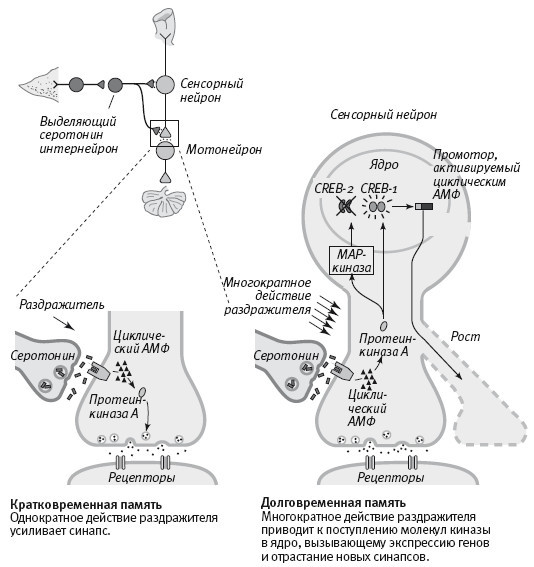
19–1. Молекулярные механизмы кратковременного и долговременного привыкания.
В 1995 году Душан Барч обнаружил, что на самом деле в соответствии с предсказаниями, которые можно было бы сделать на основе модели Жакоба и Моно, существует две формы белка CREB: одна (CREB-1) активирует, а другая (CREB-2) подавляет экспрессию генов. Многократное действие раздражителя приводит к тому, что протеинкиназа A и MAP-киназа поступают в ядро, где протеинкиназа A активирует CREB-1, а MAP-киназа инактивирует CREB-2. Таким образом, для долговременного усиления синаптических связей требуется не только включение одних генов, но и выключение других (рис. 19–1).
После этих замечательных открытий, сделанных у нас в лаборатории, меня поразили две вещи. Во-первых, мы видели, что модель регуляции генов Жакоба и Моно применима к процессу формирования памяти. Во-вторых, что открытая Шеррингтоном интегративная деятельность нейронов доходит до уровня ядра. Меня изумила эта аналогия: на клеточном уровне на нейрон поступают возбуждающие и тормозные синаптические сигналы, в то время как на молекулярном один регуляторный белок CREB способствует экспрессии генов, а другой ее подавляет. Противоположное действие белков суммируется, обеспечивая работу механизма регуляции.
Более того, противоположное регуляторное действие двух форм белка CREB обеспечивает наличие определенного порога для формирования памяти, который, вероятно, гарантирует обучение только важному, полезному для жизни опыту. Многократные удары током – это важный опыт для аплизии, точно так же, как умение играть на фортепиано или спрягать французские глаголы может быть важным опытом для нас: повторение – мать учения, потому что оно необходимо для долговременной памяти. Но состояние эмоционального напряжения, например вызванного автомобильной катастрофой, в принципе может позволить обойти ограничения, обычно наложенные на долговременную память. В подобной ситуации в ядро может сразу поступить достаточное количество MAP-киназы, чтобы инактивировать все молекулы CREB-2, тем самым облегчая работу CREB-1, активируемого протеинкиназой A, и опыт запишется в долговременную память. Возможно, именно этим объясняются так называемые мнемические фотовспышки (flashbulb memories) – яркие воспоминания о вызвавших сильные эмоции событиях, которые человек может восстановить в памяти во всех подробностях (как я могу вспомнить то, что произошло между мной и Митци), как будто вся картина события мгновенно и глубоко отпечаталась в мозге.
Необычайно хорошая память, которую демонстрируют некоторые люди, может, в свою очередь, быть связана с определяемыми генетически особенностями работы белка CREB-2, ограничивающего активность белка-репрессора, активируемого CREB-1. Хотя обычно для долговременной памяти требуются многократные повторения обучения, разделенные периодами отдыха, иногда она может возникать и после однократного события, не связанного с эмоциональным напряжением. Способность к обучению с первого раза была особенно хорошо развита у знаменитого российского мнемониста Соломона Вениаминовича Шерешевского, который, казалось, никогда, даже после десяти с лишним лет, не забывал ничего, что запомнил с первого раза. Большинство мнемонистов обладает более узкими способностями: они могут очень хорошо запоминать только какие‑то определенные разновидности опыта. Некоторые люди обладают поразительной памятью на зрительные образы, партитуры, шахматные партии, стихи или лица. Некоторые знатоки Талмуда из Польши могут воспроизвести в зрительной памяти каждое слово на каждой странице двенадцатитомного Вавилонского Талмуда, как будто эта страница (одна из нескольких тысяч) находится у них перед глазами.
Для возрастной потери памяти (доброкачественной старческой забывчивости), напротив, характерна пониженная способность к консолидации долговременных воспоминаний. Этот возрастной дефект может быть связан не только с ослаблением способности активировать CREB-1, но и с недостаточной силой сигналов для снятия тормозящего действия CREB-2 на консолидацию памяти.
Впоследствии было доказано, что обеспечиваемый CREB-белками перевод кратковременной памяти в долговременную работает одинаково у нескольких разных видов животных, что свидетельствует об эволюционной консервативности этого механизма. В 1993 году Тим Талли, специалист по генетике поведения из лаборатории в Колд-Спринг-Харбор на Лонг-Айленде в штате Нью-Йорк, разработал изящный метод изучения долговременной памяти, которая обеспечивает формирование приобретенного страха у мух. В 1995 году с Талли стал сотрудничать специалист по молекулярной генетике Джерри Инь, и вместе они установили, что для долговременной памяти дрозофилы необходимы CREB-белки. Как и у аплизии, CREB-активаторы и CREB-репрессоры играют в этом процессе ключевую роль. CREB-репрессор блокирует преобразование кратковременной памяти в долговременную. Что еще поразительнее, у специально выведенных мух-мутантов, производивших CREB-активатор в избыточном количестве, наблюдались аналоги мнемических фотовспышек. После нескольких повторов процедуры обучения, в ходе которой определенный запах сопровождался электрическим ударом, у нормальных мух вырабатывалась только кратковременная память, вызывающая страх перед этим запахом, а у мух-мутантов такое же количество повторов обеспечивало формирование долговременной памяти. Со временем выяснилось, что тот же механизм, обеспечиваемый CREB-белками, играет важную роль во многих формах имплицитной памяти у множества других видов, от пчел до мышей и людей.
Таким образом, совмещая анализ поведения вначале с клеточной нейробиологией, а затем с молекулярной биологией, мы смогли общими усилиями поучаствовать в закладке фундамента молекулярной биологии элементарных психических процессов.
Тот факт, что механизм преобразования кратковременной памяти в долговременную при обучении несложным реакциям оказался одинаковым у множества простых животных, обнадеживал нас и подтверждал убеждение, что базовые механизмы работы памяти эволюционно консервативны. Но с ним был связан непростой вопрос из области клеточной биологии нейронов. У одного сенсорного нейрона около 1200 синаптических окончаний, связывающих его примерно с 25 клетками-мишенями: мотонейронами жабр, мотонейронами сифона, мотонейронами чернильной железы и возбуждающими и тормозными интернейронами. Мы установили, что кратковременные изменения происходят лишь в некоторых из этих синапсов и не происходят в других. Это было вполне логично, потому что однократный удар током в заднюю часть тела или однократное введение серотонина вызывает локальное повышение концентрации циклического АМФ, затрагивающее только определенный набор синапсов. Но долговременные синаптические изменения требуют транскрипции генов, которая происходит в ядре и приводит к синтезу новых белков. Можно было ожидать, что эти белки будут поступать во все синаптические окончания нейрона. Тем самым, если только какой‑то особый клеточный механизм не ограничивает эффект изменений некоторыми определенными синапсами, долговременное усиление должно происходить во всех синаптических окончаниях нейрона. Если бы это было так, каждое долговременное изменение закреплялось бы во всех синапсах участвующих в этом процессе нейронов. Возникает вопрос, как обеспечивается локализация механизмов долговременного обучения и памяти в определенных синапсах.
Мы с Гелетом немало размышляли над этим вопросом и в 1986 году в своей обзорной статье в Nature предложили схему, которая стала известна под названием синаптической маркировки. Мы предположили, что мимолетные изменения в определенном синапсе, обеспечивающие кратковременную память, каким‑то образом маркируют его, и эта маркировка позволяет распознавать и задерживать белки в районе данного синапса.
Вопрос о том, как клетка направляет белки к определенным синапсам, как нельзя лучше подходил для Келси Мартин – необычайно одаренной специалистки по клеточной биологии, получившей двойную степень доктора медицины и доктора философии в Йельском университете. После окончания Гарвардского колледжа Келси и ее муж работали в Африке по программе Корпуса мира. Когда они начали исследования в Колумбийском университете, у них уже был сын Бен. В период работы Келси в нашей лаборатории у них родилась дочь Майя. Присутствие Келси придавало жизни нашей лаборатории особый дух – не только потому, что она с редким мастерством занималась наукой самого высокого уровня, но и потому, что у всех нас поднималось настроение, когда она с 16.00 до 18.00 превращала наш небольшой конференц-зал – столовую в веселый детский сад для одаренных детей.
Отследив поступление протеинкиназы A в ядро и обнаружив в нем CREB-белки, мы прошли по пути внутриклеточных реакций от синапса до ядра. Теперь нам предстояло пойти в обратном направлении. Нам с Келси нужно было выяснить, чем синапс сенсорного нейрона, обрабатываемый серотонином и претерпевающий долговременные структурные изменения, отличается от необработанных синапсов того же нейрона. Мы это сделали в культуре клеток с помощью полученной нами новой экспериментальной системы.
Мы выращивали отдельный сенсорный нейрон с разветвленным аксоном, образовывавшим синаптические связи с двумя разными мотонейронами. Затем мы имитировали поведенческое обучение, как и раньше, вводя в область синапсов серотонин, но при этом обрабатывая только синапсы, связывающие сенсорный нейрон с одним из двух моторных. Однократное введение серотонина, как и ожидалось, приводило к кратковременному усилению связи только в этих синапсах. Но и пятикратное введение серотонина вызывало долговременное усиление связи и отрастание новых синаптических окончаний только в тех синапсах, которые мы обрабатывали. Результат был удивителен тем, что для долговременного усиления связей и отрастания новых окончаний требуется активация генов CREB-белком, которая происходит в ядре клетки и должна, казалось бы, действовать на все ее синапсы. Когда Келси блокировала работу CREB-белка в ядре, это подавляло усиление связи и рост новых окончаний в области обрабатываемых синапсов (рис. 19–2).
Открытие продемонстрировало нам одно важное свойство вычислительных способностей нервной системы. Оно показало, что, хотя нейрон может образовывать тысячу или больше синаптических связей с разными клетками-мишенями, отдельные синапсы могут видоизменяться независимо при формировании как кратковременной, так и долговременной памяти. Независимость долговременной деятельности синапсов дает нейрону необычайную вычислительную пластичность.
Но чем обеспечивается эта поразительная избирательность? Мы рассмотрели два возможных ответа: что нейрон направляет информационную РНК и белки только к тем синапсам, которые маркированы для формирования долговременной памяти, и что информационная РНК и белки поступают ко всем синапсам нейрона, но только маркированные синапсы могут использовать их для отращивания новых окончаний. Начали мы со второй гипотезы, потому что ее было проще проверить.
Что же позволяет осуществлять эту “маркировку для роста”? Келси установила, что в маркированном синапсе должны происходить две вещи. Первая – просто активация протеинкиназы A. Если в области синапса не активируется протеинкиназа A, никакого усиления связи вообще не происходит. Вторая – активация механизма, управляющего локальным синтезом белков. Это было совершенно неожиданное открытие, позволившее по‑новому взглянуть на одну замечательную область клеточной нейробиологии, которую до того недооценивали и поэтому не обращали на нее особого внимания. В начале восьмидесятых годов Освальд Стьюард, теперь работающий в Калифорнийском университете в Ирвайне, обнаружил: несмотря на то что в подавляющем большинстве случаев синтез белков в нейронах происходит в теле клетки, некоторые белки синтезируются локально, непосредственно в синапсах.
Наше новое открытие указывало на то, что одна из функций локального синтеза белков состоит в поддержании долговременного усиления синаптических связей. Когда мы подавляли локальный синтез белка в области определенного синапса, процесс долговременного усиления все же запускался, и в этой области начинался рост новых окончаний с использованием белков, поступающих от тела клетки. Однако этот рост не поддерживался и через день обращался вспять. Таким образом, белков, синтезируемых в теле клетки и поступающих к окончаниям, достаточно для запускания синаптического роста, но для его поддержания необходимы белки, синтезируемые локально (рис. 19–3).
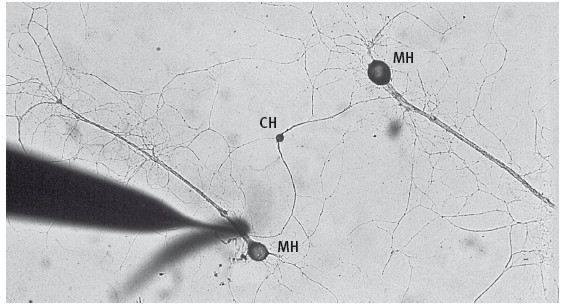
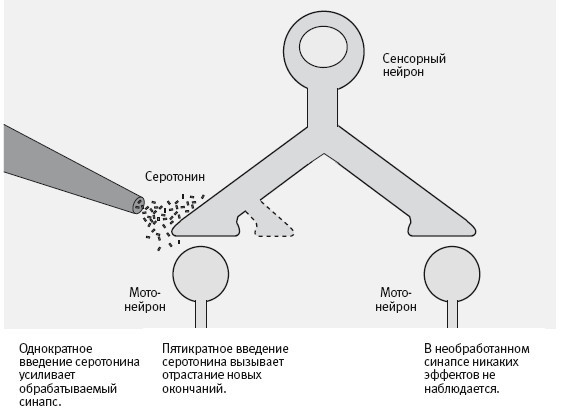
19–2. Экспериментальная система для изучения роли серотонина в синаптических изменениях. Сенсорный нейрон (обозначенный СН на фото вверху) с разветвленным аксоном образует синапсы с двумя мотонейронами (МН). Только на один из этих синапсов воздействуют серотонином. В результате только в этом синапсе происходят кратковременные и долговременные изменения. (Фото любезно предоставила Келси Мартин.)
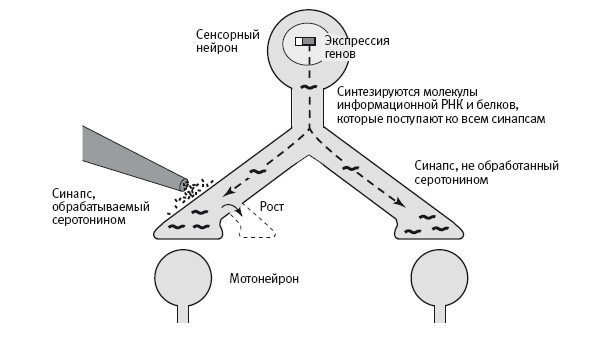
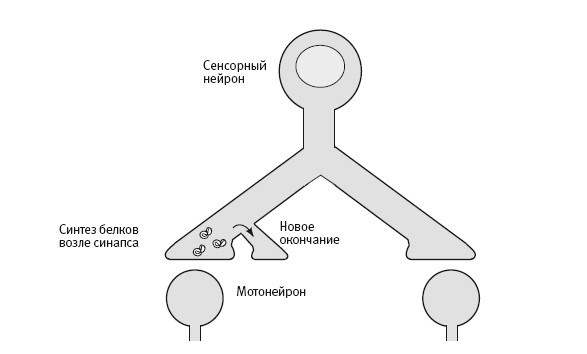
19–3. Два механизма долговременных изменений. Новые белки поступают ко всем синапсам (вверху), но только в синапсах, обрабатываемых серотонином, они вызывают отрастание новых окончаний аксона. Для поддержания роста, вызываемого экспрессией генов, необходимы белки, синтезируемые на месте.
Эти результаты позволяли по‑новому взглянуть на долговременную память. Они заставляли предположить, что в ее формировании задействованы два независимых механизма. Один запускает долговременное усиление синаптических связей, направляя в ядро протеинкиназу A, которая активирует CREB-белок, тем самым включая структурные гены, кодирующие белки, необходимые для роста новых синаптических связей. Другой закрепляет сформированную память, поддерживая новообразованные синаптические окончания, для чего требуется локальный синтез белков. Так мы поняли, что запуск и поддержание обеспечиваются здесь двумя разными механизмами. Как же работает второй?
Как раз тогда, в 1999 году, в нашу лабораторию пришел Каусик Си – необычайно самобытный и способный ученый. Каусик вырос в небольшом городке в Индии, где его отец работал школьным учителем. Когда отец понял, что Каусик увлекается биологией, он попросил своего коллегу, местного учителя биологии, взять мальчика под свою опеку. Этот учитель многому научил Каусика и способствовал развитию его интереса к молекулярной генетике. Кроме того, он убедил Каусика поехать учиться в магистратуру в Соединенные Штаты, в результате чего он стал постдоком у меня в Колумбийском университете.
Диссертация Каусика на соискание степени доктора философии была посвящена синтезу белков у дрожжей, а в Колумбийском университете он занялся проблемой локального синтеза белков в нейронах аплизии. Мы знали, что молекулы информационной РНК синтезируются в ядре, а затем в определенных синапсах на их матрице происходит синтез белков. В связи с этим нужно было ответить на вопрос, поступает ли информационная РНК в окончания в активном состоянии или в неактивном, как спящая красавица, в ожидании того, что в области маркированных синапсов ее поцелует какой‑то молекулярный прекрасный принц.
Каусик склонялся к гипотезе спящей красавицы. Он доказывал, что неактивные молекулы информационной РНК активируются только в том случае, если достигают соответствующим образом маркированного синапса и встречаются там с определенным сигналом. Он проводил параллель с интересным примером такой регуляции, который наблюдается в развитии лягушек. В ходе оплодотворения и созревания яйцеклетки лягушки неактивные молекулы информационной РНК пробуждаются и активируются под действием недавно открытого белка, регулирующего локальный синтез других белков. Этот белок называется CPEB (cytoplasmic polyadenylation element-binding protein – белок, связывающий элемент цитоплазматического полиаденилирования).
Мы проникали в лабиринты молекулярных механизмов памяти все глубже, и Каусику удалось выяснить, что неизвестная ранее форма CPEB-белка в нейронах аплизии и есть тот прекрасный принц, которого мы искали. Этот белок присутствует только в нервной системе, локализуется во всех синапсах нейрона, активируется серотонином, и его наличие в активированных синапсах требуется для поддержания синтеза белка и отрастания новых синаптических окончаний. Однако открытие Каусика отвечало на один вопрос, но задавало другой. Большинство белков в клетке распадается и разрушается в течение нескольких часов. Что же поддерживает рост синаптических окончаний в течение более длительного времени? Какой принципиальный механизм мог поддерживать мои воспоминания о Митци в течение всей жизни?
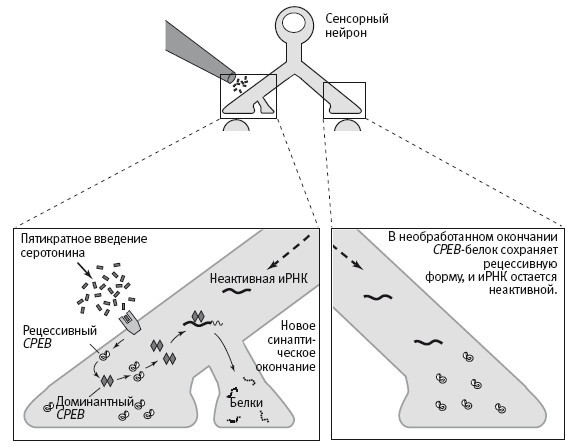
19–4. Долговременная память и обладающий прионными свойствами CPEB-белок. Введение серотонина вызвало поступление из ядра сенсорного нейрона неактивной информационной РНК (иРНК) ко всем окончаниям его аксона (1). Пятикратное введение серотонина в область одного из окончаний приводит к переходу обладающего прионными свойствами белка (CPEB), присутствующего в клетке в районе всех синапсов, в доминантную, самоподдерживающуюся форму (2). Доминантный CPEB способен переводить рецессивный CPEB в доминантную форму (3). Доминантный CPEB активирует неактивную иРНК (4). Активированная иРНК управляет синтезом белков в новых синаптических окончаниях, укрепляет синаптическую связь и обеспечивает поддержание памяти.
Внимательно изучая последовательность аминокислот нового CPEB-белка, Каусик обнаружил весьма примечательную вещь. Один из концов цепочки этого белка обладал всеми признаками приона.
Прионы – это, наверное, самые странные из белков, известных современной биологии. Их открыл Стэнли Прузинер из Калифорнийского университета в Сан-Франциско. Это были факторы, вызывающие несколько загадочных нейродегенеративных заболеваний, таких как коровье бешенство (губкообразная энцефалопатия крупного рогатого скота) и болезнь Кройцфельдта – Якоба у людей (именно эта болезнь стала причиной трагической смерти Ирвинга Купфермана в 2002 году – на пике его научной карьеры). Прионы отличаются от других белков тем, что их цепочки могут сворачиваться двояко, образуя две функционально различные формы или конформации: доминантную и рецессивную. Экспрессия генов, кодирующих прионы, приводит к синтезу рецессивной формы, но рецессивная форма может превращаться в доминантную или по чистой случайности, как это, вероятно, произошло у Ирвинга, или в связи с употреблением в пищу продуктов, содержащих доминантную форму этого белка. В доминантной форме прионы могут убивать клетки собственного организма. Еще одно отличие прионов от других белков состоит в том, что их доминантная форма способна самоподдерживаться. Под действием доминантной формы рецессивная меняет конформацию и тоже превращается в доминантную, получая способность к самоподдержанию (рис. 19–4).
Я помню, как однажды в 2001 году чудесным весенним днем, когда солнечный свет отражался от ряби на реке Гудзон за окнами моего кабинета, ко мне зашел Каусик и спросил: “Что вы скажете, если я сообщу вам, что у CPEB есть прионные свойства?”
Безумная идея! Но если правда, это позволило бы объяснить, как долгосрочная память может неограниченно долго поддерживаться в синапсах, несмотря на постоянный распад и обновление белков. Самоподдерживающееся вещество вполне может сохраняться в области синапса неограниченно долго, регулируя локальный синтез белков, необходимых для поддержания новообразованных синаптических окончаний.
В ходе моих ночных раздумий о долговременной памяти однажды ненадолго уже приходила в голову мысль, что прионы могут быть каким‑то образом задействованы в хранении этой памяти. К тому же я был знаком с новаторскими работами Прузинера, посвященными прионам и прионным заболеваниям, за исследование которых он получил Нобелевскую премию по физиологии и медицине 1997 года. Поэтому, хотя я никак не ожидал, что недавно открытая разновидность CPEB-белка может оказаться прионом, я сразу воспринял идеи Каусика с энтузиазмом.
Прионы особенно активно изучали у дрожжей, но никому еще не удавалось выяснить, какую функцию эти белки играют в норме, пока Каусик не открыл новую форму CPEB-белка, выделенную из нейронов. Поэтому его открытие было не только серьезным шагом вперед в исследовании обучения и памяти, но и новым словом для биологии в целом. Вскоре мы установили, что в сенсорных нейронах, участвующих в рефлексе втягивания жабр, превращением CPEB-белка из неактивной неразмножающейся формы в активную и размножающуюся управляет серотонин – нейромедиатор, необходимый для превращения кратковременной памяти в долговременную (рис. 19–4). В этой самоподдерживающейся форме CPEB обеспечивает также поддержание локального синтеза белков. Кроме того, обратить вспять переход в это самоподдерживающееся состояние сравнительно непросто.
Благодаря этим двум свойствам новая разновидность прионов как нельзя лучше подходит для хранения памяти. Самоподдержание, необходимое для локального синтеза белков, позволяет надолго избирательно сохранять информацию в одних синапсах, но, как вскоре установил Каусик, не влияет на множество других синапсов того же нейрона.
Помимо открытия роли нового приона в длительном сохранении памяти и в работе нервной системы в целом мы с Каусиком также обнаружили два неизвестных ранее биологических свойства прионов. Во-первых, нормальный физиологический сигнал (серотонин) обеспечивает превращение CPEB-белка из одной формы в другую. Во-вторых, новый CPEB-белок был первой самоподдерживающейся формой приона, для которой удалось установить физиологическую функцию – в данном случае поддержание усиления синаптической связи и хранение памяти. Во всех других исследованных ранее случаях самоподдерживающаяся форма приона или вызывала болезнь и смерть, убивая нервные клетки, или, реже, была неактивна.
Мы пришли к убеждению, что открытие Каусика может быть лишь надводной частью нового биологического айсберга. Такой механизм (активация ненаследуемых, самоподдерживающихся изменений белка) вполне мог быть задействован и во многих других биологических процессах, в том числе в развитии и транскрипции генов.
Это замечательное открытие, сделанное в моей лаборатории, может служить примером того, как похожа бывает фундаментальная наука на детективный роман с неожиданными поворотами сюжета: какие‑то новые удивительные процессы таятся в неизведанных уголках жизни, и впоследствии выясняется, что они играют важную роль во многих событиях. Наше открытие было необычно тем, что молекулярные процессы, лежащие в основе ряда редких заболеваний мозга, помогли разобраться в одном из механизмов долговременной памяти – неотъемлемой функции здорового мозга. Хотя обычно как раз фундаментальная биология помогает разобраться в тех или иных заболеваниях, а не наоборот.
Теперь мы можем отметить, что наши исследования, посвященные долговременной сенсибилизации, и открытие прионного механизма выдвинули на передний план три новых принципа, которые относятся не только к аплизии, но и к работе памяти всех животных, в том числе людей. Во-первых, для активации долговременной памяти требуется включение определенных генов. Во-вторых, существуют биологические ограничения, накладываемые на то, какой опыт может сохраняться в памяти. Чтобы включить гены, обеспечивающие долговременную память, необходимо активировать молекулы белка CREB-1 и инактивировать молекулы белка CREB-2, который подавляет работу генов, усиливающих память. Поскольку люди не помнят все, чему они обучались (да никто и не пожелал бы все помнить), ясно, что гены, кодирующие белок-репрессор, задают довольно высокий порог для преобразования кратковременной памяти в долговременную. Именно поэтому мы надолго запоминаем только некоторые события и ощущения своей жизни. Большинство же вещей мы просто забываем. Снятие этих биологических ограничений запускает перевод кратковременной памяти в долговременную. Гены, активируемые белком CREB-1, необходимы для отрастания новых синаптических связей. Тот факт, что для формирования долговременной памяти необходимо включить определенные гены, ясно свидетельствует о том, что гены не только определяют поведение, но и реагируют на внешние раздражители, например в процессе обучения.
Наконец, длительное сохранение памяти обеспечивается ростом и поддержанием новых синаптических окончаний. Так что, если вы запомните что‑то из этой книги, так произойдет потому, что ваш мозг будет немного другим после ее прочтения. Эта способность отращивать новые синаптические связи под действием опыта, судя по всему, крайне консервативна в эволюционном плане. Один из примеров такого консерватизма состоит в том, что и у людей, и у намного проще устроенных животных карты тела в коре головного мозга постоянно видоизменяются в ответ на изменения сигналов, поступающих по сенсорным проводящим путям.

