18. Гены памяти
Три события должны были сойтись, чтобы мой план применить молекулярно-биологические методы для исследования памяти вышел из ночной науки в дневную. Первым был переход в 1974 году в Колледж терапевтов и хирургов Колумбийского университета на место моего учителя Гарри Грундфеста, уходившего на пенсию. Колумбийский университет привлекал меня тем, что это великое учебное заведение с замечательными традициями в области научной медицины, особенно продвинутое в таких областях, как неврология и психиатрия. Основанный как Королевский колледж в 1754 году, он был пятым по счету и первым готовящим врачей университетом на территории Соединенных Штатов. Определяющим фактором для моего решения стало то, что Дениз уже была сотрудницей Колледжа терапевтов и хирургов и мы с ней купили дом в Ривердейле, потому что он находился поблизости от университетского кампуса. Поэтому, перейдя из Нью-Йоркского университета в Колумбийский, я стал намного быстрее добираться до работы, а мы с Дениз получили возможность работать в одном университете, но независимо друг от друга.
С моим переходом в Колумбийский университет было связано второе событие – начало сотрудничества с Ричардом Акселем (рис. 18–1). На первом этапе моей карьеры биолога моим наставником был Гарри Грундфест, побудивший меня заняться исследованиями работы нервной системы на клеточном уровне. На втором этапе моим проводником был Джимми Шварц, вместе с которым мы изучали биохимию кратковременной памяти. На третьем же этапе похожую роль предстояло сыграть Ричарду Акселю, совместная работа с которым позволила мне сосредоточиться на том, как диалог между генами нейрона и его синапсами обеспечивает формирование кратковременной памяти.

18–1. Ричард Аксель (р. 1946), с которым я подружился в первые годы совместной работы в Колумбийском университете. Благодаря нашему научному сотрудничеству я научился методам молекулярной биологии, а Ричард занялся нервной системой. В 2004 году Ричард и его коллега Линда Бак (р. 1947), работавшая у него постдоком, получили Нобелевскую премию по физиологии и медицине за свои классические исследования обоняния. (Из архива Эрика Канделя.)
Мы с Ричардом познакомились в 1977 году на заседании комиссии по приему сотрудников на постоянную работу. В конце этого заседания он подошел ко мне и сказал: “Мне надоело без конца заниматься клонированием генов. Я хочу заняться чем‑нибудь, связанным с нервной системой. Нам надо поговорить и, может быть, сделать что‑то по молекулярной биологии ходьбы”. Это предложение было далеко не таким наивным и грандиозным, как высказанное мной Грундфесту намерение исследовать биологические основы “я”, “оно” и “сверх-я”. Тем не менее я вынужден был сказать Ричарду, что в тот момент ходьба была, вероятно, еще недоступна для молекулярно-биологических исследований. По-видимому, более посильной задачей было бы исследовать какую‑то простую поведенческую реакцию у аплизии, например втягивание жабр, выделение чернильной жидкости или откладку яиц.
Когда я лучше познакомился с Ричардом, я быстро оценил, какой он интересный, умный и великодушный человек. Роберт Вайнберг в своей книге об истоках раковых заболеваний превосходно описывает любознательность Ричарда и остроту его ума: “У Акселя, высокого, тощего и сутулого, было яркое угловатое лицо, делавшееся еще ярче благодаря очкам в серебристой оправе, в которых он всегда ходил. Аксель <…> позволил мне открыть так называемый ‘синдром Акселя’, который я изучил путем тщательных наблюдений и затем при случае описывал сотрудникам своей лаборатории. Я впервые обратил внимание на этот синдром во время нескольких научных заседаний, на которых Аксель присутствовал в качестве слушателя. Он садился в первом ряду и внимательно вслушивался в каждое слово, доносившееся с кафедры. Затем он задавал глубокие, проницательные вопросы, которые формулировал медленно, с расстановкой, произнося каждый слог отчетливо и внятно. Его вопросы неизменно проникали в самую суть доклада, вскрывая слабые места в данных или доводах докладчика. Перспектива получить от Акселя каверзный вопрос очень нервировала тех, у кого не все было в порядке с собственными научными результатами”.
На самом деле очки у Акселя были в золотистой оправе, но в остальном это очень меткое описание. Помимо добавления “синдрома Акселя” в анналы науки Ричард внес весомый вклад в методологию работы с рекомбинантной ДНК. Он разработал общий метод внедрения любого гена в любую клетку в тканевой культуре. Этот метод, названный котрансфекцией, широко используется как в научных исследованиях, так и в фармацевтике для производства лекарств.
Ричард, как и я, был опероманом, и вскоре после того, как мы с ним подружились, мы стали вместе ходить в оперу, причем всегда без билетов. Во время первого такого похода мы попали на вагнеровскую “Валькирию”. Ричард настоял на том, чтобы мы вошли в театр через нижний вход, связанный с гаражом. Билетер, проверявший билеты у этого входа, сразу узнал Ричарда и пропустил нас. Мы прошли к первым рядам партера и стояли у стенки, пока не начал гаснуть свет. Тогда к нам подошел другой билетер, который тоже узнал Ричарда, когда мы вошли, и указал два свободных места. Ричард незаметно передал ему какие‑то деньги, причем наотрез отказался сообщить мне сколько. Это был чудесный спектакль, но время от времени меня прошибал холодный пот при мысли, что на следующий день я увижу в “Нью-Йорк таймс” заголовок: “Два профессора Колумбийского университета пробрались в Метрополитен-опера без билета”.
Вскоре после начала нашего сотрудничества Ричард спросил людей, работавших в его лаборатории: “Кто‑нибудь хочет учиться нейробиологии?” Такое желание изъявил только Ричард Шеллер, который стал нашим общим постдоком. Шеллер оказался для нас очень ценным приобретением: он был человеком творческим и смелым, о чем говорило его добровольное решение заняться нервной системой. Кроме того, он хорошо разбирался в генной инженерии: внес существенный вклад в методологию этой области, еще будучи аспирантом, и охотно помогал мне учиться молекулярной биологии.
Когда мы с Ирвингом Купферманом исследовали роль различных клеток и их групп в поведении аплизии, мы нашли две симметричные группы нейронов, каждый из которых содержит около двухсот одинаковых клеток, которые мы назвали пазушными клетками (bag cells). Ирвинг обнаружил, что пазушные клетки выделяют гормон, стимулирующий откладку яиц – инстинктивную, устойчивую форму сложного поведения. Яйца аплизии упакованы в длинные желеобразные шнуры, в каждом из которых содержится миллион или больше яиц. В ответ на действие гормона откладки яиц аплизия выделяет яйцевой шнур из отверстия половой системы, расположенного рядом с головой. При этом у нее повышаются частота сердцебиения и интенсивность дыхания. Затем она подхватывает выходящий яйцевой шнур ртом и двигает головой взад и вперед, вытягивая его из полового протока, скатывает в шарик и закрепляет на камне или какой‑нибудь водоросли.
Шеллеру удалось выделить ген, управляющий откладкой яиц, и показать, что ген кодирует пептидный гормон, то есть короткую цепочку аминокислот, и экспрессируется в пазушных клетках. Шеллер синтезировал этот гормон, ввел его аплизии и пронаблюдал за тем, как тот запускает ритуал откладки яиц животного. Это было необычайное достижение, потому что оно показывало, что одна короткая цепочка аминокислот может запускать сложную последовательность поведенческих реакций. Наши с Акселем и Шеллером совместные исследования молекулярной биологии такой сложной формы поведения, как откладка яиц, привели их обоих в нейробиологию и укрепили мое стремление проникнуть еще дальше в лабиринты молекулярной биологии.
Наши исследования обучения и памяти, проведенные в начале семидесятых, связали клеточную нейробиологию с обучением простой форме поведения. Моя совместная работа с Шеллером и Акселем, которая началась в конце семидесятых, убедила и меня, и Акселя, что молекулярная биология, нейробиология и психология могут соединиться и образовать новую молекулярную науку о поведении. Мы высказали это во введении к нашей первой статье о молекулярной биологии откладки яиц: “На материале аплизии мы описываем удобную экспериментальную систему для исследования структуры, экспрессии и модуляции генов, кодирующих пептидный гормон, обладающий известной поведенческой функцией”.
В ходе выполнения совместного проекта я познакомился с методами работы с рекомбинантной ДНК, которые сыграли ключевую роль в моих последующих исследованиях долговременной памяти. Кроме того, мое сотрудничество с Акселем положило начало крепкой научной и личной дружбе. Поэтому я был обрадован и не удивлен, когда 10 декабря 2004 года, через четыре года после того, как мои исследования были отмечены Нобелевским комитетом, я узнал, что Ричарду и Линде Бак, в прошлом работавшей у него постдоком, присуждена Нобелевская премия по физиологии и медицине за их выдающиеся работы в области молекулярной нейробиологии. Ричард и Линда вместе сделали поразительное открытие, что в носу мышей имеется около тысячи различных обонятельных рецепторов. Таким огромным набором рецепторов (существования которого никто не предполагал) и объясняется наша способность улавливать тысячи специфических запахов. Это открытие доказало, что значительная часть выполняемого нашей нервной системой анализа запахов осуществляется рецепторами носовой полости. Впоследствии Ричард и Линда независимо использовали эти рецепторы, чтобы продемонстрировать точность связей между нейронами обонятельной системы.
Последнее событие из тех трех, которые помогли мне освоить методы молекулярной биологии и использовать их для изучения памяти, случилось в 1983 году, когда Дональд Фредриксон, недавно назначенный президентом Медицинского института Говарда Хьюза, попросил Шварца, Акселя и меня составить основу группы, занимающейся новой наукой о психике – молекулярной биологией когнитивных функций. Каждая группа ученых, работу которых в университетах и других научных учреждениях страны поддерживает этот институт, называется по месту ее расположения. Так мы стали Медицинским институтом Говарда Хьюза при Колумбийском университете.
Говард Хьюз был творческим и эксцентричным человеком – промышленником, продюсером фильмов, конструктором и пилотом самолетов, на которых он участвовал в соревнованиях. От своего отца он унаследовал значительную долю акций компании Hughes Tool Company и построил на ее основе промышленную империю. В рамках этой производившей инструменты компании он организовал авиастроительное отделение, Hughes Aircraft Company, ставшее одним из основных подрядчиков Министерства обороны. В 1953 году он передал эту компанию Медицинскому институту Говарда Хьюза – научно-исследовательскому медицинскому учреждению, которое только что основал. К 1984 году, через восемь лет после его смерти, институт стал крупнейшей частной организацией, поддерживающей биомедицинские исследования в Соединенных Штатах. К 2004 году институтский фонд превысил 11 млрд долларов, институт поддерживал 350 исследователей во множестве университетов Соединенных Штатов. Около ста из этих ученых были членами Национальной академии наук, а десять – лауреатами Нобелевской премии.
Девиз Медицинского института Говарда Хьюза – “Люди, а не проекты”. В институте убеждены, что наука процветает тогда, когда выдающимся исследователям предоставляют как ресурсы, так и интеллектуальную свободу для выполнения смелых, передовых работ. В 1983 году в институте стартовали три инициативы: в областях нейробиологии, генетики и регуляции обмена веществ. Меня пригласили на должность старшего исследователя нейробиологической инициативы, и обеспеченные мне институтом возможности сыграли огромную роль как в моей научной карьере, как и в карьере Ричарда Акселя.
Новообразованный институт дал нам возможность нанять Тома Джесселла и Гэри Струла из Гарварда и убедить остаться Стивена Зигельбаума, который собирался уходить из Колумбийского университета. Это были чудесные кадры для нашей хьюзовской группы и Центра нейробиологических и поведенческих исследований. Джесселл вскоре стал ведущим специалистом по развитию нервной системы позвоночных. Серия проведенных им блестящих исследований позволила выявить гены, обеспечивающие индивидуальные особенности разных нейронов спинного мозга (тех самых, которыми занимались Шеррингтон и Экклс). Затем он показал, что эти гены также управляют вырастанием аксонов и образованием синапсов. Зигельбаум успешно использовал свои замечательные открытия, связанные с ионными каналами, для изучения того, как каналы управляют возбудимостью нейронов и силой синаптических связей и как то и другое модулируется в результате работы и под действием различных модуляторных нейромедиаторов. Струл разработал оригинальный генетический подход к работе с дрозофилой, позволяющий изучать, как в ходе развития этой плодовой мухи формируется строение ее тела.
Теперь, имея в распоряжении методы молекулярной биологии и финансирование Медицинского института Говарда Хьюза, мы могли заняться проблемами генов и памяти. Моя экспериментальная стратегия начиная с 1961 года состояла в том, чтобы улавливать простые формы памяти в наименьших возможных популяциях нейронов и использовать множество микроэлектродов для отслеживания активности задействованных клеток. Мы научились регистрировать сигналы отдельных сенсорных нейронов и мотонейронов в течение нескольких часов у интактного животного, что прекрасно подходило для исследования кратковременной памяти. Но для работы с долговременной памятью нам нужна была возможность регистрировать такие сигналы в течение дня или нескольких дней. Для этого требовался новый подход, и я обратился к тканевым культурам сенсорных нейронов и мотонейронов.
Сенсорные нейроны и мотонейроны нельзя просто так извлечь из взрослого организма и выращивать в лаборатории, потому что зрелые нейроны плохо выживают в культуре. Вместо этого нейроны нужно извлекать из нервной системы очень молодых животных и обеспечивать им среду, в которой они могут вырасти в зрелые клетки. Важнейший шаг в этом направлении сделал наш аспирант Арнольд Кригштейн. Перед самым переходом лаборатории в Колумбийский университет Кригштейн научился выращивать аплизий в лабораторных условиях от эмбриональной стадии, заключенной в яйце, до взрослого организма, чего биологам не удавалось добиться на протяжении почти ста лет.

18–2. Жизненный цикл аплизии. Личинки аплизии сидят на красной водоросли определенного вида (Laurencia pacifica) и извлекают из нее вещества, необходимые для включения механизма превращения в ювенильного моллюска. (Рисунок перепечатан из книги: E. R. Kandel, Cellular Basis of Behavior, W. H. Freeman and Company, 1976.)
По мере роста аплизия превращается из прозрачной свободноплавающей личинки, которая питается одноклеточными водорослями, в ползающего, питающегося многоклеточными водорослями ювенильного моллюска – уменьшенное подобие взрослого организма. Для того чтобы с личинкой произошло это радикальное изменение строения тела, она должна какое‑то время сидеть на многоклеточной водоросли определенного вида и подвергаться воздействию особого вещества. Никому не удавалось пронаблюдать это превращение в природе, поэтому никто не знал, что требуется. Кригштейн наблюдал за личинками аплизий в их естественной среде и заметил, что они часто садятся на красную водоросль определенного вида. Когда он испытал эту водоросль в лаборатории, предоставив личинкам возможность садиться на нее, он обнаружил, что они превращаются в ювенильных моллюсков (рис. 18–2). Те из нас, кто присутствовал на замечательном семинаре, проведенном Кригштейном в декабре 1973 года, не скоро забудут его описание того, как личинки находят эту водоросль, которая называется Laurencia pacifica, садятся на нее и извлекают из нее вещества, необходимые для включения механизма превращения. Я помню, что, когда Кригштейн показал нам первые фотографии крошечных ювенильных моллюсков, я сказал про себя: “Дети всегда такие красивые!”
После сделанного Кригштейном открытия мы начали выращивать эту водоросль и вскоре получили достаточное число ювенильных моллюсков, чтобы выращивать в культуре клетки нервной системы. Следующую принципиальную задачу – научиться выращивать конкретные нейроны в культуре и добиваться того, чтобы они образовывали синапсы, – взял на себя мой бывший студент Сэмюел Шахер, специалист по клеточной биологии. Шахеру, работавшему вместе с двумя постдоками, вскоре удалось культивировать конкретные сенсорные нейроны, мотонейроны и интернейроны, задействованные в рефлексе втягивания жабр (рис. 18–3).
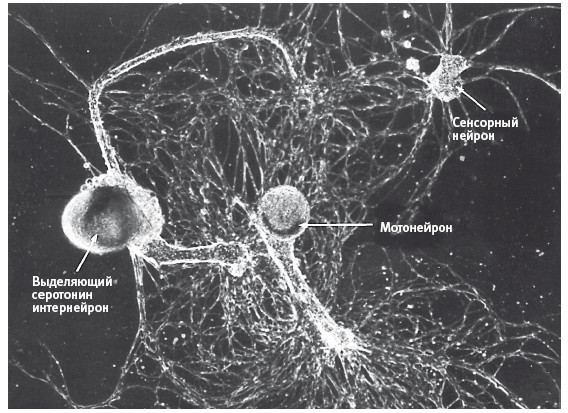
18–3. Использование конкретных нейронов, выращиваемых в лаборатории, для изучения долговременной памяти. Отдельные сенсорные нейроны, мотонейроны и выделяющие серотонин модуляторные интернейроны, выращиваемые в культуре, образуют синапсы, воспроизводя простейшие нейронные цепи, обеспечивающие и модулирующие рефлекс втягивания жабр. Эта простая, подверженная обучению нейронная цепь (первая полученная в культуре клеток) дала нам возможность исследовать молекулярно-биологические основы долговременной памяти. (Фото любезно предоставил Сэм Шахер.)
Теперь все элементы подверженной обучению нейронной цепи имелись у нас в клеточной культуре. Эта цепь позволяла исследовать компоненты хранения памяти, сосредоточившись на отдельном сенсорном нейроне и отдельном мотонейроне. Эксперименты показали, что выделенные из организма сенсорные нейроны и мотонейроны образуют в культуре в точности такие же синаптические связи и демонстрируют такое же физиологическое поведение, как в организме интактного животного. В природе удар током в заднюю часть тела вызывает активацию модуляторных интернейронов, которые выделяют серотонин, тем самым усиливая связь сенсорных нейронов с мотонейронами. Поскольку мы уже знали, что эти модуляторные интернейроны выделяют серотонин, после нескольких экспериментов мы установили, что незачем выращивать их в культуре. Мы просто вводили серотонин в культуру клеток рядом с синапсами, соединяющими сенсорные нейроны с мотонейронами, – именно там, где у интактных животных окончания модуляторных интернейронов подходят к сенсорным нейронам и выделяют серотонин. Одно из величайших наслаждений ученого, долгое время работающего с одной и той же биологической системой, связано с тем, что сегодняшние открытия становятся орудием завтрашних экспериментов. Наши многолетние исследования этой нейронной цепи и умение выделять ключевые химические сигналы, передающиеся в пределах этой цепи от клетки к клетке и внутри клеток, позволили воспользоваться теми же сигналами для манипуляций с этой системой и более глубокого ее изучения.
Мы обнаружили, что непродолжительное однократное введение серотонина на несколько минут усиливает синаптическую связь сенсорного нейрона с мотонейроном, увеличивая выделение серотонина сенсорной клеткой. Как и у интактного животного, это кратковременное усиление синаптической связи представляет собой функциональное изменение и не требует синтеза новых белков. Пятикратное введение серотонина, имитирующее пятикратный удар током, напротив, усиливает синаптическую связь на несколько дней и приводит к отрастанию новых синаптических связей, то есть вызывает анатомические изменения, требующие синтеза новых белков (рис. 18–4). Этот результат показывал, что мы можем вызывать образование новых синапсов у сенсорного нейрона, растущего в культуре, но нам по‑прежнему нужно было выяснить, какие белки задействованы в формировании долговременной памяти.
Тогда моя научная карьера сплелась с одним из величайших интеллектуальных приключений современной биологии – распутыванием молекулярного механизма регуляции работы генов, единиц хранения закодированной информации, лежащей в основе всего живого на планете.
Это приключение началось в 1961 году, когда Франсуа Жакоб и Жак Моно из парижского Института Пастера опубликовали статью, озаглавленную “Генетические регуляторные механизмы и синтез белка”. Используя в качестве модельного объекта бактерий, они сделали замечательное открытие, что работа генов может регулироваться, то есть включаться и выключаться, как водопроводный кран.
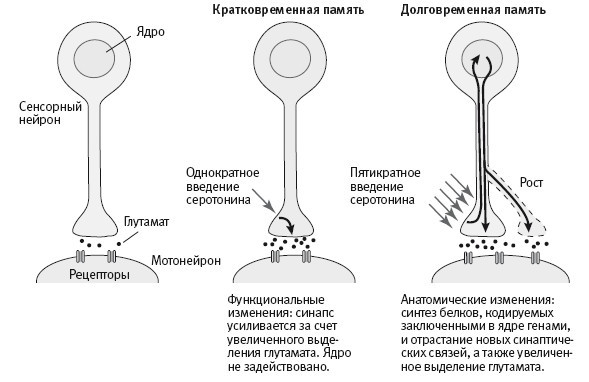
18–4. Изменения в отдельном сенсорном нейроне и отдельном мотонейроне, лежащие в основе кратковременной и долговременной памяти.
Жакоб и Моно высказали предположение, известное нам теперь как факт, что даже у сложных организмов, таких как человеческий, почти каждый ген, входящий в состав генома, присутствует в каждой клетке тела. У каждой клетки в ядре содержатся все хромосомы организма, а значит, и все гены, необходимые для развития этого организма. Из чего следовал принципиальный для биологии вопрос: почему гены не функционируют одинаково в каждой клетке тела? Жакоб и Моно выдвинули гипотезу, которая в итоге полностью подтвердилась, что клетка печени является клеткой печени, а клетка мозга – клеткой мозга потому, что в клетках каждого типа включены (экспрессируются) только некоторые из генов, а все остальные выключены (репрессированы). Поэтому клетки каждого типа содержат собственный неповторимый набор белков – подмножество всех белков, которые в принципе могут синтезировать клетки организма. Этот набор белков и позволяет клеткам выполнять особенные биологические функции.
Гены включаются и выключаются по мере надобности, обеспечивая оптимальную работу всей клетки. Некоторые остаются выключенными на протяжении большей части жизни организма, другие, например задействованные в выработке энергии, всегда включены, потому что кодируемые ими белки жизненно важны для клетки. Но в клетках каждого типа одни гены экспрессируются лишь в определенное время, а другие включаются и выключаются в ответ на сигналы, поступающие из самого организма или из окружающей среды. Из этих доводов у меня в голове однажды вечером родилась светлая мысль: что есть обучение, как не набор сенсорных сигналов, поступающих из окружающей среды, так что сенсорные сигналы разного типа (или поступающие в разной последовательности) обеспечивают разные формы обучения?
Какие сигналы регулируют работу генов? Каким образом гены включаются и выключаются? Жакоб и Моно установили, что у бактерий гены включаются и выключаются другими генами. В связи с этим они выделили две разновидности генов: структурные и регуляторные. Структурные гены кодируют функциональные белки, определяющие структуру и функции клетки, такие как ферменты и ионные каналы. Регуляторные гены кодируют так называемые регуляторные белки, которые включают и выключают структурные гены. Затем Жакоб и Моно задались вопросом, как регуляторные белки действуют на структурные гены. Они предположили, что на отрезке ДНК, где находится каждый структурный ген, имеется не только участок, который кодирует определенный белок, но и регуляторный участок – особое место, которое теперь называют промотором. Регуляторные белки связываются с промоторами структурных генов, тем самым определяя, будет ли данный структурный ген включен или выключен.
Чтобы структурный ген мог включиться, регуляторные белки должны собраться на его промоторе и помочь отделить друг от друга две цепочки ДНК. После этого информация с одной из этих цепочек копируется на информационную РНК. Этот процесс называют транскрипцией. Информационная РНК выносит содержащиеся в гене инструкции для синтеза белка из ядра в цитоплазму клетки, где структуры, называемые рибосомами, синтезируют белок согласно этим инструкциям, осуществляя так называемую трансляцию. После того как с гена считывается записанная в нем информация, две цепочки ДНК снова сцепляются, и ген остается выключенным, пока регуляторные белки снова не запустят его транскрипцию.
Жакоб и Моно не только разработали основы теории регуляции работы генов, но и открыли регуляторные гены, участвующие в этом процессе. Есть две разновидности таких генов: репрессоры, кодирующие регуляторные белки, которые выключают структурные гены, и, как показали последующие исследования, активаторы, кодирующие регуляторные белки, которые включают структурные гены. Путем блестящих рассуждений и остроумных генетических экспериментов Жакоб и Моно выяснили, что, когда в распоряжении обыкновенной бактерии кишечной палочки, живущей у нас в кишечнике, имеется богатый запас одного из источников ее пищи – сахара лактозы, у нее включается ген, который кодирует фермент, позволяющий переваривать лактозу. Когда же лактоза кончается, ген этого пищеварительного фермента внезапно выключается. Как это происходит?
Жакоб и Моно установили, что в отсутствие лактозы ген-репрессор кодирует белок, который связывается с промотором гена пищеварительного фермента, не давая информации считываться с ДНК этого гена. Когда же они вновь добавляли лактозу в среду, на которой выращивали этих бактерий, лактоза входила в клетки и связывалась с белком-репрессором, из‑за чего он отпадал от промотора. В результате промотор оставался свободным и мог связываться с белками, кодируемыми геном-активатором. Белки-активаторы включали структурный ген и обеспечивали синтез фермента, позволяющего бактерии усваивать лактозу.
Результаты этих исследований свидетельствовали о том, что кишечная палочка способна подстраивать интенсивность транскрипции генов в соответствии с поступающими извне сигналами. Дальнейшие исследования показали, что, когда эта бактерия оказывается в среде с небольшим содержанием глюкозы, в ней начинается синтез циклического АМФ, который запускает процесс, позволяющий клетке переваривать в первую очередь именно этот, более питательный сахар.
Открытие того, что работа генов может регулироваться в соответствии с потребностями клетки и условиями среды за счет сигнальных молекул, поступающих извне (как молекулы разных сахаров), а также изнутри (как вторичные посредники, например циклический АМФ), произвело революцию в моих мыслях. Оно заставило меня переформулировать в молекулярных терминах вопрос о том, как кратковременная память преобразуется в долговременную. Теперь мой вопрос состоял в том, какова природа регуляторных генов, задействованных в определенных формах обучения, то есть реагирующих на сигналы, поступающие извне, а также в том, как эти регуляторные гены переводят кратковременные синаптические изменения, необходимые для кратковременной памяти, в долговременные синаптические изменения, необходимые для долговременной.
Наши эксперименты, поставленные на беспозвоночных, как и некоторые другие, поставленные на позвоночных, продемонстрировали, что долговременная память требует синтеза новых белков. Эти результаты указывали, что механизмы хранения памяти, судя по всему, похожи у всех животных. Кроме того, Крейг Бейли сделал замечательное открытие, что долговременная память у аплизии сохраняется потому, что сенсорные нейроны отращивают себе новые окончания аксонов, тем самым усиливая свои синаптические связи с мотонейронами. Но по‑прежнему оставалось тайной, что именно позволяет переводить какие‑то кратковременные воспоминания в долговременную память. Быть может, характер действия раздражителей, вызывающий долговременную сенсибилизацию, делает это за счет активации определенных регуляторных генов, и кодируемые ими белки заставляют структурные гены запустить механизм образования новых окончаний аксона?
Изучая живые сенсорные нейроны и мотонейроны в культуре, мы редуцировали исследуемую нами поведенческую систему в достаточной степени, чтобы заняться этими вопросами. Мы установили, что принципиальный компонент долговременной памяти заключен в синаптической связи между двумя клетками. Теперь мы могли использовать метод рекомбинантной ДНК, чтобы ответить на вопрос, отвечают ли за включение и поддержание долговременного усиления этой связи определенные регуляторные гены.
Примерно в это время мои исследования начали получать официальное признание. В 1983 году я разделил с Верноном Маунткаслом премию Ласкера за фундаментальные медицинские исследования – самую престижную из естественнонаучных премий, присуждаемых в Соединенных Штатах – и получил свою первую почетную степень от Иудейской теологической семинарии в Нью-Йорке. Меня поразило, что там вообще знали о моих исследованиях. Подозреваю, что они узнали о них от моего коллеги Мортимера Остоу – одного из тех психоаналитиков, благодаря которым я заинтересовался связью психоанализа и мозга.
К тому времени мой отец уже умер, но мама пришла на церемонию награждения, где ректор семинарии Герсон Коэн в своей вступительной речи упомянул, что я получил хорошее образование на иврите в Еврейской школе Флэтбуша, и это наполнило гордостью сердце моей мамы. Я думаю, что для нее, быть может, важнее было признание того, что ее отец, мой дедушка, хорошо научил меня ивриту, чем престижная премия Ласкера, которую я получил.

