Книга: Онтогенез. От клетки до человека
Назад: Глава 16 Мера всех вещей
Дальше: Глава 18 Текущий ремонт
Глава 17
Друзья и враги
Не обижайте бактерий – у некоторых людей другой культуры нет.Наклейка на заднем стекле машины
Разум – не единственная обучающаяся машина, которая продолжает свое развитие в течение многих лет после рождения человека. Развитие умения взаимодействовать с полной микроорганизмов окружающей средой и обращать ее себе на пользу имеет огромное значение для поддержания здоровья человека.
Мы никогда не бываем одни. Первые девять месяцев нашей жизни мы живем в утробе матери. После рождения наш организм населяют сотни триллионов микроорганизмов, даже когда нам кажется, что мы свободны от них. Это очень много: на одну клетку человеческого тела приходится примерно десять микроорганизмов. После нашей смерти эти микроорганизмы продолжают жить, питаясь нашими останками и друг другом, пока запасы не исчерпаются. Некоторые из этих микробов – всего лишь попутчики, от которых нет ни пользы, ни вреда, но многие другие имеют большое значение для работы наших внутренних органов. Они нужны нам, потому что могут выполнять биохимические трюки, недоступные человеческим клеткам.
В здоровом кишечнике содержится от одного до десяти миллиардов бактерий на грамм ткани. Эти крошечные организмы выполняют несколько важных задач. О некоторых из них я расскажу потом, а пока упомяну одну: бактерии выделяют различные ферменты, способные переваривать компоненты пищи, недоступные нашим собственным ферментам. Ферменты расщепляют большие, неудобоваримые молекулы на мелкие кусочки, которые могут всасываться как слизистой оболочкой кишечника, так и бактериями. Бактерии сразу используют поглощенные молекулы и применяют полученную энергию и сырье для размножения и дальнейшего синтеза ферментов. Слизистая оболочка кишечника передает питательные вещества в близлежащие кровеносные сосуды, откуда они отправляются на переработку в печень, а затем поступают в другие части организма. Некоторые из молекул пищи, на которые действуют бактериальные ферменты, в неизменном виде были бы токсинами или канцерогенами, поэтому второй важной функцией кишечных бактерий является обеспечение безопасности пищи. С другой стороны, некоторые вещества, в частности алкоголь, становятся под действием бактериальных ферментов гораздо опаснее. Бактерии перерабатывают спирт в уксусный альдегид – токсичное и, вероятно, канцерогенное вещество. Некоторые кишечные бактерии образуют много витамина К, который важен для свертывания крови и роста костей. Клетки человеческого организма не могут сами производить этот витамин. Некоторые бактерии также синтезируют фолиевую кислоту, дополняя ту, что мы получаем с пищей. Фолиевая кислота нужна для пролиферации клеток, а кроме того, ее достаточное количество в организме матери очень важно для смыкания нервной трубки на ранних этапах развития эмбриона (глава 5). Учитывая, что кишечные бактерии участвуют в переваривании пищи, они имеют доступ к энергии и сырью и могут быстро размножаться. Однако большая часть бактерий выводится из организма вместе с остатками пищи: примерно три пятых массы нормального стула человека составляют бактериальные клетки, как мертвые, так и живые.
Еще одно место, где много полезных бактерий, – это влагалище. Они нужны там для того, чтобы помешать развитию патогенных микроорганизмов, которые, не будь во влагалище своей микрофлоры, могли бы воспользоваться теплыми и влажными условиями. Вагинальные лактобактерии питаются компонентами слизи и выделяют молочную кислоту, которая так или иначе препятствует развитию других бактерий. Ситуация во влагалище, где одни микроорганизмы защищают организм от других, – частный случай общей проблемы, характерной также для пищеварительного тракта и других органов: организм должен найти способ поддерживать полезную микрофлору, не пуская при этом внутрь опасных патогенных бактерий. Последние исследования показывают, что за долгое время совместного существования люди и их полезные бактерии разработали способы «общения» друг с другом и научились работать как одна команда.
Плод развивается в стерильной среде, глубоко в утробе матери, окруженный несколькими оболочками. Таким образом, новорожденный лишен полезных бактерий и должен приобрести их вскоре после рождения. К счастью, положение родовых путей (как заметил Сен-Бернар из Клерво, inter faeces et urinam nascimur) практически гарантирует, что в процессе появления на свет ребенок соприкоснется с бактериями влагалища, кишечника, мочевого тракта и кожи. Младенцы, появившиеся с помощью кесарева сечения, сталкиваются с этими бактериями сразу после того, как матери начинают ухаживать за ними, хотя в этом случае развитие нормальной бактериальной флоры может занять гораздо больше времени.
Когда симбиотические бактерии попадают в рот новорожденного, они проглатываются вместе со слюной или молоком и проходят через желудок в кишечник. Здесь начинается их сигнальный «диалог» с клетками человеческого организма. Этот процесс в большей степени изучен у мышей, чем у людей, но некоторые его аспекты уже проверены, по крайней мере, на культурах человеческих клеток, а эпидемиологические исследования человека говорят о том, что управление этими процессами, скорее всего, происходит у людей и мышей очень сходным образом.
Каждый участок кишечника создает питательную среду именно для того типа бактерий, который нужен на этом участке. Это можно проиллюстрировать на примере взаимодействия клеток кишечника и одного из наиболее важных симбионтов мышей – бактерий вида Bacteroides thetaiotaomicron. Попав в пищеварительный тракт, эта бактерия выделяет молекулу, которая распознается слизистой оболочкой тонкой кишки. Эта маленькая молекула существенно отличается от описанных выше сигнальных белков, которые клетки человека обычно используют в ходе развития. Это заурядная молекула из биохимического арсенала бактериального метаболизма. Тем не менее в этой главе я буду следовать принципам биосемиотики и считать, что любую молекулу, несущую информацию об определенном положении дел и влияющую на поведение клетки, которая ее получает, следует считать сигнальной, независимо от ее молекулярной природы и первопричины ее синтеза.
В ответ на этот сигнал клетки кишечника слегка меняют собственный метаболизм. Клетки животных, включая человека, как правило, «декорируют» синтезируемые ими белки, размещая на их поверхности цепи сахаров. Сахара в цепи соединены сильными химическими связями и, в отличие, например, от отдельных молекул в стакане подслащенной воды, не могут служить пищей сами по себе: комплекс сахаров и белков слишком большой, чтобы пройти через поглощающие каналы на поверхности бактериальной клетки. Бактерия может извлечь пищу из этих сахарных цепей, только если у нее есть фермент, способный разрезать связи в цепи, а для высвобождения разных типов сахара с конца цепи необходимы разные ферменты. Bacteroides thetaiotaomicron синтезирует фермент, который может освободить с концов одной из таких цепей сахар фукозу. До получения сигнала от Bacteroides thetaiotaomicron кишечные клетки не помещают фукозные остатки на концы многих цепей, но после его получения они начинают активно присоединять фукозу. По сути дела, бактерия словно бы говорит «покорми меня!», и клетка услужливо кладет ей пищу прямо в рот, причем так, чтобы другим микроорганизмам, у которых нет фермента для отщепления фукозы, не досталось ни крошки. Другие части кишечника производят другие типы связанных сахаров, вероятно, в ответ на сигналы от других симбиотических бактерий. Таким образом, каждая часть кишечника создает благоприятную среду для тех видов бактерий, которые ей нужны.
Для кишечника выгода от присутствия Bacteroides thetaiotaomicron заключается в том, что эта бактерия может перерабатывать трудноперевариваемые компоненты пищи и высвобождать питательные вещества, усвояемые клетками кишечника. Поглощение пищи, или какой-либо молекулы, всегда наиболее эффективно, если поглощенные ранее молекулы уже доставлены в отдаленные части организма, в противном случае некоторые из них «утекают» обратно и пропадают зря. Эффективность процесса «отведения» молекул повышается благодаря другой реакции на сигналы от симбиотических бактерий. Эти сигналы воспринимаются определенным типом кишечных клеток, которые в свою очередь действуют на кровеносные сосуды, вызывают образование плотного слоя разветвленных капилляров (глава 9). Эта сеть помогает собирать абсорбированные питательные вещества и отправлять их в печень, а оттуда к остальным частям тела, и, соответственно, предотвращает накопление этих веществ в стенках кишечника и их утечку. Под действием еще одного типа сигналов от Bacteroides thetaiotaomicron клетки тканей выделяют антибактериальные молекулы, относительно безвредные для этих бактерий, но токсичные для их нежелательных и опасных конкурентов, например бактерий рода Listeria. Таким образом, симбиотические бактерии и слизистая оболочка кишечника «заботятся» друг о друге: организм предоставляет бактериям питание и защиту, бактерии поставляют питательные вещества для организма, а их совместное действие препятствует появлению вредных бактерий. Это происходит как благодаря системе, создающей антимикробные молекулы, так и благодаря тому, что Bacteroides thetaiotaomicron чисто физически занимает пространство, которое иначе заполнили бы нежелательные виды бактерий (рис. 78).
Не всем бактериям «рады» в кишечнике и других частях организма. Тысячи видов бактерий вторглись бы, если бы могли, в наш теплый, богатый питательными веществами организм и поглотили бы его. Даже обычные симбионты могут вызывать болезнь, если попадут в саму ткань (что может произойти, например, при пулевом ранении, язве или раковом заболевании, когда нарушается целостность стенки кишечника). «Полезные» бактерии полезны до тех пор, пока знают свое место. К счастью, наш организм оснащен сложными защитными системами, которые, как правило, эффективно предотвращают вторжение. Немногочисленные виды бактерий, которые научились обходить эту защиту (по крайней мере, на некоторое время), печально известны как возбудители страшных болезней, наложивших печать на историю человечества. Речь идет о таких заболеваниях, как туберкулез, бубонная чума, проказа, сифилис, дифтерия, холера и брюшной тиф. Чтобы понять, как организм позволяет жить полезным бактерии в нужном месте и убивает вредные бактерии или бактерии, оказавшие не там, где надо, мы должны рассмотреть работу защитных систем организма.
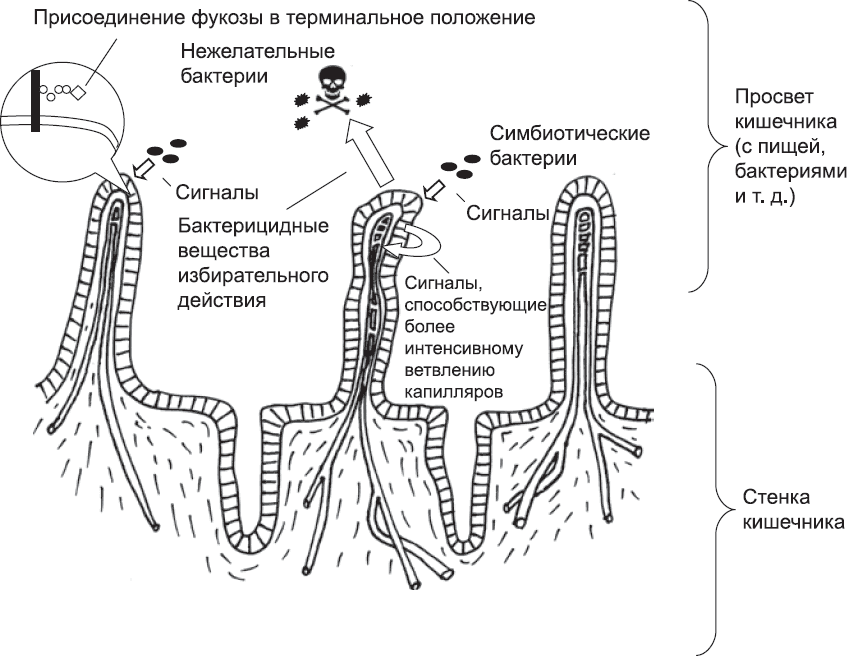
Рис. 78. Схема, обобщающая самые важные аспекты обмена сигналами между симбиотическими бактериями и тканью стенки кишечника. Под действием сигнальных молекул, выделяемых симбиотическими бактериями, кишечные клетки присоединяют остаток фукозы к цепям сахаров, продуцируют внутренние сигнальные молекулы, стимулирующие рост капилляров, и выделяют соединения, убивающие вредные бактерии. На этой схеме размер бактерии по отношению к ткани сильно преувеличен, как и пространство между ними
Есть три основные линии защиты. Первая линия в основном представлена пассивной защитой, как физической, так и химической. Физический компонент защиты состоит из барьеров на пути инфекции: твердые слои омертвевших клеток внешнего слоя кожи, вязкая, постоянно заменяющаяся слизь в носу, во рту, в трахеях и кишечнике, в уретре и во влагалище и даже непроницаемые для патогенов пленки симбиотических бактерий. Химический компонент представлен множеством белков крови, которые связываются с бактериями и повреждают их клеточные стенки. Клетки животных лишены клеточной стенки, поэтому клеточная стенка бактерий – отличная мишень для химической атаки, не сопровождающейся риском для клеток организма. Поэтому в организме животных синтезируются различные ферменты и порообразующие белки, которые проделывают в стенках бактерий смертельные дыры. Некоторые из них, в том числе лизоцим и дефензины, защищают внешние поверхности, например глаза. Другие, например, порообразующие белки системы комплемента, содержатся в крови и жидкостях, омывающих внутренние ткани. Они могут активироваться напрямую поверхностями патогенов или другими способами, о которых мы поговорим позже. Пассивные защитные системы – древнейшая первая линия защиты; она встречается в сходном виде практически у всех животных.
Вторая линия защиты активна и состоит из различных типов мигрирующих клеток, которые носят общее название фагоциты (буквально «клетки, которые едят»). Есть несколько разных видов фагоцитов, и все они образуются в костном мозге, о котором пойдет речь в главе 18. Они распространяются по всему телу с током крови, но могут покидать кровеносные сосуды, протискиваясь между выстилающими их клетками. Так они проникают в тканевые пространства, где оседают или активно патрулируют их. Перемещающиеся фагоциты очень похожи на мигрирующие клетки эмбриона (глава 8). У них есть лидирующий передний край, продвижение которого контролируется деятельностью сигнальных путей, запускаемых рецепторами на поверхности клетки. У фагоцитов есть рецепторы, которые активируются сигналами двух типов. Первый тип сигналов, к которому относится множество конкретных случаев, – это клеточные стенки и продукты жизнедеятельности бактерий (живые бактерии не могут не выделять эти продукты). С точки зрения фагоцитов, продукты жизнедеятельности бактерий тоже сигнализируют о том, что вредные бактерии неподалеку. Второй, тоже очень обширный тип сигналов – это молекулы, которые выделяют клетки человеческого организма, когда они находятся в состоянии стресса и в процессе гибели.
Вполне очевидно, для чего нужны рецепторы, распознающие бактериальные молекулы. Фагоциты мигрируют в направлении бактерий так же, как мигрирующие клетки эмбриона перемещаются в направлении источника сигналов, контролирующих эмбриональное развитие (глава 8). Оказавшись в нужном месте, фагоциты выделяют новые сигнальные молекулы, выплескивают коктейль высокотоксичных химических веществ и стараются заглотить и уничтожить любые бактерии на своем пути. Сигнальные молекулы усиливают местный кровоток и повышают утечку жидкости из кровеносных сосудов, и в результате на подмогу прибывают новые фагоциты. Токсичные вещества убивают бактерии сразу, так что фагоцитам даже не надо их заглатывать. Они настолько агрессивны, что часто наносят значительный ущерб даже нормальным тканям человеческого организма. Результатом всего этого является местное покраснение и повышение температуры (за счет увеличения кровотока), вспухание (из-за жидкости и накопления клеток) и боль в нервных окончаниях, на которые тоже действует токсичный коктейль. Эти классические признаки воспаления – rubor, calor, tumor et dolor – описал Авл Корнелий Цельс около двух тысяч лет тому назад. В центре воспаления также может быть участок беловатого гноя – это фагоциты, мертвые бактерии и отмершие ткани. Эти признаки хорошо видны на примере прыщей, от которых страдают многие люди в период полового созревания. Они вызваны бактериальной инфекцией сальных желез кожи, которые забиваются из-за перепроизводства кожного сала под действием гормонов. Прыщики – это, конечно, неприятно, но при опасной инфекции воспаление может быть спасительным, ведь вся мощь защитных систем организма направляется на саму причину воспаления.
Роль рецепторов, распознающих сигналы от клеток в состоянии стресса и сигналы, представляющие собой продукты распада мертвых клеток, – обеспечение приспособляемости организма. Не все опасные микроорганизмы являются бактериями. Есть среди них, например, одноклеточные организмы с клетками «животного» типа; они лишены клеточной стенки, которую можно было бы легко распознать, и выделяют меньше продуктов жизнедеятельности, которые могли бы выдать их присутствие. Организм таких многоклеточных паразитов, как паразитические черви, с точки зрения биохимии вообще очень похож на наш. Вирусы, мельчайшие из наших паразитов, по сути, представляют собой крошечные паразитические геномы, замаскированные оболочками инфицированных клеток человеческого организма; следовательно, они очень «человечны» с химической точки зрения. Если бы наши защитные системы реагировали только на столь конкретные химические следы, как продукты жизнедеятельности бактерий, мы были бы беззащитны перед лицом организмов, которые не оставляют таких следов. Даже если бы в процессе эволюции у нас появлялось все больше рецепторов против растущего числа возбудителей, то эти микроорганизмы, которые, как правило, размножаются очень быстро и хаотично и образуют огромные и изменчивые популяции, почти наверняка опередили бы нас в этой эволюционной «гонке вооружений». Мы, заложники нашего медленного размножения, должны каким-то образом активно реагировать на возбудителя, даже если непонятно, что он собой представляет.
Тогда и вступают в игру рецепторы, которые обнаруживают клетки в состоянии стресса и отмершие ткани человеческого организма. Защитная реакция возникнет везде, где бы ни погибали клетки. Вот почему даже стерильные ожоги сопровождаются болезненным воспалением. Чрезмерная на первый взгляд «жестокость» возбужденных фагоцитов, токсины которых убивают не только бактерии, но даже ближайшие ткани, имеет глубокий смысл в условиях внезапного повреждения ткани. Даже если фагоциты не смогут напрямую найти и обезвредить микроорганизм или вирус, спрятавшийся в клетке организма, он наверняка погибнет в общей сумятице. При этом могут серьезно пострадать нормальные ткани, но, по крайней мере, распространение болезни будет остановлено.
Таким образом, повреждение тканей – важный общий регулятор активной защитной реакции организма. Это уже отчасти объясняет, как мы можем одновременно терпеть симбиотических партнеров и отбиваться от других бактерий, но для полного понимания нужно рассмотреть третью линию защиты. Она есть только у позвоночных животных и основана на способности учиться на собственном опыте. Эта линия по-прежнему использует древнее оружие – сочетание химических веществ (составляющих систему комплемента) и фагоцитов, позволяющее эффективно убивать вторгшихся в организм врагов, – и по-прежнему контролируется, по большому счету, сигналами от поврежденной или инфицированной ткани. Новое в этой линии защиты – ряд дополнительных типов клеток и, что самое важное, набор высокоспециализированных белков, которые способны очень точно и быстро направлять фагоциты и химическое оружие системы комплемента на борьбу с захватчиками при условии, что у системы было достаточно времени. Из-за своей способности к обучению и адаптации эта линия защиты получила название «адаптивная иммунная система».
Поскольку адаптивная иммунная система состоит из мигрирующих клеток, контактирующих друг с другом относительно недолго, ее структура значительно отличается от другой самообучающейся машины – мозга. Тем не менее логика, лежащая в основе обучения, удивительно схожа в обоих случаях. В головном мозге (глава 15) основной принцип обучения заключался в том, что сначала закладывается большое количество нейронных связей, а затем, в зависимости от опыта, некоторые закрепляются, а некоторые – нет. На основе опыта, накапливающегося с ростом потока сигналов, система устраняет ненужные связи и укрепляет нужные. В адаптивной иммунной системе поток сигналов, проходящий через рецепторы, играет роль, напоминающую роль связей между нейронами в головном мозге. И здесь принцип заключается в создании огромного количества возможностей – в данном случае рецепторов, – некоторые из них в дальнейшем пригодятся, а некоторые – нет, и в пропускании через них потока сигналов, чтобы решить, какие рецепторы следует укрепить, а какие убрать.
Хотя стратегии обучения похожи в общих чертах, их детали существенно различаются, поскольку адаптивная иммунная система – это жидкая ткань, лишенная жесткой архитектуры. В отличие от нервной системы, она не может опираться на дискретные соединения между точками. Рецепторы, необходимые для процесса обучения, находятся на поверхности клеток, которые есть только у позвоночных, – Т-клеток (буква «Т» означает «тимус» – железа, где эти клетки проводят много времени на ранних этапах своего существования). Т-клетки бывают разных типов: одни контролируют деятельность других клеток, другие выступают в роли «палачей», вводя смертельно опасные ферменты в зараженные клетки ткани. Все они несут важнейшие Т-клеточные рецепторы (TCR). Чтобы система обучения начала функционировать, требуются миллионы Т-клеток. Каждая конкретная клетка несет лишь один из многих возможных TCR, а каждый TCR уникален в том, что он может распознать.
Возникновение разнообразных TCR порождает интересную проблему. Выбор TCR-специфических молекул для связывания зависит от точной последовательности аминокислот в белках, которые входят в состав TCR. Как и во всех белках, последовательность аминокислот определяется последовательностью нуклеотидов (азотистых оснований) в гене. В принципе, животное может научиться создавать несколько видов рецепторов, имея несколько версий гена, немного отличающихся нуклеотидной последовательностью. Этот подход действительно используется во многих семействах сигнальных рецепторов, участвующих в развитии, но для адаптивной иммунной системы он не годится. У нас около двадцати пяти тысяч генов, а адаптивной иммунной системе требуются миллионы различных TCR. О добавлении миллионов новых генов в геном не может быть и речи по многим причинам. Во-первых, копирование такого большого количества генов при делении клеток будет слишком затратно, во-вторых, такой геном будет нестабильным из-за рекомбинации, которая происходит между похожими участками ДНК, и, наконец, это дополнительное количество ДНК просто не поместится в клетку.
Т-клетки выходят из этой тупиковой ситуации следующим образом. Имея лишь один основной ген для каждого из двух типов белковой цепи, которые, объединяясь, образуют TCR, они проявляют крайнее пренебрежение всеми биологическими «правилами»: каждая клетка сознательно мутирует и перестраивает часть гена TCR. У них есть особый набор ферментов, которые реорганизуют именно этот участок только этого гена. Итогом процесса, включающего несколько сложных шагов, является то, что каждая Т-клетка создает TCR на основе генов со случайной последовательностью оснований именно на том участке, который определяет, с чем будет связываться TCR. Каждая клетка может создать только одну версию TCR.
Минусом такого случайного характера образования TCR является то, что многие из версий TCR не смогут образовать даже слабые связи и, следовательно, будут бесполезны. Некоторые из них смогут распознавать фрагменты опасных микроорганизмов, что ценно для защиты организма. Другие будут распознавать нормальные ткани организма, что в лучшем случае бесполезно, а в худшем опасно. Именно поэтому первым аспектом обучения в адаптивной иммунной системе является удаление бесполезных или опасных TCR, а значит, и их носителей – Т-клеток. Молодые Т-клетки, которые только что перетасовали нуклеотиды в генах случайным образом и начали производить TCR, находятся в тимусе, в окружении клеток, на поверхности которых находится множество фрагментов белков, характерных для данного организма. У TCR имеется множество шансов для распознавания этих фрагментов, если они ему подходят. На данном этапе жизнь каждой Т-клетки зависит от стимуляции TCR, но стимуляция не должна быть слишком сильной. TCR, не образующий связей ни с чем, судя по всему, бесполезен, и поэтому клетка-носитель убивает себя. Ясно, что, если TCR реагирует слабо и связывается спорадически, он может обнаруживать фрагменты молекул, но не слишком эффективно. Однако это обнадеживает, ведь слабое обнаружение фрагмента нормального белка означает, что TCR, по крайней мере, работает и есть вероятность, что он сможет обнаружить фрагмент какого-то бактериального или вирусного белка намного лучше. Поэтому такие клетки будут жить, созревать и распространяться по организму. Если TCR образует прочные связи еще в тимусе, это означает, что он с высокой точностью распознает фрагменты нормального белкового материала. В этом случае он либо совершит самоубийство, либо научится подавлять активность в отношении таких фрагментов. В любом случае иммунная система не будет действовать против самого организма.
К концу этого процесса организм будет заполонен миллионами Т-клеток, несущих разные версии TCR. Они не реагируют сколь бы то ни было сильно на компоненты тела, но проявили очень слабую реакцию хотя бы на что-то. В организме Т-клетки часто контактируют со специфическим типом фагоцитов, которые демонстрируют им мелкие фрагменты того, что им удалось заглотить (в этом случае с помощью специальных белков, удерживающих эти фрагменты на поверхности клетки). Если фагоцит прибыл из очага инфекции, среди этих фрагментов будут кусочки микроорганизма. Большинство Т-клеток никак не реагируют на эти фрагменты, но иногда фагоциту может попасться Т-клетка, которая распознает его груз. Именно этого и ждет Т-клетка. Она полностью активируется, быстро делится, создавая целую армию дочерних клеток с таким же TCR, и выделяет сигнальные молекулы, которые привлекают другие Т-клетки в этот район. Некоторые из них распознают другие фрагменты микроба и тоже активируются. Часть Т-клеток отправится убивать клетки тканей, которые несут тот же фрагмент белка, ведь они, предположительно, заражены (рис. 79).
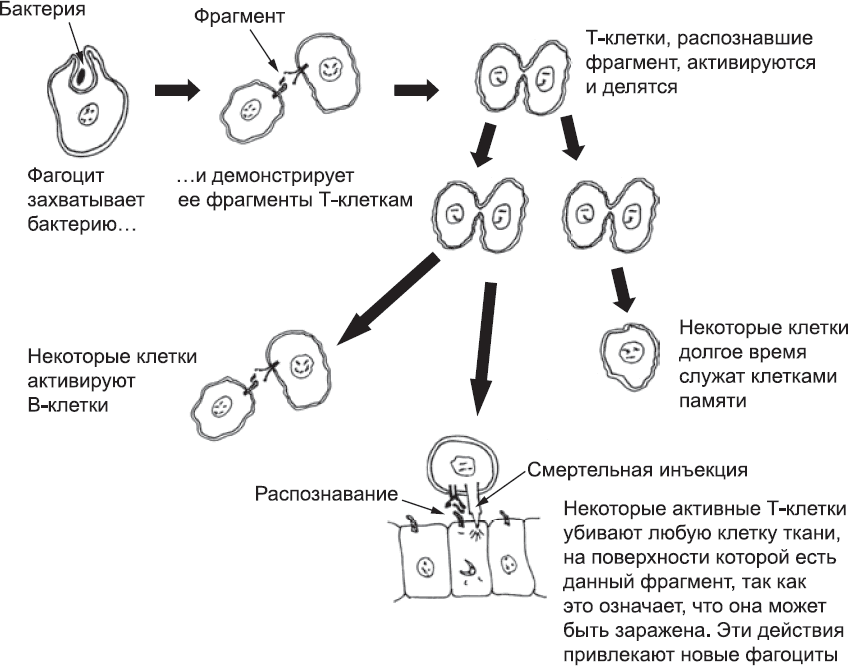
Рис. 79. Обобщенная схема некоторых способов, при помощи которых Т-клетки организуются и принимают участие в защитной реакции. Т-клетки имеют TCR, которые активируются, узнав показанный фагоцитом фрагмент бактерии. Разные события на этой схеме, например гибель клеток и использование системы комплемента, также могут привлекать фагоциты, вовлеченные во второй уровень иммунной реакции
Обучающий аспект этого процесса зависит как от деления вовлеченных в него клеток (что приводит к увеличению числа клеток с нужным типом TCR), так и от способности некоторых клеток оставаться в живых после гибели большинства других. Выжившие клетки становятся клетками памяти. Их присутствие означает, что, если тот же возбудитель болезни снова проникнет в организм, там будет гораздо больше клеток, способных распознавать его и запустить реакцию. Кроме того, клетки памяти более чувствительны к этому возбудителю, чем были любые клетки во время первого вторжения, и они меняют способы взаимодействия с остальной иммунной системой. В результате повторное вторжение того же патогена вызывает очень быструю и эффективную защитную реакцию. В таких условиях у вторгшихся микроорганизмов остается мало шансов на победу. Именно поэтому мы переносим большинство болезней только однажды, а затем у нас вырабатывается иммунитет и мы не заболеваем даже после непосредственного контакта с больным. Кажущиеся исключения, например простуда, на самом деле вызываются множеством различных микроорганизмов (в данном случае вирусов), так что всякий раз – это первый раз. Некоторые микроорганизмы, например возбудитель малярии, являются исключением, потому что в процессе эволюции у них появились механизмы обхода иммунной системы (это пример эволюционной «гонки вооружений», о которой я уже упоминал).
Т-клетки не единственные клетки тела, которые используют случайную перестановку нуклеотидов конкретных генов для производства огромного разнообразия рецепторов. Такой же прием используют В-клетки при создании В-клеточных рецепторов (BCR). BCR очень похожи на TCR. Каждая В-клетка обладает только одним уникальным BCR. В-клетки патрулируют организм, и, если находят молекулу, которую могут распознать их BCR, они поглощают ее и «разрезают» с помощью ферментов. Затем они выставляют ее фрагменты на своей поверхности – на тот случай, если встретятся с Т-клетками, которые смогут их распознать. Если это произойдет, Т-клетка пошлет В-клетке сигнал, и та начнет делиться, образуя многочисленные В-клетки с тем же BCR. Некоторые дочерние В-клетки становятся клетками памяти, готовыми к предстоящим схваткам с тем же микроорганизмом, а другие начинают выделять свои BCR в окружающую жидкость (рис. 80). Секретированный BCR называется антителом. Он может быстро распространяться по тканям и связываться с распознаваемой молекулой, все еще плавающей в жидкости или уже находящейся на поверхности микроба или инфицированных клеток. Антитело задействует старейшую химическую защиту, а также фагоциты: таким образом оно выносит «смертный приговор» любой клетке, с которой связывается.
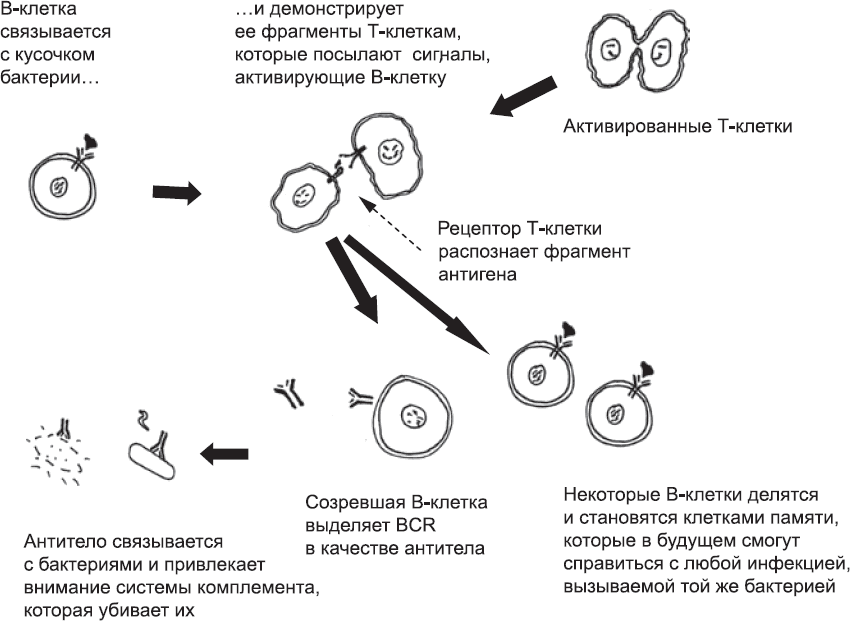
Рис. 80. Схема активации В-клеток. Если В-клетки связываются с участком бактерии, который распознал их BCR, то они демонстрируют его Т-клеткам. Если В-клетки находят Т-клетку, TCR которой распознает фрагмент, клетки обмениваются сигналами, и В-клетки активируются. Некоторые из них начинают делиться и становятся клетками памяти, которые смогут быстро активироваться при повторной инфекции. Остальные клетки созревают и производят антитела (свободные BCR). Антитело, сохранившее изначальную способность BCR связываться с этой конкретной бактерией, может задействовать систему комплемента и фагоциты и, следовательно, вызывать быструю смерть этих бактерий
Способность адаптивной иммунной системы к обучению лежит в основе вакцинации. В этом случае в организм вводят отдельные белки или безвредный или ослабленный штамм опасной бактерии или вируса, чтобы произошел первый «бой». Когда он закончится, у организма остаются клетки памяти T – и B-типа, которые смогут быстро и эффективно отреагировать, если когда-нибудь организм столкнется с настоящей болезнью. Для эффективной вакцинации, как правило, нужно, чтобы инъекция препарата вызывала достаточно сильное раздражение: она должна вызвать повреждение тканей, задействовать клетки и помочь молекуле-«мишени» продержаться достаточно долго, чтобы быть распознанной. Чистый белок в этом случае работает плохо. На этом примере хорошо видно, что начальная активация реакции адаптивной иммунной системы основана в конечном счете на древнем механизме производства сигналов тревоги от ткани в состоянии стресса или умирающей ткани, а также от бактериальных продуктов.
Адаптивная иммунная система не нуждается в априорном, генетически обусловленном знании химического строения противников, с которыми она столкнется. Как и мозг, она изменяется в зависимости от опыта, а Т – и В-клетки, которые активировали свои рецепторы в первой битве, становятся «отрядом быстрого реагирования», готовым снова нанести удар по знакомому врагу, не дожидаясь значительного повреждения тканей. Так что в данном случае выражение «все, что не убивает нас, делает нас сильнее» вполне справедливо.
Это краткое объяснение принципов работы адаптивной иммунной системы возвращает нас к вопросу о том, как же мы все-таки уживаемся с симбиотическими бактериями. Совсем недавно было обнаружено,, что клетки человеческого кишечника, распознающие сигналы от симбиотических бактерий, посылают защитным системам сигналы, означающие: «ничего страшного здесь не происходит». Сигналы действуют на фагоциты, которые специализируются на демонстрации связанных с поверхностью фрагментов бактерий Т-клеткам. Эти фагоциты могут быть в двух состояниях: в одном они демонстрируют фрагменты, сопровождая демонстрацию сигналами, которые побуждают Т-клетки начать агрессивную атаку, а в другом состоянии – сигналами, которые убеждают Т-клетки успокоиться и проявить терпимость. В норме клетки кишечника, которые контактируют только с симбиотическими бактериями, выделяют два белка, которые переводят фагоциты в зоне досягаемости в «спокойное» состояние. Фагоциты будут по-прежнему демонстрировать молекулы бактерий, частично переваренной пищи и т. д., но при этом будут способствовать толерантности, а не агрессии. Если же клетки стенки кишечника находятся в контакте с вредоносными бактериями, они посылают не успокаивающие сигналы, а сигналы тревоги. Тогда фагоциты демонстрируют Т-клеткам фрагменты бактерий вместе с сильными активирующими сигналами, и организм быстро мобилизует защиту. И в этом случае главным контролирующим элементом защитной реакции является то, испытывает ли ткань (в том числе ее иммунные клетки) стресс. А «диалог» между бактериями и стенкой кишечника добавляет к этому позитивный сигнал – ничего плохого не происходит.
Влияние симбиотических бактерий кишечника на иммунную реакцию не ограничивается обеспечением их собственного выживания. Мыши, развивающиеся в стерильных условиях и лишенные кишечных бактерий, имеют странную и дефективную иммунную систему, уязвимую к атакам разных микроорганизмов, в том числе никак не связанных с кишечником. Складывается впечатление, что фрагменты поверхности некоторых кишечных бактерий, включая Bacteroides fagilis, которые заселяют кишечник почти сразу после рождения, оказывают сильное влияние на созревание различных популяций Т-клеток во всем организме, изменяя баланс между теми клетками, которые запускают иммунные реакции, и теми, которые развивают толерантность к различным раздражителям. Если нормальное развитие иммунной системы зависит от контакта с безобидными бактериями (возможно, не только с Bacteroides fagilis, но и с сотнями других бактерий), то это может объяснить, почему повышение уровня гигиены, к которому мы так стремимся, сопровождается повышением частоты таких заболеваний, как астма, которая свидетельствует о дисбалансе иммунной системы и вызывается такими безвредными веществами, как пыль, шерсть животных и пыльца. Еще одно изменение, связанное с гигиеной, – это практически полное избавление от глистов. Люди и паразитические черви развивались вместе в течение долгого времени, и, как теперь выясняется, глисты меняют баланс иммунной системы, по сути успокаивая ее, что идет на пользу как паразитическим червям, так и их хозяевам. Животные и, вероятно, люди без глистов проявляют иммунную гиперактивность в гораздо большей степени, чем животные с некоторым количеством паразитических червей (конечно, когда их слишком много, это тоже плохо).
В организме человека две основные системы обучения – мозг и адаптивная иммунная система – начали совместную деятельность по созданию четвертого уровня защиты в дополнение к трем уровням, которые есть у всех позвоночных. Даже у других млекопитающих инстинктивный и приобретенный груминг, а также избегание гнилой пищи позволяют мозгу помочь защитным системам, просто ограничивая контакт особи с опасными микробами. Человеческий мозг, способный систематически исследовать мир и передавать знания следующим поколениям, добавил сюда новое измерение поведенческой защиты. Самые опасные занятия с точки зрения заражения – это прием пищи и питье, потому что всегда есть риск, что еда и вода содержат опасные микроорганизмы, например возбудителей сальмонеллеза или холеры. Наши древнейшие культурные открытия – термическая обработка пищи, кипячение воды или употребление ферментированных напитков – резко снизили опасность заражения. Скорее всего, не случайно все цивилизации, создавшие крупные, густонаселенные города, изобрели чай, эль или что-то подобное. Относительно недавно, после открытия бактерий и путей заражения ими, люди стали строить водопроводы для подачи чистой воды и канализацию для отведения грязной. Это лежит в основе благополучного существования городов с миллионным населением. Разработка вакцин, антибиотиков и противовирусных соединений еще больше усилила безопасность как отдельных людей, так и целых популяций. Несомненно, нас ждут новые опасности: возбудители болезней эволюционируют быстро, а благодаря глобальному туризму еще и распространяются по миру со скоростью лесного пожара. На нашем уровне развития цивилизации мы полностью зависим от этого четвертого, научно-культурного уровня защиты. Если человечество как вид когда-нибудь откажется от активных научных исследований, оно вскоре заплатит страшную цену.
Развитие разума, о котором мы поговорим в последней главе, и развитие иммунной системы, которое мы только что обсудили, – важнейшие события, связанные с развитием, которые происходят после рождения. Так и должно быть, ведь они связаны со взаимодействием новорожденного с непредсказуемой средой. Продолжительность их развития еще раз говорит о том, что развитие человека ни в коем случае не заканчивается рождением. И разум, и иммунная система продолжают развиваться всю жизнь, откликаясь на жизненный опыт. По мере развития организм также должен оберегать себя от повреждений и ежедневного износа. Об этом «техобслуживании» и его связи с эмбриональным развитием мы сейчас и поговорим.
Назад: Глава 16 Мера всех вещей
Дальше: Глава 18 Текущий ремонт

