Происхождение компонентов биоэнергетических систем
Огромное разнообразие электрон-транспортных цепей разных организмов, работающих в хемосинтезе, фотосинтезе и дыхании, строится из ограниченного количества блоков. Ферментные комплексы состоят из многих отдельных белковых молекул, причем часто мы можем найти родственные компоненты в комплексах с разными функциями. По последовательностям аминокислот в белках и по составу белковых субъединиц в разных комплексах мы можем проследить их эволюцию. Небелковая часть электрон-транспортных цепей, гемы и хиноны, имеет свою эволюционную историю, которую можно проследить по взаимодействующим с ними белкам.
Разнообразие и происхождение гемов, хлорофиллов и родственных коферментов
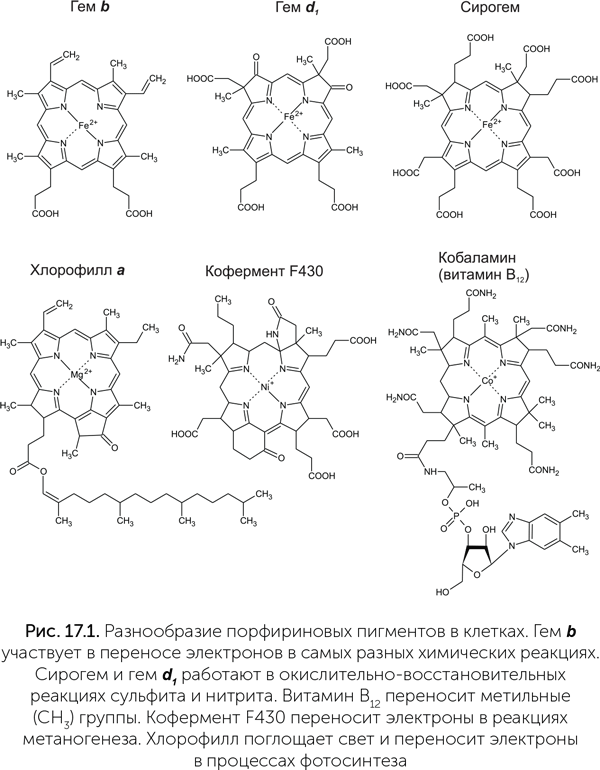
Основной пигмент современного фотосинтеза — хлорофилл, как и основной компонент электрон-транспортных цепей, гем, относится к группе веществ, называемых порфиринами. Широкие плоские молекулы порфиринов, содержащие в центре атом какого-либо металла, легко могут окисляться и восстанавливаться, поглощать свет и проводить электроны от одной соседней молекулы к другой. Также они могут быть эффективными катализаторами химических реакций.
К порфиринам, кроме хлорофилла и обычных гемов (a и b), относятся некоторые другие молекулы, работающие в клетках, например гем d1 и сирогем. Последние по сравнению с обычным гемом имеют в своей структуре меньше двойных связей и больше боковых карбоксильных (СООН) групп. Сирогем входит в состав двух типов ферментов: сульфит-редуктаз и ассимиляторных нитрит-редуктаз. Оба этих класса ферментов проводят реакции восстановления с переносом в общей сложности до шести электронов, восстанавливая сульфит до сероводорода и нитрит до аммиака. Гем d1 входит в состав единственного фермента, диссимиляторной нитрит-редуктазы, которая восстанавливает нитрит до оксида азота, NO, с переносом одного электрона.
Более далекие родственники гемов — кофермент F430 и витамин В12. Кофермент F430 содержит никель и участвует в процессах метаногенеза. Ни у каких других организмов, кроме архей-метаногенов, он не встречается. Витамин В12 же есть почти у всех организмов, содержит кобальт и участвует в реакциях переноса метильных групп. Его строение несколько отличается от типичных порфиринов: в нем отсутствует один из метиленовых мостиков, соединяющих малые кольца в большое порфириновое кольцо. Вместо этого два малых кольца из четырех связаны напрямую; такие молекулы называются «коррины» (рис. 17.1).
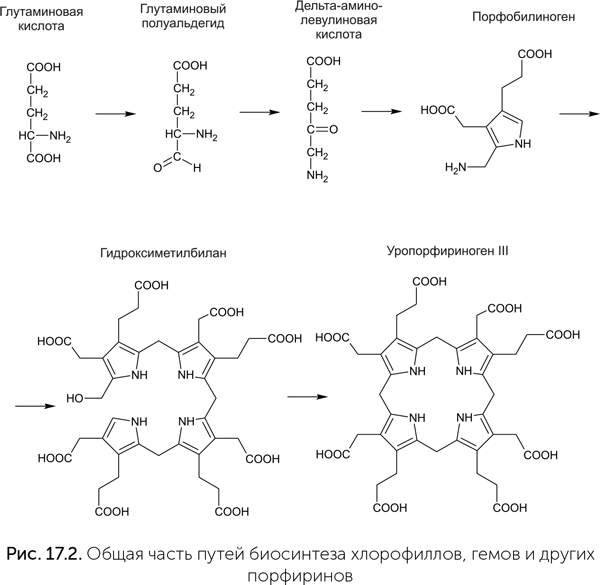
Синтез всех порфиринов и витамина В12 начинается одинаково (рис. 17.2). Глутаминовая кислота восстанавливается до альдегида, потом аминогруппа переносится на конец молекулы, и получается дельта-аминолевулиновая кислота. Две ее молекулы реагируют друг с другом, образуя порфобилиноген — вещество с пятичленным пиррольным кольцом в молекуле. Затем четыре молекулы порфобилиногена объединяются в цепочку (гидроксиметилбилан), которая замыкается в кольцо (уропорфириноген III). Отсюда пути синтеза разных порфиринов расходятся.
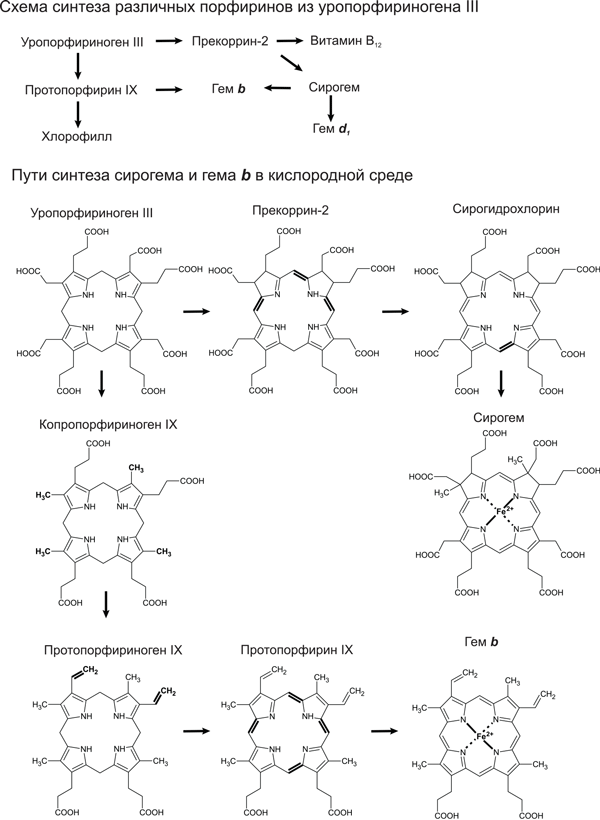
Известно несколько разных путей синтеза гемов и витамина В12 из уропорфириногена III. Их эволюционные отношения долго не удавалось распутать. Лишь недавно, с описанием всех ферментов и реакций пути синтеза витамина В12 у архей (Moore et al., 2013), удалось разобраться в этом разнообразии. Эти цепочки реакций делятся на две группы: аэробные (работающие в присутствии кислорода) и анаэробные. Их главное различие состоит в том, что в аэробных путях синтеза гема и В12 атом металла вставляется в молекулу на последней стадии, а в анаэробных — ближе к началу и участвует в последующих реакциях. Смысл этих различий, видимо, в том, что металлсодержащие промежуточные продукты в кислородной среде могут легко окисляться и быть источниками повреждающих активных форм кислорода.
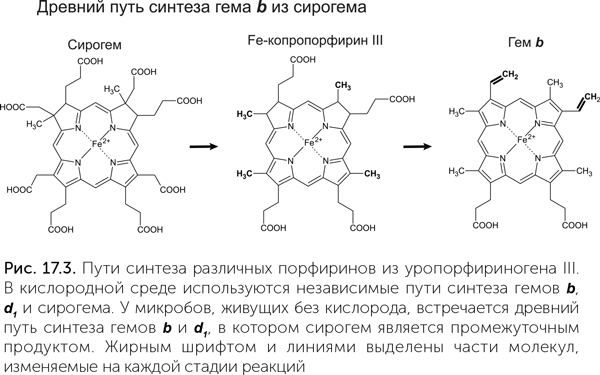
Превращение уропорфириногена III в гемы и хлорофиллы сводится к восстановлению части двойных связей, вставке железа или магния и «обработке краев напильником» — отщеплению или укорочению боковых цепей. В аэробных путях синтеза порядок реакций с боковыми цепями может различаться в разных организмах (Dailey et al., 2015). У многих архей, а также у части анаэробных бактерий (сульфатвосстанавливающих, например Desulfovibrio, и некоторых денитрифицирующих) обнаружен, по-видимому, древнейший путь синтеза гема (Bali et al., 2011). Гемы b и d1 у них образуются из сирогема, причем на всех стадиях превращений атом железа остается в центре молекулы. По-видимому, это означает, что и в эволюции сирогем был предшественником этих гемов (рис. 17.3).
Разнообразие и эволюция гем-содержащих белков
Цитохромы были открыты и разделены на типы (а, b, c) еще в конце XIX века по своим спектроскопическим свойствам — грубо говоря, по цвету. Первое время после открытия гемов считалось, что каждому типу цитохромов соответствует свой тип гема, отличающийся боковыми группами порфиринового кольца. Потом оказалось, что реально существуют только гемы a, b и d1. Цитохромы с cодержат гем b, но отличаются от прочих типов цитохромов способом соединения гема с белком. В цитохромах с гем соединен с белковой молекулой двумя прочными ковалентными связями, а в цитохромах а, b и d — только слабыми координационными связями. Цитохромы a и b образуются самопроизвольно в пробирке из очищенного белка и гема. Ковалентное соединение гема с белком в цитохромах c образуется при помощи специальных ферментов. Так что в эволюции цитохромы с должны были возникнуть позже, чем другие типы цитохромов. Распространение цитохромов с и филогенетические деревья ферментов, соединяющих гем с белком, показывают, что цитохромы с появились уже после появления основных групп бактерий. Их изобретателями могли быть протеобактерии или цианобактерии, а возможно, и те и другие независимо. Дальнейшее распространение цитохромов с по другим группам бактерий и архей происходило путем горизонтального переноса генов. Благодаря прочным ковалентным связям гема с белковой цепью в цитохромах с они гораздо устойчивее и могут участвовать в большем разнообразии реакций, чем цитохромы a и b.
О сирогем-содержащих белках мы можем с уверенностью сказать, что у LUCA из них была диссимиляторная сульфит-редуктаза (Dsr). Она восстанавливает сульфит (SO32-) до серы в сульфатном дыхании либо, наоборот, окисляет серу до сульфита в серном фотосинтезе. Молекула этого фермента состоит из двух похожих субъединиц, каждая из которых связывает сирогем, но только один из двух сирогемов образует активный центр. Значит, древний вариант сульфит-редуктазы Dsr состоял из двух одинаковых белковых половинок, кодируемых одним геном, и имел два активных центра. Филогенетическое дерево белковых субъединиц этого фермента однозначно показывает, что дупликация гена, давшая начало двум разным субъединицам, произошла до разделения бактерий и архей (Dhillon et al., 2005). Ассимиляторная сульфит-редуктаза (Asr) по структуре похожа на сульфит-редуктазу Dsr, но две субъединицы у нее слились в единую белковую цепь, а неработающий второй сирогем был утрачен. Подобной структурой обладает и нитрит-редуктаза. Усиление различий между субъединицами и их слияние указывают, что нитрит-редуктаза и сульфит-редуктаза Asr произошли от Dsr. Это согласуется и с их функциями: редуктаза Asr образует сероводород из сульфита, нитрит-редуктаза — аммиак из нитрита, а в геотермальных водоемах, где обитал LUCA, сероводород и аммиак были в достатке. Сульфит-редуктаза Dsr же может работать в обратном направлении, окисляя серу; и в этом качестве могла быть востребована у LUCA, например, в процессе фотосинтеза.
Итак, мы можем быть уверены, что из разнообразия порфиринов LUCA могли быть сирогем, участвующий в окислении серы, и витамин В12, работающий, среди прочего, в восстановительном ацетил-КоА-пути фиксации углекислого раза (см. главу 11). О древности других порфиринов мы не можем судить так же достоверно. Гемы a и b участвуют во множестве окислительно-восстановительных реакций, и у нас нет четких аргументов ни за, ни против их присутствия у LUCA. Хлорофиллы или промежуточные продукты их синтеза (протохлорофиллиды) могли быть у LUCA в качестве защитных пигментов. Нельзя исключать, что эту же функцию защиты от ультрафиолета могли выполнять какие-нибудь другие порфирины, которые не сохранились до нашего времени.
Разнообразие и эволюция хинонов
В разных группах бактерий и архей для переноса электронов в мембранах используются химически разные хиноны: убихинон, пластохинон, менахинон, кальдареллахинон и другие (рис. 17.4). Кроме того, существуют бактерии и археи, не имеющие хинонов вовсе: это ацетогены из клостридий и большинство групп архей-метаногенов. В электрон-транспортной цепи электроны передаются с более слабого окислителя на более сильный. Единственный окислитель, доступный метаногенам, CO2, слишком слаб, чтобы принимать электроны с хинонов. Лишь у архейного семейства метаногенов Methanosarcinales есть аналоги хинонов — метанофеназины, которые по своему редокс-потенциалу могут отдавать электроны на CO2.
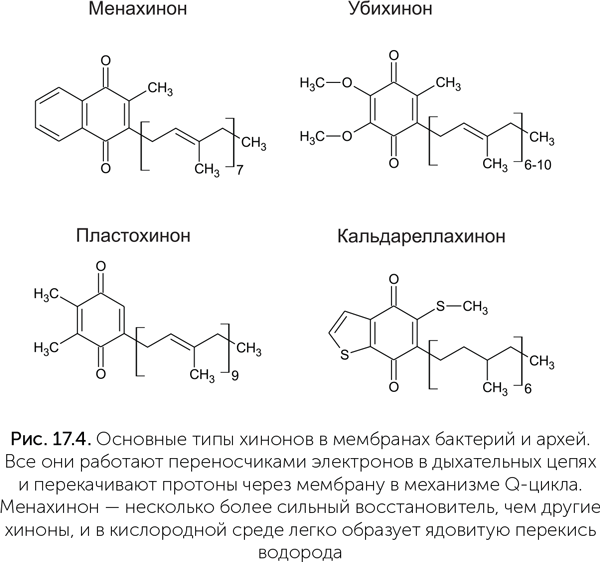
Если посмотреть распределение разных хинонов по филогенетическому дереву бактерий и архей, то легко можно увидеть, что большинство хинонов появились в эволюции после расхождения основных групп бактерий. Убихинон возник у протеобактерий, пластохинон — у цианобактерий, а кальдареллахинон — у архей Sulfolobales. Менахинон же распространен у самых разных групп бактерий и архей. Обладатели уби-, пласто- и кальдареллахинона обычно используют кислород либо устойчивы к нему, а организмы с менахиноном, как правило, строгие анаэробы. Менахинон реагирует с кислородом, образуя ядовитую перекись водорода, поэтому с появлением кислорода в атмосфере разные группы бактерий и архей независимо друг от друга нашли ему безопасную замену. Менахинон в настоящее время найден у самых разных групп анаэробных бактерий и архей, в том числе древних. Вероятно, он был еще у LUCA либо возник вскоре после разделения бактерий и архей.
Разнообразие электрон-транспортных цепей
В предыдущих главах мы познакомились с двумя самыми распространенными вариантами электрон-транспортных цепей, работающими в аэробном дыхании и в кислородном фотосинтезе. На самом деле разнообразие гораздо шире, потому что бактерии и археи используют множество разных окислителей и восстановителей (см. главу 16). Кроме упомянутых в прошлой главе окислителей (кислород, сульфат, нитрат, нитрит) разные бактерии могут использовать серу, хлорат, перхлорат, арсенат, селенат, растворенное трехвалентное железо (в кислой среде), твердые оксиды Fe2O3 и MnO2, хлорорганические соединения и другие вещества. В качестве восстановителей может использоваться такая экзотика, как фосфит, арсенит, соединения сурьмы и даже урана. Более того, существуют разные неродственные варианты ферментных комплексов для одной и той же реакции. Например, для окисления железа у разных микробов известно четыре разных ферментных системы. Описание всего этого разнообразия заняло бы целую книгу, поэтому мы ограничимся здесь разбором двух электрон-транспортных цепей: денитрификации и сульфатного дыхания/окисления серы. Первая интересна тем, что некоторые ее ферменты эволюционно родственны ферментам кислородного дыхания, а вторая, по-видимому, одна из древнейших.
В ходе денитрификации нитрат восстанавливается до азота в четыре стадии:
NO3- → NO2- → NO → N2O → N2.
Каждая из четырех реакций катализируется своим ферментом. Типичная дыхательная цепь денитрификации похожа на цепь, работающую в аэробном дыхании: в ее составе тоже есть комплекс I (НАДН-дегидрогеназа) и комплекс III (цитохромный комплекс bc1, в состав которого входят цитохромы b и с), между которыми электроны переносятся при помощи хинонов. Однако если аэробная дыхательная цепь линейна, то дыхательная цепь денитрификации разветвляется в двух местах. Хиноны в ней переносят электроны не только к цитохрому bc1, но и к нитрат-редуктазе, а после цитохрома bc1 подвижный малый цитохром с доставляет электроны по трем разным адресам: на нитрит-редуктазу, NO-редуктазу и N2O-редуктазу (рис. 17.5).
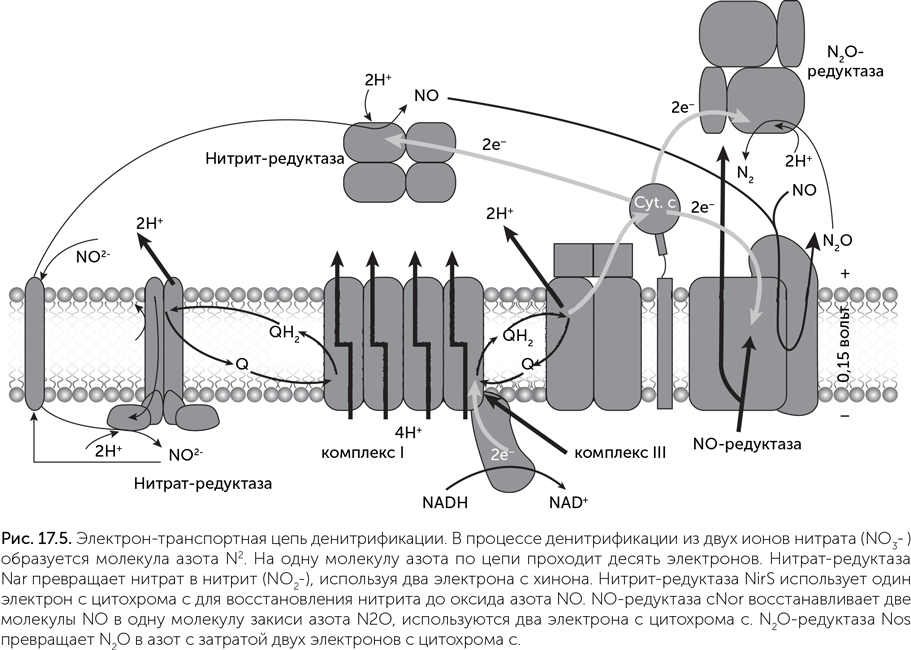
Из-за разветвления дыхательная цепь денитрификации нуждается в тонком управлении распределения тока. Например, нитрит-редуктаза производит ядовитый оксид азота NO. В норме его концентрация очень мала, потому что NO-редуктаза быстро превращает NO в безопасный N2O. Но если NO-редуктазе не хватит электронов, клетка отравит сама себя оксидом азота. Поэтому дыхательная цепь денитрификации качает меньше протонов, чем могла бы, — меньшая эффективность оказывается платой за безопасность. Кроме изображенного на рисунке варианта существуют более простые денитрификационные дыхательные цепи, в которых нет комплекса III, а все четыре редуктазы получают электроны прямо с хинона. Они проще в управлении, но переносят меньше протонов через мембрану.
Все известные варианты дыхательных цепей денитрификации, аммонификации и других окислительно-восстановительных превращений соединений азота используют компоненты, возникшие в эволюции после LUCA: цитохромы c и медьсодержащие ферменты. Медь входит в состав активного центра N2O-редуктазы и вспомогательных субъединиц NO-редуктазы. Так что их появление в эволюции, видимо, произошло уже после возникновения основных групп бактерий.
Восстановление сульфата, как и нитрата, происходит в несколько этапов. Поскольку сульфат — очень слабый окислитель, то он нуждается в активации с помощью АТФ. Сульфат превращается в аденозил-фосфосульфат, который далее восстанавливается до сульфита, серы и сероводорода:
SO42- → аденозил-фосфо-SO4- → SO32- → S → H2S.
Аденозил-фосфосульфат-редуктаза (Apr) получает электроны не от обычных переносчиков, а от белкового комплекса-партнера, который называется Qmo (рис. 17.6). Даже с учетом активации АТФ сульфат — слишком слабый окислитель, чтобы принимать электроны с хинона. Поэтому комплекс Qmo объединяет в один ток электроны из двух источников с разным напряжением: от хинона (слабый восстановитель) и от ферредоксина (сильный восстановитель). Благодаря этому Apr может восстановить сульфат до сульфита. Работа комплекса Qmo называется «электронная конфуркация».
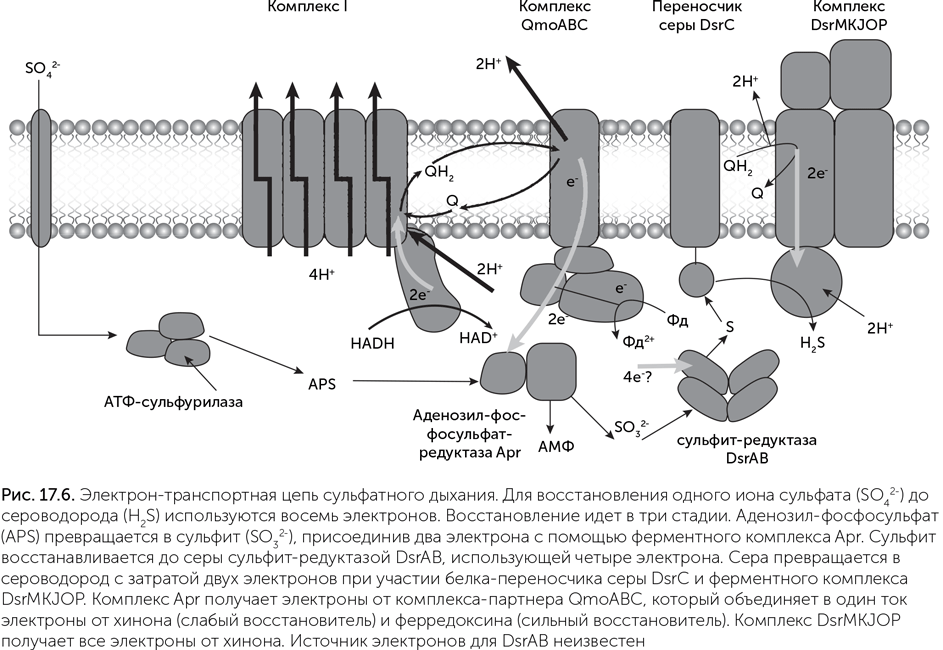
Дальше работает диссимиляторная сульфит-редуктаза (DsrAB), которая восстанавливает сульфит до серы, перенося четыре электрона. В клетках сера из активного центра сульфит-редуктазы выходит при помощи вспомогательного белка DsrC, молекула которого имеет длинную «ручку» с двумя остатками цистеина. Сера реагирует с этими цистеинами, превращаясь в H2S, а цистеины окисляются в дисульфидный мостик. Другой ферментный комплекс, гетеродисульфид-редуктаза (DsrMKJOP), восстанавливает этот дисульфидный мостик обратно, получая электроны с хинона. У многих бактерий эта система работает в обратном направлении, окисляя сероводород и серу до сульфита, например, в процессах фотосинтеза и диспропорционирования серы.
Комплексы сульфатного дыхания устроены достаточно однотипны у разных организмов, кроме того, сульфатное дыхание — признак нескольких древних, рано ответвляющихся групп архей и бактерий. Оно обходится без меди и обычно без цитохромов c. Субъединицы одного из его ферментов, сульфит-редуктазы DsrAB, судя по филогенетическому дереву, появились при дупликации генов еще до LUCA. Все это говорит о большой древности этого пути метаболизма.
Модульная структура окислительно-восстановительных ферментов
Изучение большого разнообразия дыхательных цепей показывает, что множество ферментных комплексов, работающих с разными веществами, строятся из небольшого набора субъединиц, как в конструкторе LEGO (Baymann et al., 2003). В простейшем случае дыхательная цепь состоит из двух комплексов, перенос электронов между которыми осуществляется хиноном. Каждый из двух комплексов включает как минимум три блока:
- каталитическая субъединица получает электроны от восстановителя;
- мембранная субъединица отдает электроны на хинон;
- соединительная субъединица работает «проводом» между двумя другими.
Среди каталитических субъединиц выделяются своей универсальностью молибденовые оксидоредуктазы (их еще называют CISM–Complex Iron-Sulfur Molibden). Это семейство ферментов восстанавливает гидрокарбонат (до муравьиной кислоты), нитрат (до нитрита), хлорат, перхлорат, арсенат, селенат, полисульфиды, диметилсульфоксид, триметиламиноксид и даже хлорорганические вещества. В состав этой субъединицы входит молибден, связанный с двумя молекулами витамина В9 (этот комплекс называется «молибденовый кофактор», MoCo), и один 4Fe-4S кластер (рис. 17.7).
Гетеродисульфид-редуктазная субъединица содержит три железосерных кластера 4Fe-4S (один из них связан с белком через пять атомов серы, а не через четыре, как обычно). Она входит в состав нескольких ферментов метаногенеза и сульфатного дыхания, у метаногенов восстанавливает дисульфидный мостик между двумя коферментами (CoB-S-S-CoM), у сульфатредукторов — мостик между двумя цистеинами в переносящем серу белке DsrC.
NiFe-гидрогеназная субъединица работает с молекулярным водородом (Н2). Она входит в состав разных гидрогеназ, мембранных и растворимых, поглощающих и выделяющих водород, а также формат-гидрогенлиазы и даже комплекса I (НАДН-хинон-оксидоредуктазы), и сочетается с разными «проводами» и хинонными портами.
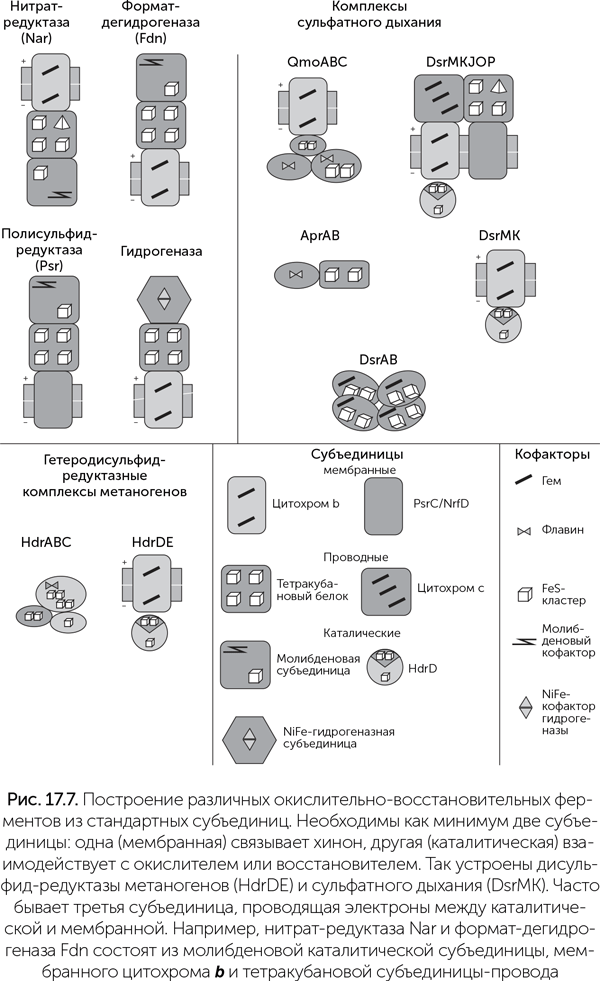
Трансмембранные цитохромы b сочетают функции «проводов» и «хинонных разъемов» и используются, когда каталитическая субъединица должна быть по одну сторону мембраны, а хинон — по другую. Они содержат два гема b и входят в состав формат-дегидрогеназы, нитрат-редуктазы, гидрогеназ, комплекса b6f в фотосинтезе и многих других ферментов.
Другой белковый модуль с хинонным сайтом носит обозначение PsrC/NrfD. Эта субъединица связывает каталитический центр с хинонами на той же стороне мембраны, в отличие от цитохромов b. Она входит в состав полисульфид-редуктаз Psr, арсенат-редуктазы, аммонифицицирующей нитрит-редуктазы Nrf и некоторых гидрогеназ. В составе некоторых комплексов эта субъединица дополнительно переносит протоны через мембрану за счет изменения формы белка.
Кроме трансмембранных «проводов» в комплексах электрон-транспортной цепи часто бывают гидрофильные провода, соединяющие разные субъединицы. Основные типы гидрофильных проводов — это тетракубановый белок (4 кластера 4Fe-4S), бактериальный ферредоксин (2 кластера 4Fe-4S, более известен как подвижный переносчик) и двухгемовый цитохром с.
Например, формат-дегидрогеназа Fdn состоит из трех субъединиц: молибденовой каталитической, тетракубанового «провода» и хинон-связывающего цитохрома b. Нитрат-редуктаза Nar собрана из таких же модулей, но в другой ориентации — ее каталитический домен обращен внутрь клетки, а не наружу.
Ферменты сульфатного дыхания дают примеры более сложных структур. Например, комплекс Qmo, проводящий электроны к аденозил-фосфосульфат-редуктазе (Apr), занимается сведением в один ток электронов от хинона и ферредоксина. В его составе есть цитохром b, дикубановая субъединица и две флавин-содержащие субъединицы. Комплекс DsrMKJOP, восстанавливающий переносчик серы DsrC, состоит обычно из пяти субъединиц: каталитической гетеродисульфид-редуктазной, двух мембранных хинонных портов (цитохром b и PsrC/NrfD типа) и двух вспомогательных на наружной стороне мембраны (трехгемовый цитохром с и тетракубановая). Зачем такая сложность — непонятно, потому что в некоторых клетках с той же работой справляется комплекс DsrMK из двух субъединиц — одной каталитической и одного цитохрома b. В группе дельта-протеобактерий ферменты сульфатного дыхания и другие комплексы еще более усложнены и содержат по несколько субъединиц цитохромов с, которые могут иметь до четырех-шести гемов. Видимо, это позволяет им быстро переключаться между разными окислителями и восстановителями.
Происхождение комплекса I (НАДН-хинон-оксидоредуктаза)
Один из сложнейших комплексов дыхательной цепи митохондрий и многих бактерий, комплекс I, переносит электроны с НАДН на хиноны. Энергия этих электронов используется для откачки из клетки протонов, которые затем входят обратно через роторную АТФазу и производят АТФ. У архей Methanosarcinales есть родственные комплексы, переносящие электроны с водорастворимого кофермента F420 на мембранный аналог хинона, метанофеназин. Минимальный вариант комплекса I включает в себя 14 разных субъединиц. В митохондриях животных комплекс I еще более сложен, и количество его субъединиц может превышать 40. Комплекс I по форме похож на букву Г, одно плечо которой лежит в мембране, а другое выступает в цитоплазму. Сайт связывания НАДН находится на конце цитоплазматического плеча. Четыре из мембранных субъединиц (J, L, M, N) непосредственно переносят протоны через мембрану за счет изменения формы белка (рис. 17.8).
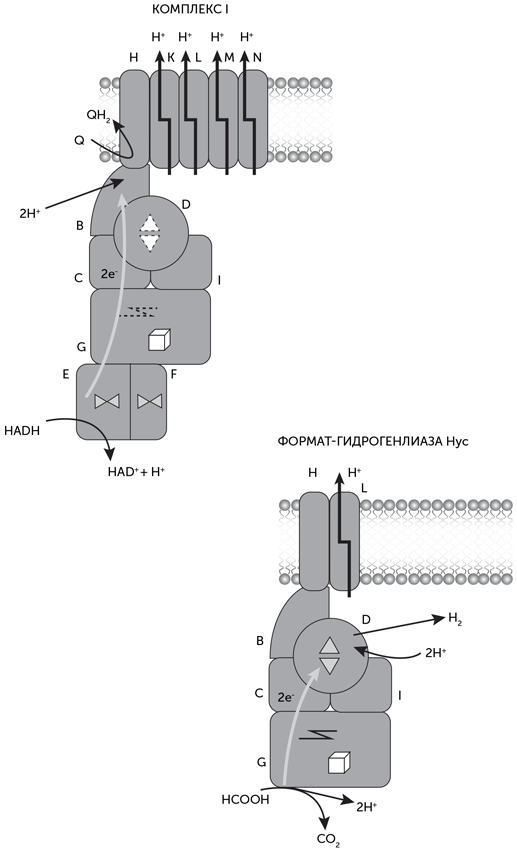
Сравнение аминокислотных последовательностей субъединиц комплекса I показало, что у многих из них есть родственники в других типах белков, прежде всего среди гидрогеназ и натрий-протонных антипортеров. Гидрогеназы — это разнообразная группа ферментов, работающих с молекулярным водородом. Они могут как вырабатывать водород, окисляя НАДН, ферредоксин и другие переносчики электронов, так и поглощать водород с восстановлением переносчиков. Эти функции востребованы, например, у организмов, использующих молекулярный водород для получения энергии и восстановления СО2 (ацетогены, метаногены и многие другие). По используемым металлам в активном центре гидрогеназы делятся на NiFe и FeFe семейства, которые дальше подразделяются на группы по составу субъединиц. Родством с комплексом I обладает четвертая группа NiFe гидрогеназ.
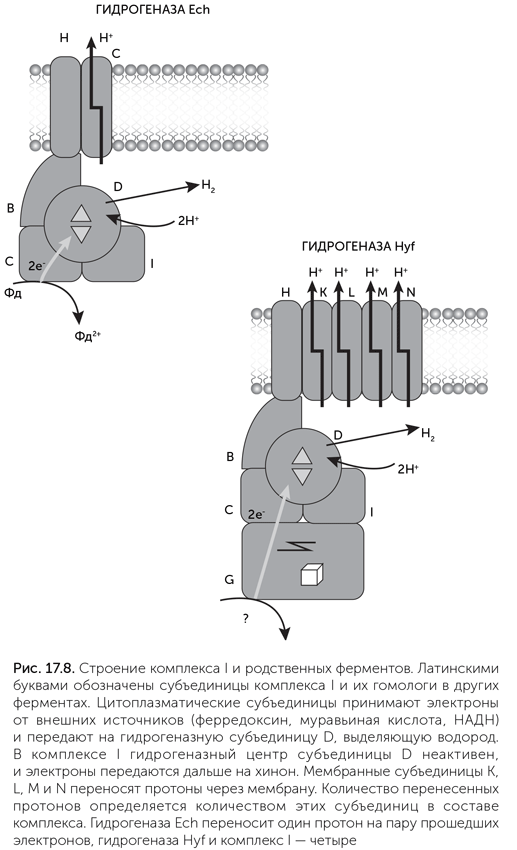
В четвертой группе гидрогеназ наиболее просто устроены гидрогеназы Ech. Это мембранные ферменты, получающие электроны от цитоплазматических доноров и выделяющие водород. Они состоят из шести субъединиц, все они имеют гомологи в комплексе I. Четыре цитоплазматических субъединицы гидрогеназы Ech родственны субъединицам B, C, D, I комплекса I, а две мембранных — субъединицам H и L соответственно (рис. 17.8). Каталитический центр гидрогеназы Ech, содержащий по одному атому железа и никеля, расположен на гомологе D-субъединицы комплекса I.
Более сложные гидрогеназы этой группы имеют дополнительные субъединицы. Например, Hyc — формат-гидроген-лиаза кишечной палочки — осуществляет разложение муравьиной кислоты с выделением СО2 и водорода. Она состоит из восьми субъединиц, шесть из которых похожи на субъединицы Ech, а две другие — молибден-содержащая формат-дегидрогеназа и субъединица, участвующая в передаче электронов от молибденового центра к никель-железному. Эти две субъединицы гомологичны, соответственно, С- и N-концам субъединицы G комплекса I. Гидрогеназа Hyf, тоже обнаруженная у кишечной палочки, имеет также гомологи мембранных субъединиц K, M, N комплекса I, которые ответственны за перенос протонов через мембрану. К сожалению, источник электронов для Hyf пока не найден. У других бактерий и архей обнаружены гидрогеназы четвертой группы, содержащие до 13 субъединиц и способные переносить ионы через мембраны. Для некоторых из них известны доноры электронов. Например, гидрогеназа Coo бактерий Rhodospirillum и Carboxydothermus окисляет угарный газ с выделением водорода и запасанием энергии.
Известны также близкородственные гидрогеназам белки, не имеющие собственно гидрогеназного центра. Наиболее просто устроены комплексы Ehr, состоящие из двух цитоплазматических субъединиц (гомологи B и D комплекса I) и четырех находящихся в мембране, которые соответствуют субъединицам H, L, M и С-концу K в составе комплекса I. Их функции неизвестны. Более сложный гидрогеназоподобный комплекс Mbx архей Pyrococcus и Thermococcus содержит также гомологи субъединиц C и I и дополнительные мембранные субъединицы. Он переносит электроны с ферредоксина на НАДФ и сопрягает эту реакцию с переносом протонов через мембрану.
Субъединицы L, M и N комплекса I ответственны за транспорт ионов. Помимо гидрогеназ четвертой группы родственные им белки входят в состав натрий-протонных антипортеров. Эти мембранные транспортные белки обменивают один ион натрия на один протон, перенося их через мембрану навстречу друг другу, и могут работать в обоих направлениях. Перенос ионов происходит благодаря движениям всей белковой молекулы. Эти антипортеры используются для соединения натриевой и протонной энергетики в одной клетке и могли быть одной из первых систем откачки протонов из клетки на заре протонной энергетики. Детальное изучение трехмерной структуры комплекса I показало, что субъединица H обладает сходной пространственной укладкой с L, M и N, но у нее отсутствуют аминокислоты, необходимые для связывания ионов. Видимо, она, подобно L, M и N, тоже происходит от натрий-протонных антипортеров, но в составе комплекса I изменила функцию и участвует в передаче движения от цитоплазматического плеча «рычага» к ионным насосам L–M-N.
Мы видим, что шире всего распространены четыре субъединицы: мембранные H и L и цитоплазматические B и D. Они присутствуют в комплексе I, во всех мембранных гидрогеназах и гидрогеназоподобных комплексах, например Ehr. Поскольку они всегда оказываются в середине ферментных комплексов, их еще называют «универсальным адаптером». Субъединицы B и D также родственны двум субъединицам растворимых NiFe-гидрогеназ. Видимо, движение электронов в этих гидрогеназах сопровождалось изменением формы белка, и соединение B-D субъединиц с мембранными H-L, происходящими от натрий-протонного антипортера, позволило гидрогеназе запасать энергию, перенося ионы через мембрану.
На следующем шаге по пути к комплексу I гидрогеназа, видимо, стала формат-гидрогенлиазой, подобно Hyc кишечной палочки. Для этого к комплексу присоединились две субъединицы, которые в современном комплексе I слились в единую субъединицу G. Потом к комплексу присоединились субъединицы E и F, родственные растворимым НАДН-дегидрогеназам, и донором электронов стала НАДН вместо муравьиной кислоты. Однако субъединица G, утратившая аминокислоты, нужные для связывания молибдена, до сих пор сохраняет сходство с формат-дегидрогеназами. Приблизительно тогда же субъединица D утратила сайт связывания никель-железного кластера и способность выделять водород, и акцептором электронов стал хинон. Разница редокс-потенциала между НАДН и хиноном больше, чем между муравьиной кислотой и водородом. Поэтому перенос электронов с НАДН на хинон позволяет получить больше энергии. Чтобы полнее использовать эту энергию, в результате дупликации субъединицы L возникли дополнительные ионные насосы M и N. Малая субъединица K похожа на вспомогательные субъединицы натрий-протонных антипортеров и, видимо, была позаимствована из них для помощи в работе L–M-N.
Эволюция комплекса I дает нам яркий пример смены функций на молекулярном уровне. Миллиарды лет назад субъединицы комплекса I потеряли железно-никелевый гидрогеназный центр и молибденовый формат-дегидрогеназный центр. Однако субъединицы D и G не были утрачены из состава комплекса и до сих пор сохраняют сходство с соответствующими активными ферментами. Видимо, они встроены в передачу механического движения внутри комплекса, и их утрата приведет к неработоспособности всей большой молекулярной машины.
Происхождение цитохромных комплексов bc1 (комплекс III) и b6f
Цитохромные комплексы bc1 и b6 f входят в состав электрон-транспортных цепей митохондрий, хлоропластов, цианобактерий и многих аэробных бактерий. Как можно догадаться из их названия, они состоят из нескольких цитохромов разных типов. Цитохромные комплексы переносят электроны с хинонов на водорастворимые высокопотенциальные переносчики, обычно малые цитохромы с или пластоцианины. Важной функцией этих комплексов является бифуркация, или разветвление пути электронов (процесс, обратный конфуркации электронов в комплексе Qmo сульфатного дыхания). Приняв два электрона с хинона на наружной стороне мембраны и выбросив наружу два протона, цитохромный комплекс пускает их по разным путям. Один электрон проходит к сайту растворимого переносчика (например, цитохрома с) и следует дальше по электрон-транспортной цепи, а другой электрон попадает на внутреннюю сторону мембраны, где находится второй хинонный сайт комплекса bc1. Когда хинон во втором сайте примет два электрона, он проходит через мембрану к первому хинонному сайту комплекса и отдает там электроны на цитохром и протоны в воду. За счет такого сложного пути электронов удается полнее использовать разницу потенциалов между хиноном и цитохромом с: на каждый прошедший через комплекс электрон через мембрану переносятся два протона, а не один, как в простейшем Q-цикле.
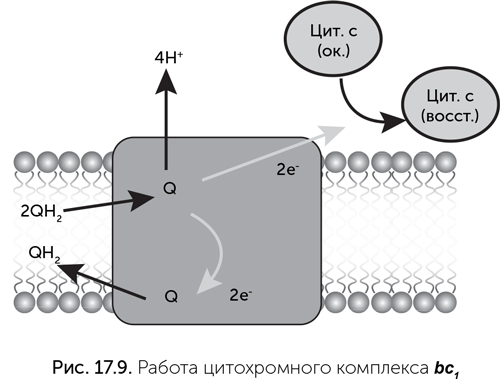
Цитохромные комплексы bc1 содержат от 3 субъединиц у ряда бактерий до 11 субъединиц в митохондриях. Три основные субъединицы, которые есть в любых вариантах комплекса bc1, — это трансмембранный цитохром b (8 трансмембранных спиралей, два гема b), цитохром с и железосерный белок Риске. Последний содержит необычный железосерный кластер 2Fe-2S, связанный с двумя цистеинами и двумя гистидинами. Из-за такого аминокислотного окружения его редокс-потенциал гораздо выше, чем у ферредоксинов, в которых железосерные кластеры связаны с белком через четыре цистеина. Комплексы b6 f устроены сходно с bc1, но вместо одного цитохрома b в них есть два разных белка: цитохром b6 с четырьмя трансмембранными спиралями и белок PetD с тремя спиралями. Они по последовательности аминокислот сходны с N- и C-концевыми половинами цитохрома b комплекса bc1, но связывают больше кофакторов: два гема b на цитохроме b6 и по одной молекуле гема с, хлорофилла а и каротина на белке PetD. Цитохром f функционально аналогичен цитохрому c1 комплекса bc1 и тоже содержит гем c, но совсем не похож на цитохром c1 по последовательности и имеет другое происхождение. Белки Риске комплексов bc1 и b6 f устроены практически одинаково.
История цитохромных комплексов запутана из-за горизонтальных переносов генов. Комплексы bc1-типа (с длинным цитохромом b) встречаются как у бактерий, так и у архей, а комплексы типа b6 f — только у бактерий. У некоторых бактерий в геноме закодировано до четырех разных комплексов, причем на филогенетическом дереве они находятся на различных ветвях. В одном геноме могут сочетаться гены комплексов bc1 и b6 f. Лишь недавно, с накоплением данных по большому количеству геномов, удалось установить, что на филогенетическом дереве есть несколько ветвей bc1 комплексов и несколько ветвей b6 f комплексов (Dibrova et al., 2013). Иными словами, переход от одного типа к другому — будь то слияние двух генов в один длинный цитохром b или разделение гена на два — происходил несколько раз. Это позволяет предположить вероятное направление эволюции: несколько независимых событий разделения гена в одной и той же точке, да еще с последующим появлением сайта связывания гема c в одном месте в разных ветвях комплексов b6 f очень маловероятны. А эволюция в обратном направлении — слияние двух соседних генов одного оперона и утрата сайта связывания гема с — вполне могла происходить много раз независимо.
Длинная 8-спиральная форма цитохрома b уникальна для комплекса bc1. Короткие 4-спиральные цитохромы b встречаются, помимо комплекса b6 f, еще в ряде мембранных окислительно-восстановительных ферментов, например в формат-дегидрогеназе, и участвуют в проведении электронов через мембрану. Такие белки могли быть востребованы еще во времена LUCA, чтобы снимать электроны с внеклеточных доноров (например, кристаллов сульфида цинка) и использовать их для восстановления веществ внутри клетки. Функция современных комплексов bc1 и b6 f — разветвление электронов — могла возникнуть только с появлением достаточно сильных окислителей. Появление кислородного фотосинтеза сделало такой сильный окислитель (кислород) доступным для биосферы, но до того единственным сильным окислителем были хлорофиллсодержащие фотосистемы. Большинство комплексов b6 f типа встречаются у фотосинтетиков (цианобактерий, Chlorobi и гелиобактерий) и участвуют в фотосинтезе. Хлорофилл и каротин в составе комплексов b6 f участвуют в регуляции транспорта электронов между фотосистемами в зависимости от освещенности.
Так что, скорее всего, первые комплексы b6 f появились у процианобактерий путем объединения цитохрома b, белка Риске (он присутствует и в других редокс-ферментах, в том числе древних) и других субъединиц. Дальше они распространялись путем горизонтального переноса, в том числе вместе с генами фотосинтеза: у гелиобактерий все субъединицы b6 f комплекса входят в супероперон фотосинтетических генов. У нефотосинтезирующих клеток светозависимая регуляция комплекса b6f не требовалась, хлорофилл и каротин терялись, и слияние субъединицы PetD с 4-спиральным цитохромом b6 помогало стабилизировать структуру комплексов после потери этих кофакторов. Дальнейшая эволюция цитохромных комплексов шла под давлением кислорода: они были оптимизированы для уменьшения образования повреждающих активных форм кислорода и приспособлены к работе в дыхательной цепи аэробного дыхания.
Происхождение цитохром-с-оксидазы
Ключевой фермент аэробного дыхания, комплекс IV, или цитохром-с-оксидаза, завершает дыхательную цепь и переносит электроны с цитохрома с на кислород. Она относится к семейству гем-медных оксидаз (НСО, haem-copper oxydase). Разные ферменты этого семейства восстанавливают кислород до воды либо оксид азота NO до закиси азота N2O. Все основные функции этих ферментов выполняются одной большой субъединицей, содержащей 12 трансмембранных спиралей, два гема и атом меди между тремя гистидинами (рис. 17.10). У работающих с NO ферментов этого семейства вместо атома меди присутствует железо. По сходству последовательностей главной субъединицы и набору вспомогательных субъединиц семейство делят на четыре подсемейства: НСО-А, НСО-В и НСО-С, которые восстанавливают кислород и переносят протоны через мембрану, и NOR, который восстанавливает NO и не переносит протоны. Подсемейство НСО-А, к которому относится и комплекс IV митохондрий (см. главу 15), оптимизировано для высоких концентраций кислорода и переносит больше протонов, чем НСО-В и НСО-С.
Среди ученых существуют очень разные точки зрения о происхождении и эволюции этого семейства ферментов. Например, в работах группы Анны-Лизы Дуклузье и Вольфганга Ницшке в Марселе (Ducluzeau et al., 2009) отстаивается сценарий, в котором ферменты подсемейства NOR (переносящие электроны с хинона на NO) были еще у LUCA и участвовали в нитритном дыхании или защите от оксида азота, а кислородные подсемейства произошли от него после появления кислородного фотосинтеза минимум два раза независимо. В пользу этого сценария ученые приводят филогенетические деревья, на которых подсемейство NOR, в отличие от других, четко делится на архейную и бактериальные ветви с корнем между ними. Именно такое дерево мы можем ожидать для белка, который был унаследован первыми бактериями и археями прямо от LUCA, а не распространялся путем горизонтального переноса.
Кроме того, до появления кислорода на Земле вся медь была связана в нерастворимых минералах в одновалентном состоянии, например в Cu2S, и не использовалась клетками. Только с появлением кислорода эти минералы стали окисляться в относительно растворимые соединения двухвалентной меди, такие как CuSO4. Все медьсодержащие ферменты эволюционно относительно молоды, и железо в активном центре NOR, казалось бы, свидетельствует о древности этого подсемейства по сравнению с медь-содержащими HCO-A, B и C. Остаток тирозина, абсолютно необходимый для восстановления кислорода, находится в HCO-C совсем не там, где в HCO-A и НСО-В. Следовательно, переход этих ферментов на работу с кислородом был вызван разными, независимыми мутациями, добавившими тирозин к активному центру.
Другие ученые, например Грибальдо (Gribaldo et al., 2009), используя несколько другие методы построения деревьев, обращают внимание на то, что НСО-А распространены в очень многих группах бактерий и архей, тогда как другие подсемейства ограничены в распространении. На основании их деревьев получается, что подсемейство НСО-В появилось у архей Sulfolobales и попало к бактериям путем горизонтального переноса, а НСО-С и NOR — изобретение протеобактерий. Дерево подсемейства НСО-А в их работе очень похоже на дерево 16S рибосомных РНК, не подверженных горизонтальному переносу, и предполагается, что НСО-А еще во времена LUCA участвовало в защите от кислорода — правда, непонятно, откуда кислород мог тогда взяться.
Некоторые факты не укладываются ни в один из этих двух сценариев: например, в составе вспомогательных субъединиц NOR есть медь, значит, и это подсемейство должно быть не старше, чем кислородный фотосинтез. Другой факт связан с липидами. Известно, что для работы НСО во впадинах главной субъединицы должны быть связаны молекулы липидов бактериального типа — с жирными кислотами. Чтобы HCO работал в мембране археи, состоящей из терпеноидных липидов (см. главу 15), в ней должна быть небольшая примесь липидов бактериального типа. Археи, использующие НСО, всегда имеют также ферменты для синтеза бактериальных липидов, явно полученные горизонтальным переносом от бактерий (Dibrova et al., 2014). Иными словами, все НСО архей должны быть получены от бактерий, а не унаследованы от LUCA. При таком переносе мембранный белок оказывается в новом липидном окружении, к которому он не был приспособлен. Оптимизация перенесенного белка для работы в окружении архейных липидов приводит к ускоренной эволюции его последовательности и ошибкам при построении филогенетических деревьев.
Прорыв в понимании происхождения этого семейства наметился в 2014 году. Биоинформатики из Техасского университета, используя чувствительные методы поиска сходства белков, нашли дальних родственников семейства НСО (Pei et al., 2014). Молекула НСО обладает несовершенной трехлучевой симметрией: 12 трансмембранных спиралей образуют 3 похожие группы по 4 спирали, расположенные вокруг общего центра. Два гема и один атом меди нарушают симметрию. Среди обнаруженных родственников НСО часть белков имеет 4 трансмембранные спирали, похожие больше всего на 9–12-ю спирали НСО (их назвали НСОН-s, НСО homolog single domain). Такие белки не могут устойчиво свернуться поодиночке, а должны объединяться по три, чтобы получилась трехмерная укладка, похожая на HCO. Если в геноме есть несколько генов HCOH-s, кодируемые ими белки могут объединяться в комплексы смешанного состава из двух субъединиц одного типа и одной — другого.
Судя по наличию связывающих гем остатков гистидина, комплексы из одинаковых субъединиц могут содержать три молекулы гема, а комплексы состава «2+1» — одну. Другие родственники НСО, НСОН-t (НСО homolog triple domain) состоят из 12 спиралей, уложенных так же, как в НСО. Большинство из них связывают один гем, некоторые — два (рис. 17.10).
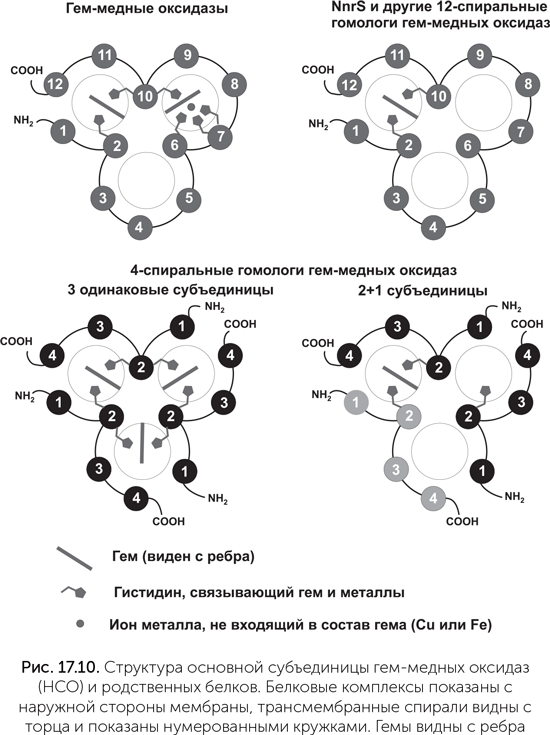
Почти все эти белки известны только из последовательностей полных геномов различных бактерий и никогда не изучались экспериментаторами. Только одна из семи групп HCOH-t попадала в руки экспериментаторов раньше. Это белок NnrS, выделенный из холерных вибрионов. У холерного вибриона он обеспечивает устойчивость к оксиду азота, вырабатываемому иммунной системой хозяина. У почвенных бактерий, где белок NnrS тоже был опознан, он организует движение клеток в сторону большей концентрации нитратов и нитритов. Точный механизм его работы неизвестен, в пробирке NnrS холерного вибриона не окисляет и не восстанавливает NO. Гены nnrS и большинства других родственников НСО в геномах соседствуют с генами ферментов нитратного и нитритного дыхания и генами защиты от отравления NO (не только иммунная система животных, но и сами бактерии травят им друг друга). Так что их функции должны быть как-то связаны с оксидами азота. 4-спиральные НСОН-s явно имеют отношение к предкам НСО, у которых еще не произошло слияния трех белковых субъединиц в одну. Остается ждать, пока биологи-экспериментаторы исследуют разведанные биоинформатиками цели, и тогда мы сможем судить о функциях предков гем-медных оксидаз.
Эволюция фотосистем
Происхождение фотосистем от простых хлорофилл-связывающих белков с функцией защиты от ультрафиолета не вызывает больших сомнений. Гораздо менее понятно, как появилось два типа фотосистем. Существует две точки зрения. По одной гипотезе (слияния), ФСI и ФСII независимо возникли из светозащитных белков в разных линиях бактерий. В этом случае цианобактерии, имеющие оба типа фотосистем в одной клетке, появились благодаря событию горизонтального переноса генов одной из фотосистем. Другая гипотеза предполагает, что две фотосистемы возникли путем дупликации генов в одной клетке и появления какого-то «разделения труда» между копиями предкового гена. От этой клетки произошли цианобактерии, а потом вторая фотосистема распространилась к другим группам бактерий путем горизонтального переноса генов.
Некоторые указания на порядок появления разных систем фотосинтеза можно найти в устройстве фотосистем. Так, реакционные центры фотосистем обычно состоят из двух белковых субъединиц. Это разные, хотя и родственные белки, возникшие в результате дупликации общего предкового гена. Однако у Chlorobi и гелиобактерий РЦ1 состоит из двух одинаковых субъединиц, т.е. их фотосистемы сохранили предковое состояние, существовавшее до дупликации. РЦ2 пурпурных бактерий и Chloroflexi состоят из двух разных субъединиц, как и ФСII цианобактерий. На филогенетическом дереве видно, что разные субъединицы РЦ2 пурпурных бактерий ближе друг к другу, чем к субъединицам ФСII цианобактерий. Следовательно, две субъединицы РЦ2 пурпурных и две субъединицы ФСII цианобактерий — это результат двух независимых дупликаций генов (рис. 17.11).
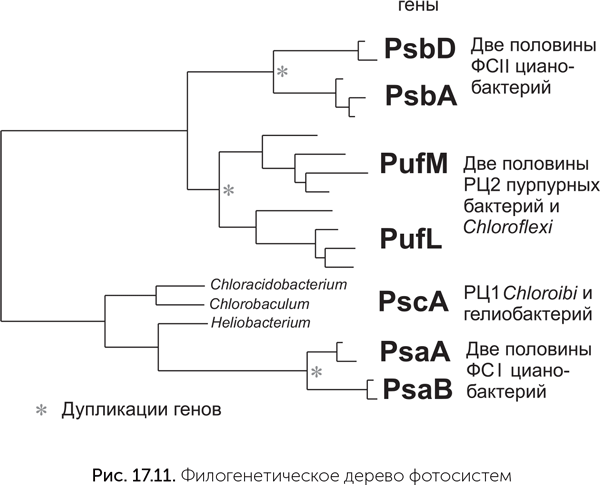
Трехмерная структура фотосистем цианобактерий показывает, что они очень близки по пространственной укладке белка и расположению кофакторов — хлорофиллов, феофитинов, хинонов (Baymann, 2001). Однако есть важное различие: в ФСI реакционный центр (в котором происходит разделение зарядов) и антенная часть являются двумя доменами одной белковой цепи, проходящей через мембрану 11 раз, а в ФСII они разделены на отдельные белковые молекулы, кодируемые разными генами. Антенная часть ФСII образуется белками CP43 и CP47, имеющими шесть трансмембранных спиралей, а реакционный центр — белками D1 и D2 c пятью трансмембранными спиралями (рис. 17.12). По трехмерной структуре CP43/CP47 и D1/D2 соответствуют двум доменам единого белка ФСI.
РЦ1 Chlorobi и гелиобактерий состоит из двух одинаковых белковых молекул с 11 трансмембранными спиралями каждая, образующими антенный домен и центр разделения зарядов, так же как ФСI цианобактерий. Однако РЦ2 пурпурных бактерий и Chloroflexi не имеют ничего похожего на CP43/CP47 и содержат только пять трансмембранных участков. Функции CP43/CP47 выполняют другие антенные белки, не имеющие никаких аналогов у цианобактерий. По аминокислотной последовательности CP43/CP47 цианобактерий больше похожи на антенный домен РЦ1 гелиобактерий, чем на антенну ФСI той же цианобактериальной клетки.
Как нам разобраться, какой вариант фотосистемы древнее — с отдельным антенным белком вроде CP43/CP47 или слитный? Хотя в процессе эволюции происходят как слияния, так и разделения белков, в данном случае гораздо более вероятно разделение предкового двухдоменного белка. Все примитивные варианты фотосистем, состоящие из одинаковых половинок (РЦ1 гелиобактерий и Chloroflexi), состоят из двухдоменных 11-спиральных белков. Появление ФСII в таком случае должно было произойти у предков цианобактерий, а РЦ2 пурпурных бактерий и Chlorobi, видимо, произошли от ФСII древних цианобактерий путем утраты CP43/CP47 и приобрели новые антенные белки (рис. 17.12).
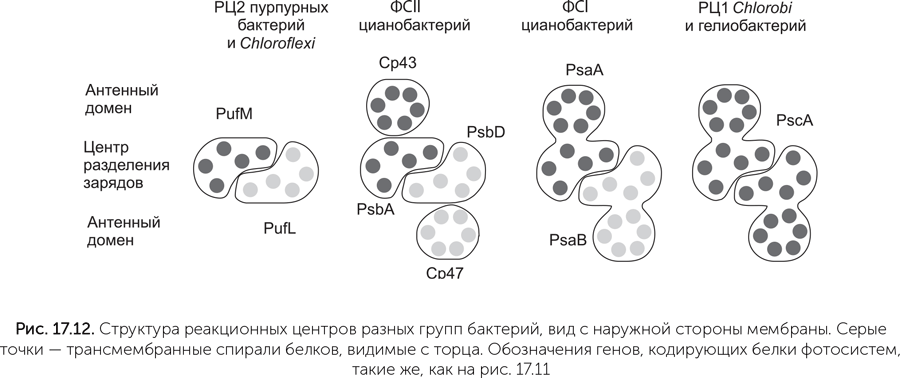
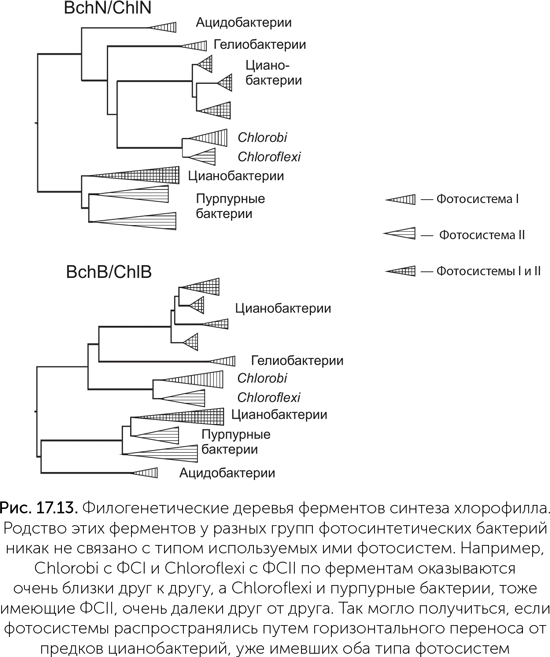
Есть и другой способ узнать, каким способом появилось два типа фотосистем. Если две фотосистемы развивались независимо в разных группах бактерий, то на филогенетических деревьях разных генов фотосинтеза должен быть виден глубокий раздел на ветви обладателей РЦ1 и РЦ2. Среди генов, относящихся к фотосинтезу, наиболее широко распространены ферменты синтеза хлорофилла. Филогенетические деревья этих ферментов (Sousa et al., 2013, Gupta, 2012) показывают, что такого раздела нет (рис. 17.13). Наоборот, Chlorobi с РЦ1 и Chloroflexi с РЦ2 на этих деревьях очень близки друг к другу, а пурпурные бактерии и вовсе попадают внутрь группы цианобактерий. Ферменты пурпурных бактерий специфически сходны с ферментами так называемой ветви С цианобактерий. Члены этой ветви — мелкие одноклеточные цианобактерии океанского пикопланктона (клетки размером менее 2 мкм), такие как Prochlorococcus и Synechococcus. Иначе говоря, история ферментов синтеза хлорофилла, так же как история белков фотосистем, лучше согласуется с появлением обеих фотосистем у предка цианобактерий и горизонтальным переносом их в четыре другие группы фотосинтетических бактерий.
Описанный в главе 16 сценарий появления кислородного фотосинтеза был основан в основном на биофизических экспериментальных данных о современных цианобактериях. Никто тогда не ожидал, что предсказанные переходные формы ФСII, окисляющие марганец и бикарбонат, удастся найти и изучить в пробирке. Однако недавнее исследование геномов цианобактерий показало, что древние варианты ФСII до сих пор существуют и используются клетками в некоторых особых условиях (Cardona, 2015).
Водоокисляющий комплекс находится на субъединице D1 — одной из двух неравных половинок реакционного центра ФСII. В геномах многих цианобактерий закодировано несколько (иногда больше десятка) вариантов D1. Было известно, что смена вариантов D1 используется цианобактериями, например, для защиты от слишком яркого света. В работе Танаи Кордона с коллегами было обнаружено, что некоторые варианты субъединицы D1 сильно отличаются от основных, повседневно используемых вариантов. На филогенетическом дереве такие нетипичные белки образуют три отдельные ветви близко к его корню (на рис. 17.14 обозначены G1, G2, G3. Обычные субъединицы D1 образуют ветвь G4). Поскольку у всех известных цианобактерий есть белки из ветви G4 (а они отвечают за окисление воды и выделение кислорода в процессе фотосинтеза), выходит, что белки ветвей G1-G3 появились в результате удвоения генов еще до появления общего предка современных цианобактерий. Ни один из этих белков раньше не попадал в руки экспериментаторов, поэтому об особенностях работы этих белков мы пока можем судить лишь на основе биоинформационного анализа, опираясь на последовательность аминокислот в белках и, соответственно, их структурных свойств и на данные об активности генов в разных условиях.
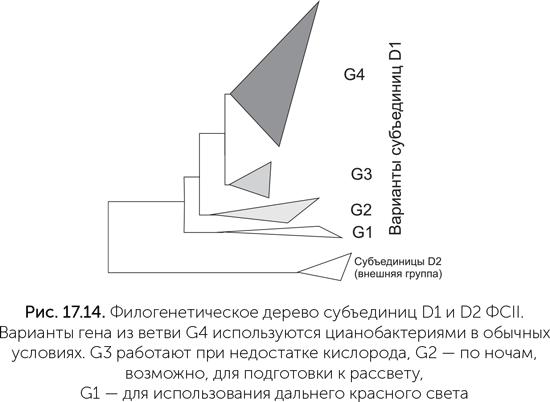
Последовательности этих необычных вариантов генов D1 показывают, что фотосистемы групп G1 и G2 не имеют аминокислот, необходимых для связывания марганцевого кластера. А значит, они не могут окислять воду. Группа G3 в этом отношении похожа на обычные фотосистемы и, видимо, может окислять воду и выделять кислород. Гены группы G1 включаются при приспособлении цианобактерий к дальнему красному свету (длина волны 720 нм и более, не поглощается обычными фотосистемами), G2 — по ночам, а G3 — при недостатке кислорода. В ближайшие несколько лет биологи-экспериментаторы должны изучить эти цели, разведанные биоинформатиками, и разобраться в деталях работы древних вариантов фотосистемы II. Их результаты должны серьезно уточнить и дополнить описанный путь эволюции кислородного фотосинтеза.
Доступность окислителей и восстановителей на древней Земле
В дыхании микробов используется четыре основных типа окислителей: кислород, соединения азота (нитрат и нитрит), соединения серы (сульфат и сульфит) и углекислый газ. Мы можем быть уверены, что в архейскую эру не было в доступе самого сильного окислителя — кислорода. Весь свободный кислород на Земле образуется благодаря растениям и цианобактериям, которые освоили кислородный фотосинтез лишь в конце архея. В осадочных породах архейского возраста встречаются легко окисляемые кислородом минералы (пирит, уранинит), в том числе в виде гальки, обкатанной в текучей воде. Они могли сохраниться в неокисленном виде, только если кислорода в атмосфере и, соответственно, в воде тогда не было. Также достоверно известно, что слабый окислитель — углекислый газ — был в изобилии. Ситуация с сульфатами и нитратами сложнее.
Вулканические газы содержат заметное количество сернистого газа (SO2) и сероводорода. В атмосфере под действием солнечного ультрафиолетового излучения они разлагаются. Сероводород превращается в пылинки кристаллической серы и водород, улетающий в космос, а сернистый газ дает серную кислоту и те же пылинки серы. Если вместе с сернистым газом облучению подвергается сероводород или метан, как, видимо, и было на древней Земле, то выход серной кислоты уменьшается, а серы — увеличивается. У геохимиков есть данные, позволяющие оценить роль разных процессов окисления и восстановления серы начиная с раннего архея, 3,5 млрд лет назад. Прежде всего, это слои барита (BaSO4), осаждавшиеся на дне морей 3,5–3,4 млрд лет назад. Барий отличается от большинства металлов тем, что его сульфат практически не растворим в воде, а другие соли с двухосновными кислотами (карбонат, сульфид, сульфит) хорошо растворимы. В современной морской воде много сульфатов и нет бария. Видимо, 3,5 млрд лет назад существовала обратная ситуация: в море был барий и не было сульфатов. Те сульфаты, которые попадали в море или образовывались в нем, оседали в виде барита, а 3,5 млрд лет назад барий в море кончился, и пошло накопление сульфатов в воде.
Об истории серы и сульфатов можно много узнать по особенностям их изотопного состава в древних породах. Природная сера состоит из основного изотопа 32S и двух тяжелых, 33S и 34S. Как и в случае углерода, биологические процессы обычно приводят к сортировке изотопов серы: сера, прошедшая через клетки, обедняется тяжелыми изотопами и обогащается легкими. Сортировка эта масс-зависима: недостача 34S вдвое больше, чем 33S. В диспропорционировании серы, когда образуется сразу два продукта (сульфат и H2S), сероводород обедняется тяжелыми изотопами, а сульфат, наоборот, обогащается. В фотолизе сернистого газа сортировка изотопов происходит по-другому: они разделяются не столько по массе, сколько по ядерному спину, и изменяется содержание нечетного 33S относительно четных 32S и 34S. Сера, образуемая при фотолизе SO2, обогащена 33S, а серная кислота им обеднена (рис. 17.15). В противовес масс-зависимому фракционированию серы этот называется масс-независимым фракционированием, потому что не зависит от массы изотопов.
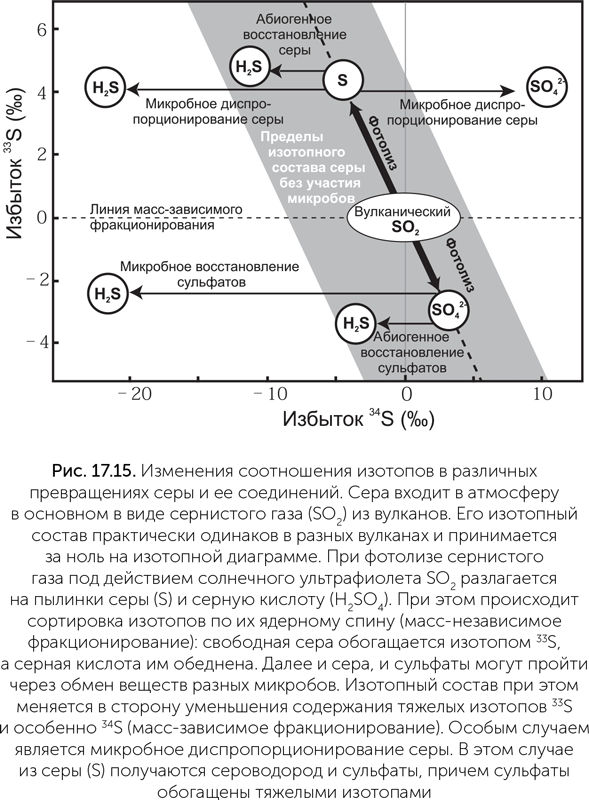
Исследования архейских баритов (Philippot et al., 2007) показали, что сульфат в них обеднен 33S и не имеет отклонений в содержании 34S, т.е. появился в процессе фотолиза сернистого газа. В этих же баритах содержатся включения пирита и других сульфидных минералов, и сера в них сильно обогащена 33S и немного обеднена 34S. Это означает, что сульфидные включения образовались каким-то способом из серы, которая происходит из сернистого газа путем фотолиза. Сниженное содержание 34S в сульфидах сначала было принято за следы микробного диспропорционирования серы. Однако в следующей работе тех же авторов (Philippot et al, 2012) c более точным моделированием фотолиза SO2 в атмосфере делается вывод, что убедительных следов жизнедеятельности микробов в изотопном составе соединений серы архейского периода нет.
Иначе говоря, для эпохи 3,4–3,5 млрд лет назад у нас есть свидетельства абиогенного образования серы и сульфатов из SO2, но нет четких следов микробного метаболизма серы. Эти геологические следы, однако, на 500–600 млн лет моложе, чем живший еще до поздней бомбардировки общий предок бактерий и архей. В его время доля SO2 в вулканических газах могла быть меньше, а H2S — больше. Как шла изотопная сортировка серы в таких условиях, мы не знаем, а значит, неясно, какие изотопные следы надо искать.
Для соединений азота ситуация немного понятнее, чем для серы. Нитриты были на Земле с древнейших времен, но в очень малых количествах. В наше время большая часть нитратов и нитритов образуется бактериями в процессе нитрификации — окисления аммиака кислородом для получения энергии. Кроме того, во время разрядов молний при огромных температурах азот реагирует с кислородом, образуя оксид азота, NO. Затем NO уже при обычных температурах окисляется кислородом до NO2 и реагирует с водой, образуя азотную кислоту, которая содержится в малых количествах в дождевых каплях во время грозы. До появления кислородного фотосинтеза эти реакции происходить не могли, но, как оказалось, кислород не обязателен для образования NO в молниях. В экспериментах с электрическими разрядами в смеси углекислого газа и азота, имитировавшей архейскую атмосферу, оказалось, что в ней оксид азота образуется с той же эффективностью, если доля углекислого газа в смеси выше 80% (Navarro-González et al., 2001). Это подтверждается и анализами атмосферы Венеры, где тоже много углекислого газа, есть азот и гремят грозы, — в ней обнаружено около 0,0001% NO.
В отсутствие кислорода NO растворялся в воде, давая азотистую кислоту (HNO2). Количество оксида азота, образующегося при разряде молний, и тогда, и сейчас не очень велико — около 1 млн т ежегодно на всю Землю. Если этот оксид азота равномерно распределялся по планете, то соответствующая концентрация азотистой кислоты в водоемах получается слишком малой, чтобы ее можно было использовать для дыхания. Однако она может быть значима как азотное удобрение, а возможно, и как яд: ферменты метаногенов к ней очень чувствительны, она губительна для них.
Если разнообразие и доступность окислителей на древней Земле были ниже, чем сейчас, то с восстановителями дело обстояло гораздо лучше. Как мы помним из главы 6, взаимодействие воды с горячими базальтами (серпентинизация) приводит к выделению водорода, метана и муравьиной кислоты, которые по трещинам выходят из горных пород на поверхность. В испарениях геотермальных полей даже в нашу кислородную эпоху присутствуют угарный газ и восстановленные формы фосфора — фосфиты и гипофосфиты. В древности их должно было быть значительно больше. Эти же испарения и геотермальные воды несли сероводород, а в морской воде было растворено много двухвалентного железа. Все эти восстановители можно было использовать — имелся бы только подходящий окислитель. В условиях дефицита окислителей особую ценность приобретают сильные восстановители, позволяющие получать энергию за счет выделения водорода: муравьиная кислота, угарный газ и фосфит.
Энергетика LUCA, первых бактерий и архей
Вооружившись информацией о доступности разных окислителей и восстановителей на древней Земле и об эволюции компонентов биоэнергетических систем, мы можем попробовать оценить, какие источники энергии могли использоваться LUCA и его ближайшими потомками — первыми бактериями и археями.
Как мы помним, в геотермальных водоемах, где шла эволюция от первых биологических молекулярных систем до LUCA, были уникальные источники химической энергии, ныне в основном исчезнувшие. Например, с конденсацией геотермального пара туда поступали оксиды фосфора, которые, растворяясь в воде, давали пирофосфат — источник энергии, аналогичный АТФ. Отложения сульфида цинка в этих водоемах на свету производили органические кислоты из CO2 и фосфорилировали разные органические вещества за счет окисления фосфита. Флавиновые коферменты могли обеспечивать примитивный фотосинтез, производя АТФ за счет энергии света, еще до появления мембран. Все это было доступно и общему предку бактерий и архей, уже имевшему мембраны и более 1000 генов.
Разделение линий бактерий и архей произошло при освоении новых местообитаний. Судя по образу жизни современных бактерий и архей, предки бактерий расселялись по поверхности суши и океана, используя фотосинтез, а предки архей ушли в трещины и пустоты земной коры, используя химические источники энергии. Скорее всего, мембрана LUCA еще не могла держать электрический потенциал, характерный для современных мембран, и мембранной энергетики в современном смысле у него не было. Однако у LUCA существовали предшественники многих ее компонентов: система секреции белков (предок роторной АТФазы), гемы (как минимум сирогем) и, вероятно, менахинон и трансмембранный цитохром b для проведения электронов через мембрану. Также у него было некоторое разнообразие окислительно-восстановительных ферментов, включая молибденовую формат-дегидрогеназу и никелевую CO-дегидрогеназу, сирогем-содержащие ферменты окисления серы и несколько гидрогеназ, в том числе мембранная гидрогеназа четвертого типа.
На основе этого набора деталей для предка архей, уходящего в подземные местообитания, можно предположить обмен веществ, основанный на окислении муравьиной кислоты, угарного газа и, возможно, фосфитов:
HCOOH → CO2 + H2
CO + H2O → CO2 + H2
В качестве продуктов обмена выделялись углекислый газ и водород, мембранный потенциал создавали гидрогеназы четвертого типа, родственные комплексу I. Высокая концентрация водорода в среде угнетает такой метаболизм, и, чтобы решить эту проблему, предки архей могли начать утилизировать выделяющийся водород, превращая его в метан:
4HCOOH → 3CO2 + CH4 + 2H2O
4CO + 2H2O → 3CO2 + CH4
Такой примитивный метаногенез (форматотрофный и карбоксидотрофный) позволил им получать энергию и при избытке водорода вокруг. В условиях перебоев в поступлении угарного газа и муравьиной кислоты отбор поддерживал изменения обмена веществ, позволяющие использовать более доступный водород. В классическом (гидрогенотрофном) метаногенезе:
CO2 + 4H2 → CH4 + 2H2O
труднее всего происходит первая стадия: восстановление CO2 до HCOOH. Для этой реакции клетка вынуждена тратить энергию, чтобы потом получить обратно на следующих стадиях. Поэтому на переходном этапе эволюции метаногенеза археи могли одновременно использовать муравьиную кислоту и водород:
HCOOH + 3H2 → CH4 + 2 H2O,
чтобы получать в два-три раза больше энергии из имеющегося количества HCOOH. Отбор поддерживал все более полное использование химической энергии, и в результате метаногенные археи научились обходиться вообще только водородом и CO2. Для этого им пришлось создать массу уникальных приспособлений: коферменты В и M, метанофуран, метаноптерин (замена фолиевой кислоты в пути восстановления С1-групп) и новые переносчики электронов — деазафлавин F420 и никель-порфирин F430.
У бактерий возможностей было больше. Их предки оставались на поверхности и могли использовать солнечный свет. С появлением мембранного потенциала и роторной АТФазы к древнему флавиновому фотосинтезу добавились новые механизмы с использованием родопсина, а потом и хлорофилла. Хотя современный хлорофилльный фотосинтез работает только с протонным градиентом, теоретически возможно включить хлорофилл и в натриевый биоэнергетический цикл. Для этого фотосистему I надо скомбинировать с вариантом комплекса I, окисляющим ферредоксин (среди бактерий такие варианты известны). В качестве доноров электронов использовались водород, сероводород и сера.
Кроме фотосинтеза бактерии освоили получение химической энергии путем диспропорционирования серы, серного дыхания и сульфатного дыхания. До того возможности получения энергии из готовой органики были ограничены брожением, а с появлением серного и сульфатного дыхания замкнулся биологический круговорот углерода, состоящий из фотосинтеза и дыхания. В современную эпоху органическое вещество создается в основном в процессах кислородного фотосинтеза растений:
6CO2 + 6H2O → C6H12O6 (глюкоза) + 6O2
и разрушается в кислородном дыхании животных, бактерий и грибов:
C6H12O6 + 6O2 → 6CO2 + 6H2O.
Подобный цикл можно замкнуть и с другими окислителями, например, соединениями серы:
6CO2 + 3H2S + 6H2O → C6H12O6 + 3H2SO4 (серный фотосинтез)
C6H12O6 + 3H2SO4 → 6CO2 + 3H2S + 6H2O (сульфатное дыхание)
Затем фотосинтезирующие бактерии освоили окисление железа и смогли заселить открытый океан, где железо было основным донором электронов. Так уже в раннем архее (около 3,5 млрд лет назад) сложилась всепланетная прокариотная биосфера, которая просуществовала без больших изменений больше 1 млрд лет, до появления кислородного фотосинтеза.

