Происхождение эукариот
Клетки с ядром — новый уровень сложности жизни
Бактерии и археи населяют всю поверхность планеты, толщу и дно океанов и несколько километров земной коры. Однако рекорды размеров и сложности принадлежат другому домену живых организмов — эукариотам. К ним относятся животные и растения, водоросли, грибы и разнообразные одноклеточные организмы — инфузории, амебы, жгутиконосцы и другие. Клетки эукариот отличаются от клеток бактерий и архей во многих отношениях. Если разнообразие бактерий и архей — это прежде всего разнообразие биохимии, то разнообразие эукариот — это во многом разнообразие форм клеток. Все эукариоты имеют практически одинаковый базовый обмен веществ, а если им надо выйти за его пределы, то они обычно «берут на работу» симбионтов-бактерий, вместо того чтобы самим осваивать новые биохимические реакции. Если клетки бактерий и архей, как правило, простые шарики, палочки, нити или спиральки, то многие эукариоты имеют клетки очень сложной формы (рис. 18.1).

Клетки эукариот крупнее примерно в десять раз и содержат ядро, отделяющее геном от остальной клетки. В клетках эукариот находятся сложные системы мембранных цистерн и пузырьков — эндоплазматический ретикулум, аппарат Гольджи, лизосомы и другие пузырьки (они называются вакуоли) (рис. 18.2). Пузырьки управляемо отшнуровываются от мембран в одних местах и сливаются с ними в других.
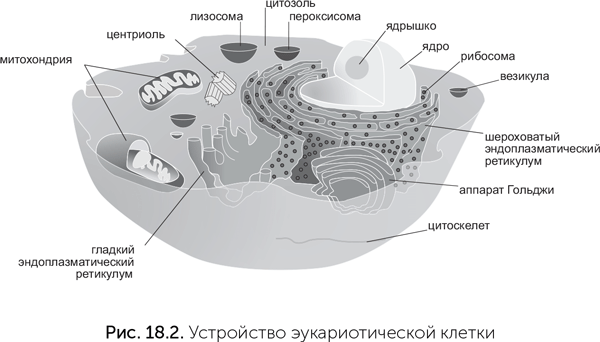
Форму эукариотической клетки поддерживает клеточный скелет (цитоскелет). Он состоит из тонких нитей белка актина (микрофиламенты) и более толстых трубочек из белка тубулина (микротрубочки). Микротрубочки в основном расходятся из центра клетки ко всей периферии. Микрофиламенты проходят параллельно клеточной мембране, образуя под ней трехмерную сеть. С цитоскелетом связаны моторные белки — миозин, динеин и кинезин. Они перемещают органеллы внутри клетки и обеспечивают движение и изменения формы всей клетки. Если повредить мембрану бактериальной клетки, то все ее содержимое начнет вытекать наружу. В случае повреждения эукариотической клетки вытекают только вода и малые молекулы, а крупные белки и РНК остаются внутри, потому что они прикреплены к цитоскелету. Благодаря ему клетки эукариот могут принимать разнообразные сложные формы.
Отшнуровка и слияние мембран регулируется множеством специальных белков. Благодаря такому управлению мембранами клетки большинства эукариот способны к фагоцитозу — поглощению твердых частиц из внешней среды внутрь клетки. При этом поглощенная частица оказывается окружена мембраной, и с ней можно дальше что-нибудь сделать, например, добавить пищеварительные ферменты и съесть. Многие одноклеточные эукариоты используют фагоцитоз для питания бактериями и друг другом. В организме животных и человека тот же механизм применяется клетками иммунной системы для уничтожения бактерий. Фагоцитоз — отличительная черта эукариот. Бактерии и археи к нему не способны и поглощают из внешней среды только растворенные вещества.
Рибосомы эукариотической клетки крупнее, чем бактериальные, содержат больше белков и используют другой механизм для узнавания матричных РНК. Рибосомы бактерий и архей могут присоединиться к мРНК в любом месте, продвинуться по ней в сторону 3` конца до ближайшего старт-кодона AUG и начать с него синтез белка. Рибосомы эукариот узнают специальную метку на 5` конце мРНК, она называется «кэп», т.е. шапочка, и представляет собой гуаниновый нуклеотид, пришитый особым образом — через 5' — 5` трифосфатный мостик. Матричная РНК без кэпа, как правило, не узнается эукариотическими рибосомами.
На 3` конце матричные РНК эукариот имеют другую модификацию — хвост из 200–500 адениновых нуклеотидов. Каждая мРНК эукариот кодирует только один белок, тогда как у бактерий обычно несколько белков, гены которых составляют один оперон.
Дыхательные цепи и мембранные АТФазы бактерий и архей находятся на внешней мембране клетки, а у эукариот убраны в специальные органеллы — митохондрии и пластиды. Геном бактерий и архей, как правило, имеет вид одной кольцевой молекулы ДНК, а геном эукариот состоит из нескольких линейных молекул ДНК — хромосом. Геномные молекулы ДНК эукариот намотаны для компактности на специальные белковые «катушки» — гистоны. Размер генома может достигать десятков миллиардов пар нуклеотидов, что на четыре порядка больше, чем у бактерий. Геном эукариот часто переполнен некодирующими последовательностями разных типов. При делении эукариотической клетки цитоскелет разделяет скопированные хромосомы по дочерним клеткам в сложном движении, напоминающем эпизод классического балета. Наконец, в жизненном цикле многих эукариот есть половой процесс, при котором в одной клетке собираются гены двух родителей, и мейоз — специальное деление, в котором хромосомы, происходящие от разных родителей, обмениваются отдельными участками, после чего диплоидная клетка делится на четыре гаплоидных (с одиночным хромосомным набором). Таким образом, эукариотическая клетка гораздо сложнее организована, чем бактериальная, и ее появление было таким же крупным эволюционным событием, как переход от РНК-мира к первым клеткам.
Деление клеток эукариот: митоз и мейоз
Геном эукариотической клетки разделен на несколько физических «томов» — хромосом. Когда клетка делится, каждой из двух дочерних клеток должно достаться по своей копии каждой хромосомы. Механизм, который это обеспечивает, называется «митоз».
В процессе подготовки к делению клетка должна вырасти до достаточного размера и скопировать все хромосомы. Когда это выполнено, начинается деление. На первой стадии митоза (профаза) в ядре прекращается синтез мРНК. Хромосомы, которые до этого находились в относительно рыхлом состоянии, становятся компактными и плотно упакованными. Только в таком состоянии их видно в световой микроскоп. Ядерная оболочка разрушается, и хромосомы оказываются в цитоплазме клетки. Микротрубочки цитоскелета клетки перестраиваются. Если между делениями они расходились звездой от центриоли — специальной структуры, организующей систему микротрубочек по всей клетке, то в профазе центриоль удваивается, две дочерние центриоли расходятся по разным сторонам клетки, и микротрубочки образуют вокруг них две звезды.
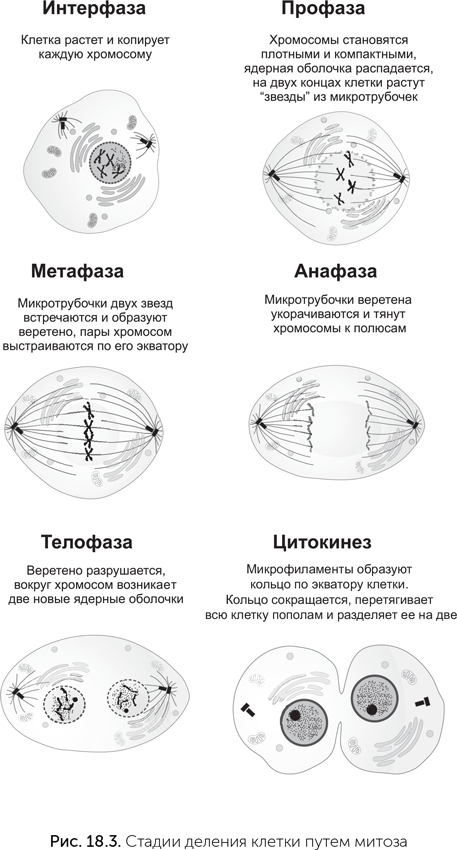
На следующей стадии, метафазе, микротрубочки двух звезд встречаются посередине. Свежескопированные хромосомы парами прикрепляются к микротрубочкам: одна хромосома каждой пары к микротрубочкам одной звезды, вторая — к другой. Эта структура из миктротрубочек и хромосом называется «митотическое веретено». В его полюсах находятся центриоли, а по экватору расположены пары хромосом.
Когда все пары хромосом правильно прикрепились к веретену, митоз переходит в следующую стадию, анафазу. До этого во время метафазы микротрубочки при помощи моторных белков тянули хромосомы к противоположным полюсам, но попарное соединение копий хромосом не позволяло им разойтись. В анафазе белки, образующие попарное соединение хромосом, разрезаются специальным ферментом. Натяжение микротрубочек растаскивает хромосомы к двум полюсам веретена.
После анафазы наступает телофаза. Веретено становится больше не нужно и разбирается, а вокруг каждой из двух групп хромосом появляется новая ядерная оболочка — образуется два ядра, пока еще в одной клетке. Наконец, после деления ядер наступает время деления всей клетки — цитокинез. В нем главную роль играет вторая половина цитоскелета — микрофиламенты. Они формируют кольцо под наружной мембраной по экватору клетки. Микрофиламенты кольца образуют много связей с мембраной, поэтому, когда кольцо сокращается, оно перетягивает всю клетку пополам и в конечном итоге разделяет ее на две.
Митоз — это самое обычное стандартное клеточное деление эукариот. В ходе митоза хромосомный набор сначала удваивается, а потом делится ровно пополам. Кроме него бывает еще специальное деление — мейоз. В мейозе происходит одно удвоение хромосом и два деления хромосомного набора и клетки. Поэтому в итоге мейоза получаются клетки с уменьшенным вдвое количеством хромосом. Мейоз есть у организмов с половым размножением. При половом размножении происходит слияние половых клеток, и образуется клетка с двойным набором хромосом — зигота. Чтобы число хромосом не удваивалось в каждом поколении, нужен мейоз, который будет уменьшать число хромосом. У животных и человека мейоз происходит при созревании половых клеток. Все клетки человека, кроме сперматозоидов и яйцеклеток, имеют двойной (2n) набор хромосом (иногда больше), только половые клетки (сперматозоиды и яйцеклетки) — одинарный (n). Другое отличие мейоза от митоза состоит в том, что первая профаза мейоза протекает очень долго. В первой профазе родственные хромосомы, унаследованные от разных родителей, обмениваются участками друг с другом. Этот процесс называется «кроссинговер» и служит для повышения генетического разнообразия потомства.
Химерное происхождение эукариот
Первым шагом в понимании происхождения эукариотической клетки стало обнаружение сходства между митохондриями и свободноживущими аэробными бактериями, а также между пластидами и цианобактериями. Первые работы в этом направлении появились еще в конце XIX века, а в современном виде теорию симбиогенеза сформулировала Линн Маргулис в 1970-х годах. К тому времени уже было обнаружено, что пластиды и митохондрии имеют собственную миниатюрную генетическую систему, включающую кольцевую молекулу ДНК, особые рибосомы — мельче, чем в цитоплазме эукариот, и похожие на бактериальные, — и никогда не образуются с нуля, а только в процессе роста и деления существующих. Все это указывает на происхождение пластид и митохондрий от бактериальных симбионтов, когда-то поселившихся в цитоплазме эукариотической клетки. Подобный симбиоз часто происходит и в наше время, например, у глубоководных червей-погонофор внутри клеток преобразованного кишечника живут хемосинтезирующие бактерии. Благодаря этим бактериям погонофоры могут питаться сероводородом. Для приобретения таких симбионтов они должны быть проглочены клеткой хозяина путем фагоцитоза, следовательно, фагоцитоз — это древняя особенность эукариот, возникшая до приобретения митохондрий.
Тогда же, в 1970-е, были попытки расширить теорию симбиогенеза и на другие системы эукариотической клетки. Несколько раз сообщалось об обнаружении собственной ДНК в центриолях — центрах организации тубулинового цитоскелета, в гидрогеносомах и пероксисомах — специальных вакуолях, осуществляющих реакции с выделением водорода и утилизацию перекиси водорода. С применением более совершенных методов эти открытия пришлось «закрыть», но оказалось, что пероксисомы и гидрогеносомы почему-то получают новые липиды для мембран по одной молекуле через специальную систему транспортных белков, ту же, что доставляет липиды в митохондрии, тогда как обычные вакуоли получают новые липиды в виде целых мембранных пузырьков. Эта особенность пероксисом может означать, что они произошли от митохондрий путем крайнего упрощения и полной потери генома.
Гораздо сложнее было установить природу ядерно-цитоплазматического компонента (ЯЦК) эукариотической клетки. Сегодня, когда прочитаны последовательности геномов более чем тысячи видов бактерий и архей, появилась возможность методами сравнительной геномики искать прокариотных родственников каждого из тысяч эукариотических белков (см., напр.: Марков А., Куликов А. Происхождение эвкариот: выводы из анализа белковых гомологий в трех надцарствах живой природы: http://evolbiol.ru/markov_kulikov.htm).
Краткие результаты такого поиска представлены на рис. 18.4.
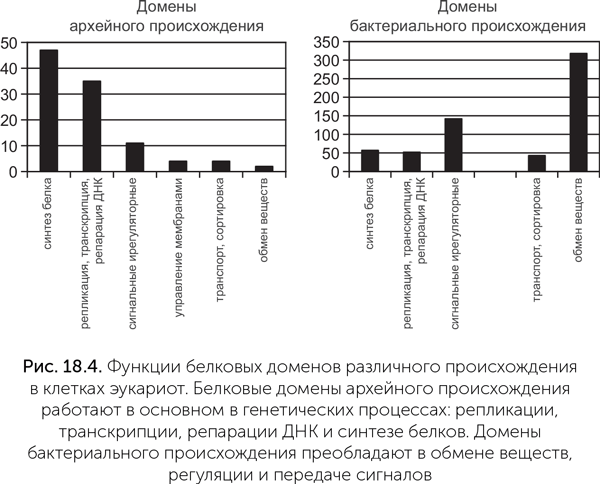
Хорошо видно, что базовые генетические процессы эукариотических клеток — репликация (копирование ДНК), транскрипция (создание РНК на матрице ДНК), трансляция (синтез белков), репарация (ремонт повреждений ДНК) — обслуживаются белками практически только архейного происхождения. Гены этих групп реже всего подвергаются горизонтальному переносу и, скорее всего, были унаследованы эукариотами напрямую. ДНК- и РНК-полимеразы бактериального происхождения в клетках эукариот работают в митохондриях и пластидах и явно перенесены из их геномов. Это значит, что предок ядра и цитоплазмы, скорее всего, был близок к археям.
Происхождение митохондрий благодаря сравнению геномов удалось значительно уточнить. Их бактериальные предки относились к группе альфа-протеобактерий, причем в современном мире к ним ближе всего находятся пурпурные бактерии Rhodospirillum. Эти бактерии способны как к фотосинтезу, основанному на окислении соединений серы для восстановления CO2, так и к аэробному дыханию на готовой органике, переключаясь между этими режимами обмена веществ в зависимости от наличия кислорода и света. Большая часть их дыхательной цепи работает как при фотосинтезе, так и при аэробном дыхании.
Ранее считалось, что некоторые безмитохондриальные эукариоты (лямблии, микроспоридии) отделились от остальных в глубокой древности и никогда не имели митохондрий. Сегодня выясняется, что в их ядерном геноме есть гены альфа-протеобактериального происхождения, похожие на аналоги у других эукариот. Гены альфа-протеобактерий попали в геном эукариот в большом количестве при обзаведении митохондриями. Это значит, что у всех безмитохондриальных эукариот, для которых прочитаны последовательности генома, митохондрии когда-то были, а затем утратились, что свидетельствует о потере когда-то имевшихся митохондрий.
Кроме кислородного дыхания у митохондрий есть другие функции. Одна из них — сборка железосерных кластеров ферментов, в том числе работающих в цитоплазме (Tielens, Rotte, Hellemond, Martin, 2002). Для этого требуется транспорт свернутых белковых молекул, содержащих железосерные кластеры, через митохондриальную мембрану. Это достаточно сложное и затратное приспособление, которое могло возникнуть, только если хозяин митохондрий сам не умел строить железосерные кластеры.
Другие возможные источники генов эукариот
Мы определили два основных источника генов эукариот: это альфа-протеобактерия, давшая начало митохондриям, и архея, ставшая ее хозяином в симбиозе. Однако этих источников недостаточно: в геномах эукариот есть много генов, которые похожи на гены разных бактерий, но отсутствуют у альфа-протеобактерий.
Кроме митохондрий у эукариот есть другая органелла, происходящая от симбионта, — хлоропласт водорослей и растений. Хлоропласты происходят от цианобактерий и, по некоторым гипотезам, могли быть у общего предка всех эукариот и утратились во всех ветвях, кроме водорослей и происходящих от них растений. Может быть, они внесли свой вклад в геном всех эукариот?
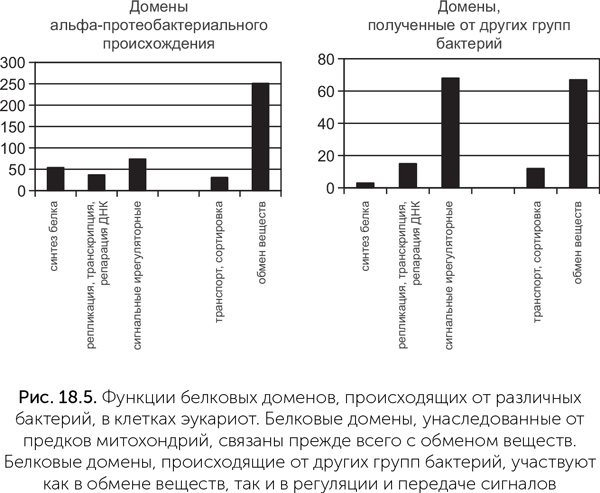
Сравнение геномов показывает, что это не так. У эукариот насчитывается более 200 генных семейств бактериального происхождения, которых нет ни у альфа-протеобактерий, ни у цианобактерий, и, следовательно, приобретенных другими путями. Функции этих генных семейств чаще всего связаны с регуляцией и передачей сигналов, тогда как гены альфа-протеобактериального происхождения связаны прежде всего с обменом веществ (рис. 18.5). Вклад цианобактерий заметен только в ядерных геномах водорослей и растений. Некоторые из белков эукариот, хотя имеют альфа-протеобактериальных родственников, но ближе к белкам других групп бактерий. Например, все ферменты гликолиза эукариот наиболее сходны с белками бактерий-бродильщиков рода Clostridium.
Несколько белковых семейств эукариот, связанных со слиянием и отшнуровкой мембранных пузырьков, имеют архейное происхождение — например, Adaptin N, Syntaxin, AdAR repeat. К сожалению, их функции в клетках архей неизвестны.
Помимо самих митохондрий, организующих кислородное дыхание, для приспособления к кислородной среде нужны белки, защищающие цитоплазму от повреждений, такие как оксигеназы, пероксидазы, каталаза. Эти белки эукариот получены от бактерий, причем не родственных митохондриям. Чего и следовало ожидать — ведь, чтобы получать выгоду от аэробного дыхания, надо сначала научиться защищаться от токсического действия кислорода, которое проявляется уже при очень малых его концентрациях.
Мембраны эукариот, подобно бактериальным, состоят из сложных эфиров жирных кислот. Ферменты биосинтеза липидов, соответственно, могли быть получены только от бактерий. По своим аминокислотным последовательностям они ближе всего к ферментам альфа-протеобактерий, а значит, получены от предков митохондрий. Другая важная группа липидов, инозитол-фосфаты, унаследована эукариотами от архей. Инозитол-фосфатные липиды составляют небольшую долю мембран эукариот, но важны как метки мембран разного назначения, регуляторы состояния мембранных белков, слияния и разделения мембранных пузырьков и даже регуляторы работы генов (на стадии созревания матричных РНК и экспорта их из ядра). Важно, что древние и универсальные мембранные белки, такие как роторная АТФаза или сигнал-распознающая частица, встраивающая новые белки в мембрану, у эукариот похожи на архейные, но работают в мембране, состоящей в основном из липидов бактериального типа. Значит, в эволюции эукариот был этап замены мембранных липидов с архейных на бактериальные. Японские биохимики воспроизвели промежуточную стадию этого процесса, создав трансгенную кишечную палочку с генами синтеза архейных липидов (Shimada, Yamagishi, 2011). Оказалось, что смесь липидов разного происхождения практически не влияет на жизнеспособность клеток при любых соотношениях бактериальных и архейных липидов.
Отличительной чертой мембран эукариотических клеток являются вспомогательные липиды — стеролы, такие как холестерол. Стеролы повышают текучесть мембран и поэтому важны для фагоцитоза и транспорта мембранных пузырьков. Выходит, что стеролы, вероятно, появились раньше, чем митохондрии. Предшественником всех стеролов является терпеновый углеводород сквален, который мы уже упоминали в главе 15 как добавку к липидам у бактерий, живущих в щелочных средах. В качестве промежуточного продукта обмена веществ сквален распространен гораздо шире, он синтезируется у многих бактерий и архей. Однако дальнейшие стадии синтеза стеролов характерны только для эукариот.
На первом шаге сквален-монооксигеназа катализирует присоединение кислорода к концевой двойной связи сквалена, образуя сквален-2,3-эпоксид. Для этой реакции требуется молекулярный кислород, хотя и в очень малой концентрации. Затем ланостерол-синтаза катализирует восстановление эпоксида, при этом неустойчивый продукт восстановления — радикал сквалена — перестраивает двойные связи в замкнутые кольца, образуя ланостерол (рис. 18.6). Ланостерол дает начало всем другим стероидам путем модификации боковых групп.
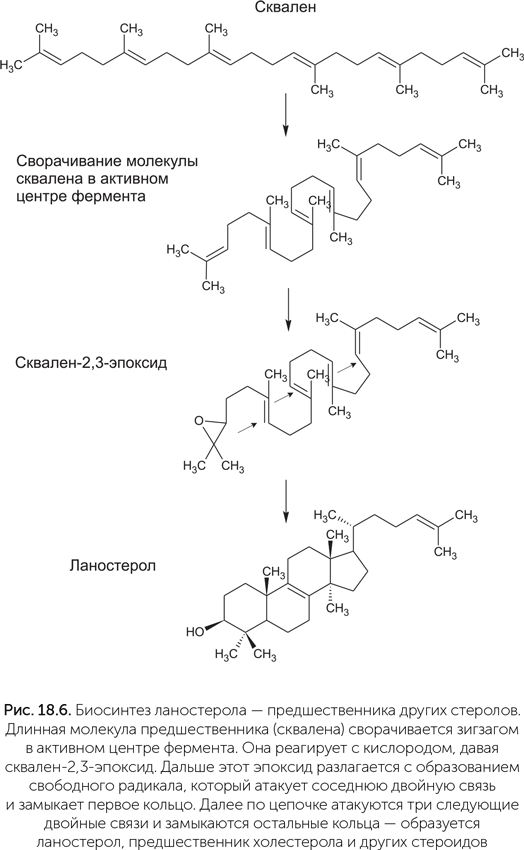
Из-за крайней важности стеролов для эукариотической клетки происхождение ферментов их биосинтеза внимательно исследовалось. Сходные ферменты, синтезирующие те же стеролы, были обнаружены у некоторых гамма-протеобактерий, например Methylococcus capsulatus (Lamb et al., 2007), у Gemmata obscuriglobus из планктомицетов (Pearson et al., 2003) и у ряда микобактерий, например Plesiocystis pacifica и Stigmatella aurantiaca. Однако подробное исследование показало, что все эти ферменты бактерий получены горизонтальным переносом от эукариот уже после расхождения линий растений и животных (Desmond, Gribaldo, 2009). Первый шаг биосинтеза стеролов — присоединение кислорода к сквалену — мог быть поначалу одним из способов защиты от молекулярного кислорода, и лишь потом нашлось применение полученному сквален-2,3-эпоксиду.
Большая часть эукариотических генов бактериального происхождения, не принадлежавших предкам митохондрий и пластид, кодирует защитные, рецепторные, транспортные, сигнальные и регуляторные белки. Сюда относятся, например, белки теплового шока Hsp90, белки устойчивости к тяжелым металлам TerC и Ttg2 и др. Что интересно, белки, которые у эукариот обеспечивают взаимодействие между компонентами клетки, у бактерий нужны для связей между разными клеткам в сообществе. Например, Tim44 эукариот необходим для транспорта белков через внутреннюю мембрану митохондрий из цитоплазмы, а его бактериальные родственники экспортируют белки из клеток во внешнюю среду. Это свидетельствует о том, что при возникновении эукариотической клетки под одной мембраной оказались уже отработанные системы связи клеток в сообществе.
В целом можно сказать, что те белки эукариот, которые получены от других бактерий (не предков митохондрий и пластид), не имеют какого-то одного источника. Скорее, они были получены от множества разных бактерий путем горизонтального переноса генов. Гипотезы, в которых до симбиоза с протеобактериями было слияние клеток какой-то другой бактерии с археей, не поддерживаются этими геномными данными.
Архейный предок эукариот
Хотя участие какой-то археи в происхождении эукариот давно стало очевидно, выделить конкретную группу архей, к которой мог относиться предок эукариот, оказалось не так просто. Многие компоненты эукариотной клетки были найдены у отдельных видов архей, но это были разные виды, относящиеся к разным крупным группам архей. Так обстоит дело, например, с цитоскелетными белками тубулинами. Давно известны белки FtsZ, отдаленно похожие по последовательности на тубулин и широко распространенные у бактерий и архей. Они собираются в пластины и трубки и необходимы для деления прокариотических клеток. В 2012 году были найдены артубулины — близкие родственники тубулина — у двух видов архей рода Nitrosoarchaeum, принадлежащих к группе Thaumarchaeota. Их функция пока неизвестна (Yutin, Koonin, 2012).
Аналогично у бактерий и архей широко распространены белки, отдаленно сходные с актином; их называют MreB. Они собираются в тонкие нити и участвуют в перетяжке делящейся бактериальной клетки. Другие дальние белковые родственники актина кодируются плазмидами (маленькими независимыми молекулами ДНК у бактерий) и служат для их расхождения при делении клетки. В 2009 году у нескольких видов группы Crenarchaeota были обнаружены кренактины, весьма похожие на актин эукариот (Ettema et al., 2011). Кренактины образуют нити, которые придают клеткам палочковидную форму, часто с разветвлениями. По своей последовательности кренактины близки не только к актинам, но и к белкам Arp2/Arp3 (Actin-related proteins), которые у эукариот образуют разветвления актиновых нитей. В некоторых случаях совместная полимеризация актина и Arp2/Arp3 на внутренней стороне клеточной мембраны достаточна для отшнуровки фагоцитозного пузырька (Yutin et al., 2009).
Наряду с артубулинами у Thaumarchaeota обнаружились гены еще одной эукариотической системы — ESCRT-III (endosomal sorting complex required for transport). Эта группа белков связана с мембранами комплекса Гольджи, эндоплазматического ретикулума и вакуолей; она участвует в сортировке содержимого мембранных пузырьков. В клетках Thaumarchaeota белки этого комплекса необходимы для деления клеток, работая вместо отсутствующего у них FtsZ (Makarova et al., 2010).
В геноме Caldiarchaeum subterranum, прочитанном в 2010 году, были обнаружены гены важной для эукариот системы убиквитиновой модификации белков. Эта система пришивает убиквитин — маленький белок — к различным клеточным белкам. Убиквитин служит обычно меткой для уничтожения белков. Кроме собственно убиквитина (Ub) в нее в минимальном варианте входит три фермента — Е1, Е2 и Е3, катализирующие разные стадии присоединения Ub. У бактерий известны отдаленные родственники Е1 и Е2, но их функции не связаны с убиквитином, они катализируют включение серы при синтезе витамина В1 и молибденовых кластеров ферментов.
Меченые убиквитином белки обычно разрушаются в протеасомах — специальных белковых комплексах для выборочного уничтожения дефектных и ненужных белков. Функциональное ядро протеасомы состоит из 28 белковых молекул, собранных в четыре кольца из семи субъединиц; кроме того, в ее работе принимают участие дополнительные регуляторные субъединицы. Протеасомы были известны ранее у некоторых бактерий (Mycobacterium tuberculosum) и архей (Haloferax volcanii), но убиквитиновой системы у этих видов нет. Протеасомы есть и у Caldiarchaeum subterranum, они похожи на эукариотические также по наличию белка RPN11, который опознает убиквитиновые метки на белках (Nunoura et al., 2011).
Почти все, что мы знаем об устройстве и образе жизни бактерий и архей, ученые узнали, выращивая и изучая микробов в лаборатории. Те микробы, для которых не удалось подобрать условия выращивания, долго оставались неизвестными. В XXI веке появились методы метагеномики — анализа всей ДНК, содержащейся в природной пробе (вода, почва, ил). Метагеномика позволяет оценить разнообразие микробов в пробе без культивирования. Используя метагеномный способ, ученые быстро выяснили, что микробное разнообразие в природе огромно. Более 99% видов микробов, которые есть в природе, никогда не вырастали в лаборатории, и до появления метагеномики об их существовании можно было только догадываться. Хуже того, половина крупных групп бактерий и архей не имеет ни одного культивируемого представителя и известна только по метагеномным данным. Ученые подозревали, что среди них скрываются и близкие родственники эукариот.
И вот в 2015 году такие археи, близкие к эукариотам, были найдены (Spang et al., 2015). Норвежская экспедиция, изучавшая геотермальное поле Замок Локи (Loki's castle) в Северной Атлантике, собрала пробы донных осадков, обильно заселенных бактериями и археями. Анализ ДНК в этих пробах показал, что в сообществе преобладает один вид архей, относящийся к некультивируемой группе архей DSAG (deep-sea Archaea group). На его долю приходилось более 10% клеток, а значит, появилась возможность прочитать не только гены рибосомных РНК, по которым устанавливают родственные связи микробов, но и собрать весь его геном. Этот вид, который получил временное название Lokiarchaeum, оказался ближе к эукариотам, чем все известные ранее археи. Его геном имеет размер более 5 млн пар нуклеотидов и кодирует 5381 белок, поэтому является одним из самых сложных геномов архей. Среди этих белков есть пять актиноподобных белков, более похожих на актины и ARP эукариот, чем кренактины (рис. 18.7). Также Lokiarchaeum обладает большим набором сигнальных белков суперсемейства Ras — 92 разновидностями! Эти белки в клетках эукариот регулируют перестройки цитоскелета, транспорт пузырьков, передачу сигналов между мембраной, цитоплазмой и ядром, деление клеток и многие другие функции. Белки Ras человека очень хорошо изучены, потому что мутации в них часто приводят к неограниченному делению клеток и раку. Хотя отдельные Ras-подобные белки встречаются в разных группах бактерий и архей, только Lokiarchaeum имеет их большой набор. При этом часть его Ras-белков попадает в отдельные эукариотные подсемейства этого суперсемейства. Еще у Lokiarchaeum есть большой набор генов системы ESCRT-III; в отличие от Thaumarchaeota у него уже произошло выделение нескольких эукариотных подсемейств этих генов. Также у него появляются гены комплексов ESCRT-I и ESCRT-II, которые у эукариот взаимодействуют с ESCRT-III, собирая вместе и загружая в мембранные пузырьки меченные убиквитином белки, подлежащие разборке на аминокислоты.
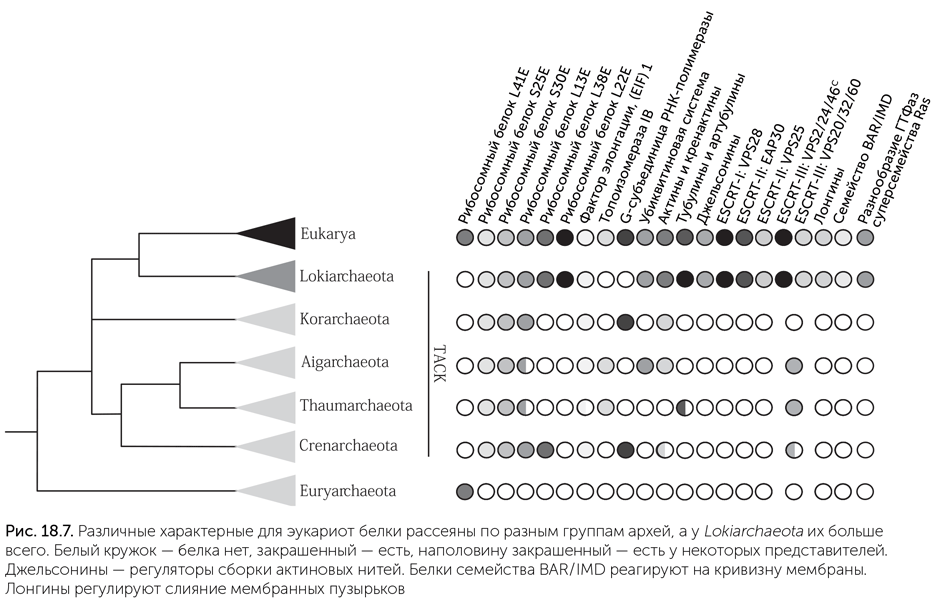
По набору генов, связанных с цитоскелетом и управлением мембранами, похоже, что Lokiarchaeum и его общий с эукариотами предок могут иметь способность к фагоцитозу. К сожалению, Lokiarchaeum не растет в лаборатории, поэтому пока нет возможности проверить, есть ли у него фагоцитоз на самом деле. Зато в тех же пробах из Замка Локи есть в меньшем количестве ДНК других локиархеот, и одна из них, Loki3, еще ближе к эукариотам. Через пару лет и ее геном, скорее всего, будет прочитан.
Причины и механизмы появления эукариот
Мы видим, что эукариотическая клетка сочетает в себе черты архей и различных неродственных групп бактерий. От архей унаследованы центральные информационные системы клетки (синтез белков, копирование и ремонт ДНК), зачатки цитоскелета, зачатки систем управления мембранами и убиквитиновая система мечения белков. От бактерий произошли ферменты обмена сахаров, липидов и отчасти — стеролов, системы защиты от кислорода и всевозможные сигнальные и регуляторные белки. Очевидно, что приобретение митохондрий было далеко не первым шагом на пути происхождения эукариот: чтобы такой симбиоз стал технически возможен, скорее всего, был необходим уже работающий фагоцитоз. А чтобы он был полезен, надо сначала иметь ферменты гликолиза, защиту от кислорода, системы транспорта веществ и передачи сигналов между симбионтом и хозяином.
Как мог происходить процесс появления эукариот? Во-первых, симбиоз, многочисленные переносы генов от разных бактерий и большая роль сигнально-регуляторных генов означают, что процесс происходил в сложном микробном сообществе. Во-вторых, митохондрии и стерол, исходно присущие всем эукариотам, свидетельствуют о том, что эукариоты эволюционировали в кислородной среде. Кислород указывает нам, что сообщество, в котором появились эукариоты, скорее всего, было цианобактериальным матом, о котором уже рассказывалось в главе 16. В-третьих, архейное происхождение базовых генетических систем (синтез белков, копирование и ремонт ДНК) эукариот свидетельствует о том, что у истоков процесса стояли археи.
Проще всего предположить, что процесс возникновения эукариотной клетки стал ответом на появление кислородного фотосинтеза и отравление среды кислородом. В обмене веществ многих архей, метаногенов и метилотрофов важную роль играют ферменты, содержащие никель. Они очень уязвимы для кислорода, а значит, архейный предок в условиях кислородного кризиса не мог больше жить по-старому и был вынужден радикально изменить обмен веществ.
В современных бактериальных сообществах есть примеры тесного взаимодействия и соседства архей с бактериями. Например, метаногенные археи, поглощающие водород, живут в симбиозе с уксуснокислыми бродильщиками, выделяющими водород. В районах просачивания метана из морского дна живут в тесном симбиозе окисляющие метан археи и восстанавливающие сульфат бактерии, и между ними происходит обмен электронами при помощи соединений железа (Sivan et al., 2014). Так что архейный предок эукариот тоже мог жить в тесном симбиозе с какими-то бактериями. По самой популярной версии, он был метаногеном и получал водород от симбионтов — уксуснокислых бродильщиков.
Появление кислородного фотосинтеза вызвало крупный экологический кризис. Многие обитатели цианобактериального мата вымерли, другим же удалось создать свои или приобрести горизонтальным переносом чужие системы защиты от кислорода. Этот процесс произошел не мгновенно, а распространялся с поверхности в глубокие слои мата. К моменту появления серьезных проблем у метаногенов их соседи сверху уже имели системы адаптации к кислороду. Многие микробы в состоянии стресса начинают активно поглощать ДНК из внешней среды — таким способом наша архея приобрела гены, необходимые для защиты от кислорода, и новый обмен веществ, скорее всего, молочнокислое брожение. Сквален-монооксигеназа, необходимая для синтеза стеролов, могла исходно служить для защиты от кислорода. Механизм проводимой ею реакции очень похож на поставленное под контроль перекисное окисление липидов, одну из форм кислородного повреждения клеток. Отсутствие клеточной стенки, актиновый цитоскелет для поддержания вытянутой и ветвистой формы клетки и стеролы позволили ей перейти к фагоцитозу и успешно конкурировать с соседями-бактериями. Мембрана высокой текучести, подходящая для фагоцитоза, плохо держит мембранный электрический потенциал. Но предок эукариот в это время получал энергию путем брожения и мало зависел от мембранных энергетических процессов.
Тем временем в верхних слоях мата пурпурные фотосинтезирующие бактерии отработали аэробное дыхание, после чего органические кислоты, выделяемые бродильщиками нижних слоев, превратились для них в ценный ресурс. Эти аэробы стали оптимальными партнерами для симбиоза с фагоцитирующими бродильщиками. Фагоцитирующий предок эукариот сначала поглощал их как добычу, затем стал откладывать их переваривание и сначала подращивать на своих продуктах брожения, а потом симбионты стали отдавать хозяину АТФ и были оставлены в живых окончательно. Эти события в чем-то похожи на переход древних людей от охоты к скотоводству.
Одним из следствий приобретения митохондрий стало размножение интронов. Эти некодирующие вставки в различных генах очень обильны у эукариот, а у бактерий и архей бывают только в генах рибосомных и транспортных РНК. Чтобы не нарушать функцию РНК или белка, интрон должен быть вырезан из РНК. У бактерий и архей синтез белков, закодированных в матричной РНК, начинается еще до того, как эта мРНК будет полностью построена на матрице ДНК. При попадании интронов в белок-кодирующие гены бактерий вырезание интрона из мРНК будет осложнено — «голова» интрона окажется в рибосоме еще до того, как «хвост» будет достроен, интрон не сможет вырезаться из мРНК, и синтезированный с нее белок станет дефектным.
Интроны и сплайсинг
В генах бактерий и архей последовательность, кодирующая белок, расположена в ДНК так же, как и в матричной РНК, — одним непрерывным куском. У эукариот белок-кодирующие последовательности прерываются некодирующими вставками — интронами. Фрагменты кодирующей последовательности, разделенные интронами, называются «экзоны». Из-за наличия интронов мРНК эукариот подвергаются сложному процессу созревания. Незрелая матричная РНК содержит копии всех экзонов и интронов гена. Для получения зрелой мРНК интроны должны быть удалены, а оставшиеся экзоны соединены. Этот процесс называется «сплайсинг» — от старого морского термина, означавшего скрепление концов двух канатов без узла.
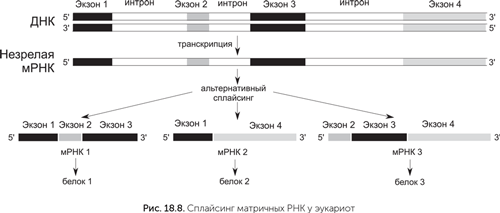
Не очень понятно, зачем эукариотам эти сложности. Сплайсинг дает некоторые преимущества, например, позволяет эукариотам получать с одного гена много разных белков. Для этого часть экзонов вырезается из мРНК вместе с интронами. В зависимости от того, какие экзоны войдут в зрелую матричную РНК, получатся разные варианты белка. Рекорд разнообразия альтернативного сплайсинга принадлежит белку иммунной системы насекомых DSCAM. Ген DSCAM мухи содержит 117 экзонов, комбинации которых дают 38 000 вариантов белка.
Эукариоты платят за эту возможность дополнительными затратами энергии и времени на синтез интронов мРНК. Хуже того, из-за сплайсинга включение и выключение генов занимает гораздо больше времени. У бактерий синтез белков на новой мРНК начинается еще до того, как она будет достроена до конца, благодаря этому через несколько минут после включения гена с него получатся первые готовые белки. У эукариот же сначала мРНК должна быть достроена до конца, а из-за интронов она длиннее, чем у бактерий, и синтезируется дольше. Потом должен пройти сплайсинг, тоже занимающий время, затем прикрепление кэпа, полиаденинового хвоста и экспорт мРНК из ядра в цитоплазму. Только после этого рибосомы смогут приступить к работе. Поэтому у эукариот от включения гена до появления первого готового белка проходит в лучшем случае от 30 до 60 минут, а часто несколько часов.
В ходе сплайсинга нередко происходят ошибки, приводящие к появлению дефектных мРНК. Для уничтожения таких матричных РНК эукариоты имеют специальную систему NMD (nonsence-mediated decay). Немногочисленные интроны в геномах бактерий вырезают себя из РНК сами, т.е. они являются рибозимами. В геномах эукариот счет интронов идет на десятки тысяч, и способностью к вырезанию самих себя они не обладают. Сплайсинг эукариот происходит при помощи специального РНК-белкового комплекса — сплайсосомы. Основную роль в ней играют шесть видов малых ядерных РНК, которые являются рибозимами. В структуре этих РНК есть сходство с самовырезающимися интронами бактерий.
Появление ядра, разделившее синтез матричных РНК и синтез белков, сняло эти ограничения, и началось бурное размножение интронов в белок-кодирующих генах предка эукариот. Мутации интронов часто нарушали их способность к самовырезанию и приводили к возникновению большого количества дефектных белков. Это вызвало давление отбора на появление системы NMD для контроля качества мРНК. Часть интронов специализировалась на вырезании других, поврежденных интронов. От них произошли малые ядерные РНК, составляющие основу сплайсосомы.
Гипотезы о происхождении ядра
Если происхождение митохондрий в целом понятно, то о пути появления ядра общепринятой теории нет. Образование ядра должно было в первую очередь обозначиться появлением оболочки вокруг генетического материала. Существует четыре гипотезы, объясняющие появление ядерной оболочки:
- гипотеза впячивания клеточной мембраны;
- эндоспоровая гипотеза;
- симбиотическая гипотеза;
- гипотеза слияния клеточных выростов.
Согласно гипотезе впячивания клеточной мембраны, оболочка ядра возникла из клеточной мембраны, часть которой ввернулась внутрь клетки. Так получилась система мембран эндоплазматического ретикулума, которая является продолжением двойной ядерной мембраны. Окружение ДНК мембраной было выгодно при питании путем фагоцитоза, так как при этом в цитоплазму неизбежно попадала чужеродная ДНК. Хуже того, в ней содержались вирусы и мобильные элементы. Поэтому появление ядерной оболочки для защиты генетического материала было поддержано отбором.
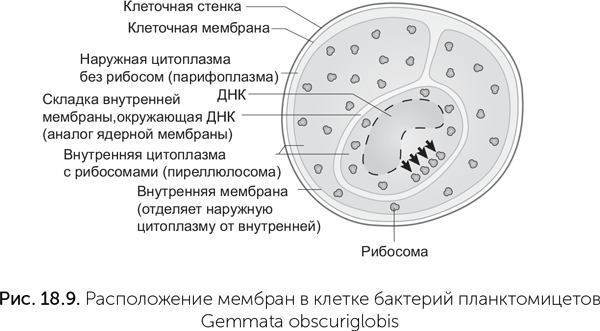
Подобное вворачивание мембраны и окружение ею ДНК известно у бактерии Gemmata obscuriglobis из группы Planctomycetes (Fuerst, Sagulenko, 2012) (рис. 18.9). Планктомицеты имеют наряду с наружной клеточной мембраной еще внутреннюю, которая делит цитоплазму клетки на две части. Внутренняя цитоплазма (пиреллюлосома) содержит рибосомы, и в ней происходит синтез белка, а внешняя цитоплазма (парифоплазма) не имеет рибосом. У Gemmata obscuriglobis внутренняя мембрана образует складку, которая окружает ДНК аналогично ядерной мембране эукариот. Однако у Gemmata эта оболочка не отделяет геномную ДНК от рибосом. Как и у всех бактерий, рибосомы Gemmata связываются с еще не завершенными матричными РНК и сразу начинают синтез белка. Ядерная мембрана эукариот же разделяет процессы транскрипции (создания матричных РНК) и трансляции (синтез белка по инструкциям в матричных РНК).
Эндоспоровая гипотеза выводит ядро и цитоплазму от двух клеток одного вида микробов. У микробов рода Bacillus при образовании спор происходит особое клеточное деление, при котором одна дочерняя клетка, дающая начало споре, оказывается внутри другой. К сожалению, такое деление известно только у Bacillus, его нет у всех остальных бактерий и ни у одной из архей.
По симбиотической гипотезе ядро и цитоплазма эукариотической клетки происходят от двух организмов, вступивших в симбиоз друг с другом. А после их слияния генетический материал предка цитоплазмы был частично перенесен в ядро, а частично утерян. Предлагались разные пары симбионтов, например спирохета внутри археи (Margulis et al., 2006) или архея внутри бактерии-планктомицета (Forterre, 2011). Иначе говоря, клетка эукариот по этим гипотезам получается химерой из трех микробов: цитоплазма — от археи (а может, от планктомицета), ядерная оболочка — от спирохеты (а может, от археи), а митохондрии — от альфа-протеобактерий. К сожалению, геномные данные не подтверждают симбиоз трех клеток. Большинство белков эукариот имеет либо архейное, либо альфа-протеобактериальное происхождение. Доля тех белков, которые происходят от других групп бактерий, меньше, а главное, не обнаруживается единого для них источника. Скорее, они получены от многих разных бактерий путем переноса отдельных групп генов, а не симбиоза и слияния целых клеток. На сегодня рассматривается только вариант симбиотической гипотезы, в котором третьим партнером был крупный вирус. О нем будет подробно рассказано дальше.
Наконец, четвертая гипотеза, предложенная только в 2014 году, выводит ядро от клетки предковой археи, покрытой клеточной стенкой, а цитоплазму — от слившихся выростов клетки, выходивших за пределы клеточной стенки (Baum and Baum, 2014). У разных архей известны такие выросты, которые увеличивают поверхность для поглощения веществ из внешней среды или для лучшего контакта с соседями по сообществу. По гипотезе Баумов, предок эукариот использовал такие выросты для улучшения контакта с будущими митохондриями. Потом выросты увеличились в объеме и частично слились между собой. Щели между ними стали эндоплазматическим ретикулумом, а слившиеся концевые части выростов создали новую клеточную мембрану (рис. 18.10).
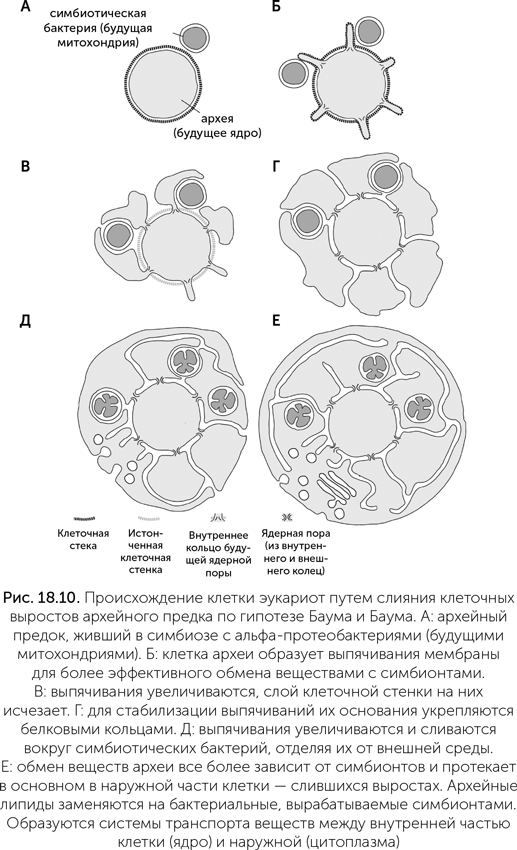
Эта гипотеза объясняет некоторые странные особенности эукариот. Например, клеточная стенка архей состоит из белковых цепей, соединенных полисахаридными перемычками через боковые аминогруппы (N-гликозилирование). Где можно было бы увидеть следы этой клеточной стенки у эукариот?
Если мембрана ядра произошла путем вворачивания наружной мембраны клетки, то мы бы ожидали увидеть химические следы предковой клеточной стенки на внешней мембране. Если ядро произошло от симбионта, поселившегося внутри археи, то следы клеточной стенки хозяина тоже должны остаться на внешней мембране. Однако следы архейной клеточной стенки обнаруживаются ближе к ядру
Архейные ферменты N-гликозилирования были унаследованы эукариотами и работают внутри эндоплазматического ретикулума, рядом с ядром, модифицируя различные белки. Инозитол-фосфатные липиды, биохимическое наследство архей, в эукариотических клетках производятся почему-то в ядре, хотя остальные функции ядра связаны с ДНК и генетикой. Митохондрии в клетках эукариот связаны с эндоплазматическим ретикулумом (ЭР), деление митохондрий происходит при помощи ЭР. Такая связь предсказывается только гипотезой слияния клеточных выростов, по которой митохондрии когда-то жили в просветах будущего ЭР, а потом прорвали его стенку и оказались в цитоплазме хозяина.
Гипотеза расширения мембраны дает ряд предсказаний, которые можно проверять. Например, она проясняет происхождение ресничек и жгутиков — тонких двигательных выростов эукариотной клетки. По этой гипотезе, жгутики произошли от тех выростов клетки, которые специализировались на движении. Как и другие выросты клетки, в месте прикрепления к телу клетки они укреплялись белковыми кольцами, которые в эукариотических клетках стали ядерными порами. Значит, в основании жгутиков могут оказаться те же белки, что и в ядерных порах. Также гипотеза расширения мембраны дает подробные предсказания о механизме сборки этих пор. Поскольку гипотеза расширения мембраны была опубликована только в 2014 году, проверка этих следствий только началась, и скоро происхождение ядра и ядерных оболочек может проясниться.
Роль вирусов в происхождении эукариот
Мы рассмотрели происхождение эукариот путем симбиоза между археей и бактерией в условиях перехода микробного сообщества к кислородной среде. Однако этот сценарий не объясняет многие особенности эукариотических клеток. Непонятно, как переход археи к фагоцитозу и обзаведение симбионтами могли способствовать появлению, например, полового размножения и мейоза. А если обратить внимание на более частные вопросы, то совершенно несуразной выглядит такая деталь эукариотической системы трансляции (считывания), как кэпы матричных РНК. Кэп — это остаток 7-метилгуанозина, пришитый к 5'-концу мРНК специальным 5' — 5'-трифосфатным мостиком (рис. 18.11). Он требуется для начала трансляции на эукариотической рибосоме — без него рибосома не может связаться с мРНК.
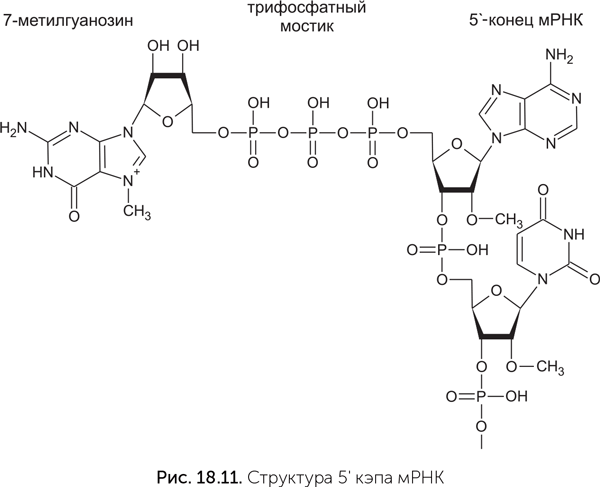
Для узнавания кэпа рибосомой есть специальный белок — фактор инициации eIF4E, не имеющий аналогов у прокариот. Важно, что из-за наличия кэпа и eIF4E эукариоты не могут иметь оперонов — групп генов, которые транскрибируются в одну длинную мРНК, кодирующую несколько белков последовательно, один за другим. Опероны позволяют бактериям и археям экономить на регуляции активности генов: достаточно одного регуляторного участка в начале оперона, чтобы одновременно управлять активностью всех его генов. (Обычно белки, которые кодируются генами одного оперона, функционально связаны, а значит, требуются в равных количествах.) Переход к кэпированным мРНК на заре эволюции эукариот потребовал бы массированной перестройки генома, распада всех оперонов и появления тысяч новых регуляторных участков для отдельных генов. Сложно представить себе причину, по которой это было бы выгодно для клетки, и еще сложнее найти причину, по которой система пришивания и узнавания кэпа вообще возникла.
Эти особенности эукариот находят объяснение, если допустить, что в их появлении участвовали помимо архейного и бактериального партнеров еще и вирусы. Вирусное происхождение отдельных компонентов эукариотической клетки не вызывает сомнения. Так, фермент теломераза, достраивающий защитные концевые структуры хромосомной ДНК (теломеры), происходит от обратной транскриптазы ретровирусов. Часть генетического аппарата митохондрий — ДНК-полимераза, РНК-полимераза и праймаза — унаследована от хвостатого бактериофага, похожего на современный фаг Т4 и встроенного в геном бактериального предка митохондрий. Однако есть и более радикальное мнение о роли вирусов в появлении эукариотической клетки — вирусная теория происхождения ядра.
Эту теорию в современном виде выдвинули вирусологи Филипп Джон Белл и Масахара Такемура (Bell, 2001; Takemura, 2001; Bell, 2009). Они утверждают, что ядро эукариотической клетки происходит от крупного ДНК-вируса, заразившего древнюю архею. Этот вирус мог перейти к умеренной эксплуатации хозяина: он не убивал его сразу (это явление называется лизисом), а сосуществовал, медленно размножая свою ДНК в его клетках (лизогения). Постепенно такой вирус мог взять клетку хозяина под полный контроль. Поначалу другие ученые практически не рассматривали эту теорию всерьез, но в последнее время она стала набирать популярность — так, к ее обсуждению подключился крупнейший французский вирусолог Патрик Фортерр.
Ключевую стадию пришивания кэпа проводит фермент гуанилил-трансфераза. Поскольку эукариотические рибосомы не связываются с мРНК без кэпа, вирусы эукариот для синтеза своих белков должны как-то решать эту проблему. Мелкие ДНК-вирусы, умеющие проникать в ядро сквозь ядерные поры, обычно используют гуанилил-трансферазу хозяина. РНК-вирусы создают на 5` концах своих мРНК сложные конструкции из шпилек (они называются IRES), которые имитируют форму белка eIF4E и позволяют РНК связаться с рибосомой без участия кэпа и eIF4E. Крупные ДНК-вирусы обычно имеют свою собственную гуанилилтрансферазу и производят матричные РНК с кэпами. В ходе эволюции эти ферменты могли передаваться между хозяевами и вирусами в обоих направлениях, но где они появились исходно?
Белл провел филогенетический анализ ферментов пришивания кэпа, который показывает, что ферменты эукариот образуют на дереве единую самостоятельную ветвь (рис. 18.12). Случай переноса фермента из клетки вирусу отразился бы на этом дереве вирусной веткой среди эукариот, но ничего такого мы не видим. А значит, следов переноса гуанилилтрансферазы от клеток вирусам нет.
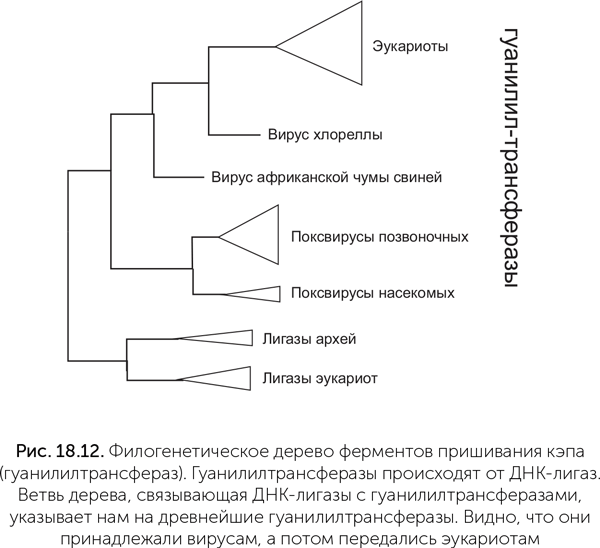
Чтобы понять, какой из узлов дерева гуанилилтрансфераз самый древний и соответствует предковому ферменту, к ним добавлены родственные ферменты — АТФ-зависимые ДНК-лигазы. Это более древние белки, предковые по отношению к гуанилилтрансферазам. Соответственно, та часть дерева гуанилилтрансфераз, которая выходит из лигазной части дерева, укажет нам древнейшую гуанилилтрансферазу. Оказывается, она принадлежала вирусам: первая ветвь ее потомков содержит ферменты поксвирусов (вирус оспы и его родственники), вторая — ферменты вируса ASF (африканской чумы свиней — African swine fever) и третья — вируса хлореллы. Гуанилилтрансферазы эукариот происходят от фермента вирусной линии, давшей начало вирусам ASF и хлореллы. Это доказывает, что кэпирование мРНК, как и другие инновации в генетических системах, появилось сначала среди вирусов и лишь затем было заимствовано эукариотами.
Для вирусов, в отличие от клеток, есть очевидная выгода в создании такой системы. Это средство перехвата управления клеткой хозяина. Вирус вносит в клетку фермент, который разрушает клеточные матричные РНК без кэпа и не трогает вирусные мРНК с кэпом. Белок eIF4E тоже мог сначала появиться у вирусов как средство захвата рибосом хозяина. Он присоединяется к рибосомам, после чего они узнают только вирусные мРНК с кэпом, останавливая синтез белков клетки. Современные клеточные eIF4E обычно связаны с рибосомами. У мимивируса обнаружен собственный белок-аналог eIF4E, роль его пока непонятна.
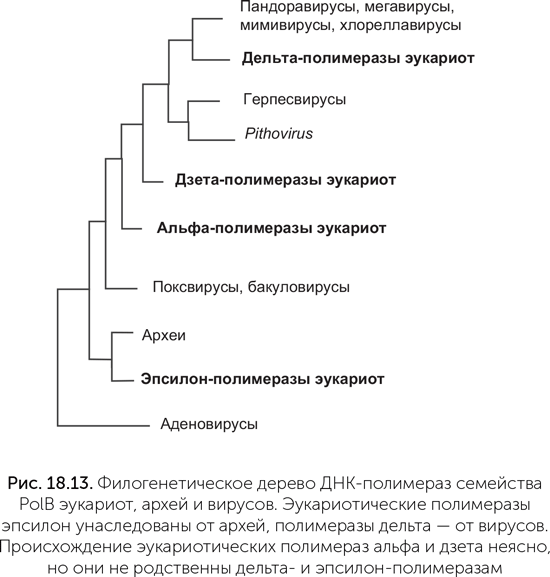
Такемура обратил внимание на систему репликации ДНК эукариот. По сравнению с машинами репликации бактерий и архей эукариотическая версия сложна и медлительна. Если у бактерий и архей скорость репликации составляет около 1000 нуклеотидов в секунду, то у эукариот обычно около 50. Там, где многие бактерии и археи обходятся одной ДНК-полимеразой (см. главу 14), эукариоты используют три родственные. Дельта-полимераза копирует отстающую цепь, эпсилон-полимераза — лидирующую, а альфа-полимераза имеет неожиданную функцию. Она удлиняет РНК-затравки на 15–20 нуклеотидов уже из ДНК, после чего уступает место полимеразам дельта и эпсилон. Альфа-полимераза часто делает ошибки, поэтому созданные ею фрагменты ДНК потом удаляются одновременно с РНК-затравками, и дельта-полимераза строит на их месте точные копии ДНК-матрицы. Кроме этих трех ДНК-полимераз у большинства эукариот есть четвертая — дзета-полимераза. Она заменяет другие полимеразы, когда нужно срочно скопировать поврежденную ДНК и нет времени на ее починку.
Все четыре эукариотические полимеразы принадлежат к семейству PolB (глава 14), но достаточно сильно различаются между собой. На родословном дереве ДНК-полимераз эукариот, архей и вирусов (рис. 18.13) хорошо видно, что полимераза эпсилон унаследована эукариотами от архей, полимераза дельта — от вирусов, а полимеразы альфа и дзета образуют отдельные ветви, начинающиеся ближе к корню дерева, чем δ. Об их происхождении нельзя судить точно, но они тоже могли попасть в клетки эукариот от каких-то вымерших или еще не открытых вирусов.
Наконец, Патрик Фортерр связал с вирусами происхождение огромного количества эукариотических белков, которые не похожи ни на какие белки бактерий и архей (Forterre, 2011). По последним оценкам, общий предок современных линий эукариот уже имел более 1400 таких белков. Среди них преобладают вспомогательные белки цитоскелета и ДНК-связывающие белки, в структуре которых присутствуют многочисленные короткие повторы. Вирусы, особенно крупные, содержат много генов, не похожих ни на какие гены клеточных организмов, а часто и на гены других вирусов. Кодируемые ими белки тоже часто имеют множественные короткие повторы. Низкая точность вирусных полимераз, интенсивная рекомбинация и «гонка вооружений» с хозяевами приводят к очень быстрой эволюции вирусных белков по сравнению с клеточными, поэтому вирусы — обильный источник принципиально новых белков.
Вирусная теория происхождения ядра и полового размножения
К крупным ДНК-вирусам (LNCDV, Large Nucleo-Cytoplasmic DNA Viruses) относятся, например, поксвирусы (из них широко известен возбудитель оспы), мимивирусы (недавно открытая группа гигантских вирусов-паразитов амеб) и фикоднавирусы, поражающие водоросли. Они имеют крупную и сложную вирусную частицу, покрытую несколькими мембранами. Самая внешняя мембрана сливается с наружной мембраной клетки при заражении, и в цитоплазму попадает вирус, окруженный двумя внутренними мембранами. Эти мембраны местами сливаются между собой, образуя некое подобие ядерных пор. Они выстланы изнутри белками капсида (вирусной оболочки), аналогичными белкам ядерной оболочки. В такой форме вирус долго существует в цитоплазме, в нем происходят транскрипция, кэпирование и полиаденилирование РНК, экспорт зрелых РНК в цитоплазму через поры вирусной частицы. Вирусы оспы раньше называли «мини-ядрами», а вирион мимивируса по размеру почти не уступает ядру клетки-хозяина.
Сходство крупных ДНК-вирусов с ядром эукариот наблюдается по многим признакам:
- генетический материал ограничен двумя липидными мембранами с белковым каркасом между ними;
- транскрипция и трансляция разделены в пространстве (транскрипция идет внутри вируса, трансляция — в цитоплазме клетки-хозяина);
- мРНК активно экспортируется через поры в мембранной оболочке;
- геном состоит из линейных молекул ДНК с тандемными повторами на концах;
- расхождение дочерних молекул ДНК при делении может сопровождаться исчезновением оболочки.
Геном таких вирусов представлен линейной двухцепочечной ДНК длиной до 200 000 пар нуклеотидов у поксвирусов и более 1 млн — у мимивирусов, что сравнимо с размером самых малых бактериальных геномов. Открытые в 2013 году пандоравирусы имеют геном размером до 2,5 млн пар нуклеотидов, что соответствует среднему геному свободноживущей бактерии. Для репликации ДНК эти вирусы разбирают вирусную частицу (она называется «вирион»). По мере накопления вирусной ДНК в цитоплазме клетки собираются новые вирионы, которые окружаются впячиваниями эндоплазматического ретикулума и плазматической мембраны. Кэпирование, полиаденилирование, а часто и подготовка дезоксирибонуклеотидов при размножении этих вирусов осуществляют их собственные ферменты, без участия клеточных белков.
По предложенному Беллом сценарию вирус, ставший предком ядра, паразитировал на метаногенной архее с клетками разветвленной формы, не имевшей клеточной стенки (Bell, 2006). Такие археи есть и сейчас, например, Methanoplasma elizabethii; разветвленная форма позволяет им плотнее контактировать с выделяющими водород бактериями-ацетогенами. Как и у многих современных крупных ДНК-вирусов, зрелые частицы этого вируса были покрыты тремя мембранами. Внешняя из трех мембран сливалась с наружной мембраной заражаемой клетки, а две внутренние имели поры, пропускавшие РНК и другие молекулы из вируса в цитоплазму клетки и обратно. Такие оболочки современных вирусов строятся из мембран эндоплазматического ретикулума клетки-хозяина, а у археи, не имевшей внутренних мембран, для их построения использовалась внешняя мембрана клетки. От мембраны клетки-хозяина «отшнуровывались» круглые пузырьки, которые затем складывались в двухслойное полушарие, окружали новые копии вирусной ДНК и выходили из клетки, покрываясь при этом третьей мембраной (рис. 18.14). Подобным образом одеваются мембранами частицы бактериофага PRD1, и в его случае все манипуляции с мембранами производят только вирусные белки.
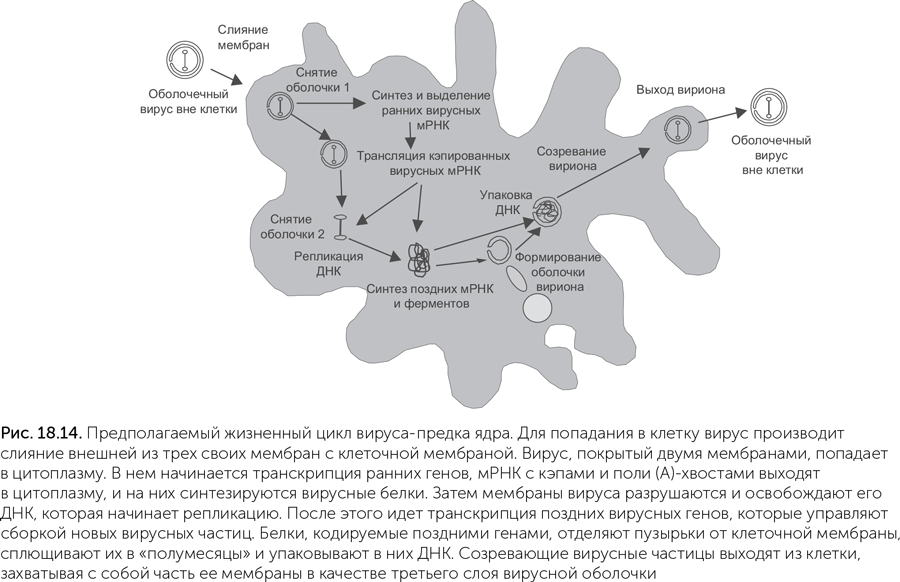
Ключевым моментом превращения вируса в ядро должен был стать, как мы уже упоминали, переход такого вируса в лизогенное состояние. Многие вирусы способны переключаться между литическим жизненным циклом (быстрое размножение с гибелью клеток хозяина) и лизогенным существованием — скрытой инфекцией, практически не влияющей на жизнеспособность хозяина. Лизогенное состояние достигается двумя способами: можно вставить свой геном в геном хозяина и пользоваться хозяйскими системами репликации или же, переключив активность вирусных генов, постоянно существовать в цитоплазме. В этом случае вирус временно превращается в плазмиду — автономную молекулу ДНК. Он тоже может пользоваться хозяйской системой репликации, но ему нужны собственные механизмы контроля количества копий. Если он будет отставать в репликации от генома хозяина, то деления хозяина будут часто порождать незараженные клетки, а если репликация вируса будет слишком активной, то он будет снижать жизнеспособность хозяина.
Большинство лизогенных бактериофагов и крупные плазмиды поддерживают минимальное число своих копий и используют специальную систему разделения копий по дочерним клеткам, похожую на ту, которая разделяет хромосомы в клетках современных эукариот. Эта система обычно включает в себя белок, способный собираться в нити, специальные участки ДНК (центромеры) и второй белок, связывающий центромеры с нитями первого белка. Центромеры — это части молекулы ДНК (хромосомы или плазмиды), которые не содержат генов и состоят из многочисленных коротких повторов. К ним прикрепляются нити веретена деления и через них же соединяются сестринские хромосомы до того, как разойтись по разным клеткам. В расхождении хромосом при делении клеток животных, которое описано во вставке в начале этой главы, веретено деления имеет два центра организации на полюсах, и хромосомы растаскиваются к этим полюсам. Гораздо более простые системы разделения копий плазмид имеют один центр организации веретена — соединенные центромеры двух копий плазмиды. Короткие нити веретена прикрепляются одним концом к одной копии плазмиды, другим — к другой. Удлинение нитей толкает две копии плазмиды в разные стороны. У ряда одноклеточных эукариот (эвглены, динофлагелляты и др.) при митозе ядерная оболочка сохраняется, веретено деления образуется внутри ядра, а механизм движения хромосом похож на таковой у плазмид.
У некоторых плазмид, например R1, белок нитей похож на актин, у других встречаются родственники тубулина. Плазмиды, не способные образовывать вирусные частицы, имеют другой путь заражения новых клеток — конъюгацию, т.е. образование специальных контактов между бактериальными клетками, по которым передается плазмидная ДНК.
И плазмиды, использующие конъюгацию, и лизогенные вирусы обычно способны отличить уже зараженные их собратьями клетки от «чистых», чтобы предотвратить бесполезное повторное заражение. Такое распознавание работает только в пределах близких видов вирусов, поэтому клетка может быть заражена одновременно несколькими разными лизогенными вирусами. Однако стабильная лизогенная инфекция несколькими вирусами требует, чтобы они использовали разные, несовместимые системы разделения копий по дочерним клеткам, иначе первое же деление клетки разносит разные лизогены по разным линиям потомков.
Лизогенные вирусы, такие как N15, и плазмиды, как R1, уже имеют цикл размножения, напоминающий митоз эукариот: они реплицируются один раз, после чего две копии остаются связанными в центромерном регионе. Дальнейшая репликация блокируется до тех пор, пока полимеризация нитей не растащит две копии далеко друг от друга. Гигантский вирус — предок ядра, в отличие от N15 и R1, имел оболочку вириона. Поэтому ему приходилось разбирать оболочку на время репликации и деления и восстанавливать ее для транскрипции генов, что еще ближе к митозу.
Следующим шагом от вируса к ядру стала потеря литического пути размножения, т.е. выхода новых вирусных частиц с гибелью хозяина. Вирус оказался «в одной лодке» с хозяином, и теперь требовалось, во-первых, по возможности снизить вред, наносимый хозяину, а во-вторых, создать механизм конъюгации для заражения новых хозяев. Второе было очень просто, так как вирус уже обладал белками, вызывающими слияние мембран. Достаточно было перенести их с оболочки вириона на клеточную мембрану, чтобы получить возможность слияния клеток зараженного хозяина с незараженным. Этот же белок на внешней мембране улучшил способности хозяина к фагоцитозу за счет слияния двух его собственных ложноножек вокруг добычи. На этой стадии использование кэпов и eIF4E для подавления трансляции генов хозяина стало опасным, и многие жизненно важные гены хозяина были перенесены в геном вируса под его управление. Современные мимивирусы содержат сотни генов, недавно перенесенных из генома хозяина, так что сценарий не выглядит нереальным. Затем кэпы пригодились для того, чтобы ограничить и поставить под контроль транскрипцию огромного количества генов, проникавших в цитоплазму из перевариваемых клеток с переходом к фагоцитозу. Поглощенные чужеродные ДНК могли транскрибироваться в цитоплазме, но получаемые при этом мРНК не имели кэпов и не узнавались рибосомами протоэукариотной клетки, оснащенными белком eIF4E. Необходимые митохондриальные гены переносились в ядро под контроль его систем регуляции. В итоге кольцевой геном архейного предка исчез совсем, а митохондриальные геномы сократились до считаных десятков генов.
Происхождение мейоза и полового размножения требует взаимодействия между разными штаммами такого лизогенного вируса. Два штамма, достаточно разных, чтобы опознавать друг друга как «чужих», но еще с одинаковой системой сегрегации, могли вызывать слияние мембран своих клеток с последующей репликацией обоих вирусных геномов. Однотипные центромеры и центромер-связывающие белки приводили к тому, что все четыре генома оказывались склеенными вместе по центромерам. Рекомбинационные белки, необходимые для достройки концов линейной вирусной ДНК, могли в этот момент вызывать рекомбинации между геномами разных штаммов, аналогичные кроссинговеру. Деление хозяйской клетки приводило к разделению вирусных геномов по два в каждую дочернюю клетку, они оставались связанными по центромере и не реплицировались. Второе деление клетки-хозяина окончательно разделяло вирусные геномы и разрешало их репликацию. Естественный отбор мог закрепить такое поведение, потому что рекомбинация между двумя вирусными геномами в одной клетке позволяет им избавиться от вредных мутаций. Нечто подобное показано для вирусов с ультрафиолетовыми повреждениями после дезинфекции: при заражении одной клетки несколькими поврежденными вирусами одного вида из их геномов собирается один работоспособный, и происходит его успешное размножение (Barry, 1961).
Итак, вирусная теория происхождения ядра лучше других объясняет такие особенности эукариот, как кэпирование мРНК, отсутствие оперонов и митоз. Она объясняет также происхождение систем слияния мембран и отшнуровки мембранных пузырьков. Серьезными доказательствами в ее пользу могут стать:
- обнаружение среди вирусов архей близких родственников крупных ДНК-вирусов эукариот;
- обнаружение у архейных вирусов системы кэпов;
- находка родственных белков мейоза у вирусов.
К сожалению, архейные вирусы пока изучены очень слабо.
Участие вируса в симбиозе, давшем начало эукариотам, снимает многие проблемы взаимодействия архейного и бактериального геномов в одной клетке и защиты от попадания чужеродной ДНК при фагоцитозе. Вирусы, и особенно крупные ДНК-вирусы, обладают изощренными механизмами для манипуляции чужими генетическими системами. Благодаря транскрипции внутри вирусной частицы и наличию кэпов матричных РНК вирус мог поддерживать функционирование зараженной клетки, несмотря на мощный поток чужих генов из фагоцитированных бактерий.
К сожалению, мы не знаем, как примирить вирусную теорию с другими версиями происхождения ядра. В рамках вирусной теории, например, с одной стороны, трудно объяснить, почему синтез инозитол-фосфатов происходит в ядре, или связь митохондрий с ЭР. С другой стороны, кэпы матричных РНК, распад оперонов и происхождение новых ДНК-полимераз трудно объяснить без участия вирусов. Скорее всего, со временем будет создан сценарий появления эукариот, который объединит сильные стороны этих теорий.
Дальнейшая эволюция эукариот
После установления симбиоза с митохондриями первые эукариоты стали высокоэффективными хищниками: аэробное дыхание повышает эффективность использования пищи почти в 20 раз по сравнению с гликолизом. Они вышли на поверхность мата и стали поедать цианобактерии. Иногда эукариоты не переваривали съеденные клетки цианобактерий, а оставляли их жить внутри пищеварительной вакуоли и потребляли только выделяемые ими сахара. Такие цианобактерии дали начало второму типу симбиотических органелл — хлоропластам. Эукариоты, приручившие цианобактерий, дали начало трем современным группам водорослей: зеленым, красным и глаукофитовым. Хлоропласты всех этих водорослей покрыты двумя мембранами: внешней — из пищеварительной вакуоли хозяина и внутренней — из клеточной мембраны симбионта. Этот симбиоз называется первичным.
Водоросли больше не нуждались в питании фагоцитозом и ушли из бактериального мата в толщу океана, другие же продолжили питаться бактериями. В дальнейшем среди эукариот появились крупные хищные формы, такие как инфузории, приспособившиеся к питанию другими эукариотами, в первую очередь водорослями. Они вместе со своей добычей составили новую экосистему открытого моря, независимую от занявших мелководья бактериальных матов.
Эукариоты легко заводят внутриклеточные симбиотические бактерии и подчиняют их себе. Так альфа-протеобактерии стали митохондриями, затем цианобактерии — хлоропластами. И в дальнейшем всякий раз, когда эукариотам требовался какой-нибудь новый биохимический путь, они брали на работу бактерий, уже владеющих им. Так, десятки групп глубоководных животных независимо приручили хемосинтетические бактерии, окисляющие сероводород или метан. Фиксация азота, разложение целлюлозы, синтез витаминов и многое другое эукариоты получают благодаря симбиотическим бактериям. Более того, эукариоты способны вступать в эндосимбиоз с другими эукариотами. Многие группы водорослей возникли в результате вторичного симбиоза, когда в роли хозяев выступали хищные амебы и жгутиконосцы, а симбионтами становились зеленые и красные водоросли (рис. 18.15). При таком симбиозе клетки водорослей дегенерируют, и от них могут остаться только хлоропласт и одна-две дополнительные мембраны. Например, хлоропласты амебы Chlorarachnion происходят от зеленых водорослей. Эти хлоропласты покрыты четырьмя мембранами (две мембраны хлоропласта зеленой водоросли, клеточная мембрана зеленой водоросли и пищеварительная вакуоль амебы). Между второй и третьей мембранами находится нуклеоморф — маленький остаток ядра зеленой водоросли с тремя хромосомами, несущими около 280 генов. Эвгленовые хлоропласты тоже происходят от зеленых водорослей, но дегенерация зашла дальше: нуклеоморфа нет, а из четырех мембран осталось три.
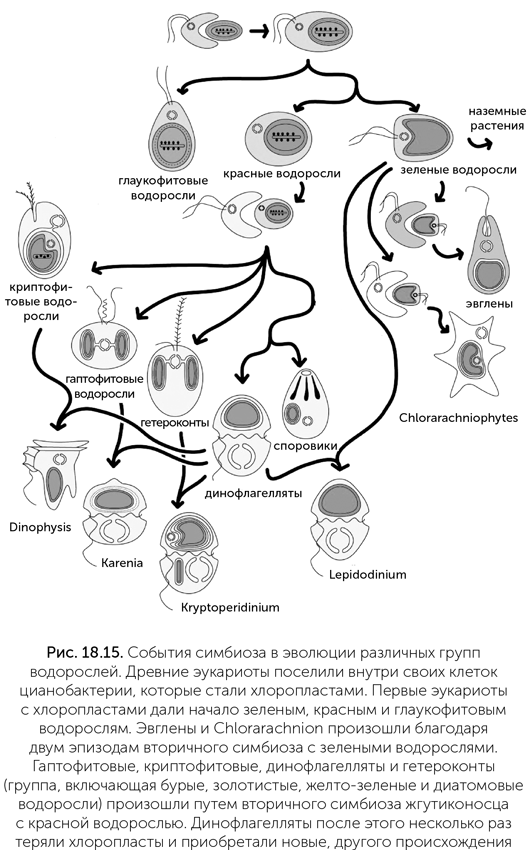
Другой хищный жгутиконосец приручил красную водоросль. Его потомки дали начало бурым, золотистым, диатомовым, криптофитовым, гаптофитовым водорослям и динофлагеллятам. Хлоропласты всех этих водорослей имеют три или четыре мембраны. У криптофитовых хлоропласты содержат нуклеоморф, как у Chlorarachnion. Многие группы динофлагеллятов, даже получив фотосинтезирующих симбионтов, возвращались к хищничеству или переходили к паразитизму.
От последних произошли споровики — группа одноклеточных, к которым относится возбудитель малярии. Предки споровиков, как и ряд других водорослей, перенесли в хлоропласт синтез липидов. Поэтому, отказавшись от фотосинтеза, потерять хлоропласт полностью они не смогли. Даже у малярийного плазмодия, предки которого сотни миллионов лет были паразитами, сохраняется апикопласт — маленький, покрытый четырьмя мембранами бесцветный остаток хлоропласта со своей кольцевой ДНК.
Среди вернувшихся к хищному образу жизни динофлагеллят есть множество примеров повторного приобретения водорослей-симбионтов. Так, Lepidodinium завел себе зеленую водоросль, Karenia — гаптофитовую, а Dinophysis — криптофитовую (Keeling, 2004).
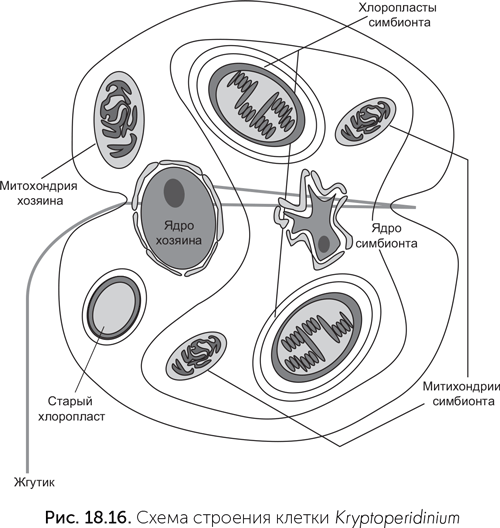
Вершиной же симбиотического таланта эукариот можно считать клетку динофлагелляты Kryptoperidinium. Эта одноклеточная водоросль происходит от динофлагеллят, которые имели хлоропласт — потомок красной водоросли. Затем эти динофлагелляты вернулись к хищному образу жизни. Старый хлоропласт остался у них в качестве маленького фоторецептора (глазка). Потом эти хищные жгутиконосцы вступили в симбиоз с диатомовой водорослью, которая сохранила ядро и значительную часть генома. В клетке Kryptoperidinium под управлением ядра находятся в общей сложности пять «чужих» геномов: свой митохондриальный, старого хлоропласта (фоторецептор), ядерный симбионта-диатомеи, митохондриальный геном симбионта-диатомеи и хлоропластный геном симбионта-диатомеи (рис. 18.16, Figueroa et al., 2009). Деление ядер хозяина и симбионта строго синхронизировано. Более того, при половом размножении происходят мейоз и слияние как главных ядер половых клеток, так и ядер симбионтов.
Наличие цитоскелета и сложной системы регуляции генов позволило эукариотным клеткам объединиться в крупные многоклеточные организмы. Сначала это были нитчатые и лентовидные водоросли, которые ускорили накопление кислорода в атмосфере. Новый уровень кислородного насыщения среды открыл возможность появления многоклеточных животных. За этим последовало радикальное усложнение биосферы («Кембрийский взрыв»), когда за короткое время появились десятки типов животных, и некоторые из ранних представителей быстро достигли метровых размеров. После «Кембрийского взрыва» эволюция шла с ускорением, и с тех пор облик Земли определяют многоклеточные растения и животные.

