Происхождение мембран и мембранной энергетики
Какие мембраны были у LUCA?
В прошлой главе мы проследили происхождение геномной ДНК и механизмов ее репликации — от РНК-белкового мира до больших кольцевых молекул ДНК, составляющих геномы бактерий и архей. Попробуем теперь путем сравнения бактерий и архей узнать структуру мембран их общего предка.
Полярные и неполярные молекулы. Мембраны
Все клетки окружены мембраной — тонкой подвижной пленкой из двух слоев особых молекул, которые называются липидами. Почему липиды образуют именно пленку, а не капли? Схожие механизмы формируют стенки мыльных пузырей и масляные пленки на поверхности воды.
Чтобы разобраться в этом, надо обратиться к деталям строения молекул разных веществ. Например, в молекуле воды электроны, образующие связи кислорода с водородом, смещены к атому кислорода. Поэтому молекула воды электрически полярна — одна ее сторона несет положительный электрический заряд, а другая — отрицательный. Благодаря полярности молекулы воды притягиваются друг к другу. Другие вещества с полярными молекулами, такие как аммиак и этиловый спирт, прекрасно смешиваются с водой.
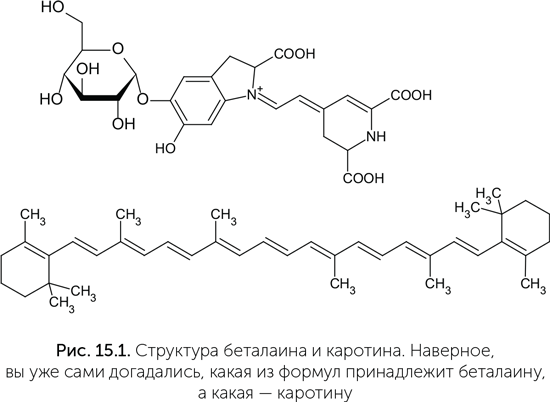
Если молекула состоит из атомов с примерно одинаковой электроотрицательностью, то в ней не будет местных электрических зарядов. Такими свойствами обладают, например, углеводороды (метан СН4, октан С8Н18, бензол С6Н6 и др.). Неполярные молекулы не притягиваются к полярным. Поэтому при смешивании полярной жидкости с неполярной, например масла с водой, получается не раствор, а эмульсия — взвесь капель одной жидкости в другой. Если в воде или в масле перед смешиванием были растворены какие-либо вещества, они могут переходить из одной жидкости в другую, более подходящую ей по полярности молекул. Это хорошо видно в тарелке борща: красный краситель свеклы (беталаин) имеет полярные молекулы и растворяется в воде, а желтый краситель моркови (каротин) неполярен и переходит в капли жира на поверхности (рис. 15.1). Полярные молекулы еще называются гидрофильными («любящими воду»), а неполярные — гидрофобными («боящимися воды»).
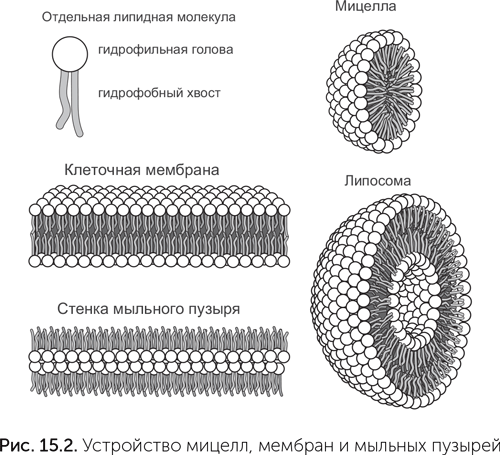
Для получения мембран и мыльных пузырей нужны молекулы с более сложными свойствами. Они должны быть вытянутой формы, с одним полярным концом и другим неполярным. Простейшие молекулы с такими свойствами — жирные кислоты. Их натриевые соли широко используются под названием «мыло». При растворении мыла в воде его молекулы образуют мельчайшие, нанометрового размера шарики и палочки — мицеллы (рис. 15.2). Каждая молекула в мицелле полярным концом контактирует с водой, а неполярный конец спрятан внутри. На поверхности воды мыло образует слой толщиной в одну молекулу. Полярные концы молекул мыла обращены в воду, а неполярные — к воздуху. Стенка мыльного пузыря состоит из двух слоев молекул, они собраны полярными концами внутрь, а неполярными — к воздуху по обе стороны от стенки. Наконец, клеточная мембрана похожа на стенку мыльного пузыря, только вывернутую наизнанку. В мембране полярные концы липидных молекул обращены к воде по обе стороны, а неполярные скрыты внутри.
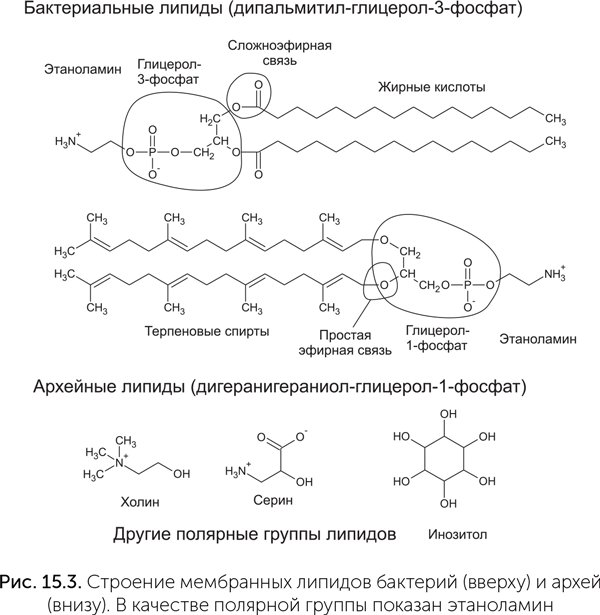
Мембраны современных бактерий состоят из фосфолипидов — сложных эфиров глицерола, двух остатков жирной кислоты и одного фосфатного остатка (рис. 15.3). К фосфатному остатку может быть присоединена дополнительная полярная группа: это может быть этаноламин, холин, аминокислота серин или многоатомный спирт инозитол. Гидрофобные хвосты жирных кислот образуют средний слой мембраны, а полярные остатки глицерола, фосфата и вспомогательных полярных групп — наружный и внутренний слои. Мембраны архей устроены в принципе похоже, но на другой химической основе. Их липиды имеют в качестве гидрофобной части терпеновые спирты, например геранилгераниол. Углеводородные цепочки терпенов несут метильные (СН3) группы через каждые четыре атома. Эти спирты простыми эфирными связями присоединяются к глицерол-фосфату, к его фосфатному остатку тоже могут присоединяться дополнительные полярные головки, такие же, как у бактерий. Глицерол-фосфат архей тоже отличается от бактериального — у архей используется другой его оптический изомер, глицерол-1-фосфат вместо глицерол-3-фосфата.
Таким образом, сравнение современных мембран ничего нам не дает для понимания их общего предкового состояния — все основные компоненты отличаются вплоть до полной несовместимости. Одна из крайних точек зрения, высказанная Мартином и Расселом (Martin, Russell, 2007), заключается в том, что последний общий предок не имел мембран вовсе и современные мембраны были изобретены независимо предками бактерий и архей при выходе из минеральных каверн.
Другая крайняя точка зрения основана на обнаружении жирных кислот в метеоритах и в условиях опыта Миллера. Согласно ей примитивные мембраны, состоящие из абиогенно синтезированных жирных кислот, существовали еще на заре мира РНК, до появления белков. Обе эти крайности, скорее всего, неверны. В реконструированном арсенале белков LUCA есть несколько мембранных белков, таких как роторная мембранная АТФаза и система секреции белков III типа. Они не могли бы сформироваться без существования хоть каких-нибудь мембран. Абиогенные жирные кислоты же обладают большим разбросом в длине углеводородной цепи, и поэтому из их смеси получаются крайне непрочные мембраны. Вахтерхойзер предполагал, что LUCA имел смесь липидов с обоими изомерами глицерола, а бактерии и археи унаследовали по одному типу из этих двух (Wächtershäuser, 2006). Однако, когда такие мембраны были получены искусственно, оказалось, что липиды с разными изомерами глицерола быстро разделяются на «острова», содержащие преимущественно один изомер из двух, а мембрана легко рвется по границам этих «островов».
Вопрос происхождения мембран также требует решения очередного парадокса «курицы и яйца»: современные мембраны непроницаемы для ионов металлов и заряженных органических молекул, таких как аминокислоты, и слабо пропускают сахара. Чтобы клетки могли поглощать органические вещества из внешней среды, мембрана содержит десятки видов транспортных белков. Клетка с мембраной без транспортных белков обречена на голод, а транспортные белки не могут возникнуть в отсутствие мембран. Хуже того, синтез мембранных белков в современных клетках требует участия мембранного белкового комплекса SRP, который связывается с рибосомой и помогает встроить в мембрану выходящую из нее белковую цепь. Без SRP участок пептида, который должен быть в мембране и состоит из неполярных аминокислот, просто застревает на выходе из рибосомы (Mulkidjanian, Galperin, Koonin, 2009)!
Информация о мембранах LUCA сохранилась в ферментах синтеза липидов
Если сами липиды бактерий и архей сильно различаются, вплоть до полной неузнаваемости, то некоторые ферменты, участвующие в их синтезе, довольно похожи. Синтез липидов состоит из многих этапов (рис. 15.4). Сначала образуются гидрофобные хвосты. Жирные кислоты собираются из ацетил-КоА, на каждом шаге синтеза молекула жирной кислоты присоединяет один ацетильный (СН3-СО) фрагмент и вырастает на два атома углерода. Терпены тоже образуются из ацетил-КоА. На первой стадии из трех молекул ацетил-КоА образуется мевалоновая кислота, которая превращается в изопентил-пирофосфат с пятью атомами углерода. Потом из молекул изопентил-пирофосфата собираются более длинные терпены: геранил-пирофосфат, фарнезил-пирофосфат и геранилгеранил-пирофосфат, содержащие 10, 15 и 20 атомов углерода.
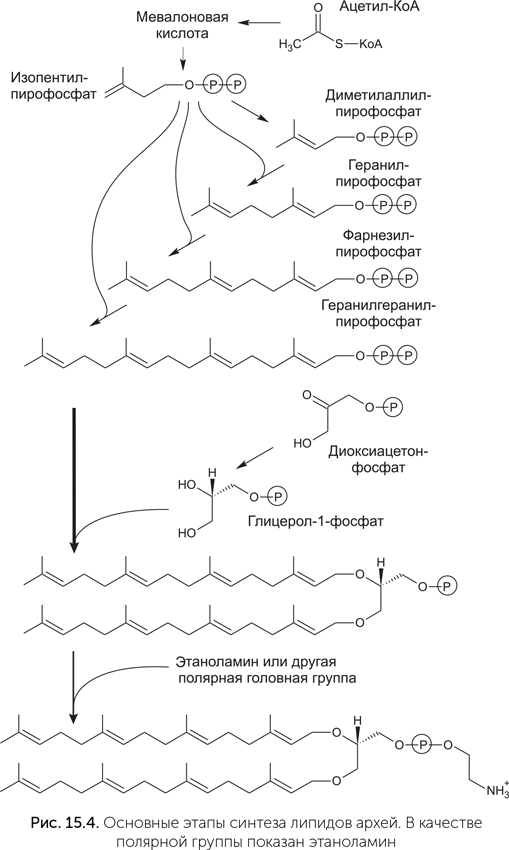
Глицерол-фосфат получается из диоксиацетон-фосфата, и затем к нему присоединяются гидрофобные хвосты. Затем к фосфатной группе прикрепляется нуклеотид цитидин-дифосфат, а на последней стадии он заменяется на полярную головную группу — холин, этаноламин, серин или инозитол.
Новая информация о мембранах LUCA появилась в 2012 году, когда несколькими группами ученых был проведен подробный анализ истории генов всех ферментов биосинтеза всех компонентов липидов бактерий, архей и эукариот (Dibrova et al., 2012; Lombard, Lopez-Garcia, Moreira, 2012).
Краткие результаты исследования приведены в таблице 15.1.
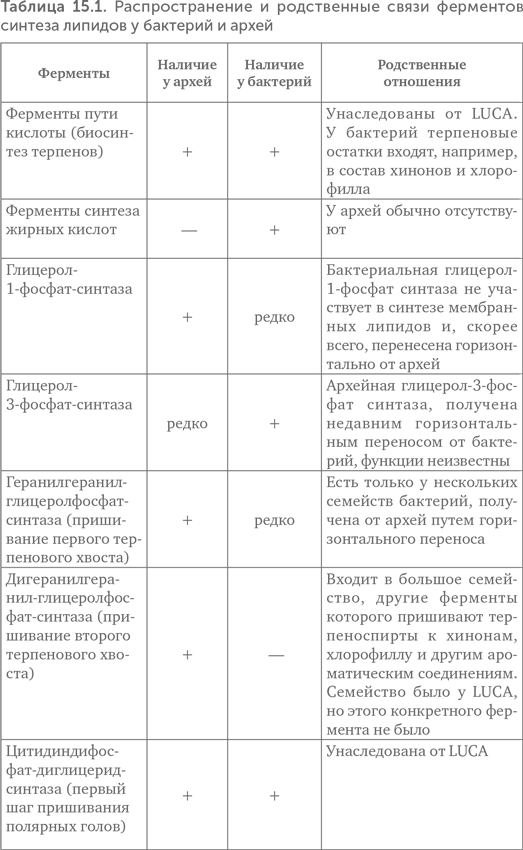

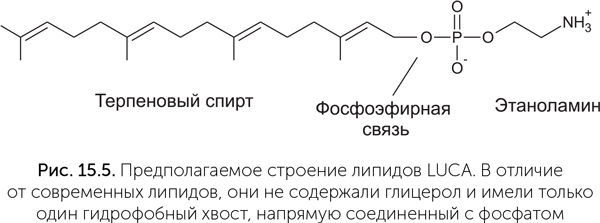
Из таблицы видно, что LUCA мог, во-первых, синтезировать терпеноспирты и, во-вторых, пришивать полярные головы к спиртам. Как синтез глицеролфосфата, так и синтез жирных кислот возникли лишь после разделения линий бактерий и архей. Следовательно, проще всего предположить, что липиды LUCA состояли из одного остатка терпенового спирта, остатка фосфата и полярной группы (серин, этаноламин или инозитол) (рис. 15.5). Подобные липиды были синтезированы искусственно. Образующиеся из них мембраны по сравнению с современными обладают высокой подвижностью, текучестью, хорошо пропускают ионы металлов и малые органические молекулы. Это позволяло древним протоклеткам поглощать готовую органику из внешней среды даже без специальных транспортных белков.
Дополнительным аргументом в пользу большей древности терпенов по сравнению с жирными кислотами в мембранах являются особенности путей синтеза тех и других. Длинные цепи жирных кислот синтезируются одним ферментным комплексом путем последовательного добавления двухуглеродных «кирпичиков» ацетил-КоА по одному. Для получения жирных кислот одинаковой длины (а следовательно, и прочной мембраны) нужны достаточно точные и совершенные ферменты. Терпены же синтезируются из более крупных пятиуглеродных строительных блоков изопентилпирофосфата, которые сначала собираются в десятиуглеродные молекулы геранилпирофосфата, а затем при помощи других ферментов — в более длинные спирты (фарнезол, геранилгераниол, кальдархеол, фитол и др.). Требования к точности и специфичности ферментов при такой крупноблочной сборке гораздо ниже.
Происхождение первых мембранных белков
Не все белки попадают в мембраны при помощи комплекса SRP. Бывают белки, которые синтезируются в одной клетке, а встроиться в мембрану должны в другой, как некоторые бактериальные токсины. Такие белки, чтобы встроиться в мембрану, используют механизм «выворачивания». Для этого белок не должен иметь участков, состоящих только из гидрофобных аминокислот. Неполярные аминокислоты, которые окажутся внутри мембраны, должны чередоваться с полярными примерно 2 аминокислоты через 2. Такой белок может выходить из рибосомы без помощи SRP и достаточно растворим в воде. Чередование «2 через 2» создает альфа-спиральные участки, у которых один бок полярный, а другой неполярный (обсуждалось в главе 13). В водорастворимой форме такой белок сворачивается неполярными участками внутрь, а попадая на мембрану, разворачивается по ней плоско. Затем его альфа-спирали могут опять собраться компактно, но уже гидрофобными участками наружу. Гидрофильные стороны спиралей образуют при этом пору в мембране, через которую могут проходить вода, ионы, полярные молекулы и даже белки и ДНК.
Мембранная электрохимия
Важнейшей функцией мембран является поддержание мембранного электрического потенциала, который используется клеткой для запасания и передачи энергии. Клеточная мембрана работает как конденсатор: ее наружная сторона несет положительный заряд, а внутренняя — отрицательный. Разность потенциалов между сторонами мембраны в активном состоянии клетки может достигать 150–200 милливольт. Напряжение, казалось бы, небольшое, но оно приложено к слою изолятора толщиной всего 10 нанометров, т.е. клеточная мембрана — хороший изолятор. Заряда этого конденсатора хватает на несколько секунд активной жизнедеятельности клетки.
Мембранные электрохимические процессы используются для синтеза основной части клеточного АТФ у большинства современных организмов. В большинстве случаев, в том числе в клетках человека, энергия для получения АТФ в конечном итоге получается в реакциях окисления сахаров и жиров кислородом, т.е. в клеточном дыхании. На первых этапах дыхания (в случае сахаров это гликолиз и цикл Кребса, мы обсуждали их в 11–1 главе) сахара расщепляются, все атомы углерода из их молекул переходят в углекислый газ, а все атомы водорода — на носители, главным образом НАД:
С6Н12О6 (глюкоза) + 6 Н2О + 10 НАД+ + 2 ФАД → 6 СО2 + 10 НАДН + 10 Н+ + 2 ФАДН2.
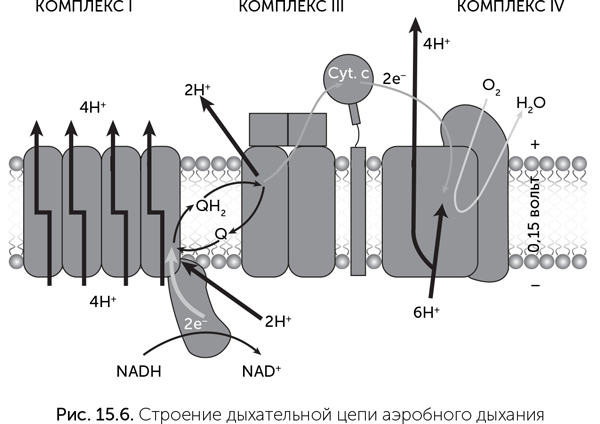
Эта часть дыхания происходит без участия мембран и кислорода. Мембраны вступают в игру на последующих этапах, а кислород — только в самом конце. Основная часть АТФ образуется благодаря работе белков так называемой «дыхательной цепи», которые находятся в мембране (рис. 15.6). Дыхательная цепь состоит из больших белковых комплексов (они называются неоригинально: комплекс I, комплекс II, III и IV) и маленьких подвижных переносчиков электронов (кофермент Q и цитохром с). Эти молекулы по цепочке передают электроны от НАДН и ФАДН2 на кислород. Основной поток электронов идет следующим путем: НАДН → комплекс I → кофермент Q → комплекс III → цитохром с → комплекс IV → кислород. Комплекс II играет вспомогательную роль, через него электроны с ФАДН2 входят в дыхательную цепь на кофермент Q.
При прохождении электронов через комплексы дыхательной цепи выделяется энергия, которая используется на откачку из клетки наружу ионов водорода — протонов (Н+). Далее протоны входят обратно в клетку через другой белок — мембранную АТФазу, которая за счет энергии протонов делает АТФ из АДФ и фосфорной кислоты.
Дыхательная цепь называется еще «электрон-транспортной цепью», потому что в ней происходит передача электронов от одних молекул к другим по цепочке.
Напряжение на мембране используется не только для синтеза АТФ, но и для транспорта нужных веществ в клетку. Поскольку на наружной стороне мембраны образуется положительный заряд, то для транспорта незаряженных молекул, таких как сахара, нужно организовать их движение в клетку совместно с протонами. Транспортный белок должен связать на наружной стороне мембраны молекулу сахара и протон, затем изогнуться или вывернуться так, чтобы сахар и протон оказались на внутренней стороне мембраны, и выпустить их внутрь клетки. Для транспорта молекул с отрицательным зарядом, таких как фосфат и нуклеотиды, вместе с каждой нужной молекулой нужно впускать в клетку несколько протонов, чтобы скомпенсировать отрицательный заряд «полезного груза».
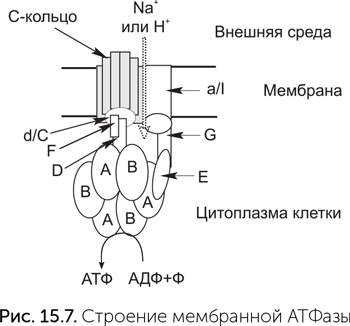
Происхождение мембранных АТФаз
Комплексы дыхательных цепей очень разнообразны, подстраиваются к условиям обитания клетки, и их гены подвержены горизонтальному переносу. Мы обсудим их происхождение в главе 17. Мембранные АТФазы же во всех клетках устроены довольно похоже. Молекулы мембранной АТФазы состоят из вращающейся части («ротор») и неподвижной («статор») (рис. 15.7). «Ротор» состоит из кольца из 8–15 мелких субъединиц С в мембране, центрального стержня из субъединиц D, d/C и F в цитоплазме. В состав статора входят боковой стержень, выступающий в цитоплазму (субъединицы E и G), и кольцо из трех А- и трех В-субъединиц. Центральный стержень ротора входит в кольцо из А и В-субъединиц, и при вращении его конец изгибает и сдвигает субъединицы А и В друг относительно друга.
Подробное видео работы АТФазы можно посмотреть по адресу: http://haa.su/Av9/.
Протоны связываются двумя карманами «статора» — по одному с каждой стороны мембраны, и чтобы пройти мембрану, они должны, связавшись с С-субъединицей, ждать поворота C-кольца на одну субъединицу. Это единственный путь от внутреннего «кармана» статора к наружному. Молекулы ATФ и АДФ связываются между A и В субъединицами цитоплазматического «статора», активный АТФазный центр образуется в контакте со статором. Чтобы из АДФ и фосфата получилась молекула АТФ, нужно движение А-субъединицы относительно соседней В-субъединицы. Это движение обеспечивает ротор за счет энергии проходящих через АТФазу протонов. На один оборот ротора каждый из трех АТФазных центров АВ-кольца создает одну молекулу АТФ. Таким образом, на один оборот молекулы через мембрану переносится от 8 до 15 протонов (по одному на каждую C-субъединицу) и синтезируется три молекулы АТФ.
Важнейшее преимущество такого преобразования энергии состоит в том, что роторная АТФаза позволяет клетке использовать для синтеза АТФ химические реакции, выделяющие мало энергии. Она синтезирует за один оборот три молекулы АТФ, а количество прошедших ионов равно числу С-субъединиц — от 8 до 15. Иначе говоря, на синтез одной молекулы АТФ приходится от трех до пяти прошедших ионов. Роторная АТФаза работает как своего рода повышающий трансформатор: достаточно, чтобы выделяющейся в химической реакции энергии хватило на перенос через мембрану одного протона, дальше из множества этих маленьких порций энергии будет собрано несколько более крупных.
Основные субъединицы АТФазы и их взаимное расположение похожи на систему секреции белков III типа (рис. 15.8). Эта общая для бактерий и архей система активно выделяет белки из клетки, развернув их в цепочку, с затратой АТФ и вращением выделяемого белка. А- и В-субъединицы статора также обладают более далеким, но достоверным сходством с хеликазами семейства Rho и белком RecA. Эти белки образуют кольца из шести одинаковых субъединиц, которые вращаются вокруг ДНК, расплетая ее с затратой АТФ (обсуждалось в главе 14). Таким образом, мембранная АТФаза происходит от древнего семейства вращающихся АТФаз с разнообразными функциями. Вероятно, сначала предковая РНК-хеликаза вступила в контакт с мембранной порой и стала работать системой экспорта РНК из протоклетки. АВ-кольцо, происходящее от хеликазы, не только проталкивало экспортируемую РНК наружу, но и крутило ее. Потом этот белковый комплекс переключился с РНК на белки и дал начало системе секреции белков III типа. Потом секретируемый белок застрял в поре этой системы секреции и стал передавать вращение, создаваемое АВ-кольцом, на С-кольцо. Для возникновения роторной АТФ-синтазы осталось только совместить вращение белка и транспорт ионов через него. В составе С-кольца системы секреции белков III типа уже есть участки связывания ионов натрия, которые помогают скреплению С-субъединиц друг с другом. Мутации бокового стержня статора могли создать проходы для этих ионов к обеим сторонам мембраны и превратить заклинившую систему секреции в роторную АТФазу.
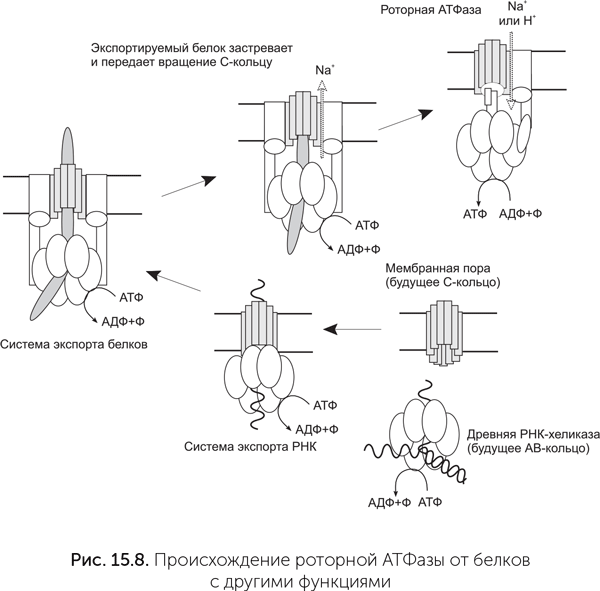
Роторные мембранные АТФазы делятся на два семейства: F и A/V. F-семейство характерно для бактерий, A/V — для архей. У организмов с клеточными ядрами, таких как животные и растения, роторные АТФазы обоих семейств встречаются в разных частях одной клетки. F-АТФазы у них обычно находятся в митохондриях, а A/V — в лизосомах и других однослойных мембранных пузырьках. Два семейства АТФаз похожи по набору субъединиц. Большинство субъединиц АТФазы одного семейства похожи и родственны аналогичным субъединицам другого семейства. Исключением является стержень ротора. Между стержнями F и A/V семейств АТФаз нет ничего общего. Поскольку стержень необходим для передачи вращения между С-кольцом и АВ-кольцом, т.е. для сопряжения ионного транспорта с синтезом АТФ, это означает, что общий предок F и A/V АТФаз мог и не быть ион-движущей АТФазой. Не исключено, что два семейства АТФаз возникли независимо из системы секреции белков, когда выделяемый белок застревал в ней и начинал передавать вращение.
Натриевая и протонная энергетика
У ряда бактерий и архей мембранные АТФазы впускают в клетку не протоны, а ионы натрия. Соответственно, у них комплексы дыхательной цепи откачивают наружу натрий вместо протонов, мембранные транспортеры и жгутики тоже работают на натрии. Первые открытые обладатели натриевой энергетики обитают в экстремальных условиях: при высокой температуре или в сильнощелочной среде, и замена протонов на натрий выглядит хорошей адаптацией к этим условиям. Однако позже были открыты бактерии с натриевой энергетикой в самых разных экологических нишах, включая морскую воду и кишечник животных. Некоторые бактерии имеют и натриевую, и протонную АТФазу, два типа комплексов электрон-транспортной цепи и в разных условиях могут переключаться между натриевой и протонной энергетикой.
На филогенетическом дереве АТФаз оказывается, что натрий-специфические ферменты занимают самые нижние ветви в обоих семействах, что указывает на их древность.
Второй аргумент в пользу древности натриевой энергетики — устройство ион-связывающих сайтов С-субъединиц. Каждый натриевый сайт образован пятью аминокислотами, атомы кислорода которых точно окружают ион натрия, заменяя молекулы воды в его гидратной оболочке. Протонные сайты же устроены очень по-разному и похожи на поврежденные мутациями варианты натриевого сайта. Причем варианты протонных сайтов хорошо согласуются с отдельными ветвями протонных АТФаз на дереве (Mulkidjanian et al., 2008).
Третий аргумент вытекает из гипотезы происхождения АТФазы на базе системы секреции. Мембранные С-субъединицы системы секреции тоже связаны друг с другом ионами натрия.
Четвертый аргумент связан с мембранными липидами. Дело в том, что мембраны из описанных в начале главы липидов, как у бактерий, так и у архей, не способны удерживать протонный градиент; протоны просачиваются через них, рассеивая энергию в тепло. Зато такие мембраны вполне герметичны для ионов натрия. Чтобы сделать мембраны герметичными для протонов, бактерии и археи добавляют в них разные специальные липиды (рис. 15.9) (Haines, 2001).
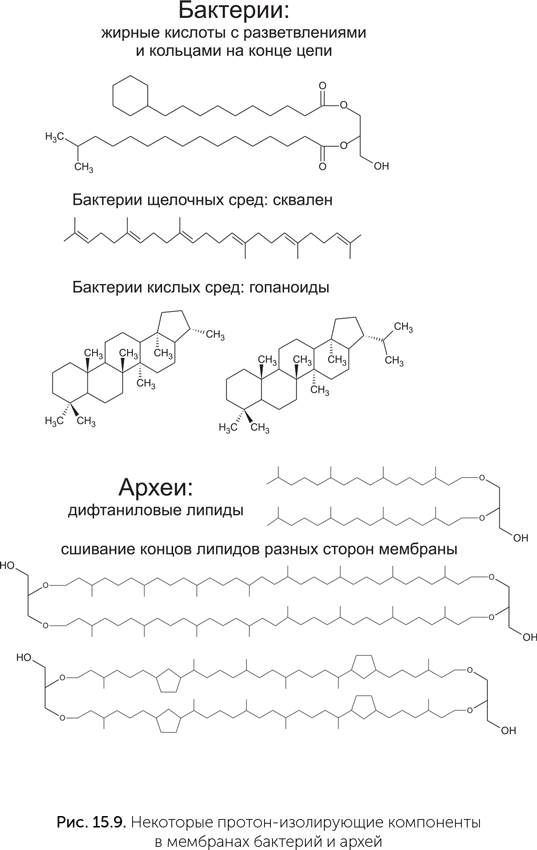
Наиболее распространены у бактерий дополнительные липиды с разветвленными концами жирных кислот. У некоторых бактерий, живущих при особо высокой температуре, таких как Bacillus acidocaldarius, на концах жирных кислот находятся еще более объемные циклогексановые кольца.
Многие группы алкалифильных (живущих в щелочных условиях) бактерий содержат в мембранах терпеновый углеводород сквален. Ацидофильные бактерии, живущие в сильнокислой среде (pH ниже 1), используют плоские циклические терпены — гопаноиды, отдаленно напоминающие стеролы эукариот. Наконец, у архей для создания протононепроницаемых мембран в дело идут дифтаниловые липиды — продукты восстановления двойных связей в обычных терпеновых липидах; кроме того, концы гидрофобных хвостов липидов двух сторон мембраны могут химически сшиваться. Проще предположить, что сначала у прокариот существовали более простые по составу мембраны, а протононепроницаемость возникла позже. Протонный энергетический цикл имеет важное преимущество по сравнению с натриевым: перенос протонов через мембрану легко сопрягается почти с любой окислительно-восстановительной реакцией. Протон-движущие комплексы электрон-транспортной цепи гораздо разнообразнее, чем натриевые. Натриевые электрон-транспортные цепи не работают, например, с молекулярным кислородом. Зато существуют не окислительно-восстановительные натриевые насосы, например пирофосфатазные и декарбоксилазные, что означает возможность мембранной энергетики без электрон-траспортных цепей.
Устройство электрон-транспортных цепей
Процесс, который биохимики называют «электронный транспорт», представляет собой упорядоченное движение электронов от молекул-восстановителей к молекулам-окислителям. Физик назвал бы это проще: «электрический ток». Мембранные электрохимические процессы в клетках отличаются от электрических явлений неживой природы тем, что в клетках переплетаются два разных электрических тока: ионный и электронный. Для ионов вода — проводник, а мембрана — изолятор, ионные токи направлены поперек мембраны через белковые молекулы. Путь электронов сложнее.
Привычный нам электрический ток — это движение электронов в металлических проводниках и полупроводниковых кристаллах. В клетках нет металлических проводов, но есть молекулы, выполняющие их функцию внутри больших белковых комплексов. Один из двух типов биологических «проводов» строится из гемов — плоских квадратных молекул с богатой системой двойных связей с атомом железа в центре (рис. 15.10). Гем известен в первую очередь как связывающая кислород «деталь» белка гемоглобина, придающая красный цвет нашей крови. Но в клетках есть множество видов других гем-содержащих белков, цитохромов, которые участвуют в переносе электронов. Цитохромы в составе комплексов электрон-транспортных цепей содержат по несколько гемов, прилегающих друг к другу краями. Цепочка гемов проводит электрический ток за счет подвижных электронов в двойных связях молекул. Ближайшим искусственным аналогом такого проводника является графен (слой графита толщиной в один атом). Второй тип внутрибелковых проводов строится из железосерных кластеров, обычно 4Fe-4S, которые подобны наночастицам полупроводящего минерала пирита (FeS2).
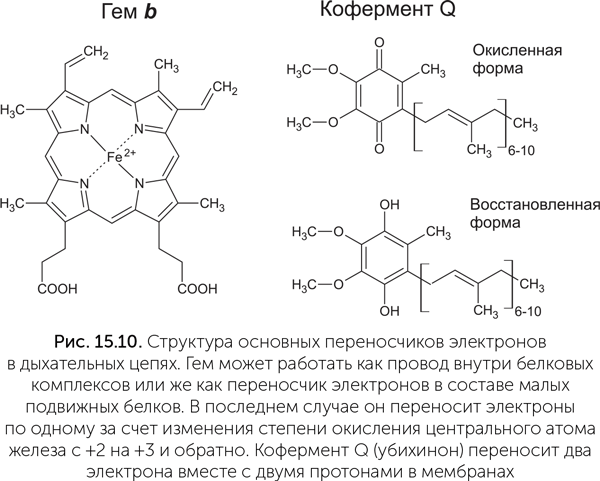
Для переноса электронов через воду нет другого пути, кроме как вместе с ионами. Например, хорошие переносчики получаются на основе металлов переменной валентности — железа и меди. В дыхательной цепи участвует цитохром c — маленький белок с одним гемом, который переносит электрон благодаря окислению и восстановлению атома железа в геме. В электрон-транспортной цепи фотосинтеза есть другой маленький подвижный белок, пластоцианин, который содержит медь.
Кроме металлов электроны могут переноситься через воду в комплекте с протонами, образуя атомы водорода. Мы уже много раз упоминали молекулы-переносчики водорода — НАД и ФАД. В мембранах есть аналогичные жирорастворимые переносчики — хиноны. Электроны попадают в дыхательную цепь клеток человека и животных в основном на НАД. Первый комплекс дыхательной цепи, НАДН-дегидрогеназа, принимает атомы водорода от восстановленного НАДН, после чего эти атомы водорода разделяются на части: электроны по железосерным проводам уходят на другую сторону белкового комплекса, а протоны просто выбрасываются в воду.
Если для ионного тока в клетке легко указать направление — поперек мембраны, то путь электронного тока описывается сложнее. Можно указать химический состав «плюса» и «минуса» его батарейки (в клетках человека это в основном кислород и НАДН), но оба полюса распределены в объеме клетки. В клеточной электрической цепи на пути от «плюса» к «минусу» чередуются большие неподвижные комплексы дыхательной цепи и маленькие подвижные переносчики. Мы можем указать только порядок молекул, между которыми по цепочке перемещаются электроны. Первый комплекс (НАДН-дегидрогеназа) имеет «разъемы» (сайты связывания) для НАДН и для хинона. Третий комплекс (цитохром bc1) имеет сайты связывания для хинона и подвижного цитохрома с. Наконец, четвертый комплекс (цитохром-с-оксидаза) имеет сайты связывания для цитохрома с и кислорода. Второй номер в этой нумерации достался вспомогательному комплексу, окисляющему янтарную кислоту и отдающему электроны на хинон. В электрической цепи он подключен параллельно первому комплексу.
Встречи больших неподвижных комплексов и маленьких подвижных переносчиков происходят благодаря тепловому движению молекул. Каждую секунду каждый комплекс дыхательной цепи сотни раз контактирует с молекулами-переносчиками электронов всех типов, какие только есть в клетке. Представьте себе электрическую цепь, в которой все соединительные провода много раз в секунду выдергиваются из своих разъемов и тыкаются обратно во все разъемы подряд. Примерно так работают электрические цепи в клетках.
Чтобы не произошло «короткого замыкания» (переноса электронов с НАДН на кислород напрямую, мимо всех или части комплексов дыхательной цепи), разные комплексы дыхательной цепи должны иметь разные, несовместимые «разъемы» под разные переносчики. Кроме того, эти «разъемы» по-разному расположены относительно мембраны: сайты связывания НАДН находятся на внутренней стороне белковых комплексов, сайты для хинона — в толще мембраны, а для цитохрома с — на внешней стороне комплексов дыхательной цепи. Цитохромные и железосерные провода обычно имеют длину порядка толщины мембраны — 10 нм. Однако бактерии семейства Desulfobulbaceae из тех же деталей строят провода вполне солидных размеров — до 1,5 см в длину. Эти нитчатые бактерии населяют морское дно и получают энергию, окисляя сероводород кислородом. Цепочки цитохромов на поверхности соседних клеток, соединенных в длинную нить, точно состыкованы друг с другом и проводят электроны по всей длине нити, позволяя бактериям использовать кислород из воды, а сероводород — из глубины осадка (Pfeffer, 2012).
Q-цикл
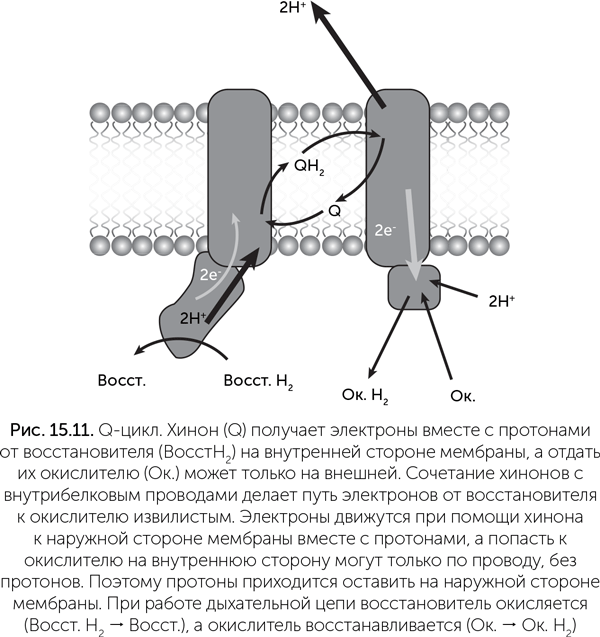
Решающее преимущество, благодаря которому протонная энергетика сильно потеснила натриевую в живом мире, — ее универсальность. Она обеспечивается тем, что для протонов (но не для ионов натрия) есть механизм переноса через мембрану, который стыкуется практически с любой окислительно-восстановительной реакцией. Он называется Q-цикл, по главной действующей молекуле — коферменту Q, или убихинону (да, это то самое вещество Q10, которое добавляют в косметику). Молекулы убихинона гидрофобны и находятся в мембранах. Кроме того, хинонное кольцо убихинона может легко присоединять и отдавать два электрона или атома водорода (рис. 15.10).
В простейшем варианте Q-цикла перенос протонов происходит за счет того, что один комплекс дыхательной цепи, отдающий электроны на хинон, имеет сайт связывания хинона на внутренней стороне мембраны, а другой, принимающий электроны, — на наружной стороне (рис. 15.11). Хинон может пройти через мембрану, только когда его электрический заряд равен нулю. Иначе говоря, в комплекте с электронами должны быть связаны протоны. Поэтому хинон присоединяет два протона из воды внутри клетки и отдает их в воду снаружи. Ни сам хинон, ни хинон-связывающие сайты ферментов не связаны непосредственно с окислителем и восстановителем, электроны проходят от восстановителя к хинону и от хинона к окислителю по внутрибелковым «проводам» из гемов или железосерных кластеров, никаких движений белковых молекул не требуется. В этой независимости и кроется секрет универсальности убихинонного цикла. Натриевые же насосы вынуждены использовать движения частей белковой молекулы для переноса ионов через мембрану и поэтому труднее перестраиваются на другие реакции.
Подводим итоги: общий предок бактерий и архей имел примитивные мембраны, вероятнее всего, с однохвостыми липидами из терпенового спирта и полярной головки, без глицерола. Эти мембраны пропускали протоны и ионы металлов, но задерживали белки и РНК, поэтому для управляемого выделения белков во внешнюю среду возникли системы секреции. После разделения линий бактерий и архей у них независимо возникли мембраны из липидов с двумя гидрофобными хвостами, непроницаемые для ионов металлов. Выход из исходных геотермальных водоемов в моря с их высокой концентрацией натрия потребовал создания систем откачки натрия из клеток. Так появились натриевые насосы, использующие энергию разных химических реакций. Один из насосов получился из системы секреции белка, в которой застрял секретируемый продукт, превратив ее в роторную Na-движущую АТФазу, и она стала откачивать натрий за счет гидролиза АТФ. Это событие могло произойти два раза независимо в линиях бактерий и архей и дать F- и A/V семейства роторных АТФаз.
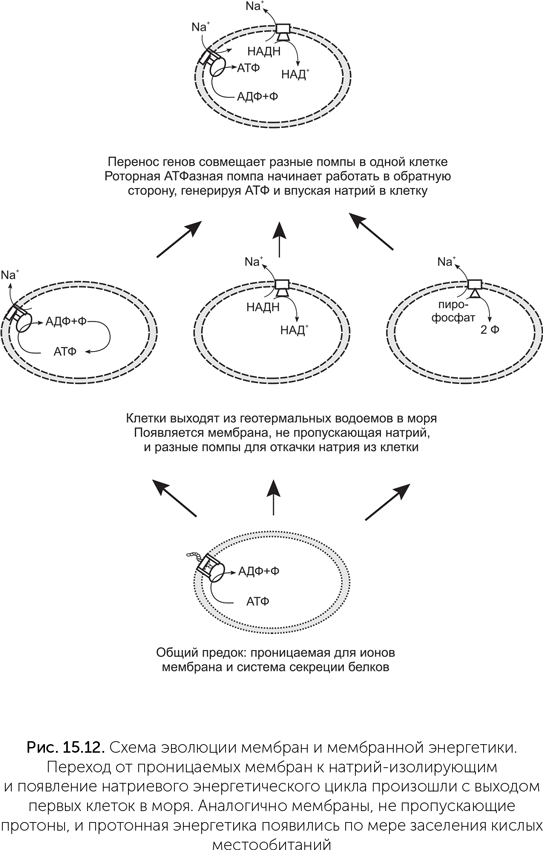
Далее горизонтальный перенос генов совместил в одной клетке разные натриевые насосы, в том числе такие, которые создавали больший потенциал, чем роторная АТФаза (рис. 15.12). В этих условиях пригодилось то, что роторная АТФаза обратима: она стала впускать натрий внутрь клетки с синтезом АТФ, и создаваемый химическими насосами натриевый потенциал начал частично расходоваться на синтез АТФ (если взять два разных электрических генератора и соединить их проводами, то тот из них, который давал меньшее напряжение, станет работать электродвигателем).
Затем, по мере освоения кислых местообитаний, появились протононепроницаемые мембраны, а мутация Na-АТФазы превратила ее в протонную. Это позволило использовать ее для откачки лишних протонов из клетки за счет энергии АТФ. Другие прокариоты для той же цели откачки лишних протонов приспособили комплексы дыхательной цепи. После этого горизонтальный перенос генов свел в одной клетке протон-движущие комплексы дыхательной цепи и протон-движущую АТФазу. Протонная энергетика благодаря универсальности Q-цикла, позволяющего легко использовать самые разные окислительно-восстановительные реакции, в значительной степени вытеснила натриевую.

