Устройство геномов, механизмы копирования и происхождение ДНК
Вся клеточная жизнь на Земле имеет общее происхождение. На это указывают сходство рибосом и, как правило, одинаковая таблица генетического кода во всех клетках. Следовательно, когда-то жил общий для них предок, который дал начало двум весьма разным группам клеток — бактериям и археям. Археи похожи на бактерии по размерам и форме клеток, но отличаются многими биохимическими особенностями. Многие археи населяют горячие источники, толщу земной коры, кислые рудничные воды и другие экстремальные местообитания. Третья клеточная линия, эукариоты (клетки с ядром) возникли позже, и мы рассмотрим их происхождение в главе 18.
Последний общий предок бактерий и архей, сокращенно называемый LUCA (Last Universal Common Ancestor), доступен для изучения методами сравнительной геномики. Поэтому о нем мы знаем намного больше, чем обо всех предыдущих стадиях развития жизни. Сравнивая последовательности генов разных современных организмов, мы можем построить родословные деревья этих генов. Чем меньше различий в последовательностях двух генов, тем позже разделились их предки. Именно таким способом, сравнивая последовательности генов рибосомных РНК, Карл Везе в 1977 году открыл архей. Точнее, ряд видов архей, конечно, был известен микробиологам задолго до 1977 года, но их биохимические особенности считались просто приспособлениями к жизни в горячих источниках. Только сравнение последовательностей рибосомных РНК показало, что отличия архей от бактерий очень глубоки и отражают древность их расхождения.
К сожалению, родословные деревья, построенные по разным генам, часто не совпадают между собой. Причин этому много, и одна из них — горизонтальный перенос генов, т.е. перемещение гена из одного организма в другой, неродственный. Часто это происходит при участии вирусов, а некоторые микробы при наступлении неблагоприятных условий сами начинают поглощать любую ДНК из окружающей среды «в надежде», что в ней окажутся гены, полезные для новых условий. Гены рибосомных РНК, судя по всему, наименее подвержены горизонтальному переносу, поэтому дерево, построенное по ним, хорошо отражает реальную историю видов.
Сравнение деревьев, построенных по разным генам, позволяет нам найти события горизонтального переноса в эволюции этих генов. Если изучаемый ген имелся еще у LUCA и с тех пор передавался только по наследству от родителей к потомкам, то его родословное дерево будет похоже на дерево клеток, от его корня будут расходиться две большие ветви бактерий и архей. Если же дерево генов имеет другой вид, то эволюционная история этого генного семейства была сложнее. Например, если его архейные гены вклиниваются на дереве между бактериальными и присутствуют у меньшинства архей — здесь можно предположить появление гена в линии бактерий и последующий его горизонтальный перенос в некоторые группы архей.
Набор генов LUCA
Сравнение прочитанных на сегодня геномов бактерий и архей показывает, что общий предок имел довольно внушительный набор разнообразных генов — более 1000 семейств. Это число соответствует уровню достаточно сложных бактерий. Удивительно, что в этот предковый набор входят гены множества разных метаболических путей, которые ныне не встречаются вместе у одного одноклеточного организма.
Что же нам говорит сравнительная геномика об истории различных клеточных систем? Большинство компонентов системы синтеза белков были уже у LUCA. Это все рибосомные РНК, 33 из 60–65 рибосомных белков и как минимум 17 из 20 аминоацил-тРНК-синтетаз. Рибосомы бактерий и архей отличаются между собой только вспомогательными рибосомными белками.
Несколько отличается история аминоацил-тРНК-синтаз — они претерпели множество горизонтальных переносов, особенно между разными группами бактерий. Аминоацил-тРНК-синтазы, по-видимому, достаточно автономны и взаимодействуют только с тРНК и неизменными аминокислотами. Но главное, что все они восходят к двум общим предкам I и II семейств, возникших еще до LUCA.
Система транскрипции (создания РНК на матрице ДНК) тоже существовала у общего предка бактерий и архей, однако ее устройство отличалось от существующей в современных клетках аналогичной системы. Центральным белком системы транскрипции является ДНК-зависимая РНК-полимераза, которая строит РНК на матрице ДНК. В современных клетках бактерий и архей гены организованы в опероны — блоки из нескольких генов, с которых читается единая матричная РНК. Транскрипция начинается на специальном участке (промоторе) в начале оперона и заканчивается на участке терминации в конце оперона. Для жизнедеятельности клеток активность разных генов должна регулироваться. Многие гены нужны только в определенных ситуациях. Например, кишечная палочка имеет гены, кодирующие ферменты усвоения молочного сахара (лактозы). Эти гены включаются (с них идет транскрипция) только тогда, когда в среде есть лактоза и нет более доступных сахаров, таких как глюкоза и фруктоза.
Регуляция активности генов происходит прежде всего на этапе начала транскрипции. Связывание РНК-полимеразы с промотором сложно регулируется с участием множества белков — транскрипционных факторов. Например, лактозный репрессор — это транскрипционный фактор, т.е. белок, который может связываться с промоторной областью лактозного оперона. Он мешает связыванию РНК-полимеразы с ДНК и не позволяет ей начать транскрипцию. Однако если в клетке есть лактоза, то лактозный репрессор связывается с ней, а не с ДНК, и РНК-полимераза может начать работу на лактозном опероне. Регуляция транскрипции на последующих этапах путем досрочного отделения РНК-полимеразы от ДНК, когда готова только часть мРНК, тоже используется, но ее роль гораздо менее значима.
Только два белка системы транскрипции унаследованы бактериями и археями от LUCA. Это ДНК-зависимая РНК-полимераза и транскрипционный фактор NusG. Он регулирует как раз досрочное отделение РНК-полимеразы. Сложные системы начала транскрипции у бактерий и архей не имеют между собой ничего общего. Следовательно, транскрипция была у LUCA, но регулировалась совсем не так, как в современных клетках.
Система репликации (так в молекулярной биологии называют копирование) ДНК у бактерий и архей устроена в общих чертах похоже, но одинаковые роли в ней играют разные, часто совершенно неродственные белки. То же относится и к системе синтеза дезоксинуклеотидов для ДНК. Мы в деталях рассмотрим сходства и различия этих систем у бактерий и архей ниже в данной главе. Это касается, прежде всего, главного участника процесса — ДНК-зависимой ДНК-полимеразы. Данный фермент у архей и бактерий отличается разительно.
Ферменты, которые делают дезоксинуклеотиды для построения ДНК, тоже, скорее всего, возникали не один раз. Существует два неродственных семейства тимидилат-синтаз, ThyA и ThyX, которые много раз подвергались горизонтальным переносам. Оба семейства есть среди бактерий, архей и вирусов, так что мы не знаем, у кого они впервые возникли.
Рибонуклеотид-редуктазы делятся на три семейства, отличающихся коферментами, механизмами реакции и чувствительностью к кислороду. Все три семейства известны у бактерий, архей, эукариот и вирусов, и часто у одного организма есть рибонуклеотид-редуктазы разных семейств. У бактерий Lactobacillus casei и Pseudomonas aeruginosa есть все три семейства, которые используются в зависимости от наличия кислорода. При этом на уровне трехмерной структуры все три семейства сходны между собой и с еще одним ферментом — пируват-формат-лиазой, разделяющей молекулу пировиноградной кислоты на ацетил-КоА и муравьиную кислоту. Так что мы не знаем, имеют ли рибонуклеотид-редуктазы единое происхождение или они несколько раз возникали из других ферментов, проводящих реакции с радикалами, например пируват-формат-лиазы.
Мы видим, что различные клеточные системы пришли к современному виду не одновременно. Устройство рибосом стабилизировалось еще до LUCA, а вот системы транскрипции и особенно репликации (копирования) ДНК пришли к современному виду уже после разделения бактерий и архей.
Геномный материал LUCA и предшествующих стадий эволюции
На основании того, что ключевые ферменты копирования ДНК у бактерий и архей не просто разные, а явно неродственные, было выдвинуто предположение, что LUCA еще обладал РНК-геномом, а переход к ДНК произошел независимо в линиях бактерий и архей (Forterre, 2006). Но эту идею трудно примирить с другими данными.
Сравнительная геномика показывает, что у LUCA было более 1000 генов. Такое количество генов общего предка бактерий и архей означает, что его геном имел достаточно большой размер, порядка 2 млн пар нуклеотидов (для сравнения: геном кишечной палочки имеет длину около 4 млн пар нуклеотидов, самый маленький геном свободноживущей бактерии Pelagibacter ubique — около 1,3 млн пар нуклеотидов). РНК-геномы современных вирусов не превышают 30 000 пар нуклеотидов, тогда как у ДНК-вирусов они достигают 2 млн пар. Размер РНК-геномов ограничен по многим причинам. Во-первых, цепь РНК подвержена самопроизвольным разрывам и еще легче разрывается ионами железа, щелочами и просто высокой температурой. Во-вторых, одно из азотистых оснований — цитозин — в воде постепенно теряет аминогруппу (дезаминируется), превращаясь в другое основание — урацил. В-третьих, при образовании шпилек в РНК нередко образуются каталитические активные участки-рибозимы, которые разрезают себя сами.
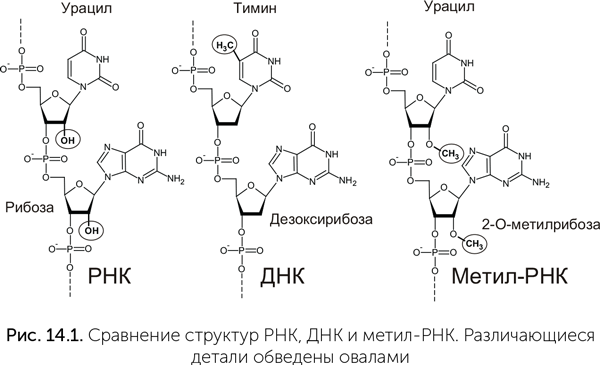
Все эти недостатки РНК устранены в ДНК. ДНК содержит дезоксирибозу, не имеющую 2' — гидроксильных групп, с которых начинается большинство реакций гидролиза (рис. 14.1). Эти же гидроксильные группы важны для каталитической активности РНК, поэтому ДНК в отличие от РНК не образует саморазрезающихся рибозимов. Наконец, вместо урацила в ДНК содержится его аналог с дополнительной метильной (СН3) группой — тимин, поэтому урацил, получившийся при дезаминировании цитозина, легко можно обнаружить и починить.
Как показано в работах Манфреда Эйгена, для поддержания структуры живой системы из поколения в поколение необходимо, чтобы среднее количество новых значимых (т.е. сильно влияющих на приспособленность) мутаций в каждом поколении не превышало одной. Все современные организмы, имеющие геномы в диапазоне от 5000 до 5 000 000 нуклеотидов (а это вирусы и бактерии), имеют частоту мутаций в пределах 0,5–1 за поколение, что ниже порога Эйгена. Животные и растения с большими геномами обошли это ограничение за счет избыточности многих генов и полового размножения (так, у человека в среднем происходит 30 новых мутаций за поколение), но вряд ли эти механизмы работали в РНК-мире. Частота мутаций складывается из двух факторов: частоты ошибок при копировании генома и частоты повреждений генома между копированиями. Точность работы РНК-зависимой РНК-полимеразы в принципе может быть достаточно высокой: в экспериментах по искусственному отбору точность РНК-полимеразы вируса желтой лихорадки была доведена до 1 ошибки на 5 000 000 нуклеотидов, что близко к точности бактериальных ДНК-полимераз (Pugachev et al., 2004). Однако уязвимость РНК к гидролизу и дезаминированию цитозина неизбежно вызывает частое появление мутаций между копированиями и ограничивает размер РНК-генома на уровне менее 100 000 пар нуклеотидов.
Реакция превращения рибозы в дезоксирибозу очень сложна и связана с образованием опасных радикалов. Рибозимы не могут ее проводить, так как будет повреждаться рибоза в их структуре. Все известные ферменты, проводящие эту реакцию (рибонуклеотид-редуктазы), — большие белки размером около 1000 аминокислот, т.е. для их кодирования нужно как минимум 3000 нуклеотидов. Поэтому между РНК и ДНК-геномами, возможно, были промежуточные стадии, более простые в получении, чем ДНК, но более стабильные, чем РНК. Одной из таких промежуточных стадий мог быть метил-РНК-геном (Poole et al., 2000). В современных рибосомных и некоторых других клеточных РНК к отдельным 2' — гидроксильным (-ОН) группам рибозы присоединены метильные (-СН3) группы (рис. 14.1, справа). Это блокирует «паразитные» каталитические процессы и защищает цепь РНК от гидролиза в метилированном месте. Метилирование РНК у архей и эукариот делается одним ферментом при помощи «направляющих» малых ядрышковых РНК (мяРНК, snoRNA). Метилированию подвергается до 1–2% нуклеотидов рибосомной РНК в клетках, а в пробирке в отсутствие мяРНК тот же фермент может прометилировать до 8% нуклеотидов. Стабильность метил-РНК генома могла отодвинуть предел Эйгена в несколько раз по сравнению с РНК-геномом, возможно, до 300 000–500 000 пар нуклеотидов.
LUCA — организм или сообщество?
Предельный размер метил-РНК-генома недостаточен для кодирования всех белков, которые были у LUCA. Что еще важнее, в наборе генов LUCA закодированы дублирующие пути обмена веществ, которые разными способами дают один и тот же продукт. В современных клетках это бывает редко, и обычно два альтернативных пути работают в разных условиях, например при наличии и отсутствии кислорода. Так, в работе Браакмана и Смита (2013) изучалась эволюция путей фиксации углекислого газа, начиная от LUCA. Авторы пришли к выводу, что у LUCA было дублирование путей фиксации CO2, причем оба пути — восстановительный цикл Кребса и ацетил-КоА-путь — работали одновременно. Они предположили, что такое дублирование обеспечивало надежность обмена веществ в условиях несовершенной регуляции генов и слабой изоляции внутренней среды организма от внешней. Но вряд ли этим можно объяснить все случаи дублирования биохимических функций LUCA.
По набору путей обмена веществ получается, что общий предок мог «в одиночку» составлять целую экосистему с замкнутыми геохимическими циклами, что практически не встречается в современной биосфере. Лишь недавно в золотой шахте на глубине свыше 2 км была найдена бактерия Desulforudis audaxviator, полностью обеспечивающая себя всем необходимым без помощи других видов (см. http://elementy.ru/news/430872), но это удивительное исключение. Иными словами, по разнообразию путей обмена веществ последний общий предок больше похож на современное микробное сообщество из многих видов, чем на любой отдельный вид бактерий или архей.
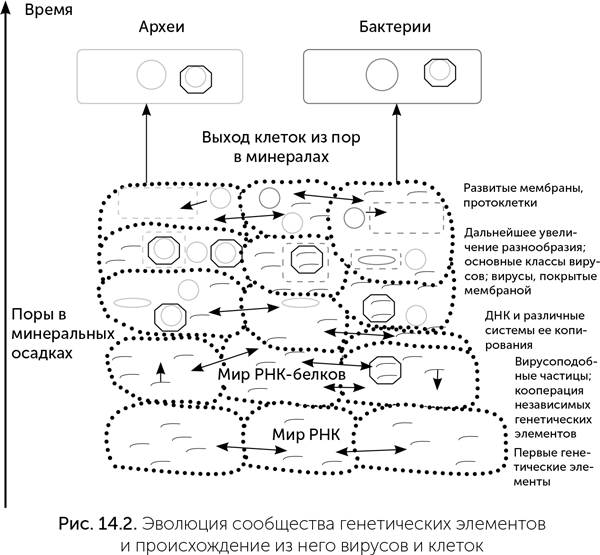
На основе этих данных выдвигались радикальные идеи относительно неклеточной природы общего предка. Например, в статье Мартина и Рассела (2007) рассматривается LUCA в виде сообщества генетических элементов, населяющих микронного размера поры в сульфидных отложениях горячих источников. Стенки в минеральных осадках разделяют протоклетки друг от друга, выполняя функцию мембран. Хотя подобная стадия наверняка была в начале эволюции РНК-мира, присутствие ряда мембранных белков в реконструированном наборе генов LUCA, например, роторной АТФазы, говорит о наличии у него мембран. В последнее время исследователи (например, Koonin, 2009) склоняются к представлению о LUCA как о сообществе молекул РНК и ДНК, обитавшем на поверхности минералов, но имевшем липидные мембраны (вопросу эволюции мембран посвящена следующая глава). Мембраны могли покрывать плоские скопления белков и нуклеиновых кислот на поверхности минерала, чтобы уменьшить их размытие в воду, а также формировать свободно плавающие мембранные пузырьки — расселительные стадии плоских «организмов-сообществ», первые объекты, похожие на клетки.
Одни генетические элементы, составлявшие эти сообщества, демонстрировали более кооперативное поведение, кодировали компоненты рибосомы и ферменты обмена веществ и в дальнейшем вошли в состав клеток. Другие паразитировали на сообществе и стали предками вирусов. Обмен генов объединял это сообщество в достаточной степени, чтобы его члены не могли эволюционировать как раздельные биологические единицы. Каждый отдельный генетический элемент такого сообщества по размеру и содержанию входящих в него генов соответствует вирусу, плазмиде или оперону в клеточном геноме (оперон — группа генов, которые выполняют общую функцию, транскрибируются в общую матричную РНК и регулируются согласованно). Сообщество этих генетических элементов соответствует по количеству и разнообразию генов современному микробному сообществу. Но элементы, похожие на современные клетки (окруженные мембраной и с геномом в виде большой молекулы ДНК, объединяющей сотни оперонов), в такой системе выделить невозможно. Клетки выделились из этой системы позднее путем объединения нескольких главных оперонов, кодирующих рибосому и систему репликации, с большим количеством подчиненных оперонов, кодирующих ферменты обмена веществ.
Такой формат генома объясняет и ситуацию с системой транскрипции LUCA, о которой мы говорили выше. В малых генетических элементах, таких как плазмиды, вирусы и митохондриальные геномы животных, часто есть один район, в котором начинается как копирование, так и транскрипция генов, и запускаются они с участием одних и тех же вспомогательных белков. Поэтому активность генов такого элемента регулируется только вместе с активностью копирования всего генетического элемента. Если нужно регулировать активность генов, не влияя на копирование, то это можно делать путем прерывания транскрипции на определенном гене, в чем и участвует имевшийся у LUCA транскрипционный фактор NusG. Кроме того, в такой системе можно регулировать активность генов при помощи РНК-переключателей в матричной РНК. РНК-переключатели — это структуры из нескольких шпилек, которые могут сворачиваться по-разному в зависимости от того, связана ли с ними какая-нибудь малая молекула. Подобный РНК-переключатель, например, регулирует гены синтеза витамина В1 у бактерий. Когда этого витамина в клетке достаточно, РНК-переключатель связывает его молекулу и меняет форму на такую, которая мешает посадке рибосомы на эту матричную РНК. РНК-переключатели встречаются и сейчас в клетках и регулируют активность многих генов вообще без участия белков.
Геном из многих отдельных молекул ДНК (хромосом) сейчас существует у эукариот — организмов с клеточным ядром. Для точного распределения копий многих молекул по дочерним клеткам при делении нужны специальные механизмы. Геном эукариот состоит из нескольких (до сотен) хромосом, и при делении клетки копии хромосом разделяются по дочерним клеткам при помощи клеточного скелета, формирующего веретено деления, и транспортных белков. Этот процесс похож на эпизод классического балета и точно так же скоординирован. Вряд ли LUCA имел что-то сопоставимое, а без специальных механизмов копии будут разделяться по потомкам случайно. Если геном состоит из десяти фрагментов и надо разделить две копии каждого по потомкам, то вероятность попадания копий каждого фрагмента в обоих потомков — меньше 1%. Большинство потомков в этом случае получит неполный набор геномных фрагментов.
Есть более простой способ передачи копий геномных фрагментов каждому потомку. У бактерий многие мелкие плазмиды (мелкие молекулы ДНК, существующие в клетке наряду с основной геномной молекулой) образуют по 10–20 копий на клетку. При делении клетки безо всяких специальных механизмов обе дочерние клетки с высокой вероятностью (99,9% при 10 копиях) получат хотя бы под одной копии плазмиды каждая. Но если таким способом делить много разнотипных плазмид, то вероятность успешного разделения всех плазмид оказывается ниже — около 99% для 10 видов плазмид, 90% — для 100 видов и 60% — для 500 видов. Количество оперонов LUCA оценивается примерно в 500, и если каждый из них в то время был отдельной плазмидой, то разделить их правильно между дочерними клетками получается далеко не всегда.
Возможно, что самостоятельные генетические элементы могли распространяться, подобно вирусам. Вирусы, выходя из зараженной клетки, упаковывают генетический материал в стойкие белковые оболочки, уплывают от места размножения и заражают новые клетки. На доклеточной стадии эволюции граница между вирусами и остальными организмами была не такой четкой, как сейчас. И будущие вирусы, и будущие элементы клеточных геномов имели сравнимые размер и сложность генома. Они отличались только стратегией поведения. Одни генетические элементы кодировали систему синтеза белков или разные ферменты обмена веществ и образовывали кооперативные сообщества, где разные гены помогали размножению друг друга. Они позже вошли в состав клеточных геномов. Другие же паразитировали на кооперативных сообществах и кодировали белки, необходимые для заражения и распространения. Благодаря интенсивному обмену генов все вирусные новшества были доступны и кооперативным генетическим элементам.
Кстати, и сейчас есть генетические элементы, которые сочетают полезные для клетки гены и почти вирусные приемы распространения. Многие бактериальные плазмиды несут полезные для клетки гены, например гены устойчивости к антибиотикам. Наряду с полезными генами у них бывает система токсин-антитоксин: два гена, кодирующие два белка. Один белок ядовит для клетки и устойчив, другой работает противоядием, но быстро разлагается. В случае потери плазмиды клетка лишится противоядия, а запас устойчивого яда ее убьет. В результате плазмида устойчиво сохраняется в клетках даже в тех условиях, когда ее гены бесполезны для клетки.
Если каждая из частей генома сама может позаботиться о своем будущем и в виде вирусоподобной частицы перепрыгнуть в те «организмы-сообщества», которые ее не унаследовали, то возможно устойчивое воспроизведение генома из десятков и сотен отдельных молекул. В этом случае даже на основе чистой РНК можно вместить в одном организме более 1000 генов. Кстати, разные части генома при этом не обязаны иметь одинаковый химический состав и механизмы копирования. С тем же успехом сегментарный геном LUCA может сочетать ДНК и РНК.
Мир вирусов и переход от РНК к ДНК
Мы видим, что история предков клеток предположительно тесно переплетена с историей вирусов. Многие биологи отказывали вирусам в праве называться «живыми» потому, что в вирусной частице нет обмена веществ. Однако споры бактерий и грибов тоже до попадания в благоприятные условия останавливают обмен веществ. Даже лягушку можно заморозить в жидком азоте с полной остановкой всех биохимических реакций, но после размораживания она оживет. Вирусная частица (вирион) — это просто покоящаяся стадия жизненного цикла вируса. Крупнейший вирусолог Патрик Фортер предлагает считать основной стадией жизни вируса его активный этап жизни, проходящий в зараженной клетке. Многие вирусы при этом образуют «вирусные фабрики» — особые структуры, сочетающие в себе клеточные и вирусные белки и собирающие новые вирусные частицы. «Вирусные фабрики» и в целом зараженные клетки («вироклетки», как предлагает их называть Фортер), естественно, имеют обмен веществ и, без сомнения, могут называться живыми. При этом они находятся под контролем вирусного генома и производят новые вирусные частицы, а не новые копии клетки, т.е. это, безусловно, живая стадия вируса.
Эволюционная биология долго пренебрегала вирусами, и лишь в последние годы они получили признание как важнейшие агенты горизонтального переноса генов, создатели принципиально новых генов и партнеры по «гонке вооружений» со всеми клеточными организмами. Эта революция подробнее описана, например, у Евгения Кунина в книге «Логика случая. О природе и происхождении биологической эволюции» (М., 2014).
Вирусы, по-видимому, существуют со времен РНК-мира. Существует огромное их разнообразие — одно- и двухцепочечные ДНК-вирусы, ретровирусы, одно- и двухцепочечные РНК-вирусы. Механизмы их репликации очень разные, и не всегда понятно, как одни могли произойти из других. Однако есть несколько характерных генов, которые встречаются во всех классах вирусов и совершенно отсутствуют в клеточных организмах. Это JRC (так называемый рулет с вареньем, jelly-roll capsid protein) — один из типов белков вирусных оболочек, хеликаза S3H, запускающая копирование разных типов вирусных геномов, и упаковочная АТФаза, переносящая ДНК и РНК в собранные белковые оболочки с затратой АТФ. Широкое распространение этих генов означает, что вирусы с древнейших времен составляли единый «вирусный мир» и обменивались между собой генами, если одновременно заражали одного хозяина.
Благодаря вирусам можно обойти еще одно сложное место на пути от РНК-геномов к ДНК-геномам. Как мы говорили выше, частота мутаций складывается из двух факторов: ошибки при копировании генома и повреждения геномных молекул между копированиями. Переход от РНК к ДНК снижает уровень повреждений между копированиями, но частота ошибок копирования в момент перехода должна возрасти! При смене типа геномного материала нужны перестройки фермента-полимеразы, который отвечает за копирование. Старая, хорошо отработанная и достаточно точная полимераза при этом неизбежно сменяется на «сырую» и недоработанную. Позже естественный отбор доведет точность новой полимеразы до совершенства, но непосредственно в момент смены РНК на ДНК отбор будет поддерживать старый геном с точной полимеразой. Закрепление замены урацила на тимин еще проблематичнее. Сам по себе тимин ничуть не лучше урацила. Он позволяет находить и исправлять дезаминирование цитозина в геноме, но для этого нужно еще несколько ферментов. Тимин в ДНК выгоднее, чем урацил, когда уже есть система обнаружения урацила в ДНК и замены его на цитозин. Но по отдельности тимидилат-синтаза бесполезна, а система замены урацила вредна, и непонятно, какой из этих ферментов мог возникнуть первым.
Патрик Фортер (Forterre, 2005; Forterre, Prangishvili, 2009) разрешает эту проблему. По его гипотезе эксперименты с новыми полимеразами велись вирусами, а первой выгодой от смены типа генома было ускользание от защитных систем хозяина. Большинство клеток и в наше время используют разные ферментативные системы, опознающие и уничтожающие вирусные ДНК и РНК. «Гонка вооружений» между вирусами и их доклеточными хозяевами могла вызвать очень быструю эволюцию геномных материалов и полимераз для их копирования. И сегодня у вирусов встречаются разнообразные геномные нуклеиновые кислоты, например ДНК с урацилом у бактериофагов PBS1 и PBS2 (Forterre, 2002). Среди вирусов известны ДНК с дополнительными модификациями нуклеотидов: гидроксиметилцитозин у бактериофага T4, гидроксиметилурацил у бактериофага SP01 и 2-аминоаденин у цианофага S-2L (Poole, Logan, 2005). Все эти странные нуклеотиды помогают вирусной ДНК избежать расщепления ферментами хозяина.
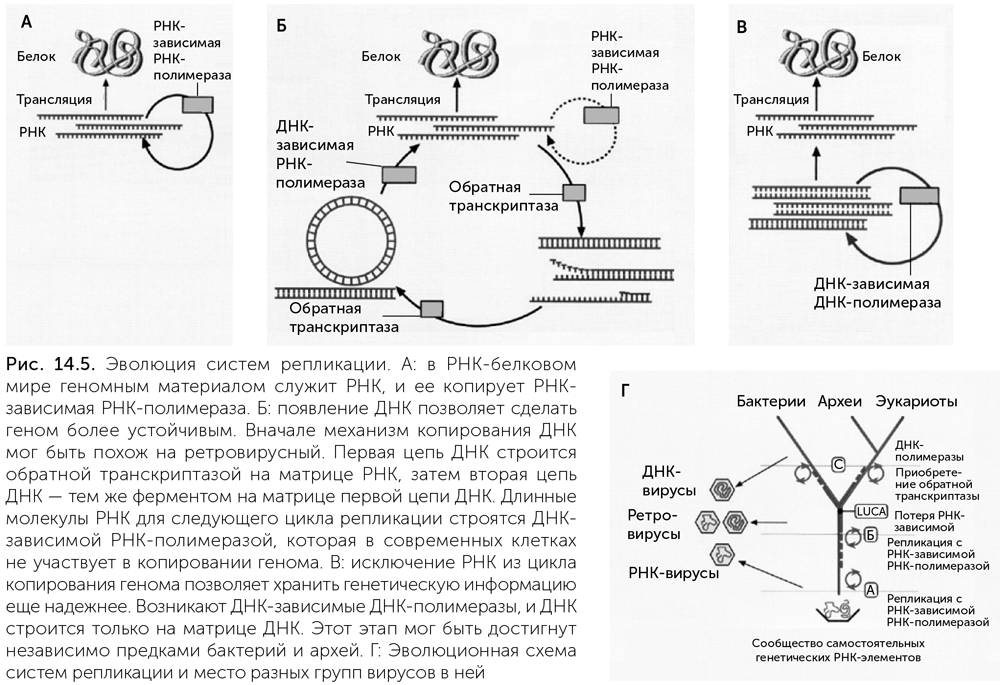
Если замена рибозы на дезоксирибозу когда-то позволила вирусу в 10 раз эффективнее заражать жертв ценой 5-кратного роста числа мутаций, то это было выгодное решение. Кроме того, малый размер вирусных геномов смягчает требования к точности копирования. А необходимость долгого автономного существования вирусной частицы без возможности исправить повреждения и без УФ-защиты минералов ужесточает отбор на устойчивость вирусного генома по сравнению с геномом протоклеток. Лишь после отработки в вирусах новые полимеразы были подхвачены их хозяевами (рис. 14.2).
Происхождение систем репликации ДНК
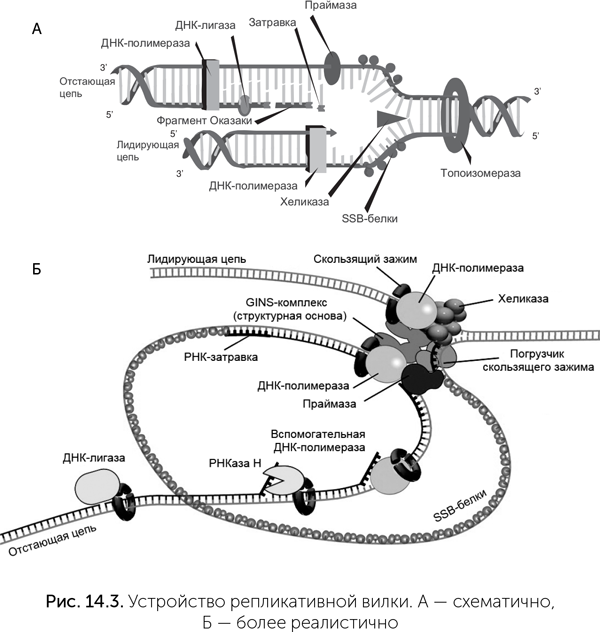
Клеточная ДНК существует в двухцепочечной форме, причем цепи направлены навстречу друг другу. Молекула ДНК-полимеразы, строящая новую цепочку по шаблону старой, всегда двигается в одном направлении — от 3` к 5` концу. Поэтому нельзя просто взять две молекулы ДНК-полимеразы и начать ими синтез двух новых цепей из одной точки двух старых цепей — молекулы ДНК-полимеразы будут двигаться в разные стороны, и большая часть генома в процессе копирования окажется в уязвимой одноцепочечной форме. Чтобы обойти эту сложность, копирование ДНК в клетках идет при помощи специальной молекулярной машины, которая называется «репликативная вилка» и состоит из более чем 20 видов белков. В этом комплексе работа нескольких молекул ДНК-полимеразы согласована так, чтобы не было длинных одноцепочечных участков ДНК.
Как работает репликативная вилка? Прежде всего, двухцепочечную ДНК надо расплести на две отдельные цепи. Это делает фермент хеликаза, молекула которого имеет форму кольца, надетого на двойную спираль ДНК. Хеликаза раскручивает двойную спираль с затратой энергии АТФ. Далее, чтобы одиночные цепи ДНК за хеликазой не соединились обратно в двойную спираль, к ним прикрепляются специальные белки, называемые SSB (single-strand binding — белки, связывающие однонитевую ДНК). После этого на матрице старых цепей ДНК полимеразы могут строить новые цепи. Поскольку цепи направлены навстречу друг другу, а репликативная вилка движется в одну сторону, то копирование двух цепей идет по-разному. Одна старая цепь, по которой репликативная вилка движется от 3` конца к 5`, называется лидирующей. Молекула ДНК-полимеразы просто строит на ней вторую цепь без каких-либо сложностей. По второй старой цепи ДНК (ее называют отстающей) репликативная вилка движется от 5` к 3` концу — в обратную сторону по сравнению с тем, как должна двигаться полимераза. Это противоречие решается через движение полимеразы скачками. Сначала ДНК-полимераза отстающей цепи движется по ней от 3` к 5` концу, строя на ней фрагмент новой цепи (эти куски получили название «фрагменты Оказаки»). Когда длина нового фрагмента достигнет 1000–2000 нуклеотидов, она прекращает синтез и совершает скачок обратно, к 3` концу, на расстояние в две длины фрагментов Оказаки, и оттуда начинает синтез следующего. Точнее, полимераза не совершает скачков, она жестко скреплена с полимеразой лидирующей цепи и другими белками репликативной вилки. Вместо этого отстающая цепь движется через репликативную вилку то в одну, то в другую сторону. Во время синтеза фрагмента Оказаки из вилки выступает все более длинная петля отстающей цепи, а потом она быстро продергивается обратно (рис. 14.3).
Такое поведение полимеразы напоминает историю попугая-контрамота из «Понедельник начинается в субботу». Попугай, который после уникального эксперимента стал жить из будущего в прошлое, сначала попался на глаза героям книги в виде трупа, на второе утро был болен и потом умер, а на третий день оказался живым и здоровым. Однако в пределах одного дня жизнь попугая шла в привычном порядке — он сначала заболел, потом умер; и летал он не задом наперед, а обычным образом.
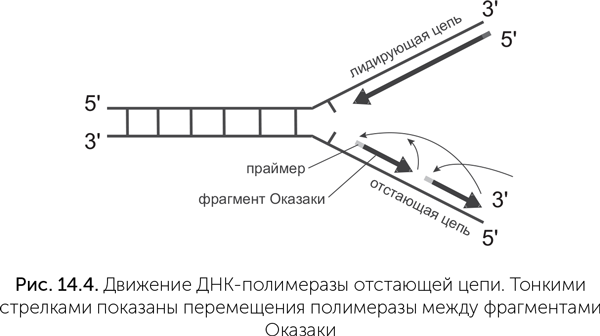
Такой способ синтеза отстающей цепи — из фрагментов Оказаки — создает свои сложности (рис. 14.4). Все ДНК-полимеразы нуждаются в затравке, или праймере — коротком фрагменте РНК, который комплементарно связан со старой цепью ДНК, и новая цепь ДНК образуется путем удлинения праймера. На отстающей цепи на каждый фрагмент Оказаки нужен свой праймер. Поэтому после работы ДНК-полимеразы новую отстающую цепь обрабатывают еще несколько ферментов. РНКаза Н удаляет РНК-затравки, а вспомогательная ДНК-полимераза вставляет ДНК на их место. Между концом одного фрагмента Оказаки и началом следующего после этого остаются «надрезы» — два соседних нуклеотида новой цепи, между которыми нет связи. Эти надрезы заделывает еще один вспомогательный фермент — ДНК-лигаза. Кроме перечисленных ферментов в репликации участвует еще несколько:
- праймазы делают РНК-затравки, с которых начинается синтез ДНК (один раз — на лидирующей цепи и на каждый фрагмент Оказаки для отстающей цепи);
- 3`–5` экзонуклеазы проверяют точность копирования за ДНК-полимеразами и удаляют неправильно вставленные нуклеотиды;
- топоизомеразы не дают ДНК запутаться в беспорядочный клубок. Эти белки совершают небольшое чудо, которое вызовет зависть у любителей шитья и вязания: пропускают одну нить ДНК через другую, так что обе нити в итоге остаются целыми;
- белок-застежка (он еще называется «скользящий зажим», или сlamp) удерживает всю конструкцию репликативной вилки на ДНК;
- репликационный фактор С (он же белок-погрузчик скользящего зажима, или Сlamp loader) с затратой энергии АТФ защелкивает его в начале репликации;
- в составе репликативной вилки могут быть структурные белки, образующие «скелет» ее конструкции, но не имеющие ферментативной активности. Например, у дрожжей и животных это комплекс GINS из четырех белков.
У вирусов можно встретить большое разнообразие систем репликации. Вирусы с большим геномом, например бактериофаг Т4 (170 000 нуклеотидов), имеют репликативные вилки, похожие на клеточные, но устроенные несколько проще. Одноцепочечные участки ДНК и РНК длиной до 10 000 нуклеотидов достаточно устойчивы, поэтому для вирусов с малыми геномами репликативная вилка не нужна. Они могут использовать самые разные варианты системы репликации. Например, механизм репликации «катящегося кольца» при помощи одной молекулы полимеразы производит длинную одноцепочечную молекулу ДНК, содержащую много линейных копий кольцевой матрицы. Потом эти копии разделяются и замыкаются в кольца при помощи ферментов рекомбинации. У ряда вирусов в качестве затравки (праймера) для начала новой цепи может использоваться не РНК, а специальный белок. Наконец, бывают ретровирусы, у которых ДНК строится на матрице РНК, а РНК — на матрице ДНК, т.е. два типа геномного материала чередуются в жизненном цикле. Более того, многие вирусы используют для своей репликации ферменты хозяина, заставляя их работать в нештатном режиме. Например, у бактериофага лямбда репликация по механизму «катящегося кольца» идет при помощи ДНК-полимеразы клетки-хозяина, в норме работающей в составе репликативной вилки. Так что контекст, в котором работают ДНК-полимеразы, может легко и быстро меняться в ходе эволюции.
Система репликации ДНК в клетках причудливо сочетает компоненты, унаследованные от LUCA, с независимо возникшими (табл. 14.1). Удивительно, что меньше всего сходства между бактериями и археями есть в самых главных компонентах репликативной вилки — ДНК-зависимой ДНК-полимеразе и праймазе. ДНК-полимеразы архей и бактерий не имеют в своей структуре ничего общего. Бактериальные праймазы родственны двум семействам хеликаз, а архейные праймазы не обнаруживают сходства ни с какими другими белками.
Другие компоненты репликативной вилки, хотя имеют сходство у бактерий и архей, но скорее всего, независимо приняли одинаковые функции. Например, работающие в репликации хеликазы всех организмов относятся к одному суперсемейству Р-петли (P-loop ATPase).Но в этом суперсемействе архейные хеликазы ближе к I семейству РНК-хеликаз, а бактериальные хеликазы — к белкам запуска репликации RecA. Проверочные 3' — 5' ДНК-экзонуклеазы относятся к одному большому суперсемейству, но архейные и бактериальные ферменты в нем ближе к разным семействам РНК-экзонуклеаз, чем друг к другу. SSB-белки бактерий и архей тоже принадлежат к одному семейству OB-укладки, куда входят различные ДНК- и РНК-связывающие белки. Однако архейные SSB-белки в пределах этого семейства ближе к аминоацил-тРНК-синтетазам, чем к своим бактериальным аналогам.
Многие вспомогательные компоненты репликативной вилки имеют общее происхождение у бактерий и архей: ДНК-лигазы, скользящий зажим, загрузчик скользящего зажима. РНКазы Н бактерий и архей тоже сходны и имеют общее происхождение, но не обязательно от LUCA. Этот же фермент есть и у ретровирусов. Он мог независимо попасть от них в клетки бактерий и архей.
Общее происхождение скользящего зажима и его погрузчика означает, что структура репликативной вилки, копирующей одновременно две цепи, могла существовать у LUCA — для более простых механизмов, например «катящегося кольца», скользящий зажим и ферменты его погрузки не требуются. Существование репликативной вилки указывает на большие геномные молекулы длиной более 100 000 пар нуклеотидов. Наличие у LUCA ДНК-лигазы и ДНК-зависимой РНК-полимеразы означает, что ДНК в какой-то форме у него уже была. Но принципиально разные ДНК-полимеразы и праймазы бактерий и архей объяснить труднее.
Возможны три основных объяснения:
1) LUCA имел обе версии системы репликации ДНК одновременно, бактерии унаследовали одну, археи — другую;
2) LUCA имел одну из современных систем репликации, в одной из двух линий потомков она была заменена на новую;
3) система репликации LUCA принципиально отличалась и от бактериальной, и от архейной, обе линии потомков ее заменили на современные варианты.
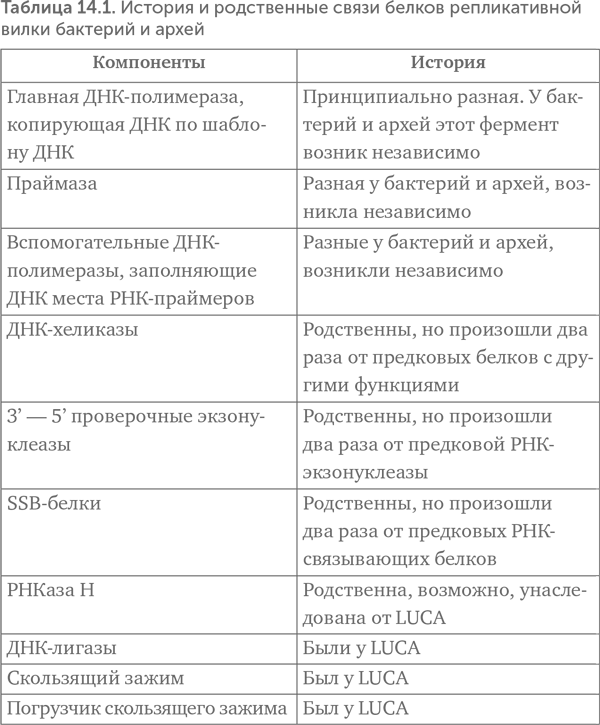
Leipe, Aravind, Koonin (1999) тогда сделали выбор в пользу третьего варианта. По их предположению, LUCA имел гетеродуплексный ДНК-РНК геном, в двухцепочечной форме которого была одна цепь РНК и вторая — ДНК. Такие двойные спирали из разных цепей называются гетеродуплексами. ДНК-РНК-гетеродуплексы прочнее, чем РНК и метил-РНК. Предполагаемый механизм репликации показан на рисунке 14.5 Б. Clamp и Clamp Loader — скользящий зажим и его погрузчик исходно могли помогать обратной транскриптазе не отделяться от копируемой цепи до окончания копирования. Нельзя, впрочем, исключить и другой вариант: у LUCA была репликативная вилка, и в ней работали вместе обратная транскриптаза и ДНК-зависимая РНК-полимераза.
Предположение о гетеродуплексном геноме LUCA легко объясняет, почему бактерии и археи имеют неродственные ДНК-полимеразы. Копировать двухцепочечную ДНК напрямую надежнее, чем через промежуточную стадию РНК, поэтому замена обратной транскриптазы на ДНК-зависимые ДНК-полимеразы была поддержана отбором в линиях бактерий и архей. Это предположение хорошо согласуется и с данными по РНК-полимеразе и ее вспомогательным белкам. Если РНК-полимераза делала молекулы РНК размером в целый геномный фрагмент, то начало и окончание ее работы должны были регулироваться не так, как в современных клетках. Казалось бы, все понятно, но последующие открытия только запутали картину.
Разнообразие и происхождение ДНК-полимераз
В работе Лейпе с соавторами не был учтен тот факт, что все клетки имеют как минимум две ДНК-полимеразы — главную и вспомогательную. Главная полимераза делает основную работу по копированию генома, а вспомогательная заполняет ДНК пустые места на месте удаленных РНК-затравок и поврежденных участков генома. У архей главная и вспомогательная ДНК-полимеразы обычно родственны друг другу и имеют похожие трехмерные структуры, а вот у бактерий две ДНК-полимеразы не похожи ни на архейных «коллег», ни друг на друга. Большинство клеточных полимераз относятся к трем семействам: PolA, PolB и PolC.
К семейству PolB относятся главные и вспомогательные ДНК-полимеразы архей и эукариот, а также подавляющее большинство вирусных ДНК-полимераз. Это семейство имеет трехмерную укладку (фолд) «ладонь и пальцы» (palm-and-fingers), которая характерна и для вирусных обратных транскриптаз, и РНК-зависимых РНК-полимераз. По всей видимости, семейство PolB имеет долгую и богатую историю репликации самых разнообразных геномов (Koonin et al., 2006).
В противоположность им семейство PolC составляют исключительно главные ДНК-полимеразы бактерий. Лишь немногие бактериофаги имеют ДНК-полимеразы семейства PolC, которые они, по всей видимости, недавно позаимствовали у своих хозяев. Трехмерная структура полимераз семейства PolC указывает на их дальнее родство с нуклеотидилтрансферазами — ферментами, достраивающими нуклеотидные цепи без помощи матрицы (Bailey et al., 2006). К ним относятся, например, ССА-трансферазы, участвующие в созревании тРНК, и полиА-трансферазы, достраивающие концы из повторяющихся адениновых нуклеотидов у матричных РНК эукариот.
Наконец, ДНК-полимеразы семейства PolA играют вспомогательную роль у бактерий и копируют геномы некоторых бактериофагов (например, Т7) и митохондрий. Их трехмерная структура отдаленно похожа на укладку «ладонь и пальцы», т.е. они произошли от той же предковой молекулы, что и PolB, но этот предок явно еще не был ДНК-полимеразой.
Кроме этих обычных семейств были обнаружены еще несколько менее распространенных. Семейство PolD найдено у многих архей, но считалось вспомогательным. Однако оказалось, что у Thermococcus геном копирует полимераза PolD, а PolB нужна лишь для ремонта разрывов ДНК (Cubonova et al., 2013). У ряда других архей PolD копирует отстающую цепь, а PolB — лидирующую. Вспомогательные полимеразы семейств PolX и PolY встречаются у отдельных представителей бактерий, архей, эукариот и вирусов. Иначе говоря, ДНК-полимеразы явно возникали в эволюции много раз из ферментов с другими функциями.
Хуже того, оказалось, что функция полимеразы может меняться очень легко. Например, вирус гепатита D копирует свой РНК-геном при помощи ДНК-зависимой РНК-полимеразы хозяина, заставляя ее «читать» РНК вместо ДНК (Macnaughton et al., 2002). У ретровирусов обратная транскриптаза (РНК-зависимая ДНК-полимераза) строит первую цепь двухцепочечного ДНК-генома на матрице РНК, а вторую — на матрице первой цепи ДНК, т.е. тоже читает и РНК, и ДНК. Тип молекулы, который полимераза может «писать», изменить чуть сложнее, но тоже легко. Замена всего двух нуклеотидов превратила ДНК-зависимую ДНК-полимеразу в РНК-полимеразу (Cozens et al., 2012).
В результате к 2015 году картина эволюции систем копирования ДНК окончательно запуталась. В 1999 году Лейпе с коллегами уверенно отвергали возможность замены одной ДНК-полимеразы в клетке на другую, потому что для этого нет очевидных причин. Данные по архейным полимеразам PolD показали, что у архей такие замены точно были, но мы не знаем их причины. Идея Фортера о вирусном происхождении клеточных ДНК-полимераз выглядит красиво и убедительно, но среди известных вирусов есть источники только PolA и PolB. Происхождение PolC от ферментов, строящих цепи РНК без матрицы, объяснить трудно. Происхождение PolD вообще неизвестно. Пока мы не узнали, какой из вариантов сотрудничества PolB и PolD у архей был исходно, трудно сказать что-то определенное про систему репликации LUCA. В рамках гипотезы о LUCA-сообществе возможно, что у него было несколько систем репликации и даже несколько типов генома (РНК, РНК-ДНК гибрид, ДНК) одновременно.
Заключение
Теперь мы можем подвести итоги. С появлением белкового синтеза первые живые системы сильно расширили свои возможности обмена веществ. Первая белковая РНК-зависимая РНК-полимераза сняла с рибозимов необходимость заниматься собственной репликацией и позволила сильно увеличить количество хранимой генетической информации. Белки также стали промежуточным звеном, создавшим возможность строить липидные мембраны. Так жизнь перешла из плоской формы прилипших к минеральной поверхности РНК к трехмерной форме — скоплениям РНК и белков во впадинах и полостях минеральных отложений, закрытых примитивными мембранами. Полная независимость от глины, сульфида цинка и других минералов тогда была еще невозможна, но появились первые структуры, похожие на клетки, — закрытые мембраной со всех сторон пузырьки, плавающие в воде. Они поначалу были расселительными стадиями плоских, сидящих на минералах протоорганизмов, геном которых состоял, по всей видимости, из множества разных молекул РНК, одно- или двухцепочечных, линейных и кольцевых. Механизмы их репликации, скорее всего, напоминали таковые у РНК-вирусов, их размер соответствовал размеру геномов РНК-вирусов, в пределах 30 000 нуклеотидов. Геномная молекула такого размера может кодировать простую систему трансляции с ее рРНК, тРНК, рибосомными белками и другими факторами.
Возможно, в протоорганизмах существовала «доминирующая» молекула РНК, кодирующая РНК-полимеразу и главные компоненты рибосомы, и многочисленные РНК-плазмиды, кодирующие ферменты обмена веществ, средства защиты и взаимодействия с внешним миром. При делении протоорганизмов эти геномные молекулы расходились не поровну и не попадали в некоторых потомков, что компенсировалось их способностью выходить наружу в виде вирусоподобных частиц и проникать в другие генетические комплексы. Наряду с «полезными» плазмидами уже тогда должен был быть весь спектр эгоистичных генетических элементов: от маленьких, ничего не кодирующих вироидов и специализированных вирусов с белковыми оболочками до внутригеномных паразитов, таких как интроны I типа и частично эгоистичных плазмид.
Вирусы в ходе «гонки вооружений» со своими хозяевами — плоскими протоорганизмами создали новые типы нуклеиновых кислот, такие как метил-РНК, урацил-ДНК и современную ДНК с тимином. Эти новые нуклеиновые кислоты были затем подхвачены протоорганизмами и позволили увеличить размер и стабильность генома. Изобретение ДНК и совершенствование механизмов ее копирования происходило параллельно в разных линиях вирусов, что привело к большому разнообразию ферментов, работающих с ДНК. Наконец, появление надежной репликации ДНК на матрице ДНК подготовило почву для объединения разнообразных генетических элементов в единые большие ДНК-геномы и последующего исхода бактериальных и архейных клеток из геотермальной колыбели в большой мир.

