Происхождение рибосом, белков и генетического кода
Важнейшим шагом на пути от мира РНК к современной клеточной жизни стало появление системы синтеза белков, основанной на генетическом коде. Мир РНК был неизбежно ограничен противоречивыми требованиями к молекулам РНК. В роли рибозимов они должны компактно и прочно сворачиваться, а в роли генетического материала РНК с той же последовательностью должны быть в вытянутом состоянии. Хотя при помощи солей, органических аминов и коротких пептидов это противоречие можно в какой-то мере разрешить, оно все равно мешает создавать большие, сложные и точные рибозимы.
Появление белков снимает это противоречие. Белки не подлежат копированию и поэтому могут сворачиваться настолько плотно, насколько это требуется для их работы в качестве ферментов. Отдельные аминокислоты и короткие пептиды использовались и в мире РНК, но революцией стало появление рибосомы и генетического кода. С этого момента открылась возможность создавать крупные белковые молекулы с нужными свойствами по инструкции, записанной в молекуле РНК.
Синтез белка в клетках
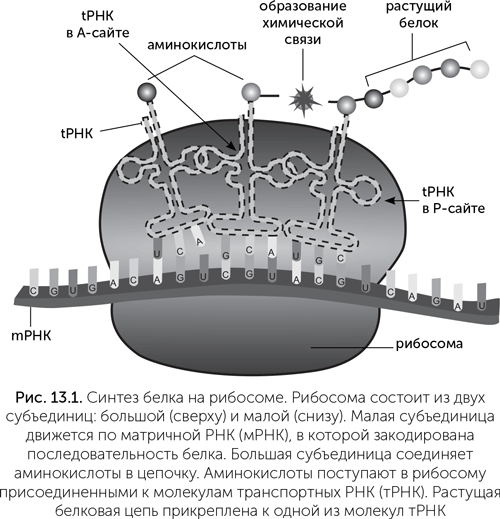
Система синтеза белка в современных клетках устроена достаточно сложно. Главная ее часть — рибосома, наномашина, которая соединяет аминокислоты в пептидные цепи по инструкции, закодированной в матричной РНК (рис. 13.1). Рибосома состоит из трех молекул РНК общей длиной до 5000 нуклеотидов и примерно 70 белков. Кроме того, для работы рибосомы нужна система подачи активированных аминокислот, которая включает в себя примерно 40 типов транспортных РНК, 20 типов ферментов — аминоацил-тРНК-синтетаз, каждая из которых присоединяет «свою» аминокислоту к нужной тРНК, и еще десяток вспомогательных белков — факторов инициации, элонгации и терминации.
Неизвестны более простые варианты этой системы, способные проводить синтез белка, хотя бы с меньшей точностью и скоростью. Поэтому сторонники «теории разумного замысла» (современной версии креационизма, утверждающей, что системы «определенной сложности» не могли возникнуть без вмешательства Творца) считают белковый синтез одним из примеров системы, полезной только в полном виде, а ее развитие шаг за шагом — невозможным. Но ученые нашли следы постепенного возникновения компонентов этой сложной системы.
Как мы обсуждали в главе 10, ряд витаминов возник еще в эпоху мира РНК, до появления белков. Аминокислоты химически более разнообразны, чем нуклеотиды, и до появления белков они могли участвовать в функционировании РНК-мира в том же статусе, что и витамины: как вспомогательные группы, пришитые к молекулам РНК. Таким образом, рибозимы с функцией аминоацил-тРНК-синтетаз, т.е. способные прикреплять аминокислоты к тем или иным РНК, могли быть востребованы задолго до появления белкового синтеза. Такие рибозимы получены в ходе экспериментов по искусственному отбору каталитических РНК, и по скорости и точности работы они практически не уступают белковым аминоацил-тРНК-синтетазам.
Механизмы синтеза белка и генетический код
Последовательность всех белков закодирована в последовательности ДНК. В состав белков входит 20 разных аминокислот, а в ДНК — только 4 нуклеотида. Надо как-то сопоставить эти два алфавита друг с другом.
Из 4 типов нуклеотидов можно составить 16 разных двоек или 64 тройки. Поэтому, чтобы закодировать все разнообразие аминокислот, приходится использовать по три нуклеотида на одну аминокислоту. Тройка (триплет) нуклеотидов, кодирующая одну аминокислоту, называется «кодон». В клетках обычно с последовательности ДНК, кодирующей белок, делаются временные копии — матричные РНК (мРНК). Этот процесс называется «транскрипцией». Затем рибосома связывается с матричной РНК, движется по ней и собирает белок в соответствии с последовательностью матричной РНК. Работа рибосомы с мРНК называется «трансляцией».
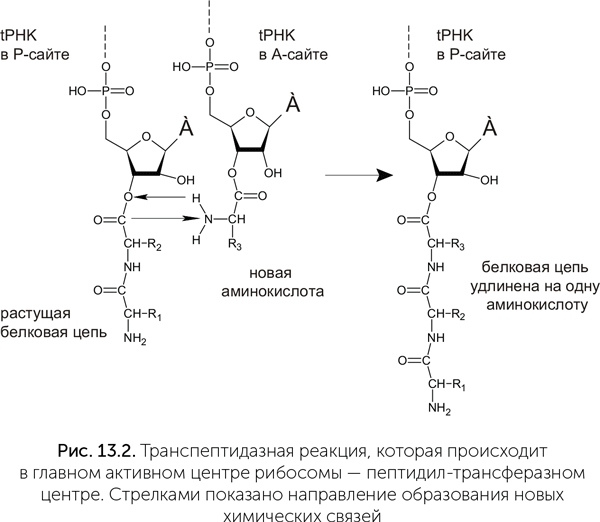
Как рибосома переводит кодоны матричной РНК в аминокислоты? В этом ей помогают специальные адаптеры, или переходники — транспортные РНК (тРНК). Один конец тРНК связывается с аминокислотой (акцепторный стебель, рис. 13.2), а другой — с кодоном (антикодон — три нуклеотида на конце антикодоновой петли).
Соответствие транспортных РНК и аминокислот обеспечивается работой специальных ферментов — аминоацил-тРНК-синтетаз. В клетках, как правило, есть 20 типов аминоацил-тРНК-синтетаз, каждая из которых узнает одну аминокислоту и соответствующие ей транспортные РНК и соединяет их.
В рибосому аминокислоты поступают только в связанном с тРНК виде (аминоацил-тРНК). Рибосома не может проверить соответствие аминокислоты и тРНК и полностью полагается в этом вопросе на аминоацил-тРНК-синтетазы. Рибосома проверяет только соответствие тРНК и кодонов матричной РНК.
В структуре рибосомы есть два «кармана» для связывания транспортных РНК. Они называются «А-сайт» и «Р-сайт». Новая тРНК, несущая аминокислоту, входит сначала в А-сайт. В Р-сайте в это время находится предыдущая тРНК, к которой прикреплена недостроенная белковая цепь. В глубине обоих «карманов» проходит матричная РНК. Для прочного связывания транспортных РНК в А-сайте и Р-сайте надо, чтобы антикодон тРНК составил три комплементарные пары с кодоном мРНК. Если в А-сайт вошла правильная тРНК (ее антикодон соответствует кодону мРНК), то дальше аминокислота на ее конце реагирует с белковой цепью на тРНК в Р-сайте. Происходит транспептидазная реакция: белковая цепь переносится с тРНК в Р-сайте на аминокислоту на тРНК в А-сайте (рис. 13.1). После этого «пустая» тРНК выходит из Р-сайта, а рибосома делает шаг по матричной РНК. При этом мРНК продвигается на один кодон, а тРНК с белковой цепочкой из А-сайта перемещается в Р-сайт. Дальше рибосома опять может принять аминоацил-тРНК в А-сайт и повторить свой рабочий цикл.
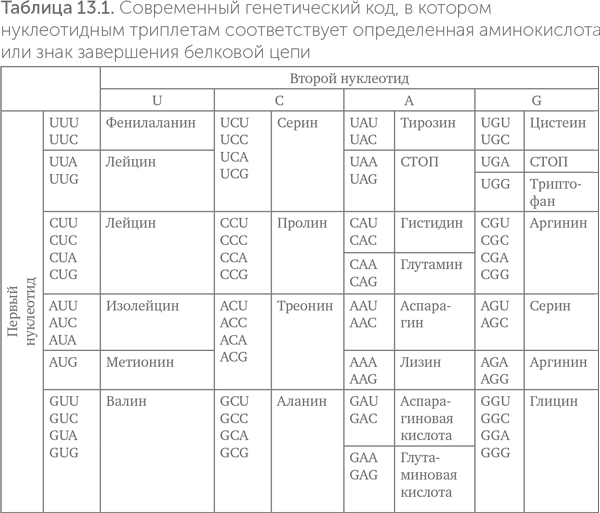
Правило соответствия 64 кодонов и 20 аминокислот называют «генетическим кодом» и обычно записывают в виде таблицы (табл. 13.1). Подобные таблицы соответствия между двумя алфавитами давно применялись в практике шифрования. Те читатели, чья работа связана с компьютерами, вспомнят таблицы компьютерных кодировок — ASCII, Win1251, UTF-8 и другие. Таблица ASCII, например, связывает 128 букв латиницы, цифр и других символов со 128 группами по 7 бит (нулей или единиц).
Если в компьютерных кодировках каждому символу соответствует только одна комбинация бит, и наоборот, то в генетическом коде многим аминокислотам соответствуют несколько кодонов. Например, для глицина есть четыре кодона: GGU, GGC, GGA, GGG. Это свойство генетического кода называется «вырожденность».
Кроме 20 аминокислот генетический код содержит знаки начала и конца белковой последовательности. Знаки конца белка называются «стоп-кодонами», их три: UAG, UAA и UGA. Знак начала одновременно служит кодоном метионина — AUG.
Для чтения 61 кодона аминокислот, казалось бы, нужен 61 тип тРНК. Реально во многих случаях одна тРНК может распознавать сразу два похожих кодона одной аминокислоты. Поэтому в клетках содержится менее 61 типа транспортных РНК, например, 49 — у человека и 41 — у кишечной палочки.
Происхождение транспортных РНК
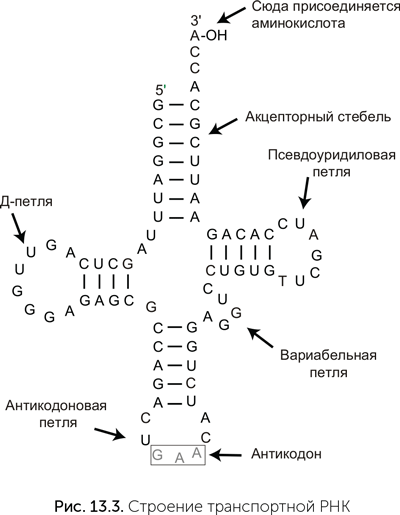
Транспортные РНК (тРНК) — скорее всего, самая древняя деталь системы синтеза белка. Все эти небольшие (обычно 76 нуклеотидов длиной) молекулы имеют одинаковую пространственную укладку с четырьмя двухспиральными участками, которая на плоскости изображается в виде клеверного листа (рис. 13.3). На «черешке» у всех тРНК есть свободный одноцепочечный фрагмент ССА (цитозин-цитозин-аденин), к которому прикрепляется аминокислотный остаток.
Но эти «клеверные листы» используются не только в производстве белков. Как выяснилось, тРНК-подобные структуры участвуют в копировании геномов РНК-вирусов. Такая структура есть, например, на конце одноцепочечного РНК-генома бактериофага Qβ, причем для его узнавания вирусная РНК-полимераза нуждается в помощи бактериальных белков, в норме связывающих транспортные РНК (Weiner and Maizels, 1987). В РНК-вирусах растений встречаются еще более точные аналоги — например, тРНК-подобную структуру из вируса желтой мозаики турнепса узнают бактериальные ферменты, работающие с собственными бактериальными тРНК (Joshi et al., 1984)! Другие вирусы, например, вирус мозаики цветной капусты, используют клеточные тРНК как затравки для синтеза первой цепи ДНК на матрице РНК (Hohn et al., 1985).
У этих и других вирусов создание новой цепи РНК всегда начинается с двух гуаниновых нуклеотидов, комплементарных двум цитозинам в одноцепочечном ЦЦА-участке тРНК-подобной структуры (рис. 13.2). Гуанин в данном случае выбран, скорее всего, потому, что он образует больше всего водородных связей как с другой цепью РНК, так и с молекулой фермента. Таким образом, аденин на самом конце РНК-матрицы не будет скопирован и должен быть достроен отдельно.
И в самом деле, различные вирусные РНК-полимеразы (например, бактериофага Qβ) и даже клеточные ДНК-полимеразы, доходя до конца матричной цепи, добавляют на конце растущей цепи один лишний аденин. Это особенно странно для бактериальных ДНК-полимераз, которые копируют кольцевые ДНК и в норме никогда не сталкиваются с концом матричной цепи. Еще одна странность проявляется в процессе созревания тРНК: сначала специальный фермент РНКаза Р обрезает концы незрелых транспортных РНК, удаляя в том числе нуклеотиды ССА, а потом ССА достраиваются обратно другим ферментом — нуклеотидилтрансферазой.
Из всех этих фактов участия тРНК-подобных структур в репликации была построена гипотеза «геномной метки» (genomic tag hypothesis). Подробное изложение см. в сборнике «RNA World» (Cold Springs Harbor press, 1999).
Эта гипотеза утверждает, что в РНК-мире тРНК-подобные «клеверные листы» появились на концах геномных молекул. Они служили местом начала копирования и защитными концевыми структурами генома. Из-за этого появились и ферменты для достройки ССА-участков, и функция добавления неспаренного концевого аденина различными полимеразами. У тех молекул, которые должны были работать рибозимами и не участвовать дальше в копировании, фермент — предшественник РНКазы Р отрезал «клеверный лист». Этот фермент и по сей день имеет в своем составе маленькую РНК-молекулу, что говорит о том, что он очень древний. Отрезанные «клеверные листы» накапливались, и в какой-то момент для них нашлась новая функция: они стали служить адаптерами для прикрепления аминокислот к рибозимам, причем аминокислоты пришивались к ССА-хвосту, а для связывания с рибозимами служили другие участки молекулы, в том числе будущая антикодоновая петля (Szathmáry, 1993).
Итак, вспомогательные молекулы белкового синтеза изначально имели другие функции и могли возникнуть раньше, чем рибосомы. Но как могла появиться сложно устроенная рибосома из десятков взаимосвязанных, подогнанных друг к другу молекул? Допустим, что первая рибосома обходилась без белков (на эту возможность намекает тот факт, что присоединение новой аминокислоты к цепочке до сих пор катализируется РНК). Но рибосомные РНК сами по себе очень сложны.
История рибосомных РНК
Изучение структуры рибосомной РНК (рРНК) показало, что она могла быть построена постепенно, путем добавления новых блоков к уже существующим. Рибосомная РНК большой субъединицы состоит из шести относительно самостоятельных структурных блоков, или доменов (отмечены римскими цифрами на рис. 13.4). Структура каждого домена определяется прежде всего связями внутри него.
В рибосоме домены образуют что-то вроде трехмерного пазла. Причем собрать этот пазл, не ломая детали, можно только в одном порядке, начиная с пятого домена. Это наводит на мысль, что пятый домен древнее всех остальных.
Подозрения подтверждаются, если изучить распределение одного из типов связей между участками РНК, так называемых А-минорных контактов. Это музыкальное название обозначает водородные связи между несколькими последовательными аденинами в одноцепочечном участке и гидроксильными группами рибозы в двухцепочечном участке. Такая связь важна для устойчивости одноцепочечного участка, но не влияет на двухцепочечный, поэтому она могла возникнуть, только если одноцепочечная сторона А-минорного контакта возникла позднее, чем двухцепочечная.
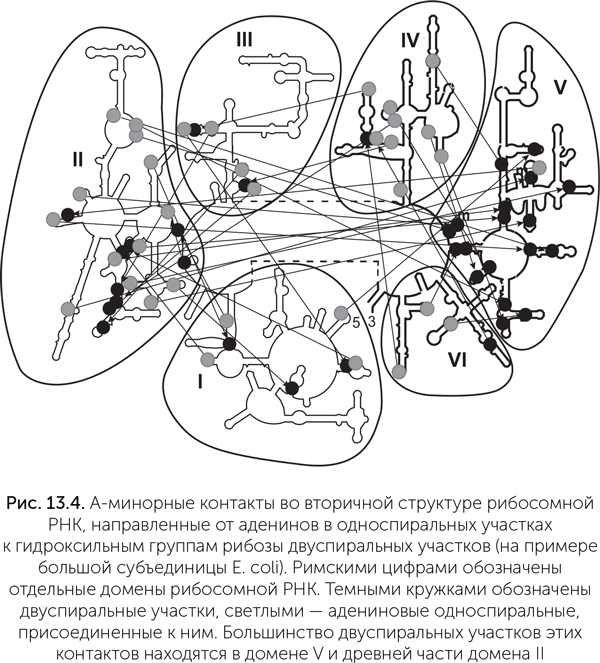
На рисунке 13.4 мы видим распределение таких контактов в большой рибосомной РНК кишечной палочки. Видно, что большинство контактов направлены к пятому домену. Это означает, что пятый домен был древнейшим, а остальные части рибосомной РНК надстроились позже (К. Боков, С. Штейнберг, 2009). Некоторые ученые пришли к аналогичным выводам, используя другие признаки: с удалением от пятого домена, в котором находится пептидил-трансферазный центр (именно там и производится присоединение одной аминокислоты к другой в цепочку), уменьшается содержание ионов магния, увеличивается доля белков и повышается упорядоченность их укладки, а в самом пептидил-трансферазном центре белков нет вовсе (Hsiao еt al., 2009). Недавно эти эволюционные реконструкции получили экспериментальное подтверждение: была синтезирована рибосомная РНК длиной 615 нуклеотидов (в 5 раз меньше, чем в обычных бактериальных рибосомах), состоящая из целого пятого домена и древних фрагментов второго и четвертого доменов. Она оказалась способна к взаимодействию с транспортными РНК и к проведению пептидил-трансферазной реакции (Hsiao et al., 2013).
Современные рибосомы состоят из двух субъединиц. Если большая непосредственно сшивает аминокислоты, то малая субъединица организует взаимодействие транспортной РНК с матричной, контролирует соответствие кодона антикодону, первой садится на матричную РНК и ищет место начала синтеза белка, а также двигает матричную РНК через рибосому. Молекулы транспортных РНК одним концом (акцепторный стебель) связываются с большой субъединицей, а другим (антикодоновая петля) — с малой.
Когда методы определения возраста доменов рибосомной РНК были применены к малой субъединице, результат оказался похож на тот, что мы видели для большой: древнейшей частью молекулы оказался декодирующий центр, в котором происходит связывание антикодоновой петли тРНК с матричной РНК и считывание последовательности матричной РНК. В обоих рибосомных РНК участки, отвечающие за связь субъединиц между собой, моложе, чем пептидил-трансферазный и декодирующий центры (Harish & Caetano-Anolles, 2012).
Получается, что две субъединицы рибосомы сначала существовали по отдельности и только потом объединились. Как могла работать древняя большая субъединица рибосомы без белков и без части доменов рРНК? На пятом домене находится пептидил-транферазный центр рибосомы — он присоединяет новые аминокислоты к растущему полипептиду. Однако этот домен не умеет связываться с матричной РНК и потому никак не может выстроить последовательность аминокислот в цепочке белка. Получается, что древняя большая субъединица рибосомы собирала пептиды из аминокислот без участия матричной РНК и использовала какие-то другие механизмы для контроля их последовательности. Дальше в этой главе мы рассмотрим, какие это могли быть пептиды и какими способами рибосома могла контролировать их последовательность до появления матричных РНК.
РНК малой субъединицы тоже вела какую-то свою, самостоятельную жизнь до того, как войти в состав рибосомы. Исследователи склоняются к тому, что раньше она работала в качестве РНК-полимеразы или РНК-лигазы, то есть строила новые молекулы РНК из отдельных нуклеотидов или из коротких фрагментов по несколько нуклеотидов. Ее современные функции — движение по матричной РНК и контроль комплементарности кодона с антикодоном — близки к функциям полимераз. Полимеразы тоже движутся по копируемой нити РНК и контролируют комплементарность присоединяемого нуклеотида (Noller, 2010). Так что, похоже, малая субъединица вошла в состав рибосомы, когда происходил переход к белкам, кодируемым при помощи матричных РНК
История генетического кода
О дальнейших этапах развития синтеза белков нам может рассказать таблица генетического кода (табл. 13.1).
Существуют четыре основные идеи происхождения связи между аминокислотами и нуклеотидными триплетами. Это теория «застывшей случайности», теория оптимизации на минимум ошибок белкового синтеза, теория структурного соответствия аминокислот кодонам («ключ-замок») и теория коэволюции кодонов и путей биосинтеза аминокислот (Koonin, Novozhilov, 2009).
Первая теория («застывшей случайности») заявляет, что соответствие аминокислот и кодонов когда-то установилось случайно, а потом таким и осталось, потому что любое изменение нарушит структуру сразу многих белков и приведет к гибели клетки. Очевидно, это почти ничего не объясняет.
Вторая, теория оптимизации, утверждает, что генетический код устроен так, чтобы при самых частых ошибках рибосомы аминокислоты заменялись на максимально похожие. Рибосома иногда допускает неточное соответствие кодона мРНК антикодону тРНК, что приводит к включению в белок неправильной аминокислоты. Эти ошибки следуют своим закономерностям: ошибка в третьем нуклеотиде вероятнее, чем в первых двух; перепутать два нуклеотида одного размера (A с G или U с C) проще, чем большой с маленьким (например, А с С).
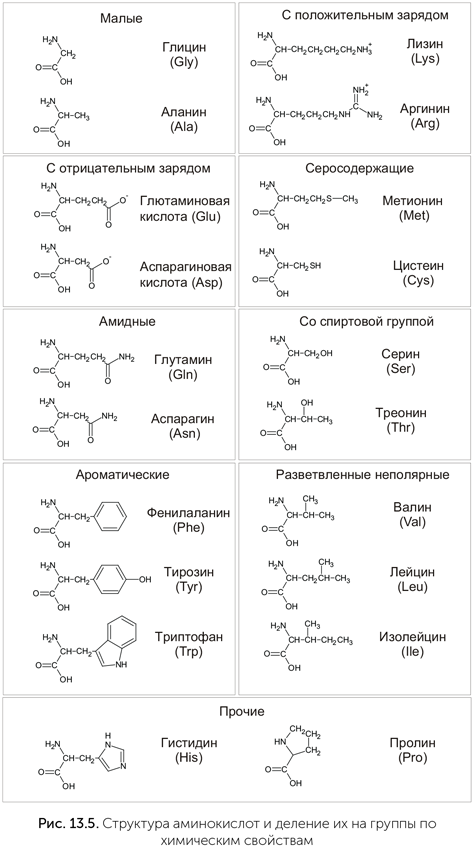
Как видно из таблицы генетического кода, многие аминокислоты кодируются четырьмя кодонами — последний нуклеотид часто не важен вовсе. Но там, где последний нуклеотид играет роль в выборе аминокислоты, ошибка в нем обычно не так опасна, как могла бы быть в других вариантах генетического кода. Из 20 аминокислот стандартного набора (рис. 13.5) очень мало по-настоящему уникальных. Большинство аминокислот образуют группы из нескольких сходных по размеру и химическим свойствам. Например, валин, лейцин и изолейцин похожи друг на друга, и замена одной из этих трех аминокислот на другую, скорее всего, не испортит белок. Аналогично похожи и во многих случаях взаимозаменяемы аспрагиновая и глутаминовая кислоты, и их кодоны отличаются только в последнем нуклеотиде.
Подсчитано, что стандартный генетический код по устойчивости к ошибкам входит в 0,1% лучших из возможных, но он не самый лучший. Например, кодон триптофана, UGA, проще всего перепутать с UGG (A либо G в третьем нуклеотиде). UGG является стоп-кодоном, т.е. служит «знаком препинания» для обозначения конца белка в матричной РНК. Если перепутать его с UGA, то вместо завершения белковой цепи к ней присоединится лишний триптофан, а за ним еще какое-то количество лишних аминокислот, пока рибосома не встретит следующий стоп-кодон. Если же произойдет путаница в другую сторону, то вместо вставления триптофана произойдет завершение синтеза белка и получится ошибочный укороченный белок. Поэтому, если стоп-кодон UGA станет кодировать триптофан, помехоустойчивость кода возрастет.
Именно такие изменения кода происходят в малых геномах, например геномах митохондрий (подробнее в главе 18). Так что на формирование стандартного генетического кода влияли и другие факторы, кроме отбора на минимум ошибок. Теория структурного соответствия («ключ-замок») утверждает, что молекулы аминокислот соответствуют по форме кодонам (или антикодонам) РНК, подобно тому как ключ подходит к замку. Благодаря такому соответствию формы кодоны (или антикодоны) способны специфически связывать «свои» аминокислоты, и это взаимодействие дало начало генетическому коду. Действительно, в экспериментах по отбору РНК, хорошо связывающих определенную аминокислоту, в ряде случаев полученные молекулы были обогащены как кодонами, так и антикодонами этой аминокислоты. Самое сильное связывание между аминокислотами и их кодонами наблюдалось для аргинина, изолейцина, гистидина, триптофана и фенилаланина. Все эти аминокислоты относятся к крупным и сложным и, вероятно, появились в составе белков позже, чем самые простые аминокислоты, такие как глицин, аланин, серин и аспарагиновая кислота. К сожалению, так и не удалось создать РНК, связывающие эти простые и древние аминокислоты.
В интересном варианте этой теории рассматривается не просто взаимодействие РНК с аминокислотой, но учитывается еще минеральная подложка, к которой прилипает РНК (Mellersh, 1993). На поверхности смектита и некоторых других глинистых минералов РНК принимает форму зигзага, при этом образуются «карманы», подходящие по размеру для молекул аминокислот и ограниченные с разных сторон тремя нуклеотидами (рис. 13.6). При высыхании зигзаг РНК меняет форму так, что аминокислоты в соседних «карманах» сближаются и могут соединиться пептидной связью.
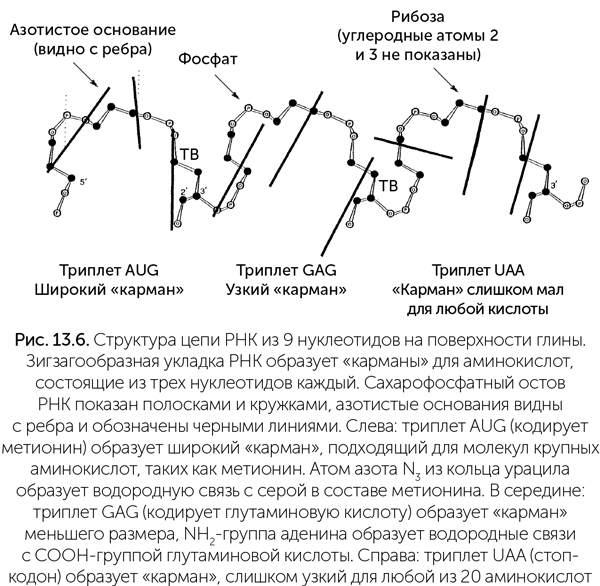
Форма «карманов» зависит от составляющих их нуклеотидов, особенно от первых двух. Молекулярное моделирование показывает, что большинство троек нуклеотидов составляют «карман», наиболее подходящий для той аминокислоты, которая кодируется этой тройкой в стандартном генетическом коде. Триплеты УАА, УАГ, УГА образуют слишком тесные «карманы» для любой аминокислоты, поэтому стали стоп-кодонами.
Хотя Меллерш, автор этого варианта теории, считал, что аминокислоты связывались напрямую с древней матричной РНК, точно такие же «карманы» могли быть на конце древних транспортных РНК, коль скоро древняя жизнь была связана с минеральными поверхностями.
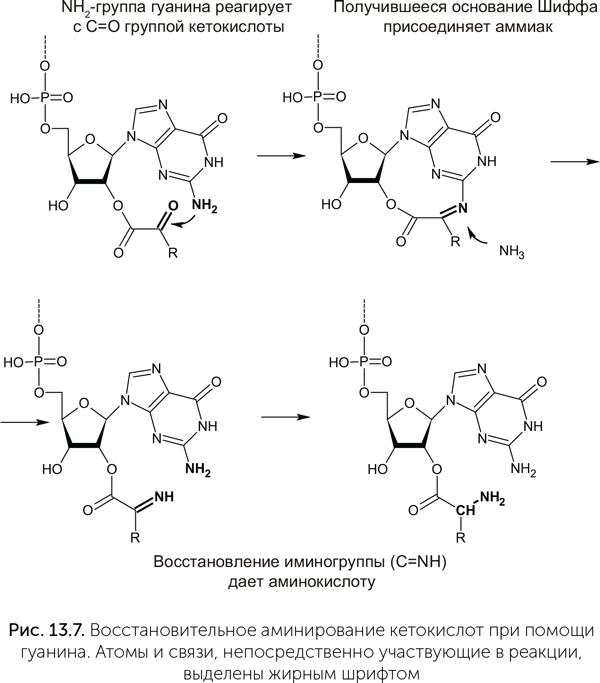
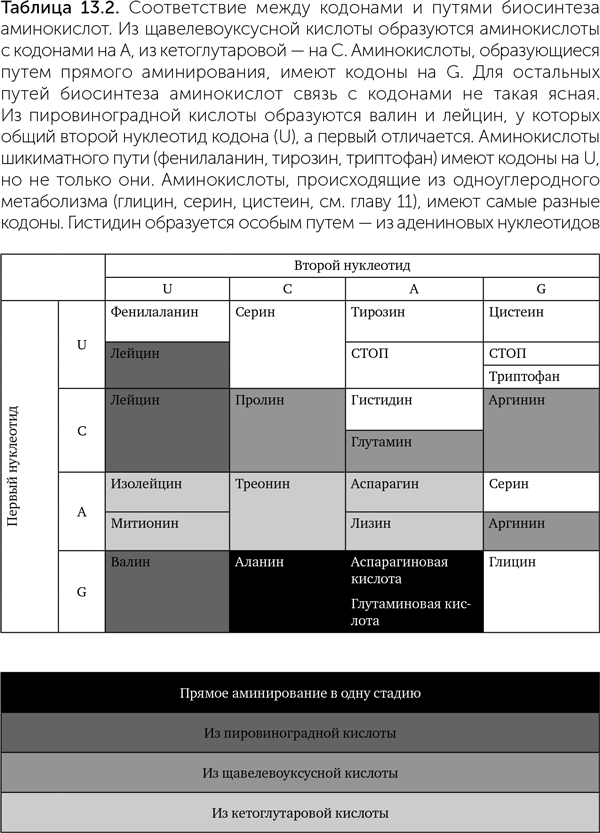
Наконец, четвертая теория (коэволюции) утверждает, что предковые кодоны принимали участие в биосинтезе аминокислот (Di Giulio, 2008). В таблице генетического кода действительно прослеживается соответствие между первым нуклеотидом кодонов и путями биосинтеза аминокислот. Например, три аминокислоты — аланин, аспарагиновая и глутаминовая — образуются в одну стадию из пировиноградной, щавелевоуксусной и кетоглутаровой кислот. Все они имеют кодоны, начинающиеся с G. В одной из лучше разработанных версий теории (Copley at al., 2005) это объясняется так: синтез аминокислот происходил после присоединения предшественника к гидроксильной группе рибозы РНК (конкретнее, к 2' — концу), и ее, РНК, первые три нуклеотида стали кодоном. В этом случае аминогруппа гуанина оказывается на подходящем расстоянии, чтобы облегчать восстановительное аминирование альфа-кетокислот, таких как пировиноградная и кетоглутаровая (рис. 13.7).
Синтез других аминокислот проходит в несколько стадий и начинается с присоединения фосфатной группы на конец будущей боковой цепи. Аминокислоты, происходящие таким способом из щавелевоуксусной кислоты, — аспарагин, треонин, изолейцин — имеют кодоны на А; происходящие из кетоглутаровой кислоты — аргинин, пролин, глутамин — на С (таблица 13.2). Фосфорилирование облегчается аминогруппами (NH2) этих нуклеотидов, причем расстояние от места прикрепления аминокислоты (2' — ОН группы рибозы) до аминогрупп разных нуклеотидов как раз соответствует разным кислотам-предшественницам.
Дальше по этой теории в игру вступает второй нуклеотид.
В работе Copley et al. (2005) приводится множество возможных реакций с участием двух нуклеотидов протокодона, ведущих к образованию 10 из 20 аминокислот. На рис. 13.7 мы привели лишь одну из них. К сожалению, для многих аминокислот, в том числе древних и важных, связи между кодонами и путями биосинтеза не вписываются в эту схему (валин, лейцин) или не прослеживаются вовсе (глицин, серин). Так что и эта теория тоже объясняет лишь часть особенностей стандартного генетического кода.
История аминоацил-тРНК-синтетаз
Аминоацил-тРНК-синтетазы — это группа ферментов, которые присоединяют аминокислоты к соответствующим транспортным РНК. Благодаря их способности к узнаванию аминокислот и транспортных РНК и реализуется генетический код. Если в рибосому попадает аминокислота на «чужой» тРНК, то синтезируется ошибочный белок. Никаких средств проверки таких ошибок рибосома не имеет.
Понятно, что современные аминоацил-тРНК-синтетазы — это белки, которые строятся в рибосоме. На ранних этапах развития рибосомы их функции должны были выполнять рибозимы. Такие рибозимы, узнающие аминокислоту и присоединяющие ее к транспортной РНК, были получены путем искусственного отбора и практически не уступают белковым аналогам в скорости работы и точности узнавания аминокислот.
Аминоацил-тРНК-синтетазы делятся на два класса, которые сильно отличаются по трехмерной структуре. Между двумя классами аминоацил-тРНК-синтетаз существует удивительная симметрия: в клетках, как правило, есть 10 синтетаз класса I и 10 — класса II; опознаваемые ими кодоны разделены тоже практически поровну — 29 и 32. Ферменты разных классов узнают транспортные РНК с разных сторон и присоединяют аминокислоту к разным местам молекулы тРНК: класс I — к 2' — гидроксильной группе концевой рибозы, а класс II — к 3'. В принципе, две аминоацил-тРНК-синтетазы разных классов могли бы присоединить две аминокислоты к одной транспортной РНК, не мешая друг другу. Возможно, что в древности это происходило на первом этапе синтеза дипептидов на одной тРНК. В современных белках аминокислоты, кодируемые двумя классами аминоацил-тРНК-синтетаз, распределены не случайно: вероятность того, что две соседние аминокислоты принадлежат разным классам синтетаз, составляет для древних универсальных белков 58,6%, а не 50%, как можно было бы ожидать. Видимо, это отголосок древних механизмов синтеза пептидов.
Разные аминокислоты распределены по классам аминоацил-тРНК-синтетаз не случайно: с одной стороны, в арсенале каждого класса есть кислые, щелочные и гидрофобные аминокислоты, с другой— большинство гидрофобных (лейцин, изолейцин, валин) принадлежат к синтетазам класса I, а самые малые аминокислоты (глицин, аланин) — класса II. Удивительно то, что самые важные аминокислоты в активном центре ферментов класса I присоединяются к своим тРНК при помощи ферментов класса II, и наоборот!
Несмотря на то, что два класса аминоацил-тРНК-синтетаз не имеют ничего общего ни в последовательности аминокислот, ни в их трехмерной укладке, Сергей Родин и Сузуму Оно выдвинули в 1995 году смелую гипотезу о том, что древнейшие синтетазы обоих классов кодировались одним геном (Rodin, Ohno, 1995). Ученые обратили внимание на то, что части генов, кодирующие активный центр (100–120 аминокислот из 600–1000, входящих в состав всей белковой молекулы) в классах I и II, обладают некоторым сходством. Сходство выявляется, если ген одного из классов читать по комплементарной цепи — т.е. «задом наперед», заменяя каждый нуклеотид на комплементарный ему. Родин и Оно предположили, что предковый ген кодировал сразу две аминоацил-тРНК-синтетазы, ставшие предками каждая своего класса, которые читались с этого гена в двух разных направлениях. Такое кодирование двух белков одним геном было тогда неизвестно, но со временем подобный пример нашелся: оказалось, что у водяной плесени Achlya klebsiana один ген кодирует в одну сторону глутамин-дегидрогеназу, а в другую — шаперон семейства HSP70 (шапероны помогают белкам правильно свернуться.) Более того, по трехмерной структуре эта глутамин-дегидрогеназа относится к суперсемейству «Россмановской укладки» (Rossman fold), как и класс I аминоацил-тРНК-синтетаз, а HSP70 по трехмерной структуре оказывается дальним родственником аминоацил-тРНК-синтетаз класса II в суперсемействе биотин-синтазной укладки (Carter, Duax, 2002). Потом совместное кодирование глутамин-дегидрогеназы и HSP70 было обнаружено и в нескольких видах бактерий. Наконец, был получен искусственный ген, кодирующий в одну сторону активный центр аминоацил-тРНК-синтетазы класса I, а в другую сторону — класса II. Оба его продукта хорошо выполняли функции аминоацил-тРНК-синтетаз (Carter et al., 2014). Так что совместное происхождение двух классов аминоацил-тРНК-синтетаз с одним предковым геном кажется очень вероятным. Более того, суперсемейство Россмановской складки — вообще крупнейшее среди белковых суперсемейств, в среднем к нему принадлежат десятки видов клеточных белков. Суперсемейство биотин-синтазного фолда скромнее, но тоже одно из крупнейших. И только у аминоацил-тРНК-синтетаз есть важные причины кодировать два разных белка одним геном — для синтеза белков нужен весь комплект этих ферментов, и вероятность потери гена для одного из них надо минимизировать. Так что эволюция двух крупных белковых суперсемейств могла начаться с аминоацил-тРНК-синтетаз.
Аналогичное экономное кодирование могло быть и в рибосомных РНК. В последовательности рибосомных РНК, особенно малой субъединицы, есть участки, похожие на гены транспортных РНК для всех 20 аминокислот. Уровень сходства составляет 60–80% совпадающих нуклеотидов. Если при помощи РНК-полимеразы сделать комплементарные копии этих участков рибосомной РНК, то они сворачиваются в трилистники так же, как настоящие транспортные РНК. Это сходство слишком велико, чтобы быть случайностью. Помимо транспортных РНК в рибосомной РНК могли быть закодированы также различные белки. Если перекодировать последовательность рибосомной РНК в белковую, как это в норме происходит с матричными РНК, то среди получившихся последовательностей будет много узнаваемых фрагментов рибосомных белков, аминоацил-тРНК-синтетаз, РНК-полимераз и других ферментов (Root-Bernstein & Root-Bernstein, 2015). Возможно, древние рибосомные РНК помимо своей основной структурной функции заодно кодировали набор транспортных РНК и какие-то из ферментов, необходимых для синтеза белков. В дальнейшем, с увеличением емкости генома, эта функция рибосомных РНК стала ненужной, поэтому следы такого кодирования, к сожалению, сильно размыты за миллиарды лет эволюции.
Структуры и функции белков
Большинство белков в клетках — водорастворимые, компактно свернутые молекулы. Укладка белковой цепи определяется порядком полярных и неполярных аминокислот в ней. Белки сворачиваются так, чтобы полярные аминокислоты находились на поверхности и контактировали с водой, а неполярные были скрыты внутри и контактировали друг с другом. Кроме того, цепь аминокислот благодаря водородным связям между C=O и N-H группами остова может образовать два типа упорядоченных структур: альфа-спираль и бета-слой (рис. 13.8). В альфа-спирали белковая цепь закручена вправо, на один оборот спирали приходится 3,6 аминокислот, и водородные связи образуются между соседними витками — через три аминокислоты. В бета-слое белковая цепь сложена в несколько параллельных прямых участков, и водородные связи образуются между соседними прямыми фрагментами цепи.
Эксперименты с искусственными белками показали, что пространственная укладка определяется в основном чередованием полярных и неполярных аминокислот в цепи. Так, для бета-слоя на поверхности белка нужно чередование «один через один» — АВАВАВАВ, так, чтобы все полярные группы аминокислот смотрели в одну сторону, а неполярные — в другую. Для альфа-спирали требуется повторение 7-аминокислотных фрагментов ААВВАВВ или АААВААВ, тогда одна сторона спирали будет полярной и обращенной к воде, а другая — неполярной внутренней.
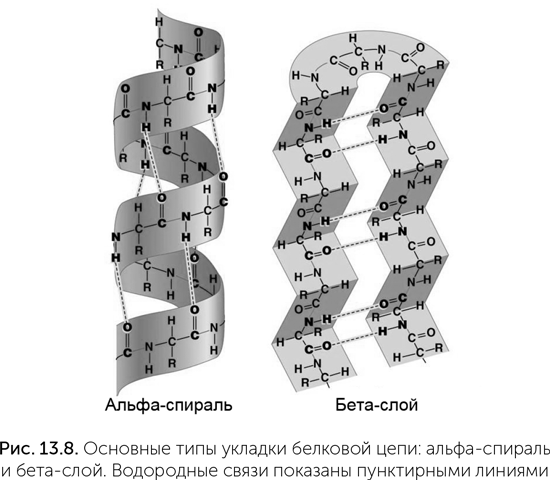
Пять неполярных аминокислот (валин, лейцин, изолейцин, фенилаланин, метионин) в значительной степени взаимозаменяемы между собой. Глицин и пролин стоят особняком, они не вписываются ни в альфа-спираль, ни в бета-слой и находятся в местах крутых поворотов белковой цепи между спиралями или между прямыми участками бета-слоя. 13 остальных аминокислот полярны и если обращены в воду, то тоже практически взаимозаменяемы. Таким образом, для расчетов трехмерной укладки белка можно в первом приближении считать, что аминокислот не 20, а только 3 — «полярная», «неполярная» и «поворотная». Это резко увеличивает вероятность получить белок с нужной укладкой случайным перебором: для белка из 100 аминокислот возможны 20100 вариантов последовательности, что намного больше числа частиц в видимой Вселенной. Но с точки зрения укладки вариантов только 3100 (приблизительно 1045), а осмысленных (с альфа-спиралями и бета-слоями) еще на много порядков меньше из-за необходимых для этого простых чередований аминокислот.
Эксперименты показывают, что коль скоро белок компактно свернут, то наличие у него какой-нибудь ферментативной активности — правило, а не исключение. Более того, активностей может быть несколько даже у короткого белка!
В опытах группы Майкла Хехта из Принстона изучались искусственные белки, складывающиеся в пучок из четырех альфа-спиралей (такую укладку имеют, например, цитохромы b — белки для переноса электронов и ферритины — белки для хранения железа). Ученые создавали на компьютере кодирующие последовательности для белков длиной 74 аминокислоты. 18 аминокислот между спиралями были всегда одинаковы и включали пролин и глицин, а альфа-спирали составлялись из 24 неполярных позиций (в каждой мог быть валин, лейцин, изолейцин, фенилаланин, метионин) и 32 полярных (в каждой могла быть одна аминокислота из шести: глутаминовая кислота, аспарагиновая кислота, лизин, гистидин, аспарагин, глутамин). При таких ограничениях возможно примерно 1041 вариантов последовательностей. Для 48 случайно выбранных виртуальных белков были синтезированы кодирующие их гены, вставлены в клетки кишечной палочки, и синтезированные белки удалось выделить и изучить. 60% из них были компактно свернуты в пучки из четырех спиралей. Среди компактно свернутых белков половина связывала гем, подобно настоящим цитохромам, а 4 из 29 проявляли пероксидазную активность (т.е. окисляли субстраты с использованием перекиси водорода). Лучшая из четырех пероксидаз из этой случайной библиотеки лишь в 3,5 раза уступает по активности природным пероксидазам, прошедшим отбор!
В ходе дальнейших экспериментов была создана библиотека 400 случайных 4-спиральных белков длиной 102 аминокислоты. Из них более 90% компактно сворачивались, 60% связывали гем, 50% проявляли пероксидазную активность. Кроме того, эти белки были проверены на другие ферментативные активности в отсутствие гема. Оказалось, что 30% проявляют эстеразную активность, а 20% — липазную. 3% белков в этой библиотеке проявляли все три ферментативные активности, на которые их проверяли! (Patel et al., 2009).
В еще более масштабном поиске более миллиона 4-спиральных 102-аминокислотных белков были проверены на способность заменять природные ферменты кишечной палочки. Кодирующие их гены встраивали в штамм, лишенный необходимого фермента, и проверяли, возвращают ли они бактериям способность расти на минимальной питательной среде. Из 27 удаленных природных ферментов в библиотеке нашлись аналоги для четырех: фосфосерин-фосфатазы, цитрат-синтазы, треонин-деаминазы и энтерин-эстеразы (Fisher et al., 2011).
Эти данные показывают, что коль скоро белок свернут, то какая-нибудь ферментативная активность у него с высокой вероятностью будет. Более того, похоже, что эволюция современных белков ограничена в первую очередь опасностью появления новых нештатных функций, а не опасностью утраты основной функции. Поэтому, например, белки, работающие в митохондриях, эволюционируют в несколько раз быстрее, чем в среднем по клетке, даже если они кодируются ядерным геномом (подробнее о митохондриях — в главе 18). Ведь в митохондриях низкое разнообразие белков и мало потенциальных партнеров для нештатного связывания.
Древняя история белков записана в рибосоме
Выше мы рассказывали о разном возрасте деталей рибосомы по мере удаления от пептидил-трансферазного центра. Структуры рибосомных белков тоже меняются в зависимости от расстояния до центра. У кишечной палочки малая субъединица содержит 22 белка, обозначаемые S1-S22, а большая — 36 белков, от L1 до L36. Самые ближайшие к пептидил-транферазному центру и, по-видимому, древнейшие белки рибосомы — это протяженные выступы белков L2, L3, L4 и L22, заходящие глубже всего в рибосомную РНК. Укладка аминокислот в этих выступах либо не упорядочена, либо образует узкие бета-слои из двух параллельных белковых цепей (бета-шпильки). При этом отсутствуют обычные альфа-спирали, составленные закрученными вправо связями между амино- и карбонильными группами. Аминокислотный состав этих древнейших белков своеобразен: они на 70% состоят всего из пяти аминокислот — глицина, аланина, пролина, аргинина и лизина (Hartman and Smith, 2014). В более молодых частях рибосомы белки образуют более широкие и упорядоченные бета-слои, и лишь в самых молодых белках на внешней поверхности есть альфа-спиральные участки. В аминокислотном составе второго поколения рибосомных белков (с широкими бета-слоями, но без альфа-спиралей) появляются в большом количестве валин и серин, а также ароматические аминокислоты. Внешние рибосомные белки, содержащие альфа-спиральные участки, по аминокислотному составу приближаются к усредненному составу всех клеточных белков, если не считать некоторого избытка лизина и аргинина.
Как мы помним, большая субъединица рибосомы поначалу работала в одиночку, без малой субъединицы и, следовательно, без матричной РНК. Она могла сшивать аминокислоты друг с другом, но не могла собирать из них длинные цепочки с определенной сложной последовательностью. Какие же пептидные цепи могла создавать проторибосома без матричной РНК?
Напрашивается три возможности. Во-первых, проще всего строить пептидные цепи из молекул одной аминокислоты, получая гомополимерный пептид. Во-вторых, можно использовать несколько (от двух до четырех) аминокислот, соединяя их в случайном порядке. Так образуются статистические пептиды. Третий и самый сложный вариант — когда проторибосома чередует две или больше аминокислот в постоянном порядке, производя периодический пептид.
Для гомополимерных пептидов сложно придумать какую-то функцию, которая будет востребована в мире РНК. А для периодических пептидов такие функции есть. Одну из них нам подсказывает структура рибосомных белков L2, L3, L4, L22. Эти белки состоят в основном из бета-шпилек, разделенных неструктурированными участками. Они несут положительный электрический заряд и стабилизируют укладку рибосомной РНК, компенсируя ее отрицательный заряд. Эту функцию почти так же хорошо могут выполнять периодические пептиды, полученные чередованием двухаминокислотных мотивов: (Ala-Arg) 2–4 — (Gly-Pro). Участки чередования аланина с аргинином образуют прямые части бета-шпилек, а пара глицин — пролин образует крутой поворот цепи, чтобы она могла сложиться в шпильку. Такие пептиды, которые могут встраиваться в крупные рибозимы и повышать стабильность их укладки, могли быть первым полезным продуктом пептидил-трансферазного центра. Еще более простой пример вспомогательного пептида с положительным зарядом упоминался в 10-й главе, это Tat-пептид вируса СПИДа. Этот пептид и его синтетические аналоги из повторов Arg-Gly и Arg-Gln-Gly тоже встраиваются в разные рибозимы, повышая стабильность их укладки и эффективность работы. Скорее всего, статистические пептиды такого состава тоже могут помогать работе рибозимов.
Другой вариант полезного периодического пептида можно подсмотреть в структуре активных центров различных ДНК- и РНК-полимераз. Все эти ферменты имеют в активном центре ион магния, связанный между тремя остатками аспарагиновой кислоты. Часто эти три остатка находятся на одном участке белковой цепи в составе последовательности Asp-Val-Asp-Gly-Asp. Следовательно, простое чередование аспарагиновой кислоты с валином и глицином позволяет получить вспомогательный пептид, повышающий эффективность рибозимов-РНК-полимераз.
Обойденные и вымершие аминокислоты
В предыдущей главе мы обсуждали возможные альтернативные варианты биохимии — на других химических элементах, в других растворителях, с другими генетическими молекулами вместо ДНК и РНК. Настало время обсудить происхождение набора из 20 аминокислот, составляющего белки, и оценить возможные альтернативы.
Во многих случаях природа выбрала наиболее простые аминокислоты из возможных. Аланин, например, — это самая обыкновенная аминокислота без особых примет. Глицин — единственная возможная аминокислота без боковой группы, благодаря чему по глицину белковая цепь может свободно изгибаться и вращаться. Также в стандартном наборе используются самые простые и доступные кислые аминокислоты (аспарагиновая, глутаминовая) и их амиды (аспарагин, глутамин), аминокислоты со спиртовой группой (серин, треонин), серосодержащие (цистеин), ароматические (фенилаланин, тирозин) с важной для многих ферментов имидазольной группой (гистидин) и жесткие, не допускающие вращения цепи (пролин) (Weber and Miller, 1989). Сложнее ситуация в группах положительно заряженных и неполярных аминокислот.
В стандартном наборе имеется две положительно заряженные аминокислоты — аргинин и лизин. Обе они имеют длинную боковую цепь и сложный путь биосинтеза. В аппарате Миллера и в метеоритах лизин и аргинин не встречаются, зато есть более простые аминокислоты со второй аминогруппой: диаминопропионовая, диаминобутановая и диаминопентановая (орнитин, рис. 13.9). Эти же три аминокислоты есть и в клетках. Диаминопропионовая и диаминобутановая кислоты встречаются у бактерий в составе пептидов специального назначения: антибиотиков и переносчиков железа. Орнитин является промежуточным продуктом в синтезе аргинина и есть у всех организмов — от бактерий до человека. Значит, возможно, что эти аминокислоты были доступны для включения в белки с самого начала, но по каким-то причинам вместо них были выбраны более сложные аргинин и лизин.
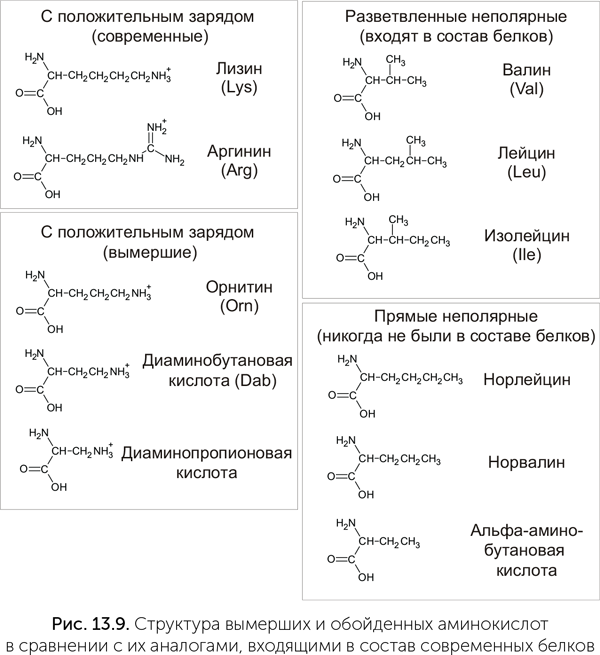
Мы можем быть уверены, что аминокислоты со второй аминогруппой входили в состав самых древних белков. Эти белки, чтобы эффективно работать в мире РНК, должны были прочно связываться с молекулами РНК, как, например, рибосомные белки. Такое связывание требует, чтобы белок нес положительный электрический заряд, т.е. имел свободные аминогруппы, которые в водной среде оказываются положительно заряжены. Рибосомные белки своим положительным зарядом компенсируют отрицательный заряд сахарофосфатного остова РНК, и только благодаря им рибосомная РНК длиной более 3000 звеньев может свернуться компактно (Hartman and Smith, 2014).
И аргинин, и лизин имеют длинные и сложные пути биосинтеза, состоящие из восьми-девяти стадий, и маловероятно, что их синтез мог проходить без участия полноценных белковых ферментов. Орнитин и диаминобутановая кислота образуются в три стадии из глутаминовой и аспарагиновой кислот, а диаминопропионовая и вовсе в один шаг из серина, т.е. они явно доступнее. Более того, для лизина у разных групп микробов существуют две разные аминоацил-тРНК-синтетазы, относящиеся к двум разным семействам. Такое разнообразие аминоацил-тРНК-синтетаз может означать, что они появились независимо, а значит, лизин вошел в генетический код уже после расхождения крупных групп микробов. Итак, у нас есть три факта:
1) положительно заряженные аминокислоты должны были быть в белках с самого начала;
2) современные аминокислоты этой группы — лизин и аргинин — имеют очень длинный и сложный биосинтез и могли возникнуть в эволюции позже других аминокислот. Для лизина это подтверждается и разнообразием аминоацил-тРНК-синтетаз;
3) существуют более простые и доступные аминокислоты с положительным зарядом, такие как орнитин, они есть в клетках, но не входят в состав белков.
Возникают подозрения, что простые положительно заряженные аминокислоты когда-то входили в состав белков, но были затем вытеснены лизином и аргинином.
Какие причины могли привести к замене простых положительно заряженных аминокислот на более сложные? В экспериментах с искусственными пептидами из аланина и разных положительно заряженных аминокислот было показано (Padmanabhan et al., 1996), что положительный заряд близко к остову пептидной цепи нарушает стабильность альфа-спирали, и лишь лизин и аргинин несут положительный заряд на безопасном расстоянии. Так что, видимо, причиной перехода на лизин и аргинин было усложнение белков и увеличение доли альфа-спиралей в них. Как видно по структуре рибосомных белков, альфа-спиральные укладки возникли в эволюции позже, чем бета-слои, которые устойчивы и с малыми положительно заряженными аминокислотами.
Где же эти аминокислоты могли быть в таблице генетического кода? В случае орнитина ответить на этот вопрос проще всего. Так как он является промежуточным продуктом на пути к аргинину, то, скорее всего, ему раньше принадлежали основные кодоны аргинина — CGN. Также вымершим аминокислотам могла принадлежать группа кодонов AGN. В современном генетическом коде кодоны AGA и AGG принадлежат аргинину, а AGC и AGU — серину. Обе эти аминокислоты имеют еще по четыре кодона в других местах (CGN аргинина и UCN серина) и, похоже, захватили и поделили кодоны вымершей аминокислоты. Кодоны AGN могли принадлежать, например, диаминопропионовой кислоте. Диаминопропионовая кислота образуется из серина и соответствует ему по размеру, а по электрическому заряду соответствует аргинину, поэтому ее кодоны были поделены между серином и аргинином.
В группе неполярных аминокислот в состав белков входят аминокислоты с разветвленной боковой цепью — валин, лейцин, изолейцин, но не используются их аналоги с прямой боковой цепью, такие как альфа-аминобутановая кислота, норвалин и норлейцин. В опыте Миллера и в метеоритной органике неразветвленные аминокислоты образуются в больших количествах, чем разветвленные. Все три аминокислоты с прямой боковой цепью известны в составе природных пептидов-антибиотиков, а аминобутановая кислота образуется и у животных при распаде белков пищи.
Проблемы со стабильностью альфа-спирали вызывает валин, а прямые неполярные аминокислоты, наоборот, вписываются в нее идеально. Так что здесь мы не видим никакой причины для замены прямых аминокислот на разветвленные в ходе эволюции. Видимо, жизнь с самого начала имела возможность выбора между прямыми и разветвленными неполярными аминокислотами, и вторые были выбраны по какой-то причине, которая больше не важна. Например, такая причина есть в теории стереохимического соответствия кодонов и аминокислот: РНК на глине содержит «карманы», соответствующие по форме валину, лейцину и изолейцину, тогда как для неполярных аминокислот с прямой боковой цепью ни один из триплетов не образует подходящих «карманов». Другое объяснение возможно исходя из теории цианосульфидного протометаболизма (глава 7): в этой сети реакций разветвленные аминокислоты (валин и лейцин) образуются в реакциях ацетона с синильной кислотой, а эффективных путей получения их прямых аналогов нет.
«Рабочий код» и происхождение генетического кода
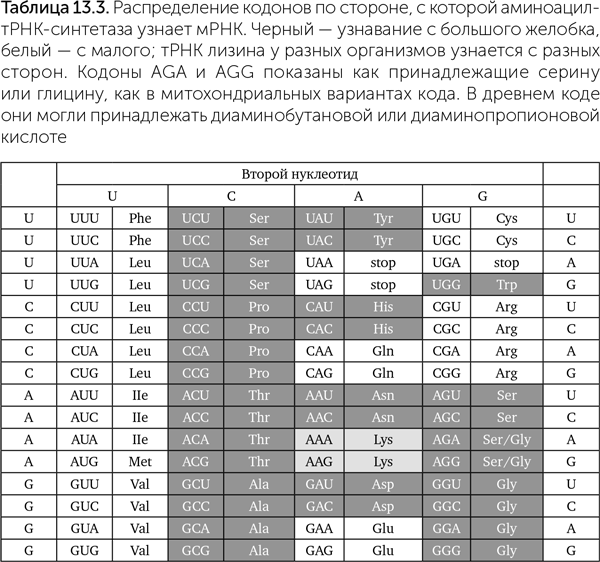
Узнавание транспортных РНК аминоацил-тРНК-синтазами определяется в первую очередь не антикодоном, а нуклеотидами акцепторного стебля — рядом с местом присоединения аминокислоты (рис. 13.2). Часть аминоацил-тРНК-синтетаз, работающая с простыми аминокислотами (такими как аланин, глицин, глутаминовая кислота), вообще не проверяют антикодон тРНК, им достаточно акцепторного стебля. Соответствие между нуклеотидами акцепторного стебля и аминокислотами получило название «рабочего кода» (operational code). Рабочий код проще, чем стандартный генетический код: в него входят три первые нуклеотидные пары акцепторного стебля, причем в этих позициях бывают обычно только гуанин и цитозин, очень редко урацил. Таким образом, рабочий код не вырожден: с его помощью можно закодировать только восемь аминокислот, не используя урацил, и до шестнадцати, используя урацил только в одной позиции из трех.
Одна из самых строгих закономерностей генетического кода — распределение кодонов по типам узнавания транспортных РНК аминоацил-тРНК-синтетазой (табл. 13.3). Аминоацил-тРНК-синтетазы могут контактировать с акцепторным стеблем транспортной РНК с двух разных сторон. У двойных спиралей ДНК и РНК есть два желобка: большой, который образуется боковыми сторонами азотистых оснований, и малый, который образован 2' — гидроксильными (-ОН) группами рибозы обоих цепей. Узнавание может происходить со стороны большого желобка акцепторного стебля (I класс и фенилаланин-тРНК-синтетаза II класса) либо малого желобка (II класс и тирозин-тРНК-синтетаза I класса). Все транспортные РНК со второй буквой кодона U узнаются с малого желобка, с C — с большого. Для кодонов с G в середине способ узнавания определяется первой буквой, с А — последней.
«Рабочий код» не столь однозначен, как классический генетический код. Он сильнее отличается у разных организмов. Однако есть закономерность, связывающая его с классическим: для двух простейших аминокислот — глицина и аланина, а также часто для валина, пролина и аспарагиновой кислоты первые три нуклеотида акцепторного стебля совпадают с одним из кодонов той же аминокислоты (Moller, Janssen, 1992).
Возможное родство «рабочего кода» и классического кода помогает разорвать порочный круг, возникающий во многих моделях происхождения генетического кода. В самом деле, для появления генетического кода должно возникнуть соответствие между аминокислотами и антикодонами тРНК. Аминокислоты и антикодоны, во-первых, химически различаются, во-вторых, находятся на разных концах молекул транспортных РНК и разделены значительным расстоянием. Теория «ключ-замок» и теория коэволюции кода дают приемлемый ответ на вопрос, как возникло соответствие между аминокислотами и какими-то триплетами в каких-то РНК. Но они требуют прямого взаимодействия аминокислоты с фрагментом РНК — будущим кодоном или антикодоном. Как возникло соответствие между аминокислотой и антикодоновой петлей тРНК, которые разделены заметным расстоянием?
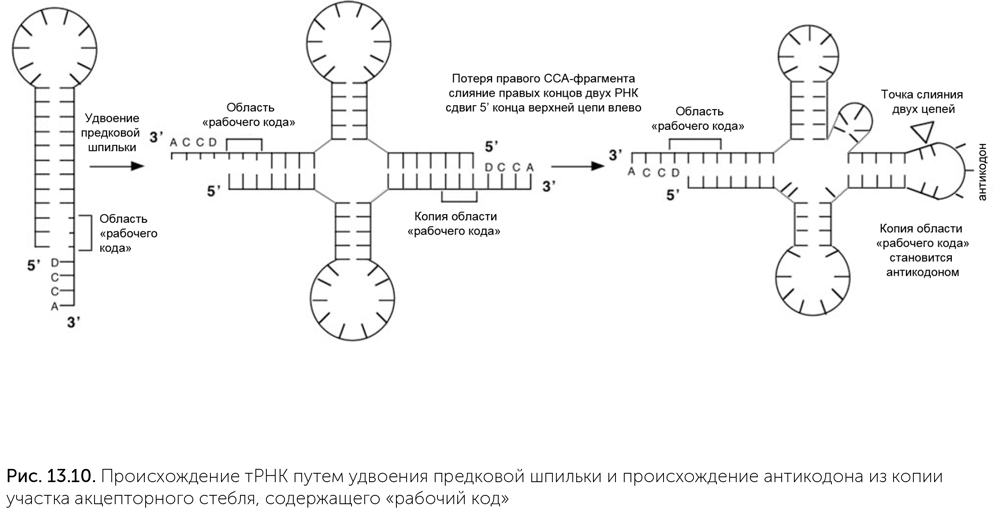
Если же у нас для присоединения аминокислот к транспортным РНК сначала использовался «рабочий код» (а для половины аминоацил-тРНК-синтетаз его достаточно и сейчас), то решение есть. Сначала на стереохимической или коэволюционной основе появился «рабочий код», при этом один и тот же участок рибозима-предка аминоацил-тРНК-синтетазы мог узнавать и аминокислоту, и акцепторный стебель. Потом должно возникнуть соответствие между разными акцепторными стеблями и антикодонами. В последовательностях транспортных РНК есть нестрогая, но заметная периодичность — повторы длинной 9–10 нуклеотидов. С учетом образования двуспиральных участков транспортную РНК можно собрать путем последовательных удвоений предковой шпильки из 19 нуклеотидов. Первое удвоение дает структуру из 38 нуклеотидов с двумя шпильками. Такие «половинки транспортной РНК» встречаются на концах геномов РНК-вирусов гораздо чаще, чем «клеверные листы», похожие на полную транспортную РНК. Те аминоацил-тРНК-синтетазы, которые не проверяют антикодон, прекрасно «пришивают» аминокислоты к таким молекулам. Второе удвоение порождает «клеверный лист», причем место стыковки двух сегментов находится на границе антикодона, а сам антикодон возникает как копия участка акцепторного стебля, образующего «рабочий код» (рис. 13.10) (Di Giulio, 2009). Мы видели, что для некоторых аминокислот (таких как глицин, аланин, пролин, аспарагиновая кислота, валин) «рабочий код» совпадает с обычным генетическим кодом. Следовательно, эти аминокислоты участвовали в сборке пептидов на проторибосоме еще до того, как произошла дупликация, породившая современные тРНК. Эта дупликация привела транспортные РНК к современному размеру и современной форме и создала антикодоновую петлю. Только после этой дупликации могли возникнуть взаимодействие антикодоновой петли с матричной РНК и кодируемый белковый синтез. Следовательно, эти пять аминокислот относятся к древнейшим.
Порядок развития белкового синтеза и генетическом кода
Мы рассмотрели ключевые факты, проливающие свет на историю рибосом и генетического кода. Попробуем теперь собрать из фрагментов последовательную историю.
1. Основа большой субъединицы рибосомы, пептидил-трансферазный центр, вначале строил пептиды из небольшого набора аминокислот без участия матричной РНК. Возможны три варианта последовательности таких пептидов: чистые полимеры одной аминокислоты, случайное чередование нескольких аминокислот и закономерное чередование, в простейшем случае повтор двух аминокислот. Наличие двух классов аминоацил-тРНК-синтетаз, узнавание ими тРНК с разных сторон и неслучайная принадлежность аминокислот двум классам синтетаз в древних белках могут быть следами двухаминокислотных повторов на этом этапе развития рибосомы. Аминокислоты доставлялись к проторибосоме на молекулах транспортных РНК. Но эти тРНК были меньше и проще современных и имели один длинный двуспиральный участок (современные — четыре коротких). «Рабочий код» (последовательность трех первых нуклеотидов акцепторного стебля) мог использоваться дважды. Сначала вне рибосомы он опознавался рибозимными аминоацил-тРНК-синтетазами для прикрепления каждой аминокислоты к своей тРНК. Затем уже в проторибосоме он мог использоваться для правильного чередования аминокислот в периодических пептидах.
2. В какой-то момент происходит внутренняя дупликация в молекулах транспортных РНК, и они превращаются из древних одиночных шпилек в современные «трилистники». Образуется антикодоновая петля как копия участка акцепторного стебля с «рабочим кодом», и взаимодействие этой петли с другими молекулами РНК позволяет упорядочить последовательность пептидов, производимых на древней рибосоме. Вероятно, сначала антикодоновые петли взаимодействовали со специальным участком рибосомной РНК, а потом ему на смену пришли сменные матричные РНК, позволив одной рибосоме производить множество разных белков. К большой субъединице рибосомы присоединилась малая и стала контролировать взаимодействие транспортной и матричной РНК.
3. Мы можем восстановить набор аминокислот, используемых проторибосомой на этих двух этапах, по двум источникам: совпадение «рабочего кода» в акцепторном стебле транспортной РНК со стандартным кодом в антикодоновой петле той же тРНК и присутствие аминокислоты в составе древнейших белков (внутренние домены рибосомных белков L2, L3, L4, L22). «Рабочий код» дает нам пять аминокислот (глицин, аланин, пролин, аспарагиновая кислота, валин), рибосомные белки — тоже пять, но других (глицин, аланин, пролин и вместо аспарагиновой кислоты и валина — аргинин и лизин). Выше мы упоминали, что в древнейшем генетическом коде вместо аргинина и лизина, скорее всего, были их более простые аналоги, такие как орнитин, диаминопропионовая и диаминобутановая кислоты. Далее для краткости мы будем называть только орнитин, но на самом деле это могла быть любая из этих трех аминокислот или даже могли быть задействованы все три одновременно. Совпадение «рабочего кода» с обычным антикодоном для них могло быть стерто позже, когда эти аминокислоты были заменены на лизин и аргинин. Иными словами, в минимальный набор аминокислот, с которого начался кодируемый синтез белка, входят шесть: глицин, аланин, пролин, аспарагиновая кислота, валин, орнитин. Скорее всего, эти же шесть аминокислот использовались и на первом этапе развития рибосомы, до внутренней дупликации тРНК и появления кода. На этом первом этапе из шести древнейших аминокислот могли строиться вспомогательные пептиды для разных рибозимов. Это могли быть пептиды с положительным зарядом, стабилизирующие укладку рибозимов, на основе чередования орнитина с аланином, глицином или пролином. Кроме того, могли производиться и пептиды с отрицательным зарядом для работы в составе рибозимов-полимераз на основе чередования аспарагиновой кислоты, валина и глицина.
4. Переход к кодированию последовательностей пептидов при помощи матричной РНК дал возможность строить более длинные и воспроизводимые вспомогательные пептиды для разных рибозимов, а затем и полноценные белки, способные компактно свернуться без участия РНК. На этом этапе возникают первые рибосомные белки и первые ферменты, состоящие из бета-слоев, в том числе аминоацил-тРНК-синтетазы.
5. Добавление к аминокислотному набору цистеина, серина и гистидина резко расширяет каталитические возможности белков. Появляются многие основные классы ферментов. Разнообразие белков растет, и все сильнее проявляется врожденный недостаток белков с бета-слоевой укладкой: они склонны соединяться в кристаллоподобные структуры. Известный пример такой кристаллизации бета-слоевого белка — образование амилоидных фибрилл в нервных клетках при болезни Альцгеймера. Толчком к появлению таких кристаллов может стать как неожиданное изменение температуры и солевого состава среды, так и мутация в гене, кодирующем этот белок. По этой причине естественный отбор поддерживает появление белковых структур, состоящих из альфа-спиралей.
6. Для появления белков со стабильной альфа-спиральной укладкой необходимо найти замену орнитину, валину и аспарагиновой кислоте, так как они нарушают устойчивость альфа-спиралей. Добавление в код лейцина, изолейцина, лизина либо аргинина, а также глутаминовой кислоты решает эту проблему. На этом этапе могла возникнуть большая часть универсальных белковых укладок.
7. Завершение стандартного генетического кода. Добавляются ароматические аминокислоты, аспарагин, глутамин. Ароматические аминокислоты могут вступать во взаимодействие с азотистыми основаниями в РНК и коферментах и дают новый способ связывания белков с РНК — это так называемое стэкинг-взаимодействие, основанное на параллельном расположении ароматических колец пуриновых и пиримидиновых оснований. Фенилаланин, кроме того, является самой крупной из гидрофобных аминокислот и повышает стабильность укладки больших белков. Позднее добавление аспарагина и глутамина связано с их плохой устойчивостью к высоким температурам. В белках гипертермофильных микробов, живущих при температуре 90–110 оС, содержание аспарагина и глутамина очень мало. Видимо, они вошли в генетический код после выхода протоклеток из горячих геотермальных водоемов в моря.
Как мы видим, сложнейшая система производства белков вполне могла развиваться постепенно. Многие ее компоненты, такие как транспортные РНК и рибосомная РНК малой субъединицы, исходно имели другие функции, не связанные с белками. Проторибосома, собирающая короткие пептиды без кода, тоже могла быть полезна для организмов РНК-мира. Появление генетического кода и матричных РНК повысило точность и воспроизводимость этих коротких пептидов. После этого дальнейшее совершенствование рибосомы и расширение набора аминокислот поддерживались естественным отбором в первую очередь потому, что позволяли получать новые, более эффективные белковые ферменты.

