Происхождение современных путей обмена веществ
Устройство обмена веществ
В прошлой главе мы подошли к разнообразным биохимическим реакциям, которые должен был освоить РНК-мир с помощью витаминов, аминокислот и микроэлементов. Теперь пора рассмотреть обмен веществ современных клеток и возможный путь к нему от древнего обмена веществ РНК-мира.
В школьных и университетских учебниках обмен веществ рассматривается на примере самых простых и важных для человека реакций. Самый известный путь обмена веществ — это гликолиз. В процессе гликолиза происходит превращение глюкозы в пировиноградную кислоту с запасанием небольшого количества энергии в виде АТФ. Гликолиз особенно важен для бактерий и дрожжей, осуществляющих брожение. В разных видах брожения он дополняется несколькими дополнительными реакциями, в результате конечными продуктами могут быть молочная кислота, этиловый спирт или уксусная кислота. В организме человека гликолиз особенно активно идет в мышцах при большой нагрузке, когда кровь не успевает доставлять достаточное количество кислорода. В этой ситуации в мышцах накапливается молочная кислота, от которой они болят после очень интенсивных тренировок.
Обмен веществ (метаболизм) делится на катаболизм (распад сложных веществ до более простых с выделением энергии), анаболизм (образование сложных веществ из простых с затратой энергии) и промежуточный метаболизм (превращение друг в друга нескольких универсальных промежуточных веществ; связующее звено между катаболизмом и анаболизмом). Путем обмена веществ называется цепочка последовательных превращений вещества, проводимая несколькими ферментами по очереди, как на конвейере. Гликолиз относится к путям катаболизма.
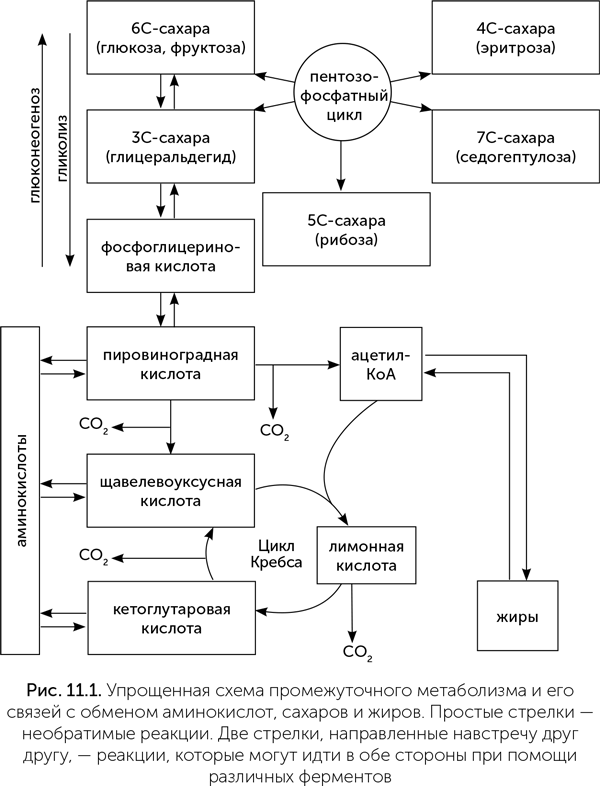
В центре обмена веществ большинства клеток находится цикл Кребса, еще называемый циклом лимонной кислоты или циклом трикарбоновых кислот. В этой последовательности реакций уксусная кислота (в виде ацетил-КоА) присоединяется к щавелевоуксусной кислоте, давая лимонную кислоту. Лимонная кислота, в свою очередь, последовательно теряет две молекулы СО2 и восемь атомов водорода, превращаясь обратно в щавелевоуксусную. В итоге уксусная кислота разлагается до углекислого газа и водорода на носителе (НАД или ФАД), который используется для получения энергии в реакции с кислородом.
Из кислот цикла Кребса строятся три основных класса веществ в клетках — сахара (из пировиноградной кислоты), жирные кислоты (из ацетил-КоА) и аминокислоты (из щавелевоуксусной, альфа-кетоглутаровой и пировиноградной кислот). Пути распада этих веществ для получения энергии — гликолиз, бета-окисление жирных кислот и дезаминирование аминокислот — приводят в конечном итоге к циклу Кребса (рис. 11.1).
Пути обмена веществ имеют модульную структуру и соединяются друг с другом через немногие универсальные промежуточные продукты. Например, обмен сахаров подключается к циклу Кребса через пировиноградную кислоту. Кроме гликолиза (распад глюкозы до пировиноградной кислоты) есть еще глюконеогенез — обратный путь от пировиноградной кислоты к глюкозе с затратами энергии. Благодаря глюконеогенезу, который происходит в основном в печени, молочная кислота в нашем организме может быть переработана обратно в глюкозу.
Кроме шестиуглеродных (глюкоза, фруктоза) и трехуглеродных сахаров (глицеральдегид, диоксиацетон) клетки умеют производить и расщеплять пятиуглеродные сахара, такие как рибоза, необходимая для построения ДНК и РНК. Для этого используется пентозофосфатный цикл — это сеть взаимопревращений всех классов сахаров, включая семиуглеродные (седогептулоза), шестиуглеродные, пятиуглеродные (рибоза, рибулоза и ксилулоза), четырехуглеродные (эритроза), и трехуглеродные (глицеральдегид). Цикл может работать в разных направлениях, например, производя из глюкозы рибозу для РНК и эритрозу для синтеза некоторых витаминов или, наоборот, превращая полученную с пищей рибозу в глицеральдегид для сжигания в цикле Кребса.
Клетки человека способны строить из веществ промежуточного метаболизма не все им необходимое. Они могут произвести основные сахара, такие как глюкоза, галактоза и рибоза, половину набора аминокислот, нуклеотиды и жиры. Более сложные аминокислоты (такие как лизин, метионин и триптофан) и витамины должны поступать с пищей. Другие организмы более самостоятельны. Например, кишечная палочка может построить все аминокислоты и витамины, имея в своем распоряжении только глюкозу и минеральный источник азота (нитратные или аммонийные соли). Но и человек, и кишечная палочка нуждаются в готовой органике и в конечном итоге разрушают ее. Для существования биосферы необходимы автотрофные организмы, такие как растения, которые могут производить все необходимые органические вещества из углекислого газа и азота (в форме аммиака или нитратов).
Включение углекислого газа в обмен веществ
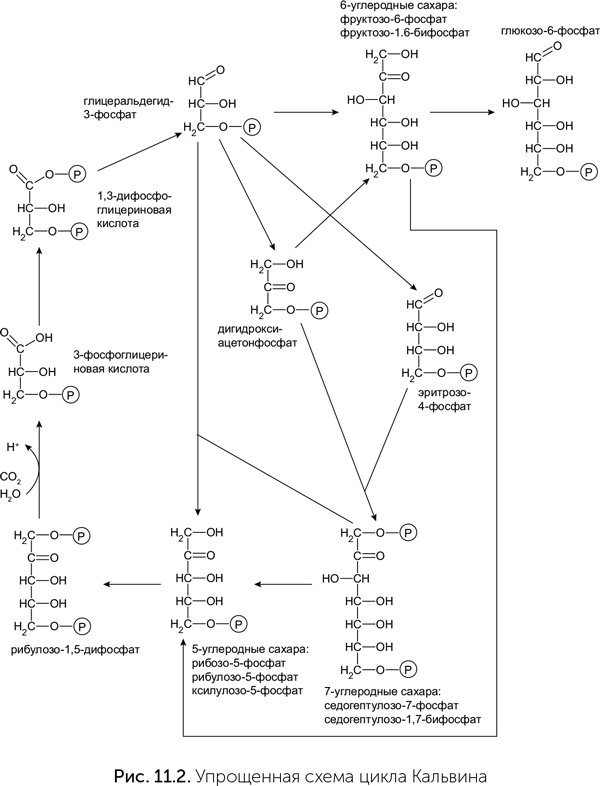
Существует несколько биохимических путей включения СО2 в метаболизм (это называют фиксацией СО2). У растений фиксация СО2 происходит в цикле Кальвина. Когда школьникам говорят, что «растения поглощают углекислый газ и синтезируют глюкозу», речь идет именно о цикле Кальвина, но это сильно упрощенная правда. Строго говоря, в цикле Кальвина образуется трехуглеродный фосфоглицериновый альдегид, а затем из него в несколько этапов получается глюкоза (рис. 11.2). На первый взгляд, схема реакций цикла Кальвина очень сложна, однако большинство этих реакций — такие же перестройки сахаров, как и в пентозофосфатном цикле. Все они происходят по одному механизму альдольной конденсации, как и реакция Бутлерова, и катализируются родственными ферментами. Для фиксации СО2 в цикле Кальвина к пентозофосфатному циклу надо добавить только три реакции:
- перенос фосфатной группы с АТФ на рибулозо-5-фосфат с образованием рибулозо-1–5-бифосфата;
- присоединение СО2 к рибулозо-бифосфату с образованием двух молекул фосфоглицериновой кислоты;
- восстановление фосфоглицериновой кислоты до фосфоглицеринового альдегида.
Последняя реакция из этих трех, кстати, уже есть в соседнем пути метаболизма — глюконеогенезе.
Все остальные реакции в этой устрашающей схеме нужны только для того, чтобы из части фосфоглицеринового альдегида получить обратно рибулозо-1–5-бифосфат для следующего оборота цикла.
Микроорганизмы используют другие пути фиксации СО2. Например, у ацетогенов и метаногенов есть так называемый восстановительный ацетил-КоА-путь. Эти организмы получают энергию за счет восстановления СО2 водородом до метана или до уксусной кислоты. И этот путь восстановления СО2 в органику у них во многом пересекается с путем восстановления СО2 для получения энергии.
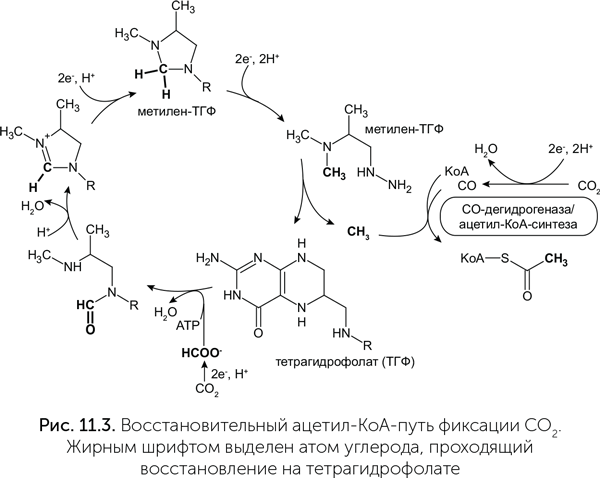
Кофермент А участвует во многих важных биохимических процессах (в том числе и в цикле Кребса, и в цикле Кальвина). Его задача — переносить остатки органических кислот на другие молекулы, например, ацетат (в главе 10 нам уже попадалось наименование этого соединения — «ацетил-КоА»). В восстановительном ацетил-КоА-пути одна молекула углекислого газа восстанавливается до муравьиной кислоты, связывается с коферментом тетрагидрофолатом (производное витамина В9) и восстанавливается далее до метильной группы (CH3). Другая молекула СО2 восстанавливается другим ферментом до угарного газа (СО) и присоединяется к метильной группе и коферменту А с образованием ацетил-КоА (рис. 11.3). Этот ацетил-КоА через цикл Кребса и другие метаболические пути становится источником углерода для всех веществ в клетке.
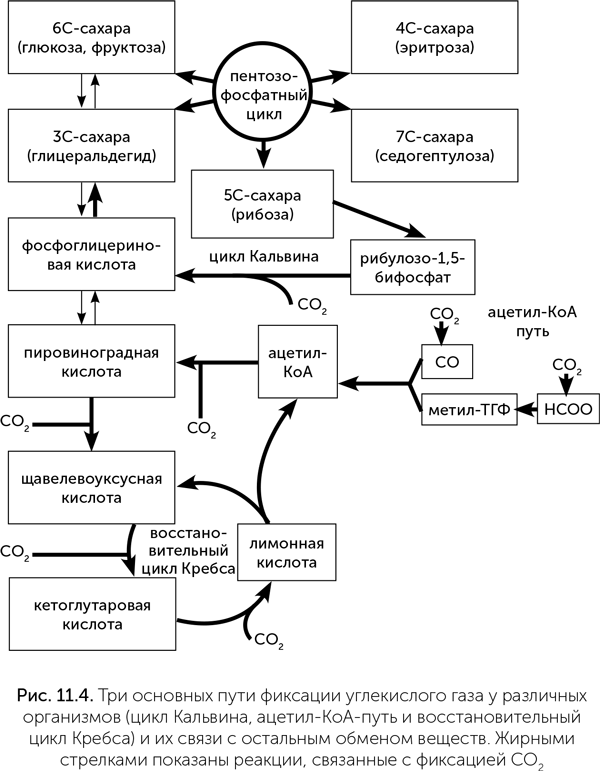
Цикл Кальвина и восстановительный ацетил-КоА-путь представляют собой достаточно независимые «модули», которые подключаются к остальному метаболизму через одну промежуточную ступень, которую представляет либо глицеральдегид-фосфат, либо ацетил-КоА (рис. 11.4).
Кроме этих путей известен вариант фиксации СО2, который вписан в самый центр обмена веществ у некоторых микробов. Как мы помним, в цикле Кребса происходит распад уксусной кислоты до СО2 и водорода. Оказывается, есть организмы, которые проводят реакции цикла Кребса в обратную сторону, фиксируя с его помощью углекислый газ (рис. 11.5). Это зеленые серобактерии и некоторые другие фотосинтезирующие и хемосинтезирующие бактерии. Поскольку обычный цикл Кребса идет с выделением энергии, для проведения его реакций в обратную сторону необходимо затрачивать энергию в виде АТФ.
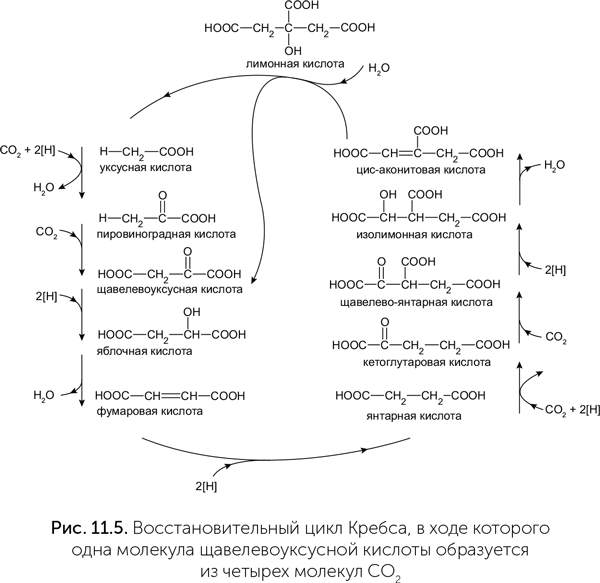
Существует гипотеза, согласно которой восстановительный цикл Кребса шел при помощи минеральных катализаторов еще до появления РНК и белков и, с побочными реакциями, создал аминокислоты и нуклеотиды из СО2 (Smith and Morowitz, 2004). Она основана на следующих фактах:
- обратный цикл Кребса является автокаталитической реакцией. С учетом ветви, в которой уксусная кислота превращается в щавелевоуксусную, за один оборот цикла из одной молекулы щавелевоуксусной кислоты и четырех молекул СО2 образуется две молекулы щавелевоуксусной кислоты. Следовательно, цикл может наращивать массу своих промежуточных веществ, потребляя СО2 и восстановитель из внешней среды;
- для реакций цикла Кребса не обязательны коферменты, кроме КоА, который в принципе можно заменить разными простыми сероорганическими веществами;
- все ферменты обратного цикла Кребса нуждаются только в одном металле (железе), водород поступает на носителе — ферредоксине (это простой белок с железосерными кластерами, о них подробнее было в главе 7), следовательно, есть надежда провести все реакции обратного цикла Кребса на поверхности какого-нибудь железосодержащего минерала;
- все реакции обратного цикла Кребса не требуют встречи двух молекул органических кислот друг с другом, следовательно, цикл устойчив к разбавлению своих реагентов.
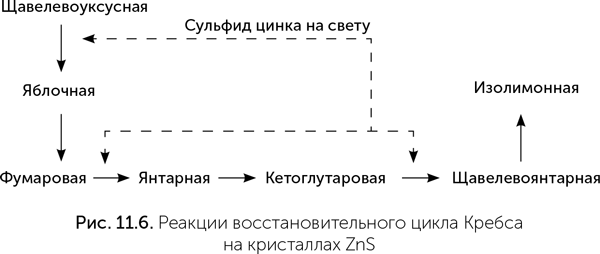
К сожалению, пока не удалось в эксперименте подобрать условия, в которых все эти реакции будут проходить на минеральных катализаторах с достаточной скоростью и выходом, чтобы цикл действительно стал автокаталитическим. На сегодняшний день экспериментально удалось провести только шесть из одиннадцати реакций восстановительного цикла Кребса, причем не на железосодержащих минералах, а на кристаллах сульфида цинка при освещении (рис. 11.6, Guzman, Martin, 2009.).
Организмы с другими путями фиксации СО2 могут использовать часть реакций восстановительного цикла Кребса. Например, метаногены и ацетогены с восстановительным ацетил-КоА-путем имеют часть ферментов этого цикла. Они могут, присоединяя СО2, превращать ацетил-КоА в пировиноградную, щавелевоуксусную и далее в кетоглутаровую кислоты, используя их для построения аминокислот. Реакций от кетоглутаровой до лимонной кислоты у них не происходит, цикл остается незамкнутым.
Порядок возникновения реакций обмена веществ
Если обмен веществ строился постепенно, начиная с фиксации СО2, то очевидно, что восстановительный цикл Кребса является лучшим кандидатом на роль самого древнего способа восстановления СО2 и включения его в органику, потому что с него начинаются синтезы аминокислот, сахаров и жиров. Использование восстановительного цикла Кребса позволяет обойтись меньшим количеством реакций и ферментов, чем в случае цикла Кальвина и восстановительного ацетил-КоА-пути. В таком случае цикл Кальвина и восстановительный ацетил-КоА-путь могли возникнуть позже, как более упорядоченные и специализированные способы фиксации углекислого газа. В самом деле, в восстановительном цикле Кребса есть четыре разные реакции включения СО2 в органику, в ацетил-КоА-пути — две, в цикле Кальвина — только одна. Поэтому цикл Кальвина проще оптимизировать для работы при малых концентрациях СО2, чем другие пути, и он преобладает в современной биосфере, где содержание СО2 в тысячи раз меньше, чем во времена зарождения жизни. Ацетил-КоА-путь, в отличие от других способов фиксации СО2, обходится без затрат АТФ и поэтому оптимален для организмов, сидящих на скудном энергетическом пайке, как метаногены.
Однако если обмен веществ строился с другой стороны — со стороны синтеза компонентов РНК для нужд РНК-мира, то обратный цикл Кребса уже не кажется удачным выбором. От кислот цикла Кребса что до рибозы, что до азотистых оснований в карте метаболизма нужно пройти очень много «шагов» — химических реакций. Цикл Кальвина в этом случае подходит лучше, так как он сразу дает рибозу. Более того, у некоторых микроорганизмов известен вариант цикла Кальвина, который начинается с нуклеотида аденозин-монофосфата (АМФ), что еще сильнее подчеркивает его связь с РНК-миром (Sato et al., 2007). Но непонятно, как связать цикл Кальвина с синтезом азотистых оснований.
Кроме того, как мы видели в предыдущих главах, древнейший обмен веществ РНК-мира строил сахара и азотистые основания из таких простых предшественников, как формальдегид, цианид и формамид. Хотя эти вещества в конечном итоге получались из СО2, необходимые для этого реакции были далеко разнесены в пространстве. Серпентинизация производила метан в толще земной коры при высокой температуре, а формальдегид и цианид получались из метана высоко в атмосфере, чтобы потом выпасть с дождем и оказаться в распоряжении РНК-организмов. Переход с питания формальдегидом и цианидом на восстановление СО2 своими силами мог произойти достаточно поздно, когда какие-то из современных путей метаболизма уже сложились. Как минимум для этого требовалось освоить синтез нескольких витаминов.
По крайней мере начиная с появления клеточных форм жизни — бактерий и архей — возможно проследить эволюцию этих путей методами сравнительной геномики по наличию и отсутствию соответствующих ферментов в реконструированных предковых геномах. Такой анализ был проведен (Braakman and Smith, 2012) и показал, что цикл Кальвина — довольно позднее изобретение цианобактерий. Два других пути фиксации СО2 оказались более древними: и восстановительный цикл Кребса, и восстановительный ацетил-КоА-путь были у общего предка всей клеточной жизни, давшего начало разным группам микроорганизмов. Это необычный результат, так как ни один современный организм не сочетает в себе два эти пути фиксации СО2 — благодаря промежуточному метаболизму все необходимые вещества можно произвести, имея только один путь получения органики из СО2. Авторы статьи считают, что сочетание двух путей повышало надежность обмена веществ. В самом деле, автокаталитические свойства восстановительного цикла Кребса могут быть не только преимуществом, но и недостатком. С одной стороны, если, например, из-за сбоев в регуляции синтеза аминокислот запас кислот цикла Кребса падает, то и скорость фиксации СО2 тоже падает, и эффективность цикла может уменьшиться ниже порога самовоспроизводства. В этом случае восстановительный ацетил-КоА-путь может быть независимым источником органики, подпитывающим ослабленный цикл Кребса и дающим ему шанс на продолжение. С другой стороны, при возникновении проблем с синтезом коферментов для ацетил-КоА-пути восстановительный цикл Кребса, мало зависящий от коферментов, дает клетке шанс на выживание. Скорее всего, общий предок бактерий и архей уступал обеим линиям своих потомков как в совершенстве систем регуляции, так и в качестве изоляции своей внутренней среды от внешних условий — например, у него были более проницаемые клеточные мембраны (подробнее об этом будет рассказано в следующей части книги). В дальнейшем, когда у клеток появились совершенные мембраны и надежные регуляторные системы, поддерживать сразу два пути фиксации СО2 стало уже невыгодно. Ацетил-КоА-путь фиксирует СО2 без затрат АТФ, но зато его ключевой фермент, CODH/ацетил-KoA синтетаза, очень уязвим для кислорода и других окислителей. Поэтому потомки оставили себе один из двух бывших у предка путей — какой именно, зависело от условий их обитания.
Чтобы проследить более древнюю историю обмена веществ, нам придется рассмотреть реакции синтеза азотистых оснований. Эти реакции при детальном рассмотрении выглядят довольно беспорядочно. Азотистые основания строятся из аминокислот (глицин, глутамин, аспарагиновая кислота) и необычных одноуглеродных продуктов (Martin and Russell, 2007). Пуриновые основания (аденин и гуанин) собираются буквально по одному атому, как лоскутное одеяло (рис. 11.7).
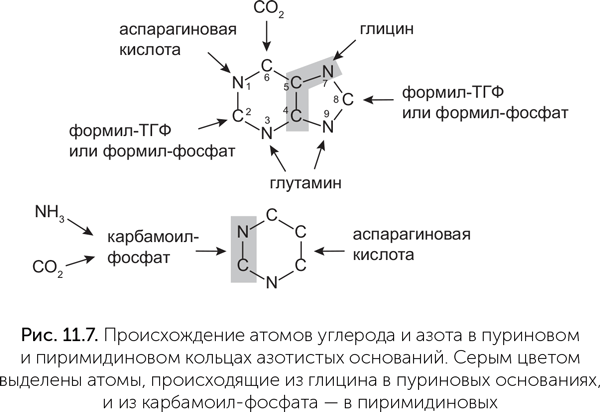
В состав пуринового кольца входят остаток глицина (практически целиком) и атомы азота, позаимствованные у других аминокислот — глутамина и аспарагиновой кислоты (атомы 1, 3 и 9 на рисунке пуринового основания). Два из пяти углеродных атомов кольца, однако, включаются при синтезе в виде формильной группы формил-тетрагидрофолата (т.е. муравьиной кислоты на носителе, атомы 2 и 8 на рисунке), а еще один — из СО2 в виде карбоксил-фосфата, простого фосфатного эфира (атом 6). Пиримидиновое кольцо строится из аспарагиновой кислоты и карбамоил-фосфата — вещества, которое образуется в клетках из СО2, аммиака и фосфатной группы АТФ.
Иными словами, фиксация углекислого газа не является строгой монополией автотрофных растений и бактерий: даже в человеческом организме происходит фиксация небольшого количества СО2 при синтезе азотистых оснований. В каждой клетке вашего тела во многих нуклеотидах один атом углерода происходит из углекислого газа, зафиксированного вашими собственными ферментами!
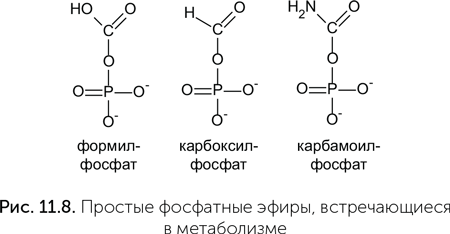
Кроме карбамоил-фосфата и карбоксил-фосфата в синтезе азотистых оснований могут участвовать другие простые фосфатные эфиры (рис. 11.8). Муравьиная кислота у некоторых микробов, например Methanocaldococcus jannaschii, может включаться в пурины в виде формил-фосфата.
Фолатный путь восстановления одноуглеродных групп
В ацетил-КоА-пути фиксации углекислого газа у микробов-метаногенов и ацетогенов участвует фолиевая кислота (витамин В9). Ее активная форма называется тетрагидрофолат, или сокращенно ТГФ). Она участвует в переносе, окислении и восстановлении одноуглеродных фрагментов. Формы витамина В9 с присоединенными одноуглеродными фрагментами называются формил-тетрагидрофолат (ТГФ), метилен-ТГФ и метил-ТГФ. Однако витамин В9 необходим и в организме человека, хотя человек не обладает способностью к фиксации углекислого газа по ацетил-КоА-пути. Зачем витамин В9 нужен человеку и животным?
В обмене веществ животных одноуглеродные фрагменты тоже используются в некоторых реакциях. Например, метил-ТГФ служит источником метильных (СН3) групп для метилирования ДНК. Метилирование (присоединение метильных групп) азотистых оснований ДНК используется для включения и выключения генов. Поэтому самые тяжелые последствия недостаток витамина В9 в диете вызывает во время беременности — при этом часто возникают врожденные уродства плода.
Также в обмене веществ животных необходим формил-ТГФ, используемый, как и у микробов, для получения пуриновых азотистых оснований.
У микробов-метаногенов метил-ТГФ образуется в конечном счете из углекислого газа через муравьиную кислоту, формил-ТГФ и метилен-ТГФ (реакции 1, 2, 3, 4 на рисунке 11.9). У человека и животных нет ферментов для получения муравьиной кислоты из СО2, и источник формил-ТГФ и метил-ТГФ у них другой. Одноуглеродные фрагменты у них образуются при распаде аминокислоты серина. Серин сначала распадается на метилен-ТГФ и глицин, а затем глицин распадается на второй фрагмент метилен-ТГФ, углекислый газ и аммиак (реакции 5 и 6 на рис. 11.9). Серин образуется в несколько стадий из фосфоглицериновой кислоты (промежуточный продукт гликолиза) (реакция 7 на рис. 11.9).
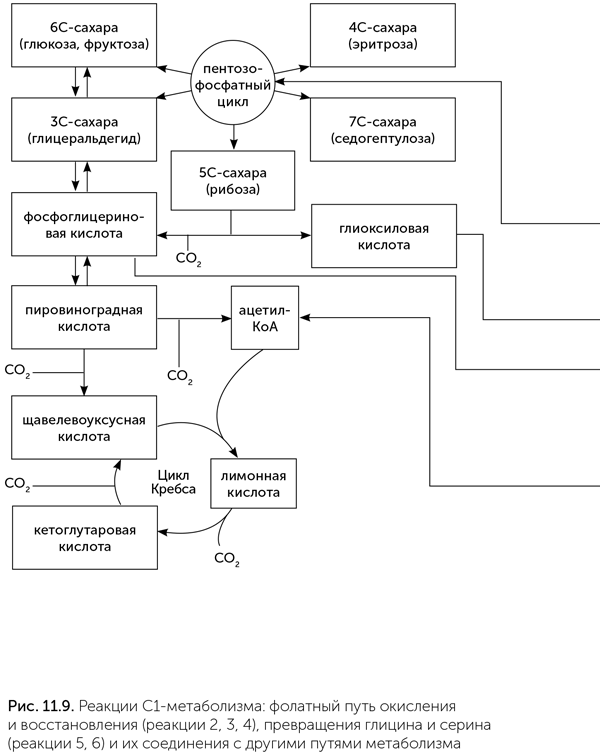

Эти реакции, в которых атомы углерода окисляются, восстанавливаются и переносятся по одному, выглядят несколько чужеродными по сравнению с остальной биохимией. Гораздо чаще новые молекулы в клетках строятся не из отдельных углеродных субъединиц, а на основе более крупных блоков, таких как двухуглеродный ацетил-КоА и трехуглеродная пировиноградная кислота.
Фолатные реакции и взаимопревращения глицина и серина образуют отдельный модуль обмена веществ, который долго был незаслуженно обойден вниманием исследователей. Большинство аминокислот образуются из продуктов цикла Кребса: аланин, валин и лейцин — из пировиноградной; аспарагиновая, треонин, изолейцин и лизин — из щавелевоуксусной; глутаминовая, пролин и аргинин — из кетоглутаровой. Однако есть аминокислоты другого происхождения. Гистидин образуется из азотистых оснований (аденина), а глицин и серин связаны с обменом одноуглеродных групп.. Молекула глицина может распадаться на метиленовый фрагмент на носителе-фолате, CO2 и NH3, а может быть собрана из двух метиленовых фрагментов и NH3. В разных частях этого цикла восстановление и окисление не всегда обратимо, поэтому при распаде возникает СО2, а при синтезе используются только метиленовые группы. Синтез и распад глицина (реакция 6 на рисунке) и превращение глицина в серин (реакция 5) полностью обратимы, так же как окисление и восстановление атомов углерода (на биохимическом жаргоне их называют С1-фрагменты) на фолате (реакции 3 и 4). Этот биохимический модуль может иметь разные соединения с другими путями метаболизма и внешней средой. В обмене веществ человека, животных и эволюционно молодых групп бактерий (например, протеобактерий, к которым относится кишечная палочка) есть путь синтеза серина из фосфоглицериновой кислоты (промежуточный продукт гликолиза) (реакция 7 на рис. 11.9). В этом случае глицин образуется из серина, метилен-ТГФ — из глицина, а фолатный путь работает от середины к двум концам — к формил-ТГФ и метил-ТГФ. Часть метиленовых групп окисляется до формильных для синтеза пуринов, а другие восстанавливаются в метильные для реакций метилирования. У растений и цианобактерий мы видим другую связь одноуглеродного метаболизма с остальным — через глицин. И формил-ТГФ, и метил-ТГФ, и серин у них образуются из глицина. Глицин, в свою очередь, образуется путем аминирования глиоксиловой кислоты (реакция 8). Глиоксиловая кислота у них образуется в нежелательной побочной реакции рибулозо-бифосфата с кислородом и должна как-то утилизироваться. В этом случае фолатный путь работает так же, как у животных: от середины к обоим концам.
Как у животных, так и у растений одноуглеродный метаболизм питается от основного. У микробов с ацетил-КоА-путем фиксации углекислого газа, наоборот, практически весь обмен веществ питается через одноуглеродный метаболизм.
Удивительный результат Браакмана и Смита состоит в том, что у многих микроорганизмов нет никаких связей между одноуглеродным блоком и остальным обменом веществ. У них нет ни ферментов окислительного серинового пути (реакция 7), ни глиоксилат-трансаминазы, превращающей глиоксиловую кислоту в глицин (реакция 8). Зато фермент формат-дегидрогеназа, проводящий реакцию 1, оказался очень широко распространен в разных группах микроорганизмов, использующих как различные пути фиксации СО2, так и питающихся готовой органикой. Это означает, что фолат-глицин-сериновый модуль метаболизма у многих микробов вообще не соединен с остальным обменом веществ и работает с углеродом, полученным только из внешней среды! Такое странное устройство обмена веществ наводит на мысль, что связи одноуглеродного метаболизма с остальным неоднократно возникали и исчезали в ходе эволюции.
Питаться муравьиной кислотой и угарным газом проще, чем углекислым газом
Почему, собственно, мы пытаемся восстановить эволюцию обмена веществ начиная с фиксации СО2? Углекислый газ — устойчивое вещество, и его восстановление без хороших катализаторов и при умеренных температурах идет очень медленно. В цикле Кальвина это проявляется в том, что восстановление углерода и включение СО2 в органику происходит на разных шагах. В ацетил-КоА-пути для восстановления СО2 используются сложные ферменты, содержащие молибден (формат-дегидрогеназа, с ее помощью получается муравьиная кислота) или никель (СО-дегидрогеназа, с ее участием производится, как видно из наименования, угарный газ). При абиогенных способах восстановления высокий энергетический порог активации этой реакции преодолевается с помощью ультрафиолета (в цинковом мире), высокой температуры (серпентинизация) или обходится через реакцию с сероводородом, дающую карбонилсульфид (железосерный мир). Однако, где бы ни существовал РНК-мир, строящий все более сложный обмен веществ, ему помимо СО2 были доступны и другие, более активные одноуглеродные вещества — например, муравьиная кислота, формальдегид и угарный газ. Муравьиная кислота на суше образуется в результате фотосинтеза на сульфиде цинка, а в море — за счет фотохимических реакций СО2 с растворенным железом; кроме того, она выносится геотермальными источниками из толщи земной коры, где образуется при реакциях горячей воды с базальтами. Формальдегид падает с неба с дождями, где он возникает при фотолизе метана. Угарный газ выделяется в составе вулканических газов и образуется в большом количестве при сгорании метеоритов в углекислотной атмосфере. Участие муравьиной кислоты в синтезе пуринов позволяет предположить, что этот биохимический путь сложился еще до появления ферментов фиксации СО2, когда жизнь довольствовалась муравьиной кислотой и формальдегидом. Гипотеза, что фиксация формальдегида и муравьиной кислоты предшествовала фиксации СО2, не нова — ее высказали еще в 1978 году Род Квэйл и Томас Ференци (Quayle and Ferenci, 1978).
Организмы, способные питаться восстановленными одноуглеродными соединениями (метаном, метанолом, метиламином, метилмеркаптаном, формальдегидом и муравьиной кислотой), существуют и сегодня. Это метилотрофные бактерии. В природе им чаще всего достаются метан и метанол, но в лаборатории они могут жить и на формальдегиде, и на муравьиной кислоте. Включение всех этих веществ в метаболизм метилотрофов происходит несколькими способами. Сначала все одноуглеродные вещества связываются с тетрагидрофолатом с затратой энергии АТФ. Получается формил-тетрагидрофолат. Затем возникают различия. Одни метилотрофы используют ацетил-КоА-путь. В нем, напомню, метил-ТГФ, полученный из метана и метанола, реагирует с угарным газом и коферментом А, давая ацетил-КоА. Другие метилотрофы окисляют метил-ТГФ до метилен-ТГФ; формил-ТГФ (из муравьиной кислоты) восстанавливается до того же метилен-ТГФ. После этого метилен-ТГФ распадается, высвобождая формальдегид (реакция 10 на рис. 11.9).
Затем включается рибулозо-монофосфатный цикл. Входящим веществом этого цикла служит формальдегид: попадая в рибулозо-фосфатный цикл, он превращается в сахара (рис. 11.10). Рибулозо-фосфатный цикл похож на пентозофосфатный цикл и цикл Кальвина и фактически представляет собой упорядоченную реакцию Бутлерова.
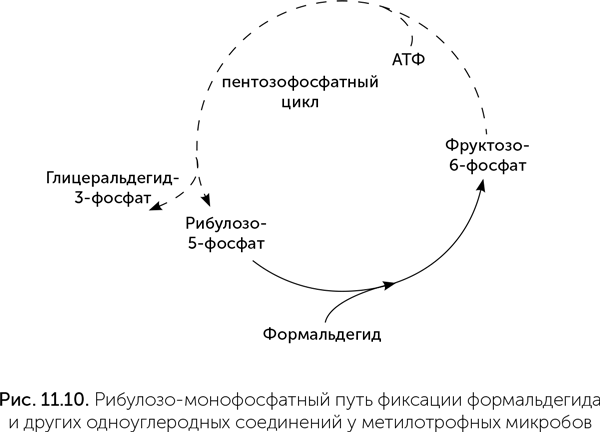
Есть и еще один вариант метилотрофного обмена веществ, в котором свободный формальдегид не участвует, а вместо этого метилен-ТГФ реагирует с глицином, образуя серин (реакция 5 на рис. 11.9) (Rothschild, 2008). Дальнейшие превращения серина обратно в глицин с вводом углерода в центральный обмен веществ (сериновый цикл) сложны. Судя по данным сравнительной геномики, сериновый цикл возник довольно поздно и заимствовал ферменты из многих других биохимических путей. Рибулозо-монофосфатный и сериновый циклы представляют собой еще два варианта связи между одноуглеродным и основным метаболизмом.
Выбор между разными способами включения углерода в обмен веществ у метилотрофов диктуется условиями среды. В анаэробных условиях выгоднее ацетил-КоА-путь, потому что он обходится без высвобождения ядовитого формальдегида (формалин, 4%-ный водный раствор формальдегида, используется как дезинфицирующее средство). Но ключевой фермент ацетил-КоА-пути уязвим к кислороду, поэтому в аэробных условиях приходится использовать рибулозо-монофосфатный и сериновый циклы. Рибулозо-монофосфатный и сериновый циклы появились как приспособление метилотрофного образа жизни к кислородной среде, несовместимой с ацетил-КоА-путем. Однако рибулозо-монофосфатный цикл, питаемый свободным формальдегидом, может быть похож на древнейшие пути синтеза сахаров, которые возникли из упорядочения реакции Бутлерова и тоже использовали формальдегид.
Становление обмена веществ
Современный обмен веществ появился не сразу. Скорее всего, его становление прошло через много последовательных стадий. Мы можем попробовать восстановить путь развития обмена веществ начиная от мира РНК и до клеточных организмов современного типа, таких как бактерии.
Обмен веществ должен делать нужные для организма вещества из тех, что есть в наличии. Для организмов РНК-мира были нужны прежде всего нуклеотиды и их компоненты — рибоза и азотистые основания. Круг веществ, которые были доступны для РНК-организмов во внешней среде, мы уже очертили в главах 6 и 7: это углекислый газ, формальдегид, муравьиная кислота, формамид, синильная кислота и ее производные (цианамид и цианоацетилен) и, скорее всего, аммиак (NH3) и угарный газ (СО).
Для получения рибозы из этого списка лучше всего подходит формальдегид, легко вступающий в реакцию Бутлерова. В современных клетках взаимные превращения сахаров (в цикле Кальвина и пентозофосфатном цикле) происходят по тому же механизму альдольной конденсации, что и стадии реакции Бутлерова. Более того, у ряда метилотрофных микробов мы встречаем рибулозо-монофосфатный цикл, производящий сахара непосредственно из формальдегида. Скорее всего, у РНК-организмов действовал какой-то примитивный вариант рибулозо-монофосфатного цикла под контролем рибозимов.
Азотистые основания нуждаются в других веществах-предшественниках. До появления жизни они могли строиться из цианида или формамида, как было рассказано в главе 7. В клетках для построения азотистых оснований используются аминокислоты (глицин и аспарагиновая кислота), муравьиная кислота (в форме формил-ТГФ или формил-фосфата), углекислый газ и карбамоил-фосфат. Кроме того, часть азота для пуриновых оснований поступает в составе третьей аминокислоты — глутамина, но его можно заменить просто достаточным количеством аммиака. Муравьиная кислота, СО2 и аммиак доступны в среде. Карбамоил-фосфат похож на формамид, соединенный с фосфатной группой, и возможно, занял место формамида в древнейшем обмене веществ. Глицин образуется в глициновом цикле, например, из муравьиной кислоты и аммиака.
Сложнее определить источник аспарагиновой кислоты. В клетках она образуется из щавелевоуксусной кислоты и аммиака. Щавелевоуксусная кислота является промежуточным продуктом цикла Кребса. Щавелевоуксусная и другие кислоты цикла Кребса образуются, например, из СО2 на кристаллах сульфида цинка при освещении, или из формамида на кристаллах оксида титана, или из синильной кислоты при чередовании освещения и нагревания в темноте. Иными словами, в среде, где есть кристаллы сульфида цинка, формамид или синильная кислота, какое-то количество аспарагиновой кислоты неизбежно получится. РНК-организмы могут при помощи рибозимов ускорять и стабилизировать любой из этих путей получения аспарагиновой кислоты.
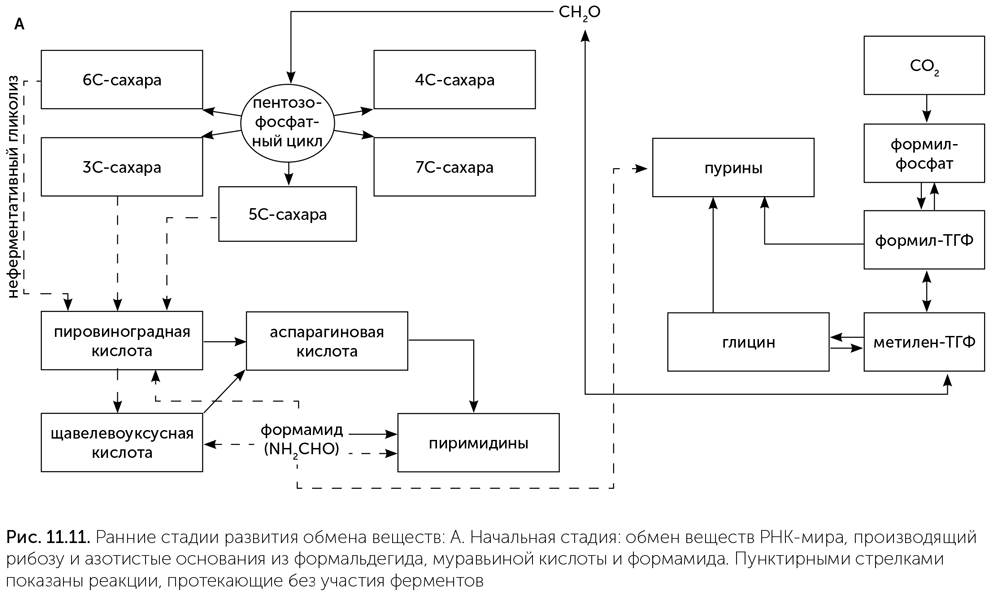
Иначе говоря, на этой стадии обмен веществ РНК-организмов имеет два относительно независимых блока: сахарный (родственный реакции Бутлерова и рибулозо-монофосфатному циклу), питаемый формальдегидом, и одноуглеродный, питаемый муравьиной кислотой и производящий глицин и пуриновые нуклеотиды (рис. 11.11. А). Связь между этими двумя блоками осуществлялась через формальдегид и метилен-ТГФ. Метилен-ТГФ может распадаться, давая формальдегид, если во внешней среде его вдруг окажется недостаточно для синтеза сахаров. Кроме того, есть какие-то химические реакции для получения аспарагиновой кислоты, но мы не знаем, какие именно.
Переход ко второй стадии связан с появлением первых белков и увеличением потребности в разнообразных аминокислотах для их построения. Большинство аминокислот, входящих в состав белков, образуются из трех кислот цикла Кребса: пировиноградной, щавелевоуксусной и кетоглутаровой. Все эти кислоты образуются из формамида или на кристаллах сульфида цинка, но с небольшим выходом, поэтому с переходом к белкам нужен более надежный их источник. К этому моменту РНК-организмы уже освоили синтез сахаров. Сахара — не очень стабильные вещества, которые постепенно разлагаются, особенно при повышенной температуре. Основным продуктом их распада является пировиноградная кислота. Различные сахарофосфаты (глюкозо-6-фосфат, рибозо-5-фосфат, глицеральдегид-3-фосфат) превращаются в пировиноградную кислоту просто при нагревании до 70 оС в растворе с солями железа (Keller, 2014). Превращение глюкозы в пировиноградную кислоту в три шага (через глюконовую кислоту и кетодезоксиглюконовую кислоту) происходит с достаточной скоростью даже при комнатной температуре в присутствии двух аминокислот — цистеина и гистидина (Shimizu et al., 2008). Эти и другие подобные реакции, постепенно переходя под контроль рибозимов и ферментов, были примитивными предшественниками гликолиза. Превращение пировиноградной кислоты в щавелевоуксусную и далее в кетоглутаровую происходит в восстановительном цикле Кребса. Эти реакции проходят на кристаллах сульфида цинка, но с небольшой эффективностью, и с повышением потребности в аминокислотах были взяты под контроль рибозимов и ферментов. На этой стадии возникает примитивный гликолиз и часть восстановительного цикла Кребса — от пировиноградной кислоты до кетоглутаровой (рис. 11.11. Б).
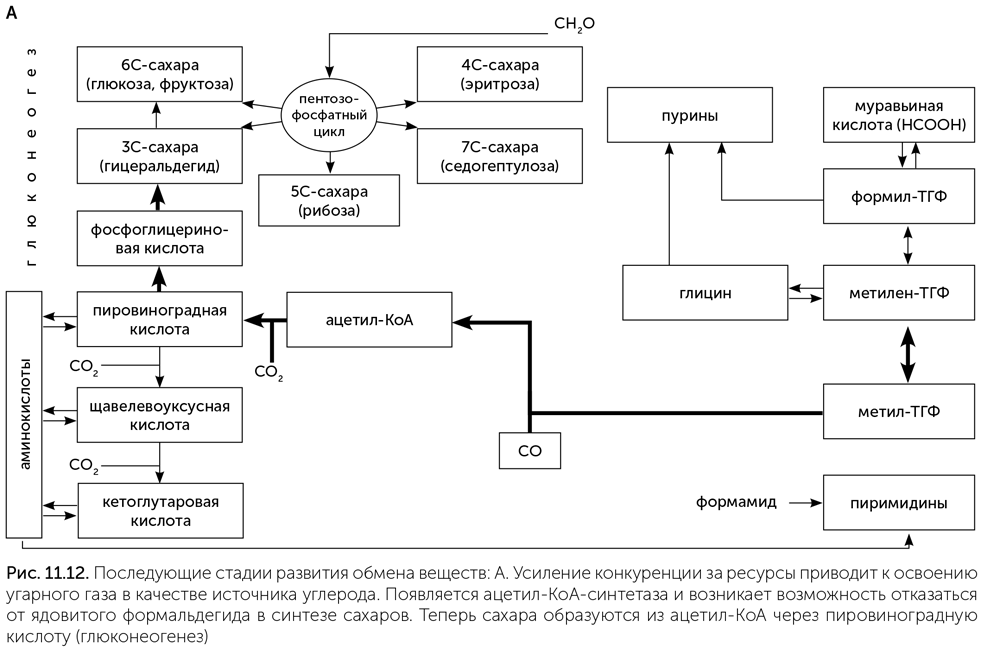
По мере развития жизни конкуренция за основные ресурсы — муравьиную кислоту и формальдегид — обостряется. В выигрыше оказываются те организмы, которые сумели освоить новые источники углерода. Например, это мог быть угарный газ (СО). Третья стадия развития обмена веществ начинается с появления фермента ацетил-КоА-синтетазы. Этот фермент соединяет метильную (СН3) группу метил-ТГФ с молекулой угарного газа и коферментом А, образуя ацетил-КоА. Появление ацетил-КоА-синтетазы открывает доступ к новому источнику углерода — угарному газу и позволяет пережить нехватку муравьиной кислоты. Вторым следствием появления этого фермента становится возникновение новой связи между одноуглеродным блоком обмена веществ, построенным вокруг реакций с участием витамина В9, и остальным обменом веществ (рис. 11.12. А). Если раньше для превращения муравьиной кислоты в рибозу и аминокислоты приходилось использовать ядовитый формальдегид в качестве промежуточного продукта, то теперь появилась возможность заменить этот путь на более безопасный, через ацетил-КоА и пировиноградную кислоту. Если раньше пировиноградная кислота получалась из сахаров, то теперь, наоборот, нужен способ получать сахара из пировиноградной кислоты. Для получения рибозы и других сахаров из ацетил-КоА через пировиноградную кислоту возникает глюконеогенез — обращение реакций гликолиза. Так путь от доступных в окружающей среде соединений углерода (муравьиная кислота и СО) к рибозе стал намного длиннее, но безопаснее.
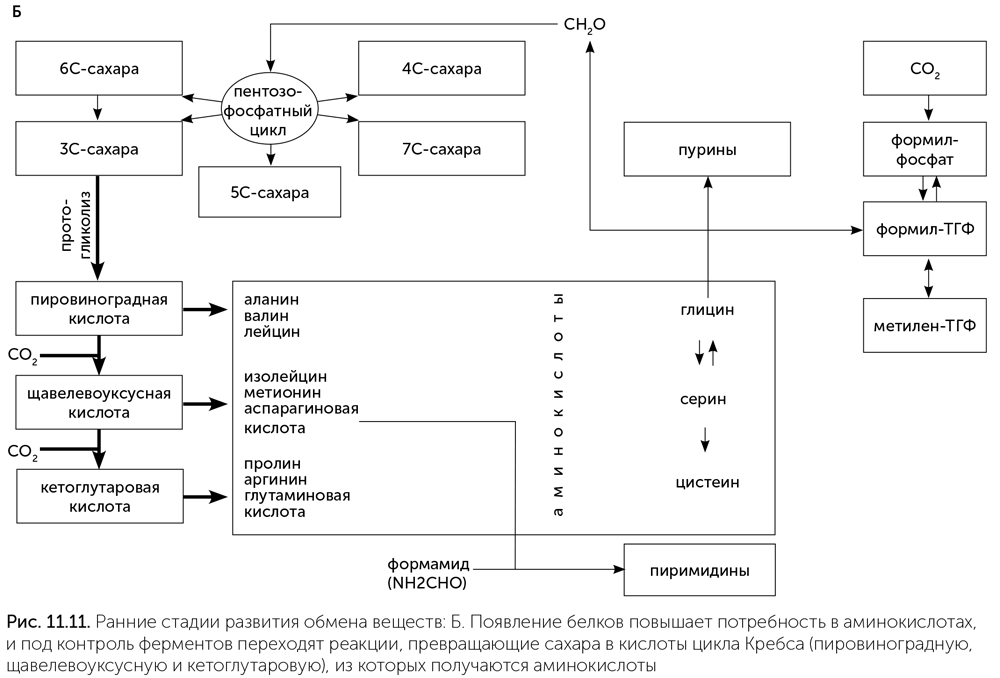
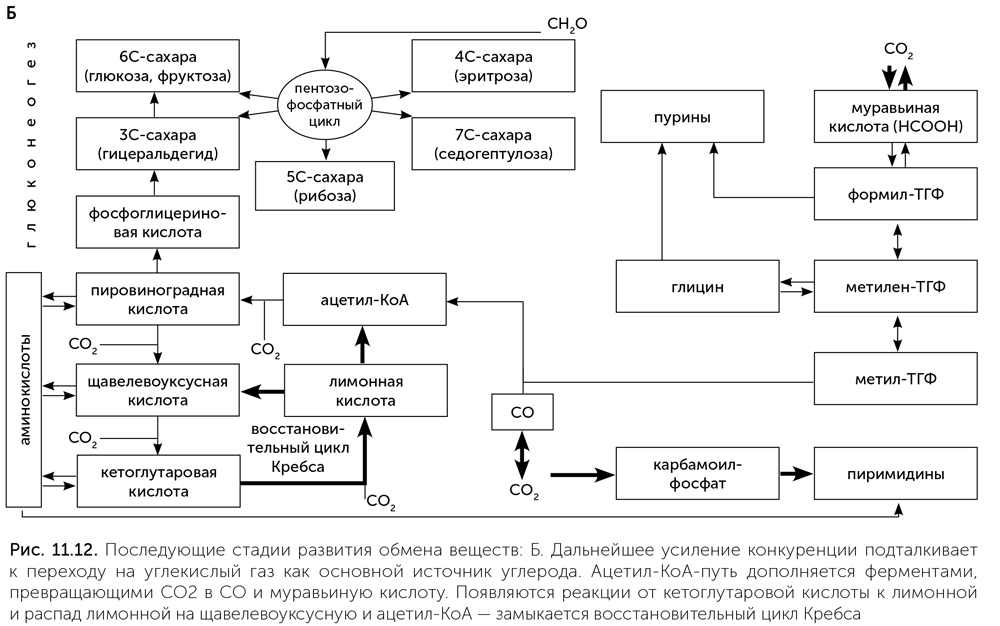
Далее в истории метаболизма происходят новые изменения. Протоклетки снижали свою зависимость от сульфида цинка и других минеральных катализаторов, замещая их ферментами, а нарастающий дефицит муравьиной кислоты, формамида и угарного раза вынуждал их переходить к потреблению углекислого газа. Появляется формат-дегидрогеназа, содержащая молибден: она восстанавливает СО2 до муравьиной кислоты для работы фолатного пути. Наконец, у ацетил-КоА-синтетазы возник второй активный центр с никель-железосерным кластером, позволяющий ей восстанавливать СО2 до СО. Так появился полностью автотрофный обмен веществ, способный строить все аминокислоты, нуклеотиды и витамины из углекислого газа в качестве единственного источника углерода, а также обладающий высокой устойчивостью за счет дублирования путей фиксации СО2 (рис. 11.12. Б). Такой обмен веществ, скорее всего, и был у последнего всеобщего предка клеточной жизни.
Итак, обмен веществ развивался и усложнялся в двух направлениях. Во-первых, он переходил от сложных и дефицитных исходных веществ к простым и легкодоступным: от рибозы и азотистых оснований — к формальдегиду и цианиду, потом — к муравьиной кислоте и угарному газу и, наконец, — к углекислому газу. Во-вторых, обмен веществ сначала строился вокруг производства компонентов РНК (рибозы и азотистых оснований), а затем основным направлением стало получение аминокислот для сборки белков.
Давний спор о способе питания первых живых организмов (автотрофный или гетеротрофный), похоже, разрешился. Первые РНК-организмы питались готовыми азотистыми основаниями и рибозой, т.е. гетеротрофным способом. Потом они усложнялись и переходили к питанию более простыми веществами. Хотя все эти готовые органические вещества (рибоза, азотистые основания, цианид, формальдегид, муравьиная кислота) в конечном итоге получались из СО2, это происходило без участия живых организмов. В современном мире круговорот углерода замыкается в основном благодаря живым организмам: автотрофы производят органику из СО2, а гетеротрофы потребляют органику, в конечном итоге превращая ее обратно в углекислый газ. Но пока жизнь делала самые первые шаги, она не могла поддерживать все эти процессы, и часть углеродного круговорота, освоенная потом автотрофами, обеспечивалась только силами неживой природы.
Какое-то время организмы позднего РНК-мира и раннего РНК-белкового мира сочетали усвоение углекислого газа, муравьиной кислоты и при случае также формальдегида и угарного газа. Иначе говоря, они сочетали в себе признаки автотрофов и гетеротрофов. Здесь хорошо видно, что местами между ними проведена довольно искусственная граница. Муравьиная кислота — органическое вещество, а угарный газ — неорганическое. Поэтому микробы, способные питаться угарным газом, должны называться автотрофами, а потребители муравьиной кислоты — гетеротрофами, хотя различия между ними сводятся буквально к одному-двум ферментам.
В конечном итоге жизнь освоила построение всех необходимых молекул из СО2, и появились действительно автотрофные клетки. Но произошло это, судя по всему, уже после появления белков и системы их производства (рибосомы). До этого жизнь успела достичь немалой сложности, питаясь муравьиной кислотой.
Такие привычные нам пути обмена веществ, как гликолиз, похоже, появились позднее. Классический гликолиз состоит из 12 последовательных реакций, и все ради того, чтобы выжать немного энергии в виде АТФ из превращения глюкозы в пируват. Если нам просто нужно получить пируват из сахаров, достаточно использовать упрощенный гликолиз, проходящий в три стадии при помощи свободных аминокислот, т.е. даже без ферментов. С выходом клеток из геотермальной «колыбели» с ее разнообразными источниками энергии в большой мир обмен веществ оптимизировался по экономичности. В том числе возник гликолиз современного типа, позволяющий получать энергию путем брожения сахаров.

