Альтернативная биохимия и водно-углеродный шовинизм
Определение жизни
В предыдущих главах мы проследили возникновение жизни на планете Земля с начала и до стадии сложного РНК-мира, использующего витамины. Теперь попробуем оценить возможность зарождения жизни в других условиях и на иной химической основе. Если на современной Земле мы можем легко отличить живые организмы (животные, растения, простейшие, бактерии, вирусы) от неживых систем, то по отношению к другим планетам нам придется определиться, что считать жизнью. Земная жизнь отличается от неживой природы множеством признаков, но какие из них обязательны для любой формы жизни, а какие обусловлены историческим путем ее развития на нашей планете, понять не так-то просто.
Многие ученые давали свои определения жизни. Очень часто они оказывались просто списком признаков, таких как рост, размножение, обмен веществ, самоорганизация, приспособляемость, наследственность, генетический код и возможность смерти. Эти списки не отражают представления о связи признаков между собой, не дают обоснования их независимости и достаточности для определения жизни. Хорошее определение должно охватывать базовые принципы организации и движущие силы явления, но в случае жизни дать такое определение оказалось очень трудно (Ruiz-Mirazo et al., 2004).
Пожалуй, наиболее серьезное и всестороннее обсуждение вопроса «Что такое жизнь?» проходило на экспертных советах NASA. Понятно, что искать в космосе жизнь, похожую на земную, проще, поскольку мы лучше представляем, что и где ищем — небесные тела, на которых как минимум есть жидкая вода. Представление о том, что любая инопланетная жизнь в главных чертах похожа на земную, критиковал великий астроном и член экспертного совета NASA Карл Саган. Он назвал эту позицию «водно-углеродным шовинизмом» и считал, что она обусловлена недостатком воображения.
Организаторов космических исследований беспокоит возможность того, что мы встретим жизнь в Солнечной системе, но наш «водно-углеродный шовинизм» помешает нам опознать ее как жизнь. Это будет очень обидно и, кроме того, вызовет вопросы о бездарно потраченных деньгах налогоплательщиков. Поэтому исследователи собрали группу ведущих ученых и попросили их максимально подробно рассмотреть все возможные варианты жизни, наметить пути экспериментальной проверки этих предположений и дать рекомендации по устройству приборов, которые надо ставить на космические зонды для обнаружения тех или иных форм жизни на Марсе, Европе, Титане или в других местах Солнечной системы.
По результатам работы экспертных советов в экзобиологических программах NASA было принято такое рабочее определение: «Жизнь — это химическая система, способная к дарвиновской эволюции» («The Limits of Organic Life in Planetary Systems», 2007). Что это значит?
Детали живых систем — это разнообразные и сложные органические молекулы. Между ними происходят упорядоченные химические реакции — обмен веществ. Обмен веществ регулируется и ускоряется специальными катализаторами — ферментами. Структура ферментов записана в наследуемой информации — геноме. Геном тоже представляет собой специальную молекулу — ДНК или РНК. Существуют нехимические системы, способные к дарвиновской эволюции. Вы можете организовать такую систему у себя на компьютере, установив на него какую-нибудь среду эволюционного программирования, например DEAP. Поскольку эволюционирующие программы в компьютере не имеют отношения к химии, мы не считаем их живыми.
Для эволюции по Дарвину (путем случайных мутаций и естественного отбора) необходимы и достаточны четыре условия. Во-первых, эволюционирующие единицы (организмы или программы) должны порождать собственные копии (размножение). Во-вторых, копирование должно быть не совсем точным (мутации). В-третьих, ошибки копирования должны передаваться следующим копиям (наследственность). И, наконец, ошибки копирования должны влиять на вероятность дальнейшего копирования данной программы или организма (отбор). Известны химические системы, способные к размножению. Например, кристалл, растущий в насыщенном растворе соли, можно расколоть, и осколки станут центрами роста новых кристаллов. Более того, в этом случае возможно появление дефектов, т.е. мутации. Но эти дефекты не наследуются: структура кристалла определяется строением атомов и молекул, из которых он строится, а не структурой затравки. Поэтому такая система тоже не может считаться живой. Автокаталитические химические системы также обладают способностью к размножению своих единиц (например, молекул сахаров в реакции Бутлерова), но не имеют наследственности.
Химические свойства биомолекул, которые важны для их функции
В биохимии широко используется принцип конструктора LEGO. Большие молекулы строятся из мономеров — маленьких кирпичиков, соединенных однотипными связями: белки — из аминокислот, ДНК — из нуклеотидов, полисахариды (целлюлоза, крахмал) — из сахаров. Структура мономера образована прежде всего атомами углерода, соединенными прочными связями C-C. Мономеры между собой связаны менее прочными связями: эфирными (С-О) или пептидными (-СO-NH-). В водной среде разрыв этих связей с участием воды (гидролиз) происходит без затрат энергии, нужен только подходящий катализатор.
С одной стороны, такое устройство позволяет легко разбирать ненужные белки и РНК на мономеры и собирать из них новые белки и РНК без повреждений самих мономеров. С другой стороны, в процессе обмена веществ прочные углерод-углеродные связи внутри аминокислот и нуклеотидов приходится образовывать и разрывать, чтобы создать новые вещества и утилизировать ненужные. Иными словами, основные химические связи в молекулах, составляющих живой организм, должны быть «по умолчанию» достаточно прочными, но должен существовать способ их ослабить, чтобы превращать одни вещества в другие.
В случае нашей земной жизни эти свойства реализованы с помощью углерода, кислорода, азота и водорода. Атомы углерода образуют прочные связи друг с другом и с водородом, поэтому соединения этих двух элементов (углеводороды) химически неактивны. Даже высокоразвитая жизнь с эффективными ферментами с трудом справляется с их расщеплением: лишь немногие бактерии способны питаться углеводородами, например, нефти, поэтому ее разливы и опасны для окружающей среды. Для ослабления связей С-С в биохимии используется, как правило, кислород. Карбонильная группа (С=О) в молекулах придает им химическую активность и позволяет легко создавать и разрушать связи С-С. Если вспомнить, как происходит образование новых и разрыв старых связей C-C в реакциях обмена веществ, то окажется, что почти всегда в этом участвует карбонильная группа. Она есть в составе ацетил-КоА, кетокислотах цикла Кребса и сахарах. Если необходимо соединить или разорвать углерод-углеродную связь там, где этой группы нет, то она сначала будет создана путем окисления, а затем использована для изменения скелета молекулы. Иногда вместо нее применяется иминогруппа (C=NH) с похожими свойствами.
Для хранения и копирования генетической информации очень удобны полимеры, образующие, подобно ДНК, две параллельные цепи, которые обеспечивают избыточность хранения, возможность исправить возникшие повреждения и простой механизм копирования: две цепи разделяются, и на каждой из них собирается новая парная ей цепь. Для генетического полимера желательно, чтобы он принимал линейную форму, а не сворачивался в клубки. ДНК содержит фосфатные группы, которые в воде несут отрицательный электрический заряд. Электростатическое отталкивание этих фосфатных групп способствует поддержанию относительно прямой формы ДНК. Наконец, физические и химические свойства генетической молекулы должны минимально зависеть от ее последовательности, несущей информацию, чтобы не нарушать взаимодействие с системой копирования. Это тоже достигается благодаря электрическому заряду фосфатных групп, распределенных по длине ДНК. Аналог ДНК, в котором фосфаты заменены на незаряженные диметилен-сульфоновые мостики (SNA — sulfone-linked DNA analog), сворачивается в клубки подобно белкам, его свойства (растворимость, способность к реакциям) сильно зависят от последовательности. В обычной ДНК соединение оснований в пары упорядочено тем же электрическим зарядом остова молекулы: остовы двух цепей отталкиваются друг от друга, и поэтому основания могут контактировать друг с другом только одной своей стороной, наиболее далекой от остова. В двухцепочечной форме SNA азотистые основания двух цепей соединяются не только в уотсон-криковские пары (А с Т и Г с Ц), но и множеством других способов, используя любые стороны молекулы, а не только самую дальнюю от остова цепи.
В качестве ферментов в земной жизни используются в основном белки. Есть два самых распространенных способа, с помощью которых разные ферменты ускоряют нужные химические реакции и подавляют побочные. Это связывание реагирующих молекул так, чтобы они контактировали только нужными сторонами, и проведение реакции в «кармане», внутри молекулы фермента, в относительно безводной среде. И то и другое требует, чтобы молекула фермента была определенным образом свернута. Белки идеально подходят для сворачивания, потому что остов белковой цепи лишен глобального электрического заряда. Аминокислоты в белке соединяются пептидными связями (-CO-NH-). Каждая такая связь несет небольшой отрицательный заряд на кислороде и небольшой положительный — на водороде, т.е. является диполем. Благодаря притяжению между диполями белки образуют свернутые структуры, такие как альфа-спираль и бета-слой (подробнее в главе 13). Другие типы связи между мономерами, например эфирная С-О-С, не обладают дипольными свойствами. Возможны только два аналога пептидной связи с аналогичными дипольными свойствами — сульфонамидная (-SO2-NH-) и фосфонамидная связь (-HPO2-NH-) (рис. 12.1).
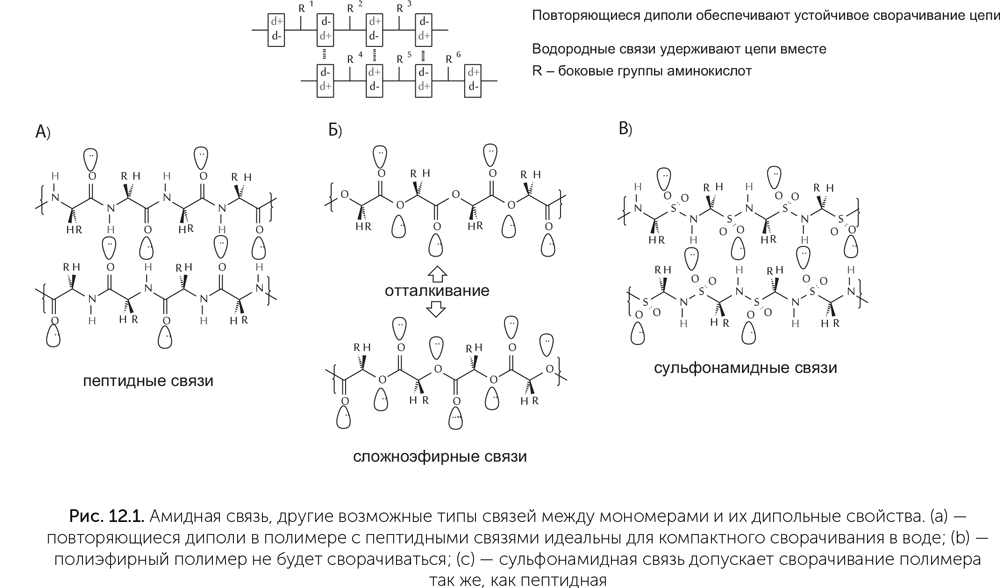
Всякий раз, когда мы задаем вопросы «Почему так?» и «Почему бы не по-другому?» об устройстве живых систем, возможны три группы ответов. Во-первых, выбор одного варианта из нескольких возможных может быть функциональным: жизнь пробовала разные варианты, и самый выгодный вытеснил все прочие. Во-вторых, выбор мог быть результатом исторической случайности: пространство вариантов устройства молекул очень велико (только для небольшого белка из 100 аминокислот возможны 20100 вариантов последовательности — это гораздо больше, чем атомов во Вселенной), и жизнь, что очевидно, не могла перепробовать все возможные варианты. В-третьих, выбор может быть рудиментарным: когда-то давно он был функциональным и лучше всего подходил для решения какой-то проблемы, которая давно уже неактуальна, а потом менять что-либо было уже поздно.
Можно проиллюстрировать три типа приведенных ответов на примере выбора азотистых оснований. Пара А-Т связана слабее, чем G-C (две водородных связи, а не три). Если заменить аденин на аминоаденин, то пара аА-Т будет тоже иметь три водородные связи. Такая замена позволила бы повысить точность копирования ДНК. Однако аминоаденин в ДНК не используется. Возможное функциональное объяснение: для оптимальной работы генома нужен выбор между сильными и слабыми связями в парах нуклеотидов. Рудиментарное объяснение: аденин устойчив к ультрафиолетовому излучению. В современных клетках это свойство аденина больше не важно, но менять аденин на другие молекулы уже слишком сложно. Объяснение путем исторической случайности: аденин легко образуется абиогенно из цианида или формамида, в отличие от аминоаденина, поэтому генетические механизмы сформировались раньше, чем появилась возможность попробовать аминоаденин.
Во всех случаях, когда мы спрашиваем «Почему бы не по-другому?», полезно пытаться придумать все три типа ответов, даже если мы не можем экспериментально их проверить.
Выбор химических элементов
Биомолекулы на 99% состоят из четырех элементов: углерода, водорода, кислорода, азота. Оставшийся процент приходится в основном на фосфор и серу. Какие общие свойства отличают эти элементы?
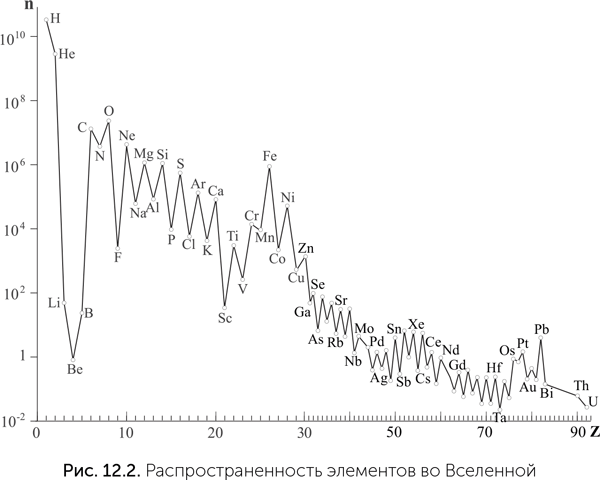
Во-первых, их очень много: все они, кроме фосфора, входят в десятку самых распространенных во Вселенной (рис. 12.2). Во-вторых, все эти элементы отличаются малыми размерами атомов. Размер атома определяется радиусом, на котором находятся самые внешние (валентные) электроны, и сложно зависит от положения атома в таблице Менделеева. В каждом периоде размер атома уменьшается с повышением атомного номера, потому что заряд ядра растет, и притяжение электронов к ядру усиливается. Но при переходе к следующему периоду появляется следующая электронная оболочка, и размер атома увеличивается скачком. C, N, O, P, S занимают правый верхний угол таблицы Менделеева и являются самыми маленькими атомами с валентностью 2 (O), 3 (N), 4 (C), 5 (P) и 6 (S), а водород — самый маленький атом с валентностью 1. В-третьих, все они, кроме водорода, образуют двойные и тройные химические связи. Помимо С, N, O, P и S стабильные двойные связи известны только у хлора, брома, мышьяка и селена.
Молекулы с двойными связями очень важны в биологии. Это азотистые основания (аденин, гуанин, цитозин, урацил), большинство витаминов, гем, хлорофилл и многие другие. Благодаря длинным системам сопряженных двойных связей биомолекулы могут взаимодействовать с видимым светом, обеспечивая окраску и фотосинтез. Кольцевые системы двойных связей в азотистых основаниях обеспечивают их плоскую форму и стэкинг-взаимодействие между соседними основаниями. Стэкинг-взаимодействие облегчает рост цепи при копировании и повышает устойчивость ДНК к ультрафиолету.
Сера и фосфор играют особую роль в биохимии. Их связи с другими атомами менее прочные, чем связи углерода, кислорода и азота. Поэтому фосфор и сера незаменимы в нестабильных промежуточных веществах биохимических реакций, для временного хранения энергии и переноса групп атомов с одних молекул на другие. Энергия, запасенная в фосфоэфирных (P-O-P и P-O-C) связях таких веществ, как АТФ, ацетилфосфат и креатинфосфат, используется для сшивания аминокислот в белки, нуклеотидов — в ДНК и других химических реакций. Сера используется для переноса кислотных групп на коферменте А (ацетил-КоА, сукцинил-КоА и т.д.), при этом энергия, запасенная в тиоэфирной связи (C-S-CO), расходуется на создание новых связей С-С. Другой серосодержащий кофермент, S-аденозил-метионин, аналогично переносит метильные (CH3) группы и тоже участвует в создании новых связей С-С.
Углерод образует до четырех прочных связей с другими атомами, и из него легко строятся цепочки и разветвленные молекулы. Кремний практически не уступает ему в этом отношении (рис. 12.3). Более того, на поверхности Земли кремния в 150 раз больше, чем углерода, следовательно, доступность углерода не была причиной его выбора для биохимии.
Хотя кремний действительно находится под углеродом в таблице Менделеева и во многом похож на него по свойствам, между ними есть и серьезные различия. Кремний обладает большим атомным радиусом, чем углерод, и поэтому прочность связи Si-Si вдвое меньше, чем связи C–C, а Si-H— меньше, чем C-H. Углерод легко образует двойные связи, в которых расстояние между атомами меньше, чем в обычных.
Кремний из-за большего размера атома практически не способен участвовать в двойных связях. В оксиде углерода CO2 углерод связан двойными связями с двумя атомами кислорода, и при обычных условиях СО2 — газ. В оксиде кремния SiO2 каждый атом Si связан одинарными связями с четырьмя атомами кислорода, каждый из которых образует мостик между двумя атомами кремния. Поэтому SiO2 образует твердые тугоплавкие кристаллы, например кварц.
Многие соединения кремния более химически активны, чем их аналоги с углеродом. Если метан (СН4) не реагирует с водой ни в обычных условиях, ни при сильном нагревании, то силан (SiH4) при комнатной температуре быстро разлагается водой с выделением водорода и кремниевой кислоты:
SiH4 + 3H2O → 2H2 + H2SiO3.
В подобные реакции вступают и многие другие соединения кремния, где атомы кремния не связаны с кислородом или азотом. Химик сказал бы примерно следующее: «Кремний — элемент третьего периода, поэтому его атом имеет незаполненные 3d-орбитали, которые позволяют ему проявлять электрофильные свойства и легче вступать в реакции с нуклеофилами».
Так что кремний, с одной стороны, образует очень прочные и устойчивые связи с кислородом, которые, в отличие от связей С-С, практически невозможно ослабить, а с другой — большинство других его химических связей неустойчивы в присутствии воды, аммиака и кислот. Поэтому практически в любых известных в космосе условиях кремний находится в виде устойчивых кристаллов оксида кремния и силикатов, иногда — карбидов и нитридов кремния, но не образует тех сложных молекул, которые получены в лаборатории. Углерод же не только на планетах, но и в межзвездных газово-пылевых облаках легко образует разнообразные органические соединения.
Известны и другие элементы, которые образуют сложные и разнообразные молекулы. Например, сосед углерода слева в периодической системе — бор. Его атом имеет три валентных (образующих химические связи) электрона, поэтому с кислородом образует три связи (например, в борной кислоте H3BO3). При этом атом бора не может достроить свою внешнюю электронную оболочку до восьми и образует уникальные дополнительные связи, охватывающие сразу три атома (рис. 12.4, справа).
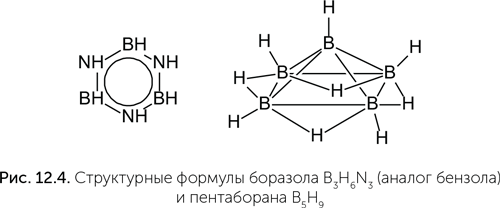
В паре с азотом он может образовать близкие аналоги органических соединений углерода: например, боразол — неорганический аналог бензола. К сожалению, большинство соединений бора химически очень активны и легко реагируют с водой, образуя борную кислоту. Но это не главный недостаток бора. Гораздо хуже то, что во Вселенной его крайне мало, примерно в 1 млн раз меньше, чем углерода. Ядра атомов бора менее устойчивы, чем ядра углерода и гелия, и в звездах бор быстро превращается в гелий и углерод. Те скромные количества бора, которые все же есть, образовались в результате ядерных реакций в газово-пылевых облаках под действием космических лучей. Таким образом, существование жизни на основе бора запрещено ядерной физикой.
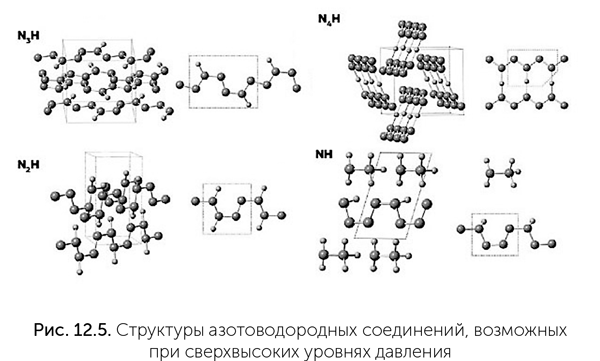
Очень экзотические сложные молекулы могут быть возможны на основе азота при сверхвысоких давлениях. Как предсказано в работах Артема Оганова (профессор Нью-Йоркского университета в Стоуни-Брук и Сколковского института науки и технологий), при давлениях выше 360 000 атмосфер азот может образовывать устойчивые разнообразные цепочки, кольца и плоские слои. Разнообразие азотоводородных молекул в этих условиях не уступает разнообразию углеводородов при обычном давлении (рис. 12.5). К сожалению, это разнообразие известно только по квантово-механическому моделированию поведения атомов и молекул. Проверить эти расчеты экспериментально очень трудно, потому что такие уровни давления достижимы лишь в очень малых объемах на гидравлических прессах с алмазными столами. В природе подобные условия могут существовать в глубинах водно-аммиачно-метановых океанов Урана и Нептуна.
Много шума вызвала публикация, сообщавшая о бактерии, которая заменила часть фосфора в своих клетках на мышьяк (Wolfe-Simon et al., 2010). Однако более тщательные исследования опровергли этот результат. Как оказалось, это просто бактерия, устойчивая к мышьяку, в том числе и внутри клетки. В состав ее ДНК и других веществ входит фосфор, а не мышьяк, как и у всех других земных организмов.
Альтернативная биохимия на тех же элементах
Как мы видим, реальной альтернативы углероду, кислороду и азоту не существует. Но, может быть, на основе этих же элементов возможна другая биохимия, непохожая на земную? Такое исключить нельзя. Возможны, например, другие растворители, кроме воды, и в них неизбежно будет совсем другая биохимия. Единственное действительно уникальное свойство воды — меньшая плотность льда по сравнению с жидкой водой. Благодаря этому водоемы зимой замерзают с поверхности, и потом слой льда замедляет потерю тепла и предотвращает полное промерзание. В озерах из других жидкостей при охлаждении твердое вещество будет тонуть, и полное промерзание наступит быстро. С точки зрения обитателей озера эта особенность воды очень полезна. Но для биосферы в целом, наоборот, такое поведение воды вредно. Лед на поверхности озер и морей отражает солнечный свет гораздо лучше, чем вода, что приводит к дополнительному остыванию планеты. Поэтому наступление ледников — самоподдерживающийся процесс. Если бы вместо воды наши моря состояли из любой другой жидкости, то климат планеты Земля был бы устойчивее.
Очевидный кандидат на замену воды — жидкий аммиак. Его молекулы тоже полярны и образуют много водородных связей, он остается жидким в широком диапазоне температур (от –78 до –33 оС при обычном давлении) и хорошо растворяет разные полярные вещества. В аммиачном растворе биохимия неизбежно будет другой, так как карбонильные (С=О) группы, очень важные для нашей земной биохимии, в аммиаке быстро превращаются в иминогруппы (C=NH). В среде аммиака иминогруппы обеспечивают такие же перестройки углеродных скелетов, как C=O в воде. Аммиак по сравнению с водой имеет тот недостаток, что в нем гораздо лучше растворяются неполярные молекулы. Поэтому липидные мембраны, ограничивающие наши клетки в водной среде, в аммиаке будут работать плохо.
Если мы посмотрим на нашу Солнечную систему, то увидим, что, в отличие от воды, аммиак в чистом виде в ней не встречается. Везде, где есть много аммиака, он смешан с водой и часто еще с метаном, будь то бездонные океаны Урана и Нептуна, ледяные кометы, спутники дальних планет и объекты пояса Койпера. На Титане водяной лед содержит 10–15% аммиака. Под ледяной корой Титана находится глубокий водно-аммиачный океан. Водно-аммиачная смесь по нескольким признакам лучше подходит для биохимии, чем чистый аммиак. По сравнению с ним она замерзает при еще более низких температурах (до –96 оС) и не растворяет углеводороды, поэтому в ней возможно существование липидных мембран, как и в воде. В водно-аммиачной смеси реакции обмена веществ могут происходить с помощью как С=О групп, так и C=NH, что допускает бóльшую гибкость, чем наша земная биохимия.
Еще один возможный растворитель — серная кислота. Она замерзает при +10 оС и кипит при +290 оС, прекрасно растворяет разные вещества и встречается в космосе в чистом виде, например в облаках Венеры. На поверхности планет, потерявших воду аналогично Венере, но более прохладных, возможно существование жидкой серной кислоты. В серной кислоте достаточно легко идут разные химические реакции, и роль карбонильной группы С=О в ней может играть просто двойная связь между атомами углерода: С=СН2 (рис. 12.6).
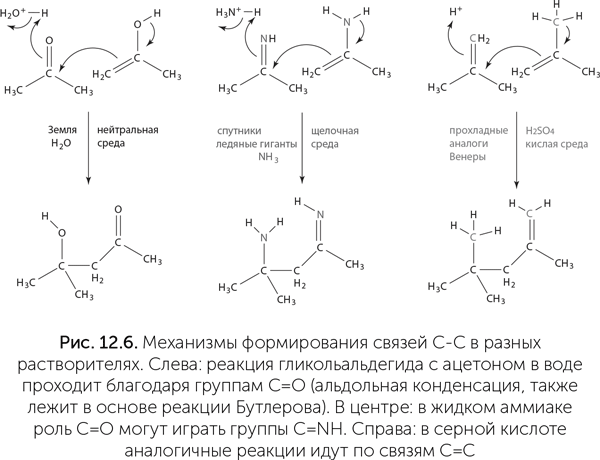
Хотя мы не можем предсказать, какие молекулы будут использоваться живыми существами в аммиаке или серной кислоте, понятно, что наши азотистые основания не подойдут для генетических полимеров в такой среде. Уотсон-криковские пары образуются только в нейтральной среде (pH от 6 до 9). В кислой среде к аминогруппам (NH2) аденина и цитозина присоединяются протоны, дающие положительный заряд, а в щелочной среде, наоборот, гуанин и урацил теряют протоны и получают отрицательный заряд на месте карбонильной группы (С=О). И то и другое нарушает водородные связи между основаниями и делает эти основания непригодными для хранения генетической информации. Поэтому все микробы, населяющие сильнокислые или щелочные среды на Земле, поддерживают внутри клетки нейтральный pH, даже если на это уходит много энергии.
Еще воду можно заменить жидкой углекислотой. При обычном давлении она не существует (сухой лед сразу переходит в газ, минуя жидкую стадию), но при повышении давления становится жидкостью. При давлении 70 атмосфер СО2 остается жидким в диапазоне температур от –50 до +31 оС, а при более высоких температурах и уровнях давления переходит в сверхкритическое состояние. Сверхкритическое состояние вещества наступает при температуре и давлении выше критической точки (для СO2 это 31 оС и 74 атмосферы, для воды — 374 оС и 218 атмосфер), оно сочетает плотность жидкости и подвижность газа и растворяет разные вещества гораздо активнее, чем обычная жидкость.
Жидкая углекислота растворяет многие вещества не хуже воды. Более того, она во многом совместима с существующей биохимией. Например, липазы и ряд других ферментов в сверхкритическом СО2 работают даже активнее, чем в водной среде, и в биотехнологии это свойство уже нашло применение. Хотя сверхкритический СО2 используется для мягкой стерилизации пищевых продуктов, его антибактериальное действие связано только с растворением клеточных мембран. Ни белки, ни нуклеиновые кислоты в СО2 не страдают. Известны штаммы плесени и бактерий (например, Pseudomonas putida), которые благодаря особому составу липидов устойчивы к некоторым органическим растворителям. Они сохраняют жизнеспособность и в сверхкритическом СО2 (Budisa и Schulze-Makuch, 2014).
Как оказалось, существуют природные микробные сообщества, приспособленные к жизни в жидкой углекислоте. На дне Окинавского желоба (Восточно-Китайское море) были найдены гидротермальные поля, на которых из недр на поверхность дна выходит жидкий СО2. Японские океанологи, исследуя этот район, обнаружили на поле Йонагуни Кнолл IV на глубине 1380 м целое озеро жидкого СО2, скрытого в толще осадков на морском дне (Inagaki et al., 2006). Диаметр озера достигает 200 м, толщина слоя жидкого СО2 — около 30 см, температура — от +3 до +10 оС. В пропитанных СО2 неконсолидированных глинистых осадках над озером обитает разнообразное микробное сообщество с численностью до 1 млрд клеток на 1 см3, которое питается, окисляя идущий снизу метан и сероводород. В толще углекислотного озера есть те же самые микробы, но их численность меньше. Так что среда жидкого СО2 вполне совместима с жизнью, и она может иметь много общего с привычной нам жизнью в водной среде. Если на Земле жидкий СО2 встречается в отдельных местах на глубине, то на более массивной планете («суперземля»), получающей меньше солнечного тепла, возможны океаны жидкого СО2 с небольшой примесью воды на поверхности. Жизнь на такой планете может использовать белки и нуклеиновые кислоты, похожие на земные, но иметь совершенно другие материалы клеточных мембран.
Еще один возможный альтернативный растворитель — формамид (NH2CHO). Этот органический растворитель достаточно безопасен для живых клеток. Он даже используется в смесях для криоконсервации тканей и клеток, так как защищает их мембраны от разрыва ледяными кристаллами. Формамид легко образуется при взаимодействии синильной кислоты с водой. Он остается жидким при температурах от +3 до +220 оС, и по удельной теплоте испарения сравним с водой. Формамид растворяет большинство веществ, растворимых в воде. Как мы помним по предыдущим главам, очень вероятно, что наша земная жизнь делала самые первые шаги не в воде, а в водно-формамидных растворах. Можно себе представить планету, на которой формамид образует не только маленькие лужицы, но и озера, и моря. Жизнь в такой среде может иметь те же азотистые основания, что и у нас, но, скорее всего, другой набор аминокислот и другие клеточные мембраны.
Альтернативные варианты биохимии на древней Земле. Ксенонуклеиновые кислоты
Мир РНК, который мы рассматривали в предыдущих главах, тоже является альтернативным вариантом биохимии по сравнению с современной земной жизнью. В самом деле, мир РНК не использует белки, которые стали важнейшей и неотъемлемой частью современной биохимии. Однако РНК не очень устойчива, а ее получение полностью абиогенным путем (без участия каких-то ферментов белковой, РНК или другой природы) очень сложно и наталкивается на много препятствий, часть которых была преодолена совсем недавно, а другие остаются актуальными до сих пор.
Многие ученые пошли дальше и предположили, что миру РНК тоже предшествовала какая-то другая, более простая жизнь, использующая другие молекулы. Эти предшественники РНК должны были легче получаться абиогенно и обладать большей устойчивостью по сравнению с РНК. Чтобы хранить генетическую информацию и со временем уступить место РНК, эти молекулы должны были содержать те же азотистые основания, что и РНК, или хотя бы совместимые с ними по комплементарным парам, а остов этих молекул должен допускать их соединение с РНК в двойную спираль, состоящую из двух химически различных цепей (такая конструкция называется «гетеродуплекс»). Молекулы, удовлетворяющие этим требованиям, получили название «ксенонуклеиновые кислоты».
В разделе «Пребиотическая химия альтернативных нуклеиновых кислот» (Cleaves II and Bada, 2012) сборника «Бытие — что было в начале» (Genesis — In the Beginning) собрана информация о свойствах различных ксенонуклеиновых кислот и об их возможных образованиях на древней Земле. Идеи о замене азотистых оснований, хотя и высказывались, но не получили широкого распространения. Во-первых, стандартные азотистые основания легко и с высоким выходом получаются абиогенно (из синильной кислоты или из формамида) и достаточно устойчивы для накопления. Во-вторых, альтернативные азотистые основания, как правило, несовместимы со стандартными, а для тех, что совместимы, сложно найти какие-то преимущества по сравнению с обычным набором. В-третьих, высокая устойчивость к ультрафиолету (см. главу 6) уникальна для стандартных оснований и не встречается ни у каких их аналогов.
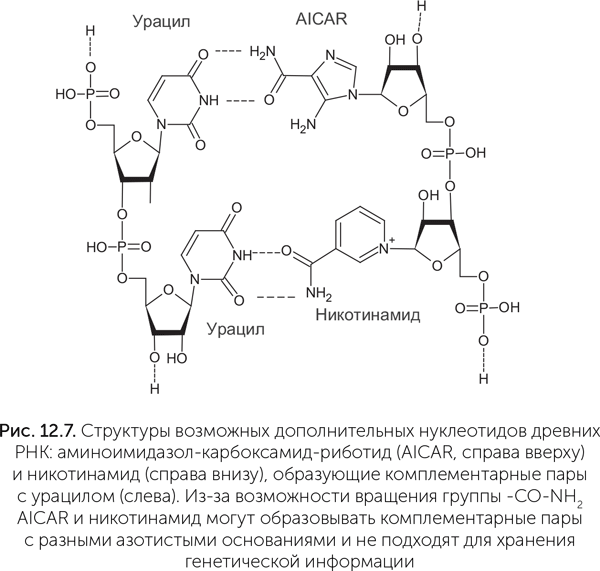
По этим причинам сейчас серьезно обсуждаются только два варианта расширения (не замены) набора азотистых оснований. Первым таким кандидатом в древние азотистые основания РНК является никотинамид, производное витамина РР, входящий в состав кофермента НАД. Как обсуждалось в главе 10, никотинамид в НАД связан с рибозой и фосфатом как обычное азотистое основание и придает рибозимам новые полезные свойства. В составе генетической молекулы никотинамид может замещать гуанин, образуя пару с цитозином (Liu and Orgel, 1995). Другое возможное дополнение к набору азотистых оснований — группа предшественников аденина и гуанина. Это прежде всего аминоимидазол-карбоксамид-риботид (AICAR), который получается как промежуточный продукт в ходе их синтеза. Эта молекула содержит пятичленное имидазольное кольцо с двумя атомами азота (рис. 12.7) и в составе РНК образует комплементарную пару с аденином (Bernhardt, Sandwick, 2014). AICAR является предшественником не только пуринов, но и важной аминокислоты — гистидина. Чаще всех других аминокислот гистидин встречается в активных центрах ферментов, и AICAR, сходный с ним по строению, мог выполнять аналогичные функции в древних рибозимах. AICAR образуется в небольших количествах при нагревании и облучении формамида, наряду со стандартными азотистыми основаниями. Иначе говоря, расширение набора азотистых оснований имеет смысл для улучшения каталитических свойств РНК, но при этом для хранения наследственной информации стандартный набор А, Г, Ц, У, по-видимому, лучший из всех веществ, которые были доступны на древней Земле.
Почему для хранения наследственной информации используются четыре вида азотистых оснований, а не два, шесть или восемь? Как мы помним из главы 6, синтетические азотистые основания позволяют расширить алфавит ДНК до шести букв. Более того, получены синтетические основания, образующие пару только сами с собой, и с ними можно получить алфавит с нечетным числом знаков, например, три или пять. Возможно, дело в устойчивости к ультрафиолету: в природе только четыре основания оснований оказались устойчивыми. Но почему природа не ограничилась двухбуквенным алфавитом?
Как обсуждается в обзоре Эёша Шатмари (Szathmary, 2003), двухбуквенный алфавит можно копировать более точно, чем четырехбуквенный. Четыре азотистых основания отличаются двумя параметрами: размером (A и Г большие, Ц и T маленькие) и положением водородных связей. Размер — более важное различие. Замены основания на другое такого же размера (A на Г или Ц на T) в геномах большинства организмов происходят от двух до пяти раз чаще, чем замены с изменением размера. Синтез четырех нуклеотидов требует больше ферментов, чем двух. Для точного копирования ДНК концентрации всех нуклеотидов в клетке должны быть по возможности равными. Поддерживать равные концентрации четырех нуклеотидов сложнее, чем двух. Получается, что для основной современной функции ДНК — хранения информации о последовательности белков — четырехнуклеотидный алфавит подходит хуже, чем двухнуклеотидный.
Четырехнуклеотидный алфавит оказывается лучше, чем все прочие, когда дело доходит до образования шпилечной структуры РНК. Математическое моделирование показывает, что РНК-подобная молекула с двумя типами оснований, как правило, имеет множество вариантов сворачивания в различные шпилечные структуры. Для РНК с четырьмя типами оснований обычно есть одна или две устойчивые структуры (Valba et al., 2012). Эксперименты с созданием рибозимов из РНК с ограниченным выбором нуклеотидов (три или даже два из четырех) это подтверждают: при меньшем разнообразии звеньев рибозимы возникают с меньшей вероятностью, и их эффективность ниже, чем у четырехнуклеотидных аналогов (Reader and Joyce, 2002).
Треозонуклеиновые и гликоленуклеиновые кислоты
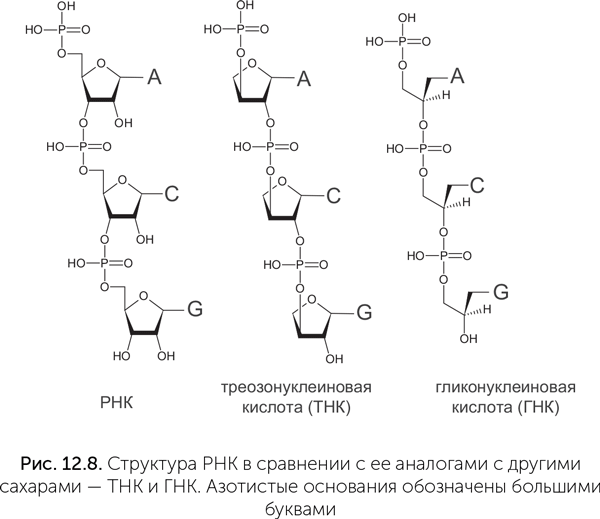
Гораздо больше внимания ученые уделяли поиску альтернатив сахарофосфатному остову РНК, потому что «слабым звеном» РНК является рибоза. Она менее устойчива, чем другие сахара (глюкоза, эритроза, глицеральдегид), и быстрее разлагается. В составе цепочки РНК много неприятностей доставляют гидроксильные (-ОН) группы на втором углеродном атоме каждой рибозы. Они облегчают разрыв цепи РНК. Современная генетическая молекула, ДНК, не имеет этих групп и поэтому, в отличие от РНК, устойчива к щелочам, ионам железа, переносит более высокие температуры, а в нормальных внутриклеточных условиях в десятки тысяч раз менее склонна к самопроизвольным разрывам по сравнению с РНК. Поэтому много исследований было посвящено двум ксенонуклеиновым кислотам, в которых рибоза заменена на четырехуглеродный сахар (треозу) или трехуглеродный спирт (глицерин) — треозонуклеиновая кислота, ТНК, и гликоленуклеиновая кислота, ГНК (рис. 12.8).
Молекулы треозонуклеиновой кислоты (ТНК) образуют двойные спирали друг с другом и с РНК благодаря комплементарным парам азотистых оснований. Прочность связи двух нитей в таких комплексах примерно такая же, как в двуспиральной ДНК (Schoning et al., 2000). Были получены мутантные формы РНК-полимеразы, которые способны строить ТНК на матрице ДНК, и с их помощью удалось адаптировать для ТНК технологию искусственного отбора (SELEX), применяемую для получения новых рибозимов. Так, из ТНК удалось получить аптамеры — молекулы, которые избирательно связывают одно определенное вещество, в данном случае белок тромбин (Yu et al., 2012).
Гликоленуклеиновая кислота (ГНК) была подробно изучена на несколько лет позже, чем ТНК (Zhang et al., 2005). Молекулы ГНК, подобно ТНК, образуют двойную спираль друг с другом и с РНК. Форма нити ГНК такова, что уотсон-криковские пары в ней оказываются прочнее, чем в РНК, поэтому копирование ГНК на заре жизни могло быть более точным, чем РНК. С другой стороны, эта же особенность ГНК требует более высокой температуры, чтобы расплести ее двойные спирали для следующего цикла копирования.
ТНК и ГНК, подобно ДНК, не имеют свободных гидроксильных (-ОН) групп рядом с фосфоэфирной связью и поэтому устойчивы к щелочам, железу и высокой температуре. Однако эти 2' — гидроксильные группы, которые делают РНК уязвимой, одновременно важны для ее каталитических функций. Попытки получить дезоксирибозимы из ДНК показали, что они встречаются в смеси молекул случайной последовательности с вероятностью в 10–100 раз меньше, чем аналогичные по функциям рибозимы из РНК (Silverman, 2004). Скорее всего, ТНК и ГНК по каталитической активности уступают РНК и близки к ДНК.
Еще один аргумент против роли ТНК и ГНК в происхождении жизни связан с проблемой соединения азотистых оснований с сахарами. Как обсуждалось в главе 7, азотистые основания невозможно правильно соединить с рибозой или другим сахаром без помощи ферментов. Все недавно открытые обходные пути получения нуклеотидов, в которых эта проблемная связь образуется до завершения сборки азотистого основания, строго привязаны к химическим свойствам рибозы и непригодны для получения нуклеотидов ТНК и ГНК. Наконец, факт существования ДНК, которая по надежности хранения информации не лучше ТНК, но заметно сложнее в синтезе и явно произошла в процессе эволюции от РНК уже после появления белков (подробнее см. в главе 14), тоже говорит против древней жизни с ТНК или ГНК. Если эти ксенонуклеиновые кислоты когда-либо использовались жизнью, то сложно придумать причину, по которой столь простые и надежные генетические молекулы были бы потеряны и затем заменены более сложной ДНК, — жизнь редко полностью отказывается от проверенных решений.
Пептидо-нуклеиновые кислоты
Кроме ТНК и ГНК были предложены и более радикальные альтернативы РНК, такие как пептидо-нуклеиновые кислоты (ПНК) (Nelson et al., 2000). Эти молекулы состоят из пептидной цепочки, сходной с таковой в белках, к которой присоединены азотистые основания (рис. 12.9). Пептидная цепь может состоять из разных аминокислот, не обязательно входящих в стандартный набор 20 белковых аминокислот. Пептидный остов отличается большей стабильностью по сравнению с любыми вариантами сахарофосфатного остова. Наиболее изучен вариант ПНК, остов которого состоит из звеньев N-аминоэтил-глицина (aeg-ПНК). Такая ПНК образует двойную спираль сама с собой и устойчивые гетеродуплексы с ДНК и РНК. В отличие от природных нуклеиновых кислот и большинства ксенонуклеиновых, звенья aeg-ПНК не содержат хиральных центров и не могут иметь левых и правых изомеров. Спираль, однако, имеет левую и правую формы. Одиночная нить aeg-ПНК может принимать и право-, и левоспиральную форму в гетеродуплексах с правой (природной) и левой ДНК. Двухцепочечная aeg-ПНК может легко менять хиральность спирали в зависимости от того, какие хиральные молекулы прикрепляются к ее концам. Значит, жизнь на основе aeg-ПНК могла отложить решение проблемы хиральной чистоты на более поздние этапы.
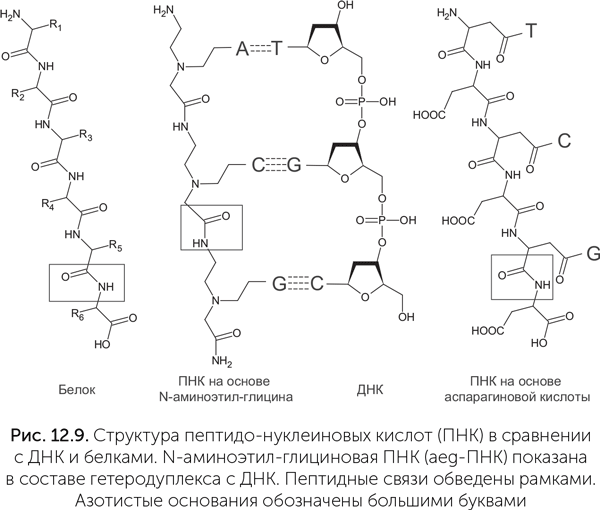
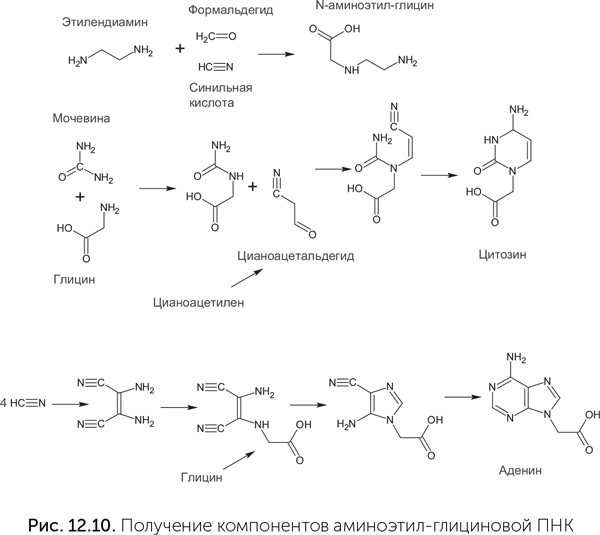
Для компонентов aeg-ПНК известен достаточно надежный абиогенный путь синтеза (Nielsen et al., 2007). Облучение растворов синильной кислоты с добавлением глицина и формальдегида дает одновременно N-аминоэтил-глицин для остова и четыре азотистых основания с ацетатными боковыми группами, которые нужны для их соединения с пептидным остовом (рис. 12.10).
Простой абиогенный синтез и отсутствие хиральности делают aeg-ПНК привлекательной в качестве главной молекулы древнейшей жизни, но другие ее свойства могут этому препятствовать. Как мы уже обсуждали, для хранения генетической информации лучше подходят молекулы с распределенным по всей длине электрическим зарядом, который мешает им свернуться в клубки. С одной стороны, aeg-ПНК не заряжена, и длинные ее цепи должны быть склонны к компактному сворачиванию. К сожалению, во время экспериментов пока исследовались только короткие, менее 20 звеньев, цепи ПНК. С другой стороны, в качестве катализатора ПНК благодаря компактному сворачиванию может быть лучше, чем РНК.
Более подходящий для хранения генетической информации вариант ПНК имеет остов из остатков аспарагиновой или глутаминовой кислоты, соединенных пептидными связями, как в обычных белках. Азотистые основания здесь прикрепляются к боковым COOH-группам аминокислот через одну. Половина СООН-групп остается свободной и обеспечивает отрицательный электрический заряд по всей длине молекулы (Mittapalli et al., 2007). К сожалению, пути абиогенного синтеза такой ПНК неизвестны. Так что пока мы не можем указать ни один конкретный полимер, который мог быть предшественником РНК, и никаких следов таких полимеров в биохимии не сохранилось.
Жизнь без полимеров
Еще более радикальной альтернативой РНК-мира стали гипотезы протометаболических циклов. Согласно им на древней Земле сначала сложилась сеть химических реакций между малыми молекулами, аналогичная реакциям обмена веществ в клетках. Катализаторами этих реакций служили минералы и сами участвующие в них малые молекулы. Нуклеотиды появились как один из продуктов этой сети реакций. Возникновение РНК, рибозимов, а затем и белков лишь придало устойчивость и увеличило скорость этой сети реакций.
Конечно, теория РНК-мира не отрицает, что какие-то реакции между малыми молекулами стали источником нуклеотидов и предшествовали появлению РНК. Разногласия между гипотезой протометаболических циклов и гипотезой РНК мира (в широком смысле, включая ПНК и другие полимеры, способные к комплементарному соединению в двойные спирали; в англоязычной литературе эти группы гипотез называются metabolism-first и replication-first) заключаются в другом. В гипотезе протометаболических циклов предполагается, что сеть реакций была способна к эволюции и усложнению, т.е. у нее могло быть много вариантов, каждый из которых был способен воспроизводить себя. Такое наследование, где сохраняется и воспроизводится химический состав смеси реагирующих веществ, получило название композиционного, или концентрационного генома. Теория РНК-мира же предполагает, что наследование, а следовательно, и дарвиновская эволюция возможны только на основе полимерных молекул.
В большинстве версий протометаболической гипотезы в качестве исходной части сети реакций обмена веществ рассматривается центральный круговорот обмена веществ — цикл Кребса. В статье Лесли Оргела (Orgel, 2008) рассматриваются препятствия для прохождения этого цикла реакций на минералах без помощи ферментов. Серьезной проблемой становится специфичность катализа. Например, в восстановительном цикле Кребса двойная связь C=C в одном случае должна восстанавливаться (при образовании янтарной кислоты), а в другом — к ней должна присоединяться молекула воды (при превращении аконитовой кислоты в лимонную). Если аконитовая кислота подвергнется восстановлению (а в тех условиях, где идет восстановительный цикл Кребса, эта реакция будет необратима), то вещество будет уходить из цикла в побочную реакцию. Аналогично, если какой-то минерал катализирует распад лимонной кислоты на уксусную и щавелевоуксусную, то он же будет вызывать распад и других кислот цикла.
Есть и другие мнения о том, какие вещества составляли первые автокаталитические циклы. Например, Альберт Эшенмозер предполагает (Eschenmoser, 2007), что исходным веществом, питающим цикл, был не углекислый газ, а синильная кислота (HCN). Молекулы синильной кислоты в воде самопроизвольно объединяются по четыре, образуя тетрамер. Эти тетрамеры при нагревании или облучении превращаются в аденин и гуанин, а при низкой температуре и в темноте постепенно подвергаются гидролизу. При этом образуются органические кислоты, близкие к кислотам цикла Кребса, — гидрокси-щавелевоуксусная, дигидрокси-фумаровая. Дальше из этих кислот могут получаться простейшие сахара (гликольальдегид, глицеральдегид) и более сложные кислоты цикла Кребса, такие как лимонная. Важно, что альдегиды (формальдегид, ацетальдегид, гликольальдегид) ускоряют сборку тетрамеров синильной кислоты и образуются в ходе гидролиза этих же тетрамеров. Иными словами, здесь возможно образование разных автокаталитических циклов и накопление многих веществ, важных и в современной биохимии.
К сожалению, в ходе экспериментов так и не удалось провести эти реакции достаточно эффективно, чтобы заработал автокатализ и производительность цикла стала расти. Для восстановительного цикла Кребса, как мы упоминали в прошлой главе, удалось провести только шесть реакций из одиннадцати. В качестве источника энергии при этом использовалось ультрафиолетовое излучение, а катализатором служили кристаллы сульфида цинка (Guzman, Martin, 2009).
Идея жизни без полимеров вызывает скепсис у многих ученых не только потому, что конкретные ее варианты не удается воспроизвести в лаборатории. Сомнения вызывает сама концепция концентрационного генома — возможности хранения информации в химическом составе смеси веществ. В любом сколько-нибудь значительном объеме будет так много молекул, что их концентрации могут изменяться плавно, без заметных скачков. Например, в объеме бактериальной клетки (размер — 0,001 мм, объем — 10–9 мм3) содержится около 1010 атомов и, следовательно, около 108 молекул-мономеров, таких как аминокислоты и нуклеотиды. Обмен веществ типичной бактерии включает несколько сотен разновидностей малых молекул (аминокислоты, нуклеотиды, сахара, липиды, витамины и промежуточные продукты, такие как кислоты цикла Кребса). Следовательно, в объеме бактериальной клетки будет примерно от 10 000 до 1 млн малых молекул каждого сорта, и их концентрация может меняться ступеньками по 0,01% и меньше, что совершенно неразличимо на биохимическом уровне точности. Случайные колебания концентраций веществ, вызванные тепловым движением молекул, легко разрушат хранимую таким образом информацию. Здесь уместен пример из области электроники — при аналоговой передаче сигнала он неизбежно искажается и загрязняется шумами, поэтому сейчас для записи и передачи звука и других аналоговых сигналов их переводят в цифровую форму — последовательность нулей и единиц, не подверженную слабым помехам.
Наша ДНК тоже представляет собой цифровую запись информации. Нуклеотидов всего четыре, и вероятность превращения одного из них в другой очень мала. Вероятность ошибки при копировании ДНК выше, но сложные и совершенные ферменты позволяют снизить и ее до одной ошибки на 100 млн нуклеотидов. К идее, что генетическая информация может надежно храниться только в цифровом виде, первым подошел физик Эрвин Шрёдингер в своей пророческой работе 1944 года «Что такое жизнь?». К тому времени было известно, что наследственная информация хранится в очень малом объеме, соответствующем крупной молекуле, и единственный квант рентгеновского излучения может вызвать мутацию. Пытаясь понять, как такие маленькие структуры могут надежно сохраняться годами, он пришел к идее «апериодического кристалла». Значительно позже Докинз предположил (Dawkins, 1996), что надежное хранение генетической информации возможно только в виде последовательности разных мономеров в полимерной молекуле, независимо от химической природы жизни. Строгое доказательство этого было выведено российским математиком Сергеем Вакуленко (Vakulenko, Grigoriev, 2008).
Ненадежность «концентрационного генома» можно проиллюстрировать на примере действия радиации на геномы обычные. Как известно, радиация очень опасна для живых организмов, особенно сложных. Например, для человека поглощенная доза излучения 10 грей приводит к смерти в течение двух-трех недель. Единица поглощенной дозы, грей, определяется как 1 джоуль излучения, переданный на 1 кг массы тела. Иначе говоря, смертельная доза радиации в пересчете на привычные единицы энергии — это всего лишь 700 джоулей, или 160 калорий. По всем обычным энергетическим масштабам человеческого организма это смехотворно мало. Это меньше, чем тепловая энергия, которую он получает от одного стакана умеренно горячего чая с температурой 40 оС. От стакана горячего чая еще никто не умирал. Почему же радиация так опасна?
Отличие радиации от тепла в том, что тепловая энергия распределена на гигантское количество мелких порций — движений отдельных молекул. Радиация же представляет собой довольно большие порции энергии в малом объеме — гамма-кванты, нейтроны, быстрые заряженные частицы. При встрече такой частицы с молекулой ДНК или белка большая порция энергии точечно воздействует на одну связь между атомами и, естественно, ее разрывает. Тепловые движения соседних молекул воздействуют на каждое звено ДНК миллиарды раз в секунду, но не превышают ее предела прочности. Если мы сравним тепло и радиацию с другими формами энергии, то окажется, что 700 джоулей вполне могут быть опасны, если они взаимодействуют с живым организмом в концентрированной форме. Например, 700 джоулей механической энергии организм человека получает при падении с высоты одного метра или от двух выстрелов из пистолета в упор. Понятно, что второй случай гораздо опаснее.
Тепловая энергия настолько безопасна для нас, как и для любого другого живого организма, потому что она распределена на мелкие порции, далеко не достигающие предела прочности ДНК. Концентрационный геном такого предела прочности не имеет и будет накапливать изменения просто от тепловых движений молекул. Поэтому при любой температуре кроме абсолютного нуля концентрационный геном будет разрушаться, как ДНК под действием радиации.
Если же для хранения наследственной информации важна не точная концентрация вещества, а только есть оно или нет, то информационная емкость подобной системы слишком мала — в ней должен быть свой автокаталитический цикл на каждый бит хранимой информации. Разные автокаталитические циклы из малых молекул не всегда хорошо уживаются друг с другом, поэтому вряд ли в одном объеме их может быть больше десяти. Для записи десяти бит информации достаточно последовательности из трех нуклеотидов. Так что аналоговый концентрационный геном ненадежен, а цифровой концентрационный геном (со своим автокаталитическим циклом на каждый бит информации) имеет ничтожную емкость по сравнению с простейшими молекулами РНК и не может поддерживать эволюцию.
Итак, мы видим, что нет убедительных доводов в пользу какой бы то ни было живой системы, предшествовавшей миру РНК. Только с появлением генетического полимера становятся возможными устойчивое воспроизведение тысяч разновидностей похожих, но разных живых систем, а значит, и эволюция путем мутаций и естественного отбора. Затем эта эволюция превратила РНК-организмы в клетки, оснащенные белками, ДНК и клеточной мембраной, изолирующей внутреннюю среду. Можно полагать, что клеточная жизнь вышла из геотермальной колыбели, освоила всю поверхность планеты и стала глобальной силой, регулирующей состав атмосферы и климат. В третьей части книги мы увидим, как это происходило.

