Витамины, аминокислоты и пептиды в РНК-мире
Рибозимы осваивают обмен веществ
Как только на Земле появляются молекулы РНК, которые как-то копируются, между ними начинается конкуренция. Одни молекулы РНК копируются быстрее, чем другие, и могут накапливаться в большем количестве. Любая новая особенность рибозима, повышающая вероятность его копирования, будет подхвачена естественным отбором.
В прошлой главе мы обсудили возможности и ограничения рибозимов-полимераз и лигаз, которые прямо участвуют в копировании РНК. Но это не единственные способы, которыми рибозим может влиять на количество своих копий и их эволюционную судьбу. Как справедливо замечено в обзоре Martin et al., 2015, путь от простой органики к РНК состоит из многих шагов, и ускорение любого из них при помощи рибозима будет выгодно для этого рибозима. Рибозимы в принципе могут как ускорять уже идущие реакции синтеза и активации нуклеотидов, например синтез Сазерленда, так и пускать в дело отходы и побочные продукты — свободные азотистые основания, рибозу и нуклеозиды, которые образуются при распаде РНК и нуклеотидов. Кроме того, если конкурирующие молекулы РНК находятся в лабиринте пор в минеральном осадке, то между соседями вероятно возникновение кооперации, когда каждый из них ускоряет копирование не только самого себя, но и молекул, находящихся рядом. В таком сообществе будет разделение труда, когда одни рибозимы копируют РНК, а другие занимаются производством нуклеотидов для них. Так появляется обмен веществ: химические реакции между малыми молекулами, проходящие под контролем соседних молекул; такие помощники-контроллеры получили название «ферменты».
Ресурсы, которые потребляет это сообщество РНК, можно рассортировать по сложности использования. Проще всего применять, конечно, готовые активированные нуклеотиды, такие как АТФ и ГТФ (гуанозинтрифосфат, у которого три фосфатные группы присоединены не к аденину, а к гуанину), — это одновременно и строительный материал для новой РНК, и источник энергии. Следующими после готовых активированных нуклеотидов будут нуклеотид-монофосфаты — готовые строительные блоки РНК, но без запаса энергии. Еще немного сложнее использовать нуклеозиды — чтобы пустить их в дело, надо добавить фосфатную группу. И нуклеотид-монофосфаты, и нуклеозиды неизбежно появлялись при распаде цепочек РНК.
Следующие по сложности использования ресурсы — отдельные азотистые основания и рибоза, образующиеся из цианида и формальдегида. Они должны быть правильно соединены друг с другом, чтобы получились нуклеозиды. Затем, когда и этот ресурс использован, можно было попытаться ускорить превращение гликольальдегида, глицеральдегида, формальдегида и цианистых соединений в нуклеотиды. Наконец, когда весь цианидно-формальдегидный дождь стал быстро и эффективно превращаться в РНК, в конкуренции начали выигрывать те химические системы (возможно, их уже допустимо называть живыми организмами), которые освоили восстановление углекислого газа и получили неисчерпаемый источник углерода.
Как только кончаются готовые активированные нуклеотиды — и строительный материал, и запас энергии «в одном флаконе», — нужно осваивать другие источники энергии. В условиях грязевых котлов их много. Например, летящие с вулканическими газами оксиды фосфора, растворяясь в воде, дают полифосфаты, которые легко использовать для активации нуклеотидов. Можно получать энергию, окисляя фосфиты и гипофосфиты, образующиеся из тех же вулканических оксидов фосфора. Можно как-то пристраиваться к фотохимическим реакциям на кристаллах сульфида цинка или пытаться улавливать солнечный свет своими силами. Мы не знаем, какие из этих источников энергии были освоены РНК-организмами раньше, но в итоге, скорее всего, они все так или иначе использовались.
В лабораториях идет поиск рибозимов, которые проводили бы все эти реакции. Например, правильное соединение рибозы и азотистых оснований в нуклеозиды, которое так долго не удавалось сымитировать в абиогенных условиях, рибозимам вполне по силам. Путем искусственной эволюции были получены рибозимы, которые соединяют активированную форму рибозы (5-фосфорибозил-1-пирофосфат) с азотистыми основаниями, производя нуклеозиды. В клетках фосфорибозил-пирофосфат тоже является ключевым промежуточным продуктом на пути к нуклеозидам. Рибозим A15 соединяет с рибозой урацил и цитозин, а рибозим МА — аденин и гуанин (рис. 10.1). Оба они ускоряют соответствующую реакцию в миллионы раз (Martin et al., 2015).
Активация нуклеозидов путем добавления к ним трех фосфатных групп катализируется рибозимом TPR1 размером 96 нуклеотидов. В качестве источника фосфора и энергии он использует триметафосфат, промежуточный продукт растворения оксида фосфора в воде, который доступен в грязевых котлах. В водно-формамидном растворе фосфорилирование нуклеозидов может происходить даже без помощи рибозимов. Нужен только самый обычный фосфатный минерал гидроксилапатит Ca5 (PO4) 3OH, немного солей меди и нагревание до 80 оС. Медь используется для фосфорилирования нуклеозидов и в современных клетках, она входит в состав фермента пурин-нуклеозид-киназы.
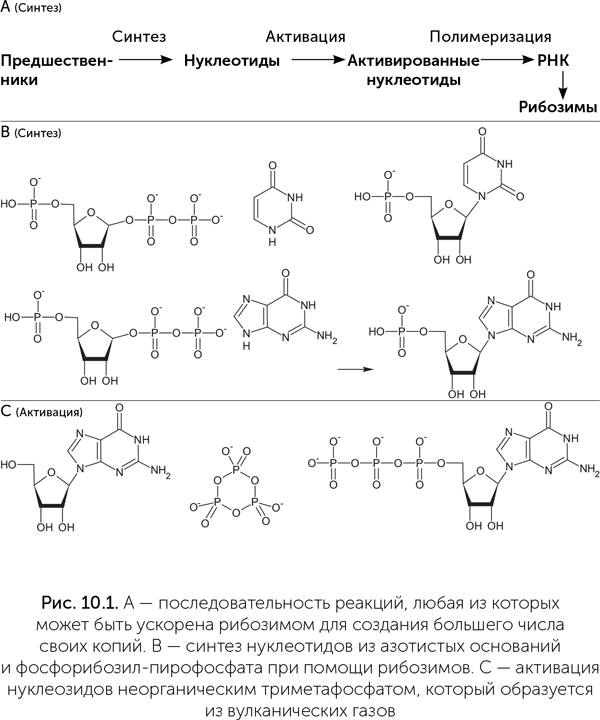
Основной шаг, повторяемый в реакции Бутлерова, называется в химии «альдольная реакция» (рис. 10.2). Рибозимы, проводящие альдольную реакцию, тоже получены в эксперименте (Chen et al., 2007). Для превращения в катализаторы им необходимы ионы цинка, подобно их функциональным белковым аналогам — альдолазам класса II.
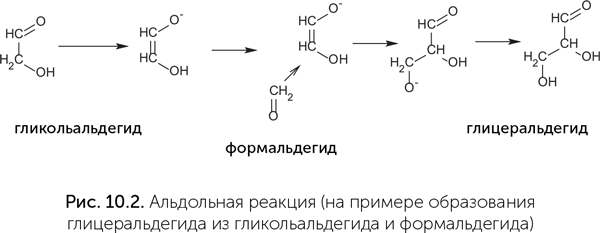
Для многих других химических реакций, нужных для производства нуклеотидов из простых молекул, возможностей чистой РНК недостаточно. Прежде всего, РНК неспособна к окислительно-восстановительным реакциям, следовательно, рибозимы не могут восстанавливать СО2 и использовать энергию окисления неорганических веществ, таких как сера, железо и водород. Белки, состоящие из 20 разных аминокислот, могут проводить гораздо больше химических реакций, но и их возможности ограничены. Более половины ферментов для работы нуждаются в дополнительных веществах — коферментах и микроэлементах. Например, для проведения окислительно-восстановительных реакций в наборе из 20 аминокислот есть цистеин, который может легко и обратимо окисляться и восстанавливаться. Однако большинство ферментов окисления и восстановления нуждаются в дополнительных веществах. Это могут быть коферменты НАД (никотинамидадениндинуклеотид) и ФАД (флавинадениндинуклеотид), железосодержащий кофермент — гем, железосерные кластеры, молибденоптериновый комплекс и ряд более экзотических веществ.
РНК и витамины
Коферменты — это разнородная группа веществ, которые выполняют особые функции в биохимии и не относятся ни к одному из основных классов веществ живых организмов (белки, нуклеиновые кислоты, сахара, липиды). Организм человека не способен производить большинство коферментов из простых предшественников, поэтому мы должны получать их «заготовки» с пищей, в виде витаминов. Коферменты НАД и ФАД переносят атомы водорода и участвуют в окислительно-восстановительных реакциях. Кофермент А (КoA) работает в реакциях, связанных с переносом ацетильных групп (-CO-CH3) и других кислотных остатков. Тиаминпирофосфат принимает участие в реакциях карбоксилирования и декарбоксилирования (присоединения и отщепления углекислого газа). Цианкобаламин служит для переноса метильных (CH3) групп.
Многие важнейшие коферменты имеют в своем составе адениновый нуклеотид: у кофермента А (КoA) к нему присоединена молекула витамина В5, у НАД — витамин РР, у ФАД — витамин B2 (рис. 10.3). Адениновый нуклеотид также входит в состав аденозил-кобаламина — активной формы витамина В12. Более того, у коферментов НАД и ФАД молекула в целом выглядит как два соединенных нуклеотида, где одно азотистое основание — обычный аденин, а в роли второго выступает никотинамид или флавин. Аденин в составе коферментов никак не участвует в их работе и служит только для узнавания коферментов белками. Скорее всего, это наследие РНК-мира, в котором витамины были пришиты к рибозимам для расширения их каталитических возможностей.
В опытах по искусственному отбору рибозимов были получены рибозимы, катализирующие часть этапов синтеза коферментов, а именно присоединение пантетеина, никотинамид-мононуклеотида и флавин-мононуклеотида к АТФ с образованием КoA, НАД и ФАД соответственно (Jadhav, Jarus, 2002). Также известны рибозимы, которые специфически пришивают НАД, ФАД или КoA к концу своей собственной молекулы или к другой РНК.
Коферменты НАД и ФАД переносят атомы водорода от одной молекулы к другой и необходимы в клетке для проведения окислительно-восстановительных реакций. Хотя в клетках они работают совместно с белками, в экспериментах были получены рибозимы, которые прочно и избирательно связывали НАД и с его помощью окисляли спирт в альдегид (рис. 10.4), — в клетках эту реакцию проводит НАД-содержащий белковый фермент алкоголь-дегидрогеназа (Tsukiji et al., 2004). Для никотинамида, ключевого компонента НАД, обнаружен простой путь синтеза, не требующий никаких ферментов и вполне реальный в условиях древней Земли. В нем простой сахар (диоксиацетон-фосфат) реагирует с аспарагиновой кислотой (одна из обычных аминокислот в составе белков) в водном растворе при температуре 60–100 оС (Cleaves, Miller, 2001). РНК, в которых на 5' конце находится НАД вместо обычного нуклеотида, обнаружены и в современных клетках: у кишечной палочки такой модификации подвергается до 15% малых регуляторных РНК (sRNA) (Cahova et al., 2014), хотя функция НАД в составе этих РНК пока неизвестна.
Кофермент А тоже прекрасно ладит с рибозимами. Очень впечатляет работа Вазанта Ядхава и Михаэля Яруса (Jadhav и Yarus, 2002). Они создали набор рибозимов, проводящих в одном опыте три последовательные химические реакции: пришивание КoA к концу РНК, активацию органической кислоты при помощи АТФ (при этом получается ацил-аденилат) и перенос кислотного остатка ацил-аденилата на КoA в составе рибозима. Затем другая команда химиков получила рибозим, который использует ацетил-КоА и малонил-КоА для реакции конденсации Клайзена (Ryu et al., 2006). В этой реакции — а она является ключевым шагом в построении длинных молекул жирных кислот— соединяются два остатка органических кислот.
Еще один кофермент, который удалось заставить работать вместе с рибозимом, — это тиаминпирофосфат, активная форма витамина В1. Он используется в обмене веществ там, где надо присоединить или отщепить молекулу углекислого газа. Канадские химики Пол Чернак и Дипанкар Сен получили рибозим, который прочно связывает тиаминпирофосфат и с его помощью отщепляет СО2 от пировиноградной кислоты и ее аналогов (Cernak, Sen, 2013). Эта реакция очень важна в обмене веществ, через нее проходит «сгорание» всех потребляемых нами сахаров (подробнее в главе 11). Воспроизведение ее при помощи рибозима, а не белкового фермента — существенное доказательство возможности сложного обмена веществ до появления белков.
В той же лаборатории под руководством Дипанкара Сена рибозимы «подружились» и с гемом. Этот кофермент входит в состав гемоглобина крови, придавая ей красный цвет и способность переносить кислород. Кроме того, гем входит в состав цитохромов — большой группы белков, участвующих в самых разных окислительно-восстановительных реакциях.
РНК, отобранные на прочное связывание гема, заодно проводили две химические реакции: окисление разных веществ перекисью водорода при помощи гема и вставку цинка и меди в протопорфирин IX (подобная реакция происходит на последней стадии сборки гема) (Sen and Poon, 2011).
РНК и свет
Как мы помним, еще до возникновения жизни компоненты РНК прошли отбор на устойчивость к ультрафиолетовому излучению. Главный механизм этой устойчивости заключается в том, что азотистые основания очень быстро превращают энергию поглощенного ультрафиолета в тепло. Для запуска этого механизма поглощенная порция энергии должна быть достаточно велика. Азотистые основания поглощают ультрафиолет с длиной волны 240–280 нм (УФС), который сейчас задерживается озоновым слоем и не доходит до поверхности Земли. Более длинноволновый ультрафиолет (УФА и УФB) азотистые основания не поглощают, и возбуждение соседних молекул, вызванное поглощением УФА или УФВ, не снимают. Следовательно, если мы хотим создать рибозим, который будет делать что-то полезное при помощи света, надо дать ему «антенну» — какую-то вспомогательную молекулу, чтобы она поглощала свет. И поглощать она должна видимый свет или УФА, чтобы азотистые основания не могли растратить его энергию в тепло. Примерно так рассуждали в лаборатории Дипанкара Сена, когда начали работу по созданию рибозима-фотолиазы.
Обычная фотолиаза — это фермент, который чинит тиминовые димеры, один из типов повреждений ДНК, возникающих под воздействием ультрафиолета (рис. 10.5). Фотолиаза содержит кофермент ФАД и работает только при освещении синим светом. Для расщепления очень прочного четырехчленного кольца тиминового димера обычного восстановительного потенциала ФАД недостаточно, и в реакцию вступает его возбужденная синим светом форма (о возбужденных состояниях и их химических свойствах рассказывалось в главе 6).
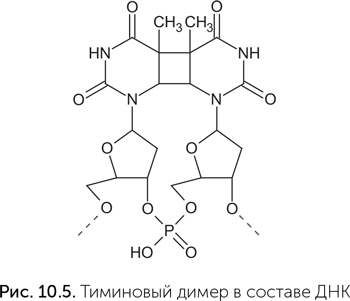
Фотолиаза сохраняет некоторую активность и без ФАД. В этом случае ей нужен не синий свет, а ближний ультрафиолет (УФА), который поглощается аминокислотой триптофаном в составе белковой цепи. В норме триптофан передает возбуждение на ФАД, но без ФАД может и напрямую восстанавливать кольцо тиминового димера.
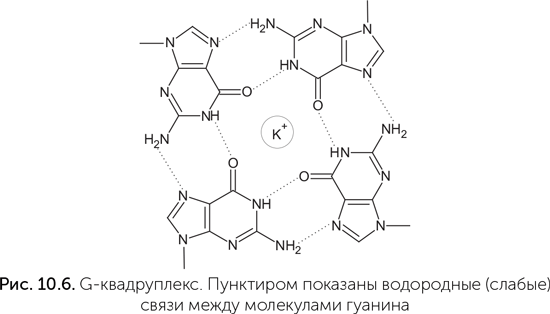
Аспиранты Дипанкара, зная эти детали, в эксперименте по отбору рибозимов-фотолиаз взяли в качестве антенны серотонин — производное триптофана. Серотонин работает в качестве сигнальной молекулы в нашей нервной системе, но ни в каких особых отношениях со светом замечен не был, хотя он хорошо поглощает УФА. В эксперименте было получено несколько разных рибозимов-фотолиаз, лишь немного уступающих по активности белку-фотолиазе. Подробное изучение показало, что один из этих рибозимов, названный UV1C, прекрасно обходится без серотонина (Chinnapen, Sen, 2004)! Он поглощает более коротковолновый ультрафиолет, чем рибозимы с серотонином (300 нм против 320), работает менее эффективно, но тоже неплохо. Как оказалось, за поглощение света и его использование в UV1C отвечает G-квардуплекс — особая структура из четырех гуанинов, связанных водородными связями в большое плоское кольцо (рис. 10.6). Такая структура взаимодействует со светом как единое целое. Квадруплекс поглощает более длинные волны, чем одиночный гуанин или пара G-C, и не рассеивает их в тепло. Такие четверки образуются в ДНК и РНК, богатых гуанином, и важны для поддержания устойчивости концевых частей хромосом в наших клетках. Они же, как оказалось, нужны для связывания гема рибозимами.
Та же фотолиаза вдохновила на исследования и Михаила Критского из Института биохимии имени А. Н. Баха в Москве. Его группа изучала взаимодействие со светом кофермента ФАД. Этот кофермент участвует во многих окислительно-восстановительных реакциях как переносчик водорода и электронов, но играет и другие роли. Кроме фотолиазы ФАД поглощает свет в криптохромах — белках, регулирующих суточные ритмы животных и растений. На основе ФАД-содержащих криптохромов у животных возникли также системы восприятия магнитного поля.
Критский с сотрудниками обнаружили, что флавин можно получить очень просто, запекая сухую смесь аминокислот (глутамат, глицин, лизин) при температуре 180 оС без доступа воздуха. При растворении запеченной смеси в воде с силикатами образуются микросферы из неупорядоченных пептидов, силикатов и флавина. Эти микросферы при освещении поглощают синий свет и за счет его энергии способны синтезировать АТФ из АДФ и неорганического фосфата, осуществляя фотореакцию с неплохой эффективностью — одна молекула АТФ на пять поглощенных квантов света (Kritsky et al., 2007). Реакция идет лучше в присутствии окислителей: воздуха, перекиси водорода или солей трехвалентного железа. Точный механизм флавиновых фотореакций неизвестен, но он включает какие-то промежуточные окислительно-восстановительные шаги. Силикатный матрикс микросфер, видимо, необходим для удержания реагирующих молекул в правильной ориентации друг к другу — просто раствор флавинов в воде не способен производить АТФ на свету (Telegina et al., 2013).
В РНК-мире возможны и другие пути использования энергии Солнца. Например, тиоацетат (серное производное уксусной кислоты) разрушается при облучении ультрафиолетом. Но в присутствии урацила и фосфатов он при этом превращается в ацетил-фосфат — богатое энергией соединение, которое может отдавать фосфатную группу, активируя нуклеотиды и способствуя синтезу РНК (Hagan, 2010).
Аминокислоты и пептиды в мире РНК
Если рибозимы легко могут использовать коферменты для получения новых химических способностей, то можно предположить, что они могли также использовать аминокислоты. Из 20 стандартных аминокислот, входящих в состав белков, меньше половины бывают ключевыми элементами активных центров ферментов: гистидин, аспарагиновая и глутаминовая кислоты, лизин, аргинин, тирозин, серин, цистеин. Даже среди этих восьми аминокислот есть две пары относительно взаимозаменяемых: аспарагиновая-глутаминовая кислоты и лизин-аргинин. Иными словами, пять-шесть видов аминокислот, вставляемых в рибозимы, могут приблизить их к белкам по химическому разнообразию и возможностям катализа.
Отдельные свободные аминокислоты и короткие пептиды из них могут ускорять химические реакции, подобно ферментам. Например, двух аминокислот — гистидин и цистеин — достаточно для превращения глюкозы в пировиноградную кислоту в три шага (через глюконовую кислоту и кетодезоксиглюконовую кислоту) (Shimizu et al., 2008).Эта последовательность реакций может быть простым аналогом гликолиза, где глюкоза тоже превращается в пировиноградную кислоту, но более сложным путем и с запасанием энергии в АТФ (о месте и значимости этой реакции в обмене веществ будет подробнее рассказано в главе 11). Две соединенные аминокислоты, серин и гистидин (такая связка называется дипептидом), могут расщеплять пептиды на аминокислоты и РНК на нуклеотиды, а в условиях недостатка воды этот же дипептид ускоряет обратную реакцию сборки РНК из нуклеотидов (Adamala et al., 2014).
В составе рибозима те же аминокислоты могут проявлять более высокую каталитическую активность и специфичность, потому что рибозим образует «карман» активного центра вокруг каталитической аминокислоты. Молекулы, не подходящие по форме к «карману», не смогут связаться с аминокислотой и прореагировать. Те молекулы, которые по форме соответствуют «карману», будут реагировать в нем быстрее, чем в растворе, потому что «карман» ориентирует их нужной стороной друг к другу. К сожалению, получению рибозимов, использующих аминокислоты, уделялось недостаточно внимания по сравнению, скажем, с поисками рибозимов-полимераз. Известен один пример рибозима, использующего гистидин. Этот рибозим расщепляет РНК и ДНК и, в отличие от других рибозимов с такой активностью, не нуждается в солях магния (Roth и Breaker, 1998).
Есть и другой способ применить пептиды для повышения эффективности рибозимов. Пептиды с положительным электрическим зарядом (в водной среде такой заряд пептидам придают аргинин и лизин) могут прочно связываться с РНК и стабилизировать ее укладку. Примеры такой помощи мы видим в рибосоме. Рибосомная РНК (крупная РНК, проводящая сборку белков из аминокислот, подробнее в главе 13) содержит много необычных элементов укладки нуклеотидной цепи, не похожих на стандартные двуспиральные петли — шпильки. Эти укладки устойчивы только благодаря тесному взаимодействию с рибосомными белками, богатыми лизином и аргинином и несущими заметный положительный заряд. В меньшем масштабе подобное взаимодействие используют вирусы. Например, у вируса иммунодефицита человека в РНК имеется особый участок, называемый TAR; он состоит из чередования двойных спиралей и шпилек. Этот участок TAR приобретает стабильную форму только при связывании с белком Tat. Контакты с РНК образуют девять идущих подряд аминокислот в белке Tat, и этот небольшой фрагмент прекрасно связывается с РНК безо всей остальной белковой молекулы. Более того, оказалось, что его можно сократить практически до полутора аминокислот — аргинин-амид тоже хорошо связывается с TAR и стабилизирует ее форму (Noller et al., 2004). 9-аминокислотный пептид из Tat в экспериментах хорошо связывался с разными рибозимами, стабилизировал их укладку и повышал их активность в десятки раз (Robertson et al., 2004).
Мы видим, что рибозимы могут использовать коферменты, аминокислоты и пептиды для расширения своих возможностей. С помощью этих дополнительных молекул рибозимы проводят многие основные типы реакций, необходимые для обмена веществ, и даже могут использовать энергию света. Судя по всему, рибозимы с коферментами могут проводить все химические реакции на пути от простых молекул до нуклеотидов.

