Механизмы копирования РНК и начало РНК-мира
Первые РНК возникают случайно
Итак, в предыдущих главах мы нашли подходящее место для РНК-мира: грязевые котлы и другие горячие источники на суше, где возможен синтез активированных нуклеотидов из веществ цианидно-формальдегидных дождей и выделяемых с вулканическими газами соединений фосфора. Также мы нашли несколько механизмов, которые могли нарушить равенство левых и правых хиральных вариантов нуклеотидов и аминокислот. Теперь можно искать пути от одиночных нуклеотидов к длинным молекулам РНК, способным создавать собственные копии.
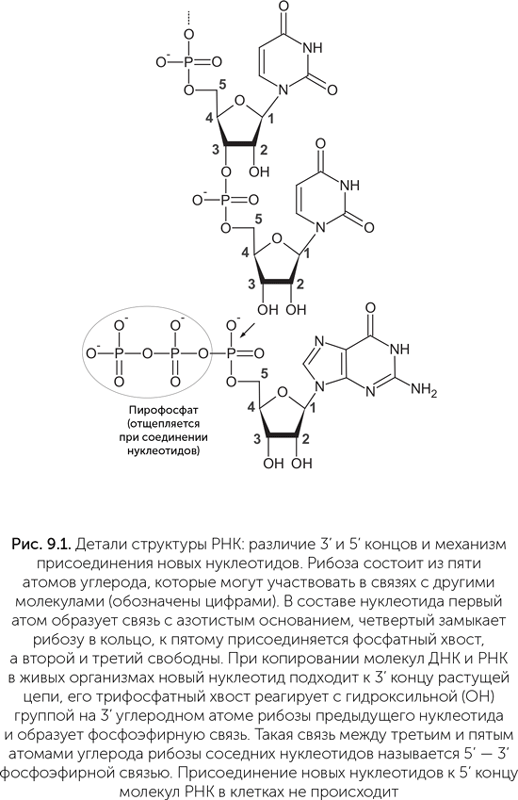
В исходном варианте теории РНК-мира предполагалось, что сначала какие-то молекулы РНК синтезировались силами неживой природы — при помощи минералов, солнечного света и самопроизвольно идущих химических реакций. Потом среди них возник рибозим, способный копировать молекулы РНК, и с этого момента началась эволюция под действием естественного отбора (напомним, что рибозимы — это молекулы РНК, способные ускорять химические реакции, подобно белковым ферментам). В экспериментах по воссозданию такого рибозима поначалу подразумевалось, что в мире РНК копирование молекул РНК шло в принципе так же, как в современных организмах: новая нить строится из нуклеотид-трифосфатов, которые присоединяются по одному к 3' — концу растущей цепи (рис. 9.1); фермент, проводящий копирование, скользит по копируемой цепи, а матрицей служит однонитевая РНК либо одна из нитей двунитевой РНК, расплетаемой для копирования.
На поверхности смектита (разновидность глинистых минералов) происходит соединение нуклеотидов в цепи РНК длиной до 50 звеньев. Необходимы только активированные нуклеотиды; процесс занимает не более суток (Huang и Ferris, 2006). Дальнейшие эксперименты с глиной показали, что оседающие на нее нуклеотиды аккуратно выстраиваются в цепочку еще до того, как между ними возникает химическая связь, и поэтому даже из равной смеси «правых» и «левых» нуклеотидов образуется заметное количество хирально чистых цепочек. Среди четырехнуклеотидных связок оказывается 93% хирально чистых, а среди пятинуклеотидных — 97% (Jheeta, Joshi, 2014). К этим экспериментам можно придраться, так как в них использовались неестественные активированные нуклеотиды — нуклеотид-имидазол-монофосфаты, появление которых в условиях древней Земли практически невозможно. Однако и с более реальными формами нуклеотидов — циклическими нуклеотид-монофосфатами, которые образуются в результате синтеза Сазерленда, — получаются цепочки РНК длиной до 20 звеньев, а из чистого циклического гуанин-монофосфата — до 100 нуклеотидов даже без глины, просто при нагревании водного раствора до 80 оС (Costanzo et al., 2009).
РНК можно получить из простых, неактивированных нуклеотидов, таких как аденозин-монофосфат. В этом случае нужен тот или иной внешний источник энергии. Например, на поверхности глины при ультрафиолетовом облучении нуклеотид-монофосфаты соединяются в короткие цепочки РНК, состоящие из четырех-шести звеньев. Превращение энергии света в химические связи в этом случае осуществляется с помощью глины: можно сначала облучить УФ влажную глину, а потом в темноте добавить нуклеотиды, и получатся короткие РНК (Otroshchenko et al., 2009).
Тепловая энергия тоже может помочь. Например, при впрыскивании тонкой струйки нагретого до 100 оС раствора нуклеотидов в ледяную воду часть их соединяется по два и по три (Ogasawara et al., 2000). Наконец, самые длинные РНК получаются при упаривании раствора нуклеотидов с липидами — жироподобными веществами, образующими клеточные мембраны (Rajamani et al., 2008). В этих условиях при нагревании липидно-нуклеотидного осадка до 70–90 оС образуются молекулы РНК со средней длиной около 50 нуклеотидов, а при максимальной температуре — свыше 100 нуклеотидов. Липиды в высыхающем растворе образуют плоские слои и тонкие длинные цилиндры, внутри которых нуклеотиды накапливаются в высокой концентрации и почти без воды. В отличие от нагреваемых сухих смесей, в липидных слоях нуклеотиды упорядоченно расположены один за другим и сохраняют некоторую подвижность. Все это очень облегчает соединение нуклеотидов в длинные молекулы РНК.
РНК копирует себя: проблемы и ограничения
Попытки найти рибозим-полимеразу, которая могла бы возникнуть при случайной полимеризации нуклеотидов, до сих пор не увенчались убедительным успехом. В экспериментах были получены относительно эффективные полимеразы: среди рибозимов, работающих в водном растворе при комнатной температуре, лучшим на сегодня является tC9 (Wochner et al., 2011). Этот рибозим способен удлинять короткую РНК-затравку на 95 звеньев-нуклеотидов. Этого категорически недостаточно для самокопирования: сам tC9 имеет длину около 200 нуклеотидов, удлинение затравки на 95 нуклеотидов занимает более суток, а высокая концентрация магния, необходимая для работы tC9, приводит к его постепенному разрушению. Есть варианты условий, в которых эффективность таких рибозимов возрастает. Например, Джеймс Атуотер исследовал работу рибозимов во льду — в тонких прослойках жидкости между ледяными кристаллами. Начав с tC9, он получил его холодоустойчивую разновидность tC9Y, работающую на морозе до –19 °С. При оптимальной температуре –7 оС tC9Y присоединяет к затравке до 206 нуклеотидов за 60 часов, причем разрушение самого рибозима ионами магния сильно уменьшилось по сравнению с комнатной температурой (Attwater et al., 2013).
Опыты с рибозимами-полимеразами показали, что на этом пути есть несколько трудноразрешимых проблем. Во-первых, сколько-нибудь эффективные рибозимы-полимеразы отличаются большой длиной, до 200 нуклеотидов, следовательно, их самопроизвольное возникновение без участия дарвиновского отбора очень маловероятно. Евгений Кунин в своей замечательной книге «Логика случая. О природе и происхождении биологической эволюции» приводит расчеты, согласно которым для случайного образования такой молекулы с трудом хватает количества планет и времени существования видимой части Вселенной, содержащей миллионы галактик. Дарвиновская эволюция могла бы многократно ускорить появление сложного рибозима, но для нее необходим хоть как-то работающий механизм копирования.
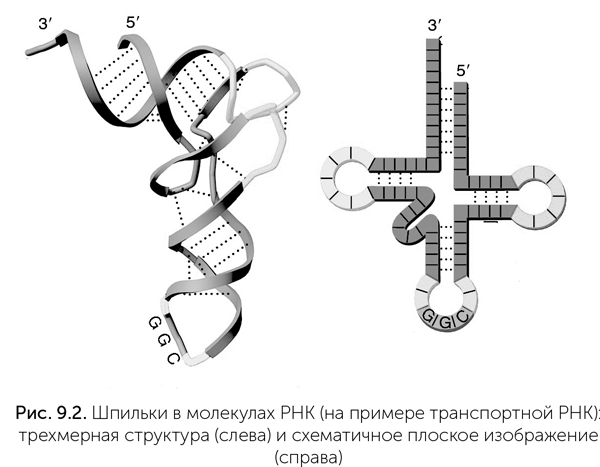
Во-вторых, для этих рибозимов не все РНК-матрицы одинаково хороши. Лучше всего копируются те РНК, которые не образуют устойчивых внутримолекулярных двуспиральных участков (они называются шпильками, см. рис. 9.2). Однако все рибозимы, наоборот, содержат много устойчивых шпилек, поэтому tC9Y не может создать собственную копию.
В-третьих, рибозимы-полимеразы имеют недостаточную точность. Чтобы копируемая последовательность РНК или ДНК могла как-то эволюционировать под действием отбора, число ошибок должно быть меньше одной на одну копию — такое условие называется «предел Эйгена» в честь биофизика Манфреда Эйгена, доказавшего это в 1971 году (Eigen M., 1971). Если ошибок больше, то естественный отбор не справится даже с сохранением имеющейся генетической информации, не говоря уже о создании новой. Копирование всех бактериальных и вирусных геномов происходит именно с такой точностью. Большие геномы высших животных и растений формально не проходят предел Эйгена (например, в геноме человека размером около 3 000 000 000 нуклеотидов происходит около 30 мутаций за поколение), но поскольку большая часть нашего генома ничего не кодирует, то мутации в ней не влияют на жизнеспособность. Для tC9Y частота ошибок составляет около 2%, т.е. при копировании РНК длиной 200 нуклеотидов он совершает в среднем 4 ошибки. При копировании самого себя с такой точностью рибозим будет разрушен мутациями за несколько поколений, несмотря на действие отбора.
В-четвертых, все известные рибозимы-полимеразы нуждаются в затравке, или праймере — коротком фрагменте РНК, который комплементарно связывается с РНК-матрицей, образуя двуспиральный участок, и будет дальше удлиняться путем присоединения нуклеотидов по одному. Эти затравки должны откуда-то браться. В современных клетках при копировании ДНК-геномов затравки делает специальный фермент, праймаза, родственный полимеразам. Эксперименты с этими ферментами показали, что совместить функции праймазы и полимеразы в одной молекуле очень сложно — хорошая праймаза делает много ошибок при удлинении затравки. Клеточные РНК-полимеразы, работающие в транскрипции (делающие РНК на матрице ДНК), обходятся без внешних затравок, но дорогой ценой — более 90% РНК, которые они начинают синтезировать, обрываются на первых 5–10 нуклеотидах. Древний рибозим, который был не столь совершенным, как современные белковые ферменты, вряд ли смог бы копировать РНК без затравок. Бывают, правда, ситуации, когда молекула ДНК или РНК может выступать в качестве затравки для копирования самой себя. Например, при репликации способом «катящегося кольца» у некоторых вирусов двунитевой кольцевой ДНК-геном разрезается по одной цепи. ДНК-полимераза начинает удлинять один конец разрезанной нити, вытесняя другой, и совершает много оборотов по кольцу без перерыва. Однако кольцевую РНК трудно сложить в структуры, необходимые для рибозимов, и возникает необходимость в разрезании колец в определенном месте.
В-пятых, после работы рибозима-полимеразы образуется длинная двунитевая РНК, которая не может служить матрицей для следующего копирования. Чтобы продолжить копирование, надо как-то расплести ее на две отдельные нити. В клетках это делают специальные ферменты — хеликазы, расходующие энергию в виде АТФ на расплетание двойных спиралей, а специальные белки (они называются SSB — single-strand binding) связываются с одиночными нитями, чтобы они не слипались обратно. В раннем РНК-мире такой сложной системы, очевидно, быть не могло, и надо искать другие способы расплетания двунитевых РНК. Простейшим способом могут быть колебания температуры, которые используются в полимеразной цепной реакции (ПЦР) — лабораторном методе копирования ДНК в пробирке, при помощи одной полимеразы. В полимеразной цепной реакции построение вторых цепей ДНК идет при температуре 60–70 оС, а периодический короткий нагрев до 95 градусов разделяет двунитевые молекулы на отдельные нити. В условиях древней Земли подобные колебания температуры могут давать периодические выбросы кипятка из гейзеров или приливы на морском берегу. Однако при падении температуры две длинные нити РНК могут соединиться обратно. Для запуска нового цикла копирования нужно, чтобы концентрация затравок была в 100–1000 раз выше, чем длинных молекул. В ПЦР этого добиваются, добавляя большое количество искусственных затравок. В РНК-мире доступность затравок особенно критична при копировании РНК в липидных пузырьках, стенки которых пропускают только одиночные нуклеотиды, но и в растворе, и на минералах затравки все равно нужны.
Копирование РНК путем крупноблочной сборки
Стало понятно, что надо искать другие подходы к копированию РНК. Например, процесс копирования мог поначалу происходить путем сшивания концов коротких цепей, а не одиночных нуклеотидов. Обзор Карлоса Брионеса с соавторами (2009) суммирует главные открытия в этой области.
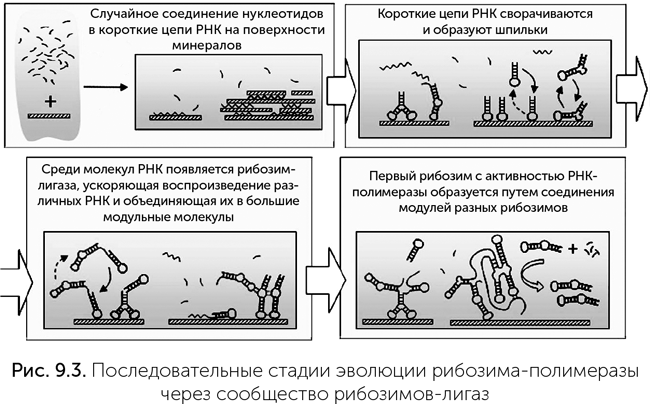
В этом сценарии первые РНК длиной 20–30 нуклеотидов образуются при случайной полимеризации на минералах. Многие из них имеют участки, комплементарные другой части молекулы, и образуют шпильки (рис. 9.3). Среди них были первые рибозимы, проводящие реакцию сшивания концов двух цепей РНК, под названием «лигазы». Они сшивали некоторые РНК друг с другом, что приводило к появлению, во-первых, более активных лигаз, а во-вторых, эти лигазы лучше узнавали те короткие РНК, из которых могли быть построены их собственные копии. По мере роста размеров и сложности РНК среди лигаз могли появиться и рибозимы-полимеразы.
Такой сценарий решает часть проблем, которые были в сценарии случайного появления полимеразы. Во-первых, рибозимы-лигазы гораздо проще и короче, чем рибозимы-полимеразы: при комнатной температуре хорошо работают лигазы длиной 40–50 нуклеотидов, а во льду — даже более короткие фрагменты, вплоть до 29 нуклеотидов (Vlassov et al., 2004). Молекулы РНК таких размеров реально получить при случайной сшивке нуклеотидов без помощи рибозимов. Во-вторых, лигазы могут сшивать две разные функциональные молекулы РНК, образуя более крупные модульные рибозимы, — путь усложнения, малодоступный для рибозимов-полимераз. В-третьих, в экспериментах рибозимы-лигазы склонны образовывать сообщества, в которых разные лигазы ускоряют сборку друг друга, поддерживая более сложную и разнообразную систему, чем один рибозим-полимераза. Более того, такие сообщества выигрывают в конкуренции с эгоистичной лигазой, собирающей только свои копии. В экспериментах Трейси Линкольн и Джеральда Джойса пара лигаз собирала копии друг друга (Lincoln, Joyce, 2009) и удваивала свою численность менее чем за час, тогда как полимеразы не могут собрать свою копию и за сутки! Более того, добавив в систему несколько версий «сырья» — коротких цепочек РНК, они добились конкуренции разных вариантов рибозимов-лигаз и начала эволюции среди них. Единственный недостаток известных сообществ лигаз, не позволяющий признать их окончательным решением проблемы копирования в мире РНК, — это необходимые для них исходные материалы. Лигазы Линкольн и Джойса так же, как их аналоги, полученные другими учеными, требуют довольно длинных фрагментов РНК, около 20 нуклеотидов, для построения из них собственных копий. Если материал для лигаз поставляется случайным соединением нуклеотидов на глине, то вероятность получения нужного 20-нуклеотидного фрагмента РНК будет крайне мала — около одной триллионной. Лигазы, хорошо работающие с кусочками РНК в три — пять нуклеотидов, пока получить не удается.
Интересный вариант содружества лигаз был получен в работе Щепанского и Джойса (Sczepanski, Joyce, 2014). Они отступили от принципа хиральной чистоты и сделали рибозим из нуклеотидов с «левыми» молекулами рибозы, отбирая его на способность сшивать обычные РНК с «правой» рибозой. В этом случае звенья рибозима не образуют комплементарных пар с теми молекулами, которые он сшивает. Подобные взаимодействия приводят к застреванию молекул РНК в обычных рибозимах-полимеразах и лигазах и сильно замедляют их работу. «Левый» рибозим из 83 нуклеотидов оказался очень хорошей лигазой, способной построить свою зеркальную копию из 11 коротких фрагментов РНК по 7–11 нуклеотидов. Зеркальная копия, в свою очередь, так же эффективно строит исходный «левый» рибозим из «левых» коротких РНК. Такой способ копирования был назван «кросс-хиральная репликация». Как и некоторые другие лигазы, этот рибозим может по совместительству «подрабатывать» полимеразой: он достраивает РНК-затравку, присоединяя к ней до шести нуклеотидных звеньев, причем к «правой» затравке присоединяются только «правые» нуклеотиды из смеси, а к «левой» — «левые». Этот эксперимент заставляет задуматься об истории хиральной чистоты: может быть, мир РНК сначала использовал левые и правые нуклеотиды в равной мере, а хиральная чистота возникла позже, с переходом к белкам? Авторы надеются в ближайшие пару лет сделать из этой лигазы кросс-хиральную полимеразу, которая будет строить из отдельных нуклеотидов свои зеркальные отражения. Посмотрим, что у них получится.
Итак, ни рибозимы-полимеразы, ни рибозимы-лигазы, известные на сегодняшний день, не обеспечивают устойчивого копирования РНК из доступных в окружающей среде древней Земли компонентов — отдельных нуклеотидов и их цепочек длиной до пяти-восьми звеньев. Чтобы запустить копирование, а следовательно, конкуренцию и естественный отбор, необходимы какие-то другие способы копирования РНК.
РНК копируются внешними силами
Самопроизвольное соединение активированных нуклеотидов, с которого мы начали эту главу, может происходить не только на глине, но и на однонитевых молекулах РНК, работающих в качестве матрицы. Достижения и проблемы в этой области обобщены в обзоре Джека Шостака (Szostak, 2012).
Еще в 1987 году было достигнуто неферментативное копирование РНК длиной 14 нуклеотидов. Использовались нуклеотид-метилимидазол-фосфаты и водный раствор с высокой концентрацией солей магния (Acevedo, Orgel, 1987).
В последующие годы это направление исследований было практически заброшено, так как ученые переключились на искусственный отбор рибозимов. Но в последние годы Джек Шостак вернулся к неферментативному копированию, причем с новыми идеями — он пытается проводить его внутри протоклеток, т.е. пузырьков, окруженных липидной мембраной. Недавно ученицей Шостака Катаржиной Адамалой было осуществлено копирование РНК внутри протоклеток (Adamala, Szostak, 2013).
Копирование РНК без помощи ферментов имеет много недостатков, которые нам знакомы по рибозимам-полимеразам:
- в конце копирования, как и у полимеразы, образуется устойчивая двунитевая РНК, которую надо как-то расплести для следующего цикла копирования;
- скорость и точность неферментативного копирования еще хуже, чем с рибозимами: ошибок — около 10%, а на присоединение одного нуклеотида уходит более часа.
У неферментативного копирования есть и другие проблемы, которые не свойственны рибозимам-полимеразам:
- при копировании без ферментов связи между нуклеотидами образуются по-разному. Как в клеточных РНК, так и в продуктах рибозимов-полимераз, фосфатные мостики всегда связывают третий углеродный атом одного остатка рибозы с пятым атомом другого (3' – 5' — фосфодиэфирная связь, см. рис. 9.1). Без ферментов же наравне с 3' – 5' связями образуются неправильные 2' – 5' связи, и долго было непонятно, насколько это мешает появлению активных рибозимов;
- неферментативное копирование требует высокой концентрации магния, что приводит к постепенному разрушению как РНК-матрицы, так и активированных нуклеотидов. Нуклеотиды теряют фосфатные группы и превращаются в нуклеозиды, которые сами непригодны для построения цепи РНК и, хуже того, конкурируют с нуклеотидами за место на копируемой цепи РНК;
- нуклеозиды надо как-то убирать из среды, где происходит копирование РНК, или превращать их обратно в нуклеотиды;
- химические способы реактивации нуклеозидов опасны для РНК-матрицы.
По последним данным, не все эти проблемы действительно серьезны. Оказалось, что случайное чередование 3' – 5' и 2' – 5' связей не нарушает активность рибозимов по сравнению с чистыми 3' – 5' связанными РНК (Engelhart et al., 2013). Более того, примесь 2' – 5' связей снижает устойчивость двунитевой РНК и облегчает ее расплетание для повторного копирования. Так как доля 2' – 5' связей в копиях одной РНК-молекулы будет отличаться, то между ними возможно своего рода разделение труда: молекулы с большей долей 2' – 5' связей будут служить матрицами для дальнейшего копирования, а с меньшей — будут более стабильными рибозимами. Иначе говоря, даже в пределах РНК-мира за счет изменчивости связей между нуклеотидами возможно некоторое разделение на генетический материал и функциональные молекулы.
Проблемы, связанные с побочными реакциями ионов магния, удалось решить в упомянутой выше работе Адамалы и Шостака. Адамала пробовала разные вещества, которые образуют устойчивые комплексы с ионами магния, в надежде, что эти комплексы будут участвовать в одних реакциях, подобно свободным ионам магния, но не смогут участвовать в других. И оказалось, что цитрат (лимонная кислота) образует комплекс с магнием с нужными свойствами. Магний-цитратный комплекс катализирует образование РНК из активированных нуклеотидов, но не катализирует гидролиз (разрушение) РНК и отдельных нуклеотидов. Кроме того, магний-цитратный комплекс безопасен для липидных оболочек протоклеток, в отличие от обычных магниевых солей. В этих экспериментах использовались мембраны из жирных кислот, по свойствам близкие к обычному мылу. Как известно, мыло в жесткой воде (содержащей много кальция и магния) плохо мылится, т.е. не образует пузырьков, и это долго было препятствием к репликации РНК в протоклетках.
Копирование РНК в тепловой ловушке
Все процессы соединения нуклеотидов в РНК очень чувствительны к концентрации нуклеотидов, которые в разбавленном растворе гораздо хуже соединяются в цепочки. К сожалению, все известные пути получения нуклеотидов, возможные в природных условиях, дают относительно разбавленные растворы продуктов. Было бы очень хорошо найти какой-нибудь эффективный механизм их концентрирования.
Как мы помним, возникновение жизни произошло на горячих источниках. В этом ландшафте возникают пересыхающие лужи, в которых могут накапливаться различные растворенные вещества, например формамид. К сожалению, для накопления нуклеотидов этот механизм не очень подходит: при испарении воды увеличивается концентрация всех растворенных веществ, включая минеральные соли, которых заведомо больше, чем нуклеотидов. Но, как оказалось, на тех же геотермальных полях есть механизмы концентрирования, которые отличают крупные молекулы нуклеотидов и РНК от растворенных минеральных солей. Для геотермальных полей характерны мелкопористые осадки и устойчивая разница температуры между горячей подземной водой и холодным воздухом. В этих условиях в порах и трещинах, заполненных водой, возникает устойчивая конвекция: поток жидкости и тепла. Благодаря конвекции и перепадам температур эти трещины становятся удобным местом концентрирования нуклеотидов и копирования РНК.
В работе Baaske et al. (2007) изучалось поведение нуклеотидов и РНК разной длины в поре, закрытой снизу и открытой сверху в холодную воду. При подогреве сбоку в такой поре происходят конвекция жидкости и перенос растворенных молекул вдоль градиента температуры (термофорез). Оказалось, что нуклеотиды и РНК в такой поре подсасываются из холодной воды и эффективно накапливаются в нижней части холодной стенки (рис. 9.4). Для поры шириной 1 мм и длиной 10 мм получается концентрирование нуклеотидов и коротких РНК в шесть-семь раз. Но степень концентрирования очень сильно (экспоненциально) зависит от отношения длины к ширине поры. Пора размером 0,1 мм × 10 мм или 1 мм × 100 мм концентрирует нуклеотиды примерно в 100 млн раз. РНК длиной примерно 40 нуклеотидов и более ведут себя по-другому по сравнению с одиночными нуклеотидами и короткими РНК. Они очень сильно концентрируются даже в коротких порах — в 20 000 раз в поре 1 мм × 10 мм для РНК длиной 100 нуклеотидов. Длинные молекулы РНК, попавшие в такую пору, практически неизбежно захватываются ею и накапливаются на маленьком (меньше 0,01 кв. мм) участке в нижней части холодной стенки. Концентрация РНК там ограничена только их физическими размерами.
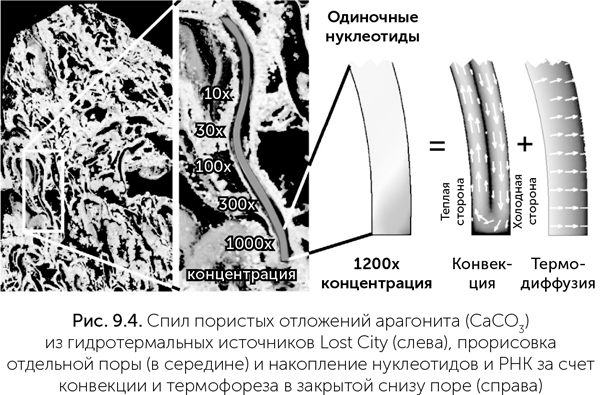
Если в такой закрытой нагреваемой поре происходит еще и образование РНК из нуклеотидов (здесь неважно, идет ли речь о копировании существующей РНК или о случайной сборке), то конвекция, термофорез и накопление нуклеотидов очень способствуют образованию длинных РНК. В работе Маста с коллегами (Mast et al., 2013) было рассчитано, что в тепловой ловушке будут получаться РНК длиной 200–300 нуклеотидов безо всяких ферментов и рибозимов. К сожалению, по техническим причинам проверяли они эти расчеты не на полимеризации РНК из отдельных нуклеотидов, а на ДНК, и при этом еще не сборка отдельных нуклеотидов, а стыковка 95-нуклеотидных фрагментов ДНК при помощи одноцепочечных «липких концов». Такие видоизменения потребовались потому, что только к фрагментам ДНК такой длины возможно присоединить флуоресцентные метки, не мешающие полимеризации. Но зато благодаря таким меткам удалось в реальном времени и с высоким разрешением измерить накопление и полимеризацию ДНК на нижнем конце холодной стенки. И в точном соответствии с теорией получилось, что молекулы ДНК в этих условиях получаются в 10–20 раз длиннее, чем при любой одинаковой со всех сторон температуре.
В поре, открытой с обоих концов, поведение молекул несколько отличается. Если есть проток жидкости снизу вверх и нагрев с одной стороны, то в поре тоже происходят конвекция и термофорез. Молекулы РНК накапливаются на нижнем конце холодной стенки, но их поведение сильно зависит от длины. Нуклеотиды и короткие РНК слабее увлекаются термофорезом в нисходящий холодный поток и в итоге вымываются из поры с восходящим потоком, а РНК длиннее определенного порога (он зависит от скорости потока и размеров поры) накапливаются в ней. Это избирательное удержание длинных РНК может противостоять быстрому размножению коротких РНК и сохранять длинные молекулы в ряду поколений несмотря на то, что они копируются медленнее (Kreysing et al., 2015).
И в открытых, и в закрытых порах благодаря конвекции молекулы РНК последовательно попадают в горячие и холодные зоны. В горячей зоне двухцепочечная РНК может разделяться на одиночные цепи, которые смогут стать матрицами для следующего цикла копирования.
Мир шпилек
Изящное решение проблемы затравок было недавно предложено Александром Марковым (http://macroevolution.livejournal.com/170098.html). Оно состоит в том, что в условиях неферментативного копирования РНК преимущества получают те последовательности, которые могут служить затравками для синтеза собственных копий (рис. 9.5). Такими свойствами обладают палиндромные последовательности РНК. Палиндромами называли слова или фразы, которые читаются одинаково в обе стороны («А роза упала на лапу Азора»). В случае РНК и ДНК палиндромной последовательностью называют такую, которая читается одинаково слева направо и — после замены нуклеотидов на комплементарные — справа налево. Например, последовательность GGACCUAGGUCC будет палиндромом.
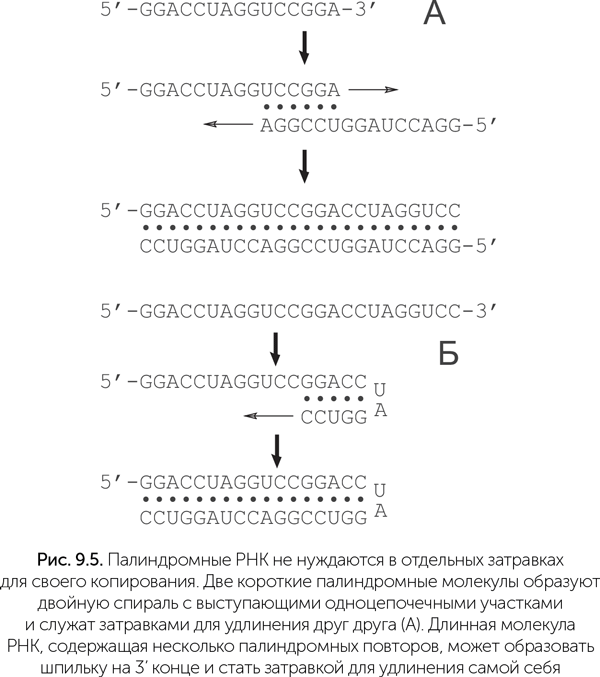
При случайном разрыве таких цепей РНК получаются короткие фрагменты, которые тоже могут служить затравками для удлинения своих родственников. В условиях неферментативного копирования РНК идея Маркова («Мир палиндромов») превращает необходимость затравок из проблемы в фактор естественного отбора, который начинается еще до появления первого активного рибозима, с молекулами РНК длиной 15–20 нуклеотидов. Причем низкая скорость неферментативного копирования здесь не страшна: достройка концов палиндромных РНК требует присоединения лишь 5–10 нуклеотидов за один цикл. Палиндромность первых РНК повышает вероятность появления рибозимов, так как палиндромные последовательности образуют множество шпилек (рис. 9.6).
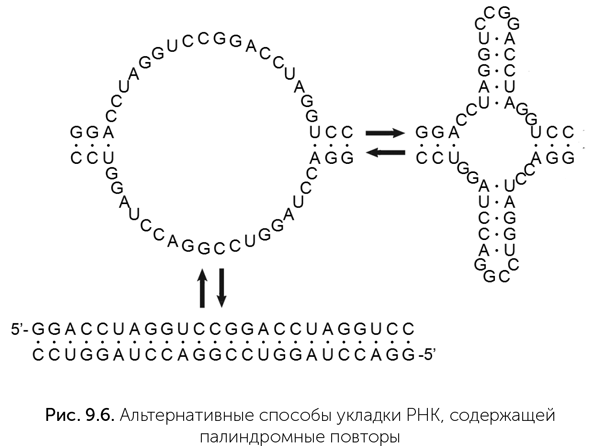
Следы такого способа роста структур РНК до сих пор видны в древнейшем реликте РНК-мира — молекулах транспортных РНК (тРНК). Эти молекулы длиной 76 нуклеотидов имеют форму клеверного листочка. «Стебелек» и каждый из «листиков» трилистника включают двуспиральные участки РНК. Три «листика» образуют шпильки, а стебелек заканчивается свободными концами цепи РНК. В последовательности тРНК давно были обнаружены внутренние повторы, допускающие другие варианты укладки молекулы, например, в виде одной длинной двухцепочечной шпильки с несколькими внутренними петлями. На основе этих повторов были предложены модели роста тРНК путем увеличения количества палиндромных сегментов молекулы (Rodin et al., 2011; DiGiulio, 2009).
Если у нас есть механизм абиогенного копирования РНК, хотя бы только коротких и палиндромных молекул, то среди них могут оказаться РНК с какой-то рибозимной активностью. Строго говоря, не только лигаза и полимераза способны ускорить накопление своих копий в такой системе. Например, рибозимы-экзонуклеазы, разрушающие молекулы РНК, могут быть полезными для их точного и быстрого копирования. Экзонуклеазы работают в клетках вместе с полимеразами и служат для отрезания неправильно присоединенных нуклеотидов, повышая точность копирования. Рибозим с такой активностью мог бы повышать точность неферментативного копирования РНК и косвенно — скорость копирования, потому что после неправильно присоединенного нуклеотида (не образующего комплементарную пару с матрицей) следующий нуклеотид присоединяется намного медленнее обычного. Кроме того, для увеличения количества собственных копий рибозим может вообще воздействовать не на копирование РНК, а на предшествующие шаги — превращение простых органических веществ в нуклеотиды. Иначе говоря, появляется обмен веществ — химические реакции малых молекул, происходящие под контролем ферментов. В следующей главе мы подробнее рассмотрим, на что способны рибозимы в процессе обмена веществ.

