Книга: В интернете кто-то неправ! Научные исследования спорных вопросов
Назад: Глава 2 “Прививки вызывают аутизм”
Дальше: Глава 4 “Акупунктура – серьезный метод лечения”
Глава 3
“ВИЧ не приводит к СПИДу”
Если не лечить, то приводит. Почти всегда.
Нозифо Бенгу, жительница Южно-Африканской Республики, умерла от СПИДа в 32 года. Общественная организация по борьбе с заболеванием, выражая соболезнования семье, назвала смерть Нозифо “преждевременной и необязательной” [1].
Первые несколько лет после постановки диагноза Нозифо получала антиретровирусную терапию, но затем перешла на альтернативное лечение. Ежедневно она ела чеснок и имбирь, чтобы бороться с инфекциями. Пила лимонный сок и ела цедру для детоксикации организма и поддержки печени. Свекла в ее диете была призвана улучшать показатели крови, арбуз служил источником витаминов. Была еще какая-то бутылочка с экстрактом растений – история не сохранила их названия, но зато известно, что бутылочка обещала “позитивную жизнь” [2].
Нозифо решила отказаться от лечения не сама по себе. Она сделала это под влиянием… официальной государственной пропаганды. Табо Мбеки, президент ЮАР с 1999 до 2008 года, неоднократно заявлял, что антиретровирусная терапия опасна и не работает, а ВИЧ вообще не вызывает СПИД. Лекарства не были полностью запрещены в стране, но достать их было не так-то просто. Все благотворительные программы, предполагающие бесплатную выдачу антиретровирусных препаратов, были свернуты. К концу 2005 года лекарства принимали чуть больше 100 тысяч человек [3] – притом что общее число ВИЧ-инфицированных, по самым скромным оценкам, составляло тогда в ЮАР 5 миллионов и не менее 600 тысяч из них уже остро нуждались в антиретровирусной терапии, чтобы предотвратить развитие СПИДа. По оценке Гарвардской школы общественного здравоохранения [4], c 2000 до 2005 года политика Табо Мбеки привела к преждевременной смерти 330 тысяч граждан ЮАР, а также к заражению ВИЧ 35 тысяч новорожденных, чьи матери не получали антиретровирусную терапию во время беременности.
Новая эпидемия?
В начале 1980-х американские врачи заметили [5], что редкие заболевания стали встречаться чаще. С октября 1980-го по май 1981-го в клиниках Лос-Анджелеса было зарегистрировано целых пять случаев пневмонии, вызванной грибками Pneumocystis carinii. К тому времени было известно, что эти грибки могут вызывать воспаление легких, но только в редчайших случаях, у людей с тяжелыми поражениями иммунной системы. С какой стати микроорганизмы вдруг почувствовали себя комфортно в легочной ткани пятерых молодых мужчин, трое из которых прежде вообще не жаловались ни на какие проблемы со здоровьем, оставалось непонятным. Помимо этого, в 1981 году были описаны сразу восемь случаев саркомы Капоши (опухолей, ассоциированных с бурным размножением вируса герпеса 8-го типа) – и тоже у молодых и прежде здоровых мужчин. Множилось и число других оппортунистических инфекций (вызываемых условно-патогенными микроорганизмами, безопасными для здоровых людей). Американские Центры по контролю и профилактике заболеваний (CDC) вскоре создали комиссию по расследованию этих необычных случаев; не остались в стороне и исследователи из других организаций. К началу 1982 года было ясно: существует синдром приобретенного иммунодефицита; он передается от человека к человеку; большинство заразившихся – гомосексуальные мужчины, практиковавшие незащищенный анальный секс (сопряженный с высоким риском травмирования слизистой, а значит, и передачи инфекции); заболевание, по всей видимости, вызывается вирусом, поражающим клетки иммунной системы, в частности Т-лимфоциты.
Возбудителя новой болезни нужно было идентифицировать, и множество лабораторий в США и Европе сосредоточились на решении этой задачи. Лидерами в гонке стали американец Роберт Галло и француз Люк Монтанье. Лаборатории, в которых работали эти исследователи, тесно сотрудничали, обменивались информацией и экспериментальными образцами, открыли вирус независимо друг от друга и назвали его двумя разными именами. К сожалению, ключевые статьи лаборатории Роберта Галло были опубликованы в 1984 году, а вот Люк Монтанье успел заявить об открытии [6] уже в 1983-м. Задержка сотрудников лаборатории Галло была вызвана вполне уважительной причиной: их работы были более обстоятельными. Авторы не только проанализировали полсотни пациентов с синдромом приобретенного иммунодефицита, обнаружили у них новый вирус и показали, что он размножается в культуре Т-лимфоцитов [7], но и разработали первую тест-систему для выявления антител к ВИЧ в сыворотке крови зараженных людей [8]. Этот подход к диагностике применяется во всем мире и сегодня (теперь уже наряду с другими методиками, но долгое время был единственным). Тем не менее Нобелевская премия 2008 года за открытие ВИЧ досталась только Люку Монтанье и его коллеге Франсуазе Барре-Синусси, а вот Роберта Галло обошли стороной – к немалому удивлению всех участников истории.
За прошедшие с тех пор десятилетия ученые узнали о вирусе иммунодефицита очень много. Сегодня известно, что мы подцепили его у обезьян, причем передача инфекции происходила несколько раз. Самая распространенная и опасная разновидность, ВИЧ-1, находится в близком родстве с вирусом иммунодефицита шимпанзе [9]; впрочем, некоторые варианты ВИЧ-1, как показывают недавние исследования, могли быть получены и от горилл [10]; ВИЧ-2, которым заражены около миллиона людей в Западной Африке, произошел от вируса, который носят в своей крови мангабеи, родственники мартышек [11]. Заражение вирусом иммунодефицита от обезьяны возможно при любом контакте с ее кровью (до недавнего времени жители многих африканских племен охотились на обезьян, чтобы употреблять их в пищу; достаточно, чтобы человек порезался, пока разделывает свежепойманную добычу), но в подавляющем большинстве случаев иммунная система человека благополучно уничтожает этот вирус: есть исследование, показавшее, что в крови здоровых африканских охотников встречаются антитела к вирусам иммунодефицита обезьян, свидетельствующие о перенесенной инфекции [12]. Неизвестно, сколько раз нам не везло и вирус мутировал таким образом, чтобы обрести способность передаваться от человека к человеку и уничтожать нашу иммунную систему. Вероятно, большинство таких событий оставались незамеченными, пока люди жили в маленьких поселениях, рассеянных по джунглям. Ситуация радикально изменилась в XX веке, когда началась глобализация, африканские города начали бурно расти, в них появилось много трудовых мигрантов, оторванных от своих семей и ищущих беспорядочных половых связей, люди стали активно путешествовать между континентами. Тогда наступил звездный час ВИЧ: из Африки его увезли на Гаити (приблизительно в 1966 году [13]), затем вирус попал в США, а оттуда в Европу.
К началу 2014 года, по данным ВОЗ, вирусом иммунодефицита были заражены 35 миллионов человек на нашей планете. Эта цифра ежегодно увеличивается на 2 миллиона за счет тех, кто заражается ВИЧ, – и, увы, уменьшается на 1,5 миллиона за счет людей, погибающих от СПИДа. В основном эти огромные цифры формируются за счет Африки. В России, по данным Росстата, заражены ВИЧ около 460 тысяч человек, а умирают от СПИДа примерно 13 тысяч в год. В США, по данным CDC, живут 1,2 миллиона ВИЧ-положительных людей и около 14 тысяч в год погибают от СПИДа. В Великобритании, по данным PHE (Public Health England, подразделение местного Минздрава) за 2014 год, заражены 107 800 человек, а умерли от СПИДа 320. Если очень грубо прикинуть соотношение зараженных и умирающих, то получится, что в мире в целом за год умирают 4,3 % от общего числа зараженных, в России – 2,9 %, в США – 1,2 %, в Великобритании – 0,29 %. Это различие связано как с медицинскими, так и с социальными факторами. С одной стороны, важно, чтобы в стране были качественные программы диагностики и лечения, чтобы антиретровирусная терапия была современной и доступной. С другой стороны, максимальная смертность от СПИДа в любой стране наблюдается среди самых бедных, необразованных и социально незащищенных людей с крайне ограниченным доступом к медицине. Если человек впервые приходит к врачу уже тогда, когда у него появились симптомы СПИДа, помощь может оказаться малоэффективной. Если же инфекцию обнаружить вовремя, если вовремя назначить антиретровирусные препараты, то продолжительность жизни ВИЧ-положительного человека будет вполне сопоставима с продолжительностью жизни неинфицированного.
Но перед тем как рассказывать про антиретровирусную терапию, имеет смысл в общих чертах разобраться, как работает иммунная система и как ее работу нарушает вирус, если в этот процесс не вмешиваться. Эта история, скорее всего, покажется вам занудной и перегруженной деталями, если у вас нет биологического или медицинского образования, или же чудовищно упрощенной и вульгаризованной, если оно у вас есть. Так что она неплохо иллюстрирует, почему нас, научных журналистов, вообще никто не любит – ни с одной стороны баррикад.
Дурная весть в белковом конверте
Быть многоклеточным сложно. Иммунная система ежедневно, ежесекундно должна контролировать, что происходит в каждой клетке организма: не поселились ли в ней какие-нибудь враги, не переродилась ли она в опухолевую. Чтобы пройти этот контроль, каждая обычная клетка – в коже, в легких, в печени, везде – постоянно выставляет на свою поверхность фрагменты собственного внутреннего содержимого. Она делает это с помощью белков MHC–I. Кроме того, специализированные антигенпрезентирующие клетки (например, макрофаги) ползают везде, ловят потенциальных врагов, размалывают их на кусочки и выставляют эти кусочки на своей поверхности с помощью белков MHC–II.
Анализом представленных антигенов занимаются T-лимфоциты. Они так называются, потому что формируются в тимусе, это такой маленький и важный орган, расположенный за грудиной. У каждого T-лимфоцита есть T-клеточный рецептор (TCR), который как раз должен распознавать то, что показали остальные клетки на своих MHC-белках, – это нужно для принятия решения о том, стоит ли разворачивать активные боевые действия. Молекулы TCR могут быть очень-очень разными: гены, которые их кодируют, проходят процесс реаранжировки, их фрагменты комбинируются случайным образом (принцип тот же, что и при формировании новых иммуноглобулинов во время созревания B-лимфоцитов, этот процесс я упоминала в главе про прививки) – в итоге получается, что разные Т-лимфоциты могут распознавать разные, практически какие угодно, вражеские антигены. Рядом с молекулой TCR есть корецептор, который называется CD4 или CD8, – он нужен, чтобы клетка узнавала MHC-белки.
Т-лимфоциты с корецептором CD8 называются цитотоксическими лимфоцитами. Они распознают MHC–I, то есть анализируют состояние обычных клеток организма. Если у цитотоксического лимфоцита есть основания полагать, что клетка заражена вирусом или переродилась в злокачественную, – это значит, что клетка должна умереть. Цитотоксический лимфоцит либо приказывает ей самостоятельно совершить самоубийство, либо проделывает в мембране клетки отверстие и впрыскивает внутрь токсины.
Т-лимфоциты с корецептором CD4 называются T-хелперами. Они взаимодействуют с MHC–II, то есть распознают антигены, которые им показывает другая иммунная клетка, заранее их поймавшая, нарезавшая и подготовившая.
Т-хелперы первого типа (Th1) отвечают за запуск клеточного воспалительного иммунного ответа. Они в основном общаются с макрофагами – клетками, чья основная работа заключается как раз в том, чтобы съедать врагов, – и разрешают макрофагам активировать оружие массового поражения (например, производить токсичные молекулы оксида азота) в том случае, если ситуация действительно серьезная.
Т-хелперы второго типа (Th2) нужны для активации гуморального иммунного ответа – они общаются с B-лимфоцитами и разрешают им начать размножаться и синтезировать антитела. Этот механизм очень важен для защиты от любых патогенов, находящихся вне наших клеток, – в первую очередь для бактерий, но и вирусы он позволяет успешно уничтожать в тот момент, когда они уже вышли из одной клетки и еще не проникли в следующую.
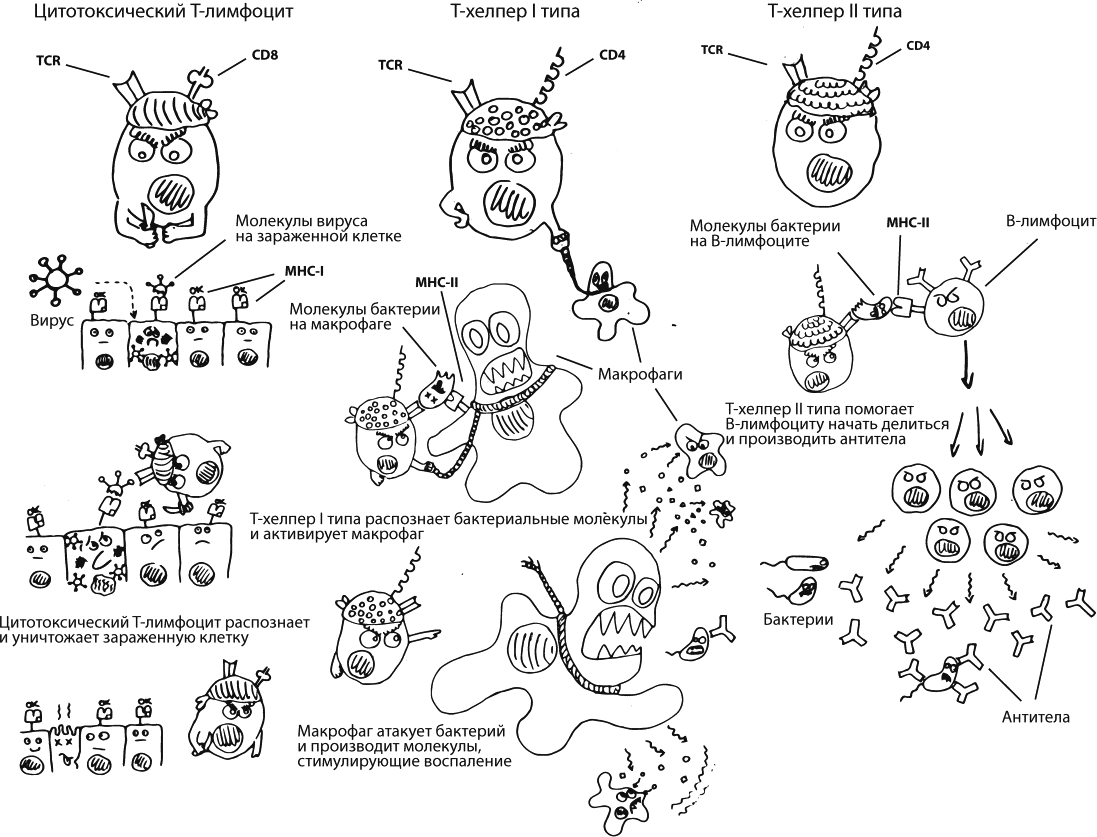
Есть еще ряд клеток, которые несут на своей поверхности корецептор CD4. Например, его используют для коммуникации с коллегами макрофаги и дендритные клетки – раннее звено иммунитета, клетки, которые первыми ловят врагов, чтобы потом можно было разобраться, что с ними делать. К сожалению, у этой важной молекулы есть одно неприятное свойство: именно с CD4 связывается вирус иммунодефицита человека, чтобы проникать в клетки.
ВИЧ, как и любой другой вирус, – это не совсем живое существо, а скорее “дурная весть в белковом конверте”, по выражению нобелевского лауреата Питера Медавара. В отличие от бактерий, вирусы не могут ни питаться, ни двигаться, ни самостоятельно размножаться – они только могут, если повезет, попасть в клетку хозяина и тогда уже используют ее ферменты для того, чтобы скопировать свой генетический материал, построить белки, собрать все это в новые вирусные частицы.
Наследственная информация вирусов может храниться в виде ДНК, как у нормальных существ, а может и в виде РНК, с которой в хозяйской клетке уже сразу считываются вирусные белки. Бывает и третий, самый хитрый вариант: наследственная информация хранится в виде РНК, но после попадания в клетку вирус использует принесенный с собой фермент, обратную транскриптазу, чтобы построить двуцепочечную ДНК. Вирус встраивает свою ДНК в геном хозяйской клетки, чтобы она потом читала ее точно так же, как собственные гены. Этот путь используют ретровирусы, семейство, к которому относится и ВИЧ.
Жизненный цикл ВИЧ изучен настолько хорошо, что ничего не понятно. То есть информации накоплено так много, что любой человек, который не занимался изучением вируса профессионально, в ней немедленно путается и тонет. Я уже утонула и, чтобы не утянуть вас за собой, рекомендую для начала просто посмотреть какое-нибудь образовательное видео – например, очень красивую, совершенно космическую анимацию сделал Медицинский институт Говарда Хьюза. Если возможности посмотреть видео у вас сейчас нет, то могу предложить краткий пересказ учебников и справочников [14], [15], [16].
На внешней, липидной оболочке вируса расположен гликопротеиновый комплекс в виде гриба (его шляпка называется gp120, ножка – gp41). Этот гриб взаимодействует с молекулами CD4, в результате чего меняет свою форму, связывается с еще одной разновидностью молекул на мембране Т-лимфоцита (чаще всего CCR5), а это приводит к слиянию оболочки вируса с оболочкой клетки. Содержимое вирусной частицы оказывается внутри. Фермент обратная транскриптаза, который вирус принес с собой, строит из его РНК двуцепочечную ДНК. Она проникает в ядро, где встраивается в хозяйскую ДНК с помощью вирусного фермента интегразы. После этого сама клетка, с помощью собственных ферментов, создает копии РНК вируса, строит его белки и гликопротеины, создает кластер гликопротеинов gp120 и gp41 на своей собственной мембране. Новые РНК и белки вируса собираются вместе и отпочковываются от клетки, одевшись в мембрану хозяина. После этого свободная вирусная частица еще некоторое время дозревает (вирусный фермент протеаза должен отрезать некоторые белки вируса друг от друга – они синтезировались как единый комплекс), и наконец готовая вирусная частица отправляется к новым победам.
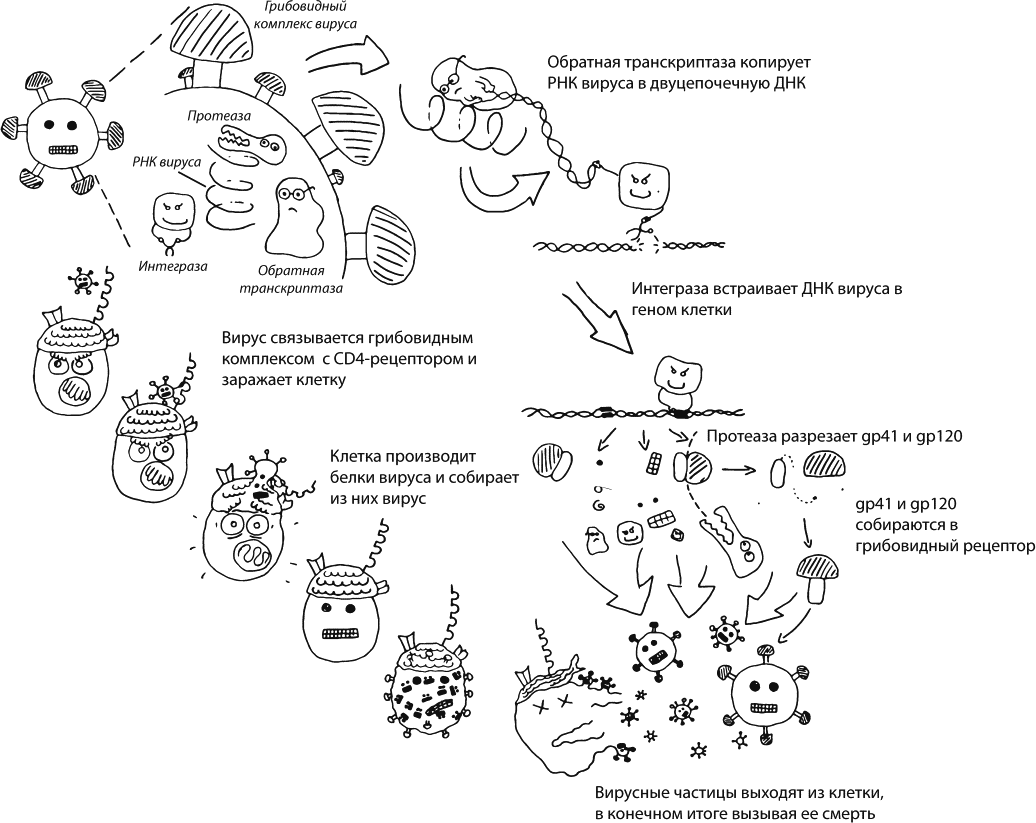
Жизненный цикл вируса иммунодефицита человека
Это была очень упрощенная схема. Есть ряд оговорок. Размножение вируса происходит очень бурно в первые недели после заражения (многие люди испытывают в это время симптомы, напоминающие тяжелый грипп), но тем временем иммунная система старается что-то сделать с новой инфекцией, и нельзя сказать, что ее усилия полностью безуспешны. Антитела к вирусу все-таки вырабатываются, цитотоксические Т-лимфоциты (без рецептора CD4, см. выше) пытаются уничтожать зараженные клетки, а производство CD4+ лимфоцитов увеличивается, чтобы компенсировать потери. Размножение вируса слегка ограничивается. Но полностью уничтожить его не удается – во-первых, он быстро мутирует, уходя из-под воздействия наработанных антител, а во-вторых, иммунная система никак не может отличить клетки, в чью ДНК вирус встроился, от незараженных, если вирус в данный момент сидит молча и никак себя не проявляет. Так что после первого всплеска инфекции в организме устанавливается хрупкое равновесие: иммунитет пытается контролировать вирус, вирус пытается выйти из-под контроля иммунитета. Этот баланс удается удерживать несколько лет (по-разному, в зависимости от биологических особенностей вируса и его хозяина – иногда два года, иногда двадцать, обычно между пятью и десятью), но потом численность CD4+ лимфоцитов, в которых размножается вирус, все же падает до критически низкого уровня, и организм становится беззащитен перед ордами варваров, возбудителей оппортунистических инфекций, которых иммунная система здорового человека давит не задумываясь, изо дня в день. Это состояние и называется синдромом приобретенного иммунодефицита. Ко всему прочему вирус уничтожает иммунные клетки не только за счет того, что он в них размножается (от чего у них, например, чисто физически не успевает восстанавливаться мембрана, которую он использует для создания своей оболочки: число производимых в каждой клетке вирусных частиц исчисляется миллионами), – он еще и способствует запуску апоптоза и пироптоза [17] (это разновидности запрограммированного самоубийства), и в результате получается, что гибнуть могут не только сами зараженные лимфоциты, но и те, кто в этом лимфоузле просто мимо проходил. Еще одно печальное обстоятельство связано с тем, что в ходе развития ВИЧ-инфекции большую роль играют обычные процессы презентации антигенов – может быть так, что, например, дендритная клетка просто поймала первую вирусную частицу прямо на слизистой оболочке (где бы она, может, разрушилась бы себе спокойно) – и радостно потащила ее в лимфоузел, знакомить с восприимчивым Т-лимфоцитом, потому что для всех нормальных инфекций это работает.
Как вы уже заметили, история с ВИЧ и СПИДом объемная, запутанная, полноценной популяризации пока поддается плохо, даже у профессиональных биологов еще полно работы по выявлению всех механизмов развития заболевания. Но важно, что вопросы, над которыми работают сегодня профессиональные биологи, – это вопросы узкоспецифичные и конкретные, что-нибудь вроде “Какую роль играет хеликаза DDX5 при контроле вирусной транскрипции?” или там “При каких вариантах MHC благоприятен генотип KIR2DL3+/KIR2DL2– у ВИЧ-инфицированных?” (первые попавшиеся примеры при поиске по научным статьям, вышедшим в 2015 году). В научных публикациях не ведется никакой дискуссии на тему того, существует ли ВИЧ и вызывает ли он СПИД, – по той же причине, по которой отсутствуют дискуссии о том, впадает ли Волга в Каспийское море, возможен ли вечный двигатель и не мешает ли твердый небесный свод полетам космических кораблей. Тем не менее у научного журнала Nature есть и специальные страницы, отведенные не для описания новых научных работ, а для всякой околонаучной публицистики, в том числе полемики с антинаучными течениями. В 2000 году, в разгар смертоносной политики Табо Мбеки, там была опубликована Дурбанская декларация [18], посвященная как раз тому, что Волга впадает… в смысле ВИЧ вызывает СПИД. На момент опубликования ее подписали более 5000 специалистов в области молекулярной биологии, вирусологии, иммунологии и смежных дисциплин. При беглом просмотре списка подписей я заметила там двух состоявшихся и двух будущих (на тот момент) нобелевских лауреатов, вполне возможно, что их там больше. В Дурбанской декларации – как полагается, со ссылками на серьезные исследования – приводятся следующие аргументы.
1. Пациенты с синдромом приобретенного иммунодефицита, независимо от того, где они живут, инфицированы ВИЧ.
2. Без лечения большинство людей с ВИЧ-инфекцией заболевают СПИДом в течение 5–10 лет. ВИЧ-инфекция определяется в крови с помощью выявления антител, генетических последовательностей или вирусных частиц. Эти тесты настолько же надежны, насколько тесты, применяемые для выявления любых других вирусных инфекций.
3. Люди, получившие переливание крови или ее компонентов, содержащих ВИЧ, заболевают СПИДом, а те, кто получил незараженную кровь, – нет.
4. Большинство детей, заболевших СПИДом, рождены ВИЧ-инфицированными матерями. Чем выше вирусная нагрузка у матери, тем выше риск того, что ребенок заразится.
5. В лаборатории ВИЧ инфицирует именно те клетки крови (CD4+ лимфоциты), численность которых падает у людей, больных СПИДом.
6. Лекарства, которые блокируют размножение ВИЧ в пробирке, также снижают вирусную нагрузку и замедляют развитие СПИДа. Там, где лечение доступно, оно снижает смертность от СПИДа более чем на 80 %.
7. Обезьяны, которым вводят даже не сам вирус, а только полученную биотехнологическими методами ДНК вируса иммунодефицита обезьян (соответствующую продукту работы обратной транскриптазы при настоящем заражении), становятся инфицированными и заболевают СПИДом.
Хроническая болезнь
Помните, когда мы были маленькие, по телевизору и в бумажной прессе рассказывали про ВИЧ-инфекцию фактически как про смертный приговор? Ох уж эта телевизионная кухня: выбрать героя помоложе и посимпатичнее, снять его в кабинете врача как будто бы в тот момент, когда он узнает шокирующее известие, добавить тревожной музыки на монтаже, показать плачущую старушку-мать, которая никогда не увидит внуков (в идеале настоящую, но можно и актрису нанять для съемки). Между тем в начале девяностых все так и было. Надпись “ВИЧ+” в результатах анализов действительно означала, что человек умрет через десять лет довольно неприятной смертью. В Африке – география как машина времени! – результат анализа до сих пор может означать именно это. Но в развитых странах, к каковым в данном случае относится и Россия, ситуация довольно быстро изменилась, вот только телевизор уже забыл нам об этом подробно рассказать, потому что на хороших новостях рейтинга не сделаешь.
Поиски лекарства от ВИЧ начались даже раньше, чем ВИЧ был обнаружен. Дело в том, что уже в 1970 – х ученым были известны другие ретровирусы, например T-лимфотропный вирус человека (HTLV), вызывающий T-клеточный лейкоз. Был уже открыт фермент, который позволяет вирусам этого семейства строить ДНК на базе РНК, – обратная транскриптаза, и был открыт сурамин, первое вещество, которое блокировало работу вирусного фермента [19]. Поэтому, когда в 1984 году команда исследователей из американских Национальных институтов здоровья, возглавляемая Сэмюелем Бродером, научилась поддерживать в пробирке жизнеспособную культуру CD4+ лимфоцитов человека и заражать ее ВИЧ, что позволило приступить к активному поиску лекарств, первые надежды ученые возлагали именно на это вещество. Быстро выяснилось, что сурамин действительно замедляет размножение вируса – как в пробирке, так и у принимавших его добровольцев, больных СПИДом, – но параллельно обладает высокой токсичностью для клеток нашего организма.
Первое лекарство оказалось ненамного лучше болезни. Но по крайней мере стало понятно, в каком направлении копать. Команда Бродера вступила в сотрудничество с исследовательскими лабораториями фармкомпании GlaxoSmithKline, они перебирали разные вещества, потенциально способные связываться с обратной транскриптазой и блокировать ее работу, и вскоре обратили внимание на 3'-азидо-2',3'-дидезокситимидин, он же AZT, он же зидовудин. Эта небольшая молекула хорошо блокировала работу обратной транскриптазы вируса и одновременно была относительно безопасной для человеческого организма. FDA (американское Управление по надзору за качеством пищи и лекарственных препаратов) одобрило применение зидовудина рекордно быстро, и уже в 1987 году человечество располагало первым лекарством против СПИДа.
Это было уже гораздо лучше, чем ничего. Зидовудин достоверно замедлял падение уровня Т-лимфоцитов и развитие СПИДа у зараженных ВИЧ [20], примерно на полгода продлевал жизнь пациентов, у которых СПИД уже развился [21], снижал вероятность передачи вируса ребенку при беременности [22]. Правда, были и проблемы. Принимать препарат приходилось каждые четыре часа (в том числе среди ночи). У ряда пациентов наблюдались заметные побочные эффекты (например, миопатии). Но главное – уже в 1989 году были описаны мутантные формы ВИЧ, невосприимчивые к терапии [23], и было понятно, что они будут распространяться все шире.
Хорошая новость в том, что параллельно испытывались десятки других препаратов. Было получено еще несколько блокаторов обратной транскриптазы, но важно было найти лекарства, воздействующие и на другие ферменты вируса. И вот наконец в 1995 году FDA одобрило первое лекарство нового типа: ингибитор протеазы, препятствующий нормальному созреванию вирусных частиц. В 1996-м, на XI международной конференции по СПИДу, врачи обсуждали первые испытания схемы лечения, в которой использовалось сочетание лекарств двух разных классов. Результаты принципиально превосходили все предшествующие, и с 1996 года новым золотым стандартом, рекомендуемым для всех больных, стала высокоактивная антиретровирусная терапия (HAART), в которой одновременно используются ингибиторы обратной транскриптазы и ингибиторы протеазы. В 1997 году окончательно стало понятно, что это была блестящая идея: первые большие исследования [24], [25] показали, что новый подход к терапии ВИЧ-инфицированных позволяет радикально замедлить развитие СПИДа, в десятки раз снижает вирусную нагрузку, способствует восстановлению популяции CD4+ лимфоцитов в организме. Понятно, почему так происходит. ВИЧ хорошо мутирует и потенциально может выработать устойчивость к любому лекарству. Но если одновременно использовать несколько препаратов, то вероятность того, что вирус одновременно обретет устойчивость ко всем, резко снижается. Пускай он устойчив к ингибитору обратной транскриптазы – о’кей, он погибнет из-за ингибитора протеазы. Пускай он устойчив к ингибитору протеазы – он успеет погибнуть из-за ингибитора обратной транскриптазы. Если же он все-таки умудрится выработать устойчивость ко всем применяемым препаратам – врач это заметит по увеличению количества вирусных частиц и снижению числа лимфоцитов в крови больного и назначит новую комбинацию препаратов, благо сегодня их существуют десятки.
Этот подход принес совершенно фантастические результаты. Анализ данных, полученных при наблюдении за динамикой инфекционного процесса у 45 тысяч пациентов с 1996 до 2005 года, позволил ученым рассчитать ожидаемую продолжительность жизни – число лет, которые человек в среднем имеет шанс прожить с момента постановки диагноза [26]. Получилось следующее. Если у человека выявили инфекцию в 1996 году и ему при этом было 20 лет, то его ожидаемая продолжительность жизни составляла 36 лет. В смысле еще 36 с момента постановки диагноза, до 56-ти. Если же инфекцию у двадцатилетнего человека выявили в 2003 году, когда способы контроля за развитием заболевания и способы его лечения стали еще лучше, то ожидаемая продолжительность жизни для него – уже 49 лет, человек может ориентироваться на то, что доживет примерно до 69-ти. Налаживать личную жизнь человек с ВИЧ тоже может: помимо того, что сама по себе антиретровирусная терапия снижает численность вирусных частиц в крови, а значит, и вероятность передачи инфекции (не пытайтесь повторить это дома!), нужно постоянно использовать презервативы. Если никогда не отступать от этого правила, то, согласно кохрейновскому обзору [27], регистрируется 11 случаев заражения на 965 человеко-лет наблюдений: пожалуй, на машине ездить опаснее. Заводить детей тоже можно. Вообще без лечения (это тоже не надо пытаться повторить дома!) вирус передается ребенку от зараженной матери примерно в 25 % случаев (цифры отличаются в разных исследованиях, многое зависит от вирусной нагрузки во время беременности). При лечении зидовудином в начале 1990-х риск снижался до 8 %. Схемы высокоактивной ретровирусной терапии, применявшиеся в начале нулевых, приводили к тому, что заражались ВИЧ 2 % младенцев, рожденных от ВИЧ-положительных матерей. В 2010–2011 годах этот показатель составил [28] 0,46 %.
Основной проблемой с антиретровирусной терапией остается высокая стоимость курса лечения. Конкретные цифры зависят от того, какие именно препараты принимает человек, но речь идет о десятках, а иногда о сотнях тысяч рублей в год. По данным общественной организации “Коалиция по готовности к лечению” [29], в России цены на лекарства сильно завышены по сравнению с большинством других стран, причем известны случаи, когда цена таблетки в двух регионах страны различалась в 42 раза, а дженерики закупались по стоимости, превышающей цену оригинальных препаратов. Это, вероятно, специфика системы госзакупок, которая, с одной стороны, позволяет обеспечивать граждан препаратами для антиретровирусной терапии бесплатно, но с другой – открывает широкие возможности для злоупотреблений. Я не берусь оценить, выделяется ли на лечение ВИЧ-инфицированных достаточно денег (тут даже о количестве таких людей Росстат и Федеральный центр по борьбе со СПИДом друг с другом договориться не могут), но в интернете несложно найти сообщества людей, где активно обсуждаются перебои с доставкой антиретровирусных лекарств в региональные медицинские центры (а такие перебои смертельно опасны, так как способствуют появлению устойчивых к лекарствам штаммов вируса). В открытую продажу препараты против ВИЧ, как правило, не поступают. В этом есть своя логика – без врачебного контроля их прием неэффективен и опасен, но в результате человек, даже способный заплатить за свои лекарства самостоятельно, оказывается зависим от особенностей организации государственного здравоохранения.
Антиретровирусная терапия со временем становится дешевле – во всех странах мира. Самая дорогая из всех применяемых в России схем лечения первого ряда (т. е. таких, которые назначаются в первую очередь – в отличие от схем второго ряда, которые назначаются, если схема первого ряда не помогла) стоит в разных регионах от 132 до 186 тысяч рублей в год. Даже это – большой прогресс по сравнению с 10–15 тысячами долларов в год, которые приходилось платить в конце девяностых. Снижение цен связано не только с оптимизацией производства и появлением новых технологий, но и с тем, что срок патента на лекарство составляет, как правило, 20 лет. Это значит, что вот как раз сейчас массово заканчиваются патенты на препараты, которые были разработаны в 1990-х. Соответственно, конкурирующие медицинские компании могут производить дженерики, что неизбежно приводит и к снижению стоимости оригинального препарата.
Несмотря на все проблемы, диагноз “ВИЧ+” сегодня – это уже далеко не смертный приговор, а скорее неприятная новость, хроническое заболевание, что-то вроде диабета. Да, заразившемуся человеку придется постоянно контролировать состояние своего здоровья, предупреждать об инфекции потенциальных половых партнеров, принимать лекарства, смиряться с их побочными эффектами (или менять набор препаратов, если побочные эффекты оказываются выраженными). И делать это ВИЧ-инфицированному человеку предстоит всю жизнь. До старости. Десятилетиями. Параллельно с учебой, работой, воспитанием детей и выбором программы ипотечного кредитования на 30 лет.
Когда мы окончательно победим ВИЧ?
Пока непонятно. Вряд ли в ближайшие 10 лет. Но прогресс есть.
Самая известная из впечатляющих историй – история Берлинского пациента, Тимоти Рэя Брауна. Этот удачливый человек одновременно был заражен ВИЧ и болен лейкемией. Ему требовалась пересадка костного мозга. Его лечащий врач Геро Хюттер, собираясь приступить к рутинной процедуре поиска совместимого донора, вспомнил университетскую лекцию о том, что у некоторых людей встречается мутация корецептора CCR5 (который, наряду с CD4, используется вирусом для проникновения в клетку) и такие люди значительно менее восприимчивы к ВИЧ. В регистре потенциальных доноров костного мозга нашлось 80 человек, чьи клетки подходили для пересадки Тимоти Брауну (фантастически удачный результат, между прочим). Доктор Хюттер начал исследовать ген CCR5 у всех этих людей, и на 62-й попытке его надежды оправдались. Новые лимфоциты Тимоти Брауна обладают приятным дополнительным свойством: в них практически не может проникнуть вирус иммунодефицита человека. В 2009 году, через 20 месяцев после операции, доктор Геро Хюттер сообщил [30], что, несмотря на отсутствие антиретровирусной терапии, ВИЧ до сих пор не удается выявить ни в крови, ни в костном мозге, ни в слизистой оболочке кишечника. В 2011 году врач подтвердил: признаков репликации вируса по-прежнему обнаружить не удается [31]. В 2013 году несчастного Тимоти Брауна придирчиво обследовали в шести лабораториях и буквально со всех сторон – биопсии, пункции, колоноскопии, куча анализов крови, все мыслимые и немыслимые способы поиска вируса во всех биологических материалах [32]. При таких условиях двум лабораториям удалось обнаружить следы РНК вируса в плазме крови, а одна обнаружила его ДНК в прямой кишке – правда, учитывая отсутствие таких данных в остальных лабораториях, нельзя окончательно исключить и ложноположительный результат. Во всяком случае, вирус по-прежнему не удается обнаружить ни в клетках крови, ни в лимфоузлах, ни в спинномозговой жидкости, ни в слизистой оболочке тонкого кишечника (где всегда тусуется много лимфоцитов, так что место для поиска вполне логичное). А в 2015 году сам Тимоти Браун опубликовал статью о своем опыте [33]: как заболел, как случайно выбрал ближайшую к дому больницу, где встретился с Геро Хюттером, как шло лечение, почему решил не скрывать свое настоящее имя и общаться с прессой. “Я не хочу быть единственным человеком в мире, излеченным от ВИЧ, – пишет Тимоти. – я хочу, чтобы другие ВИЧ-положительные пациенты присоединились к моему клубу!” Сегодня он переехал из Германии обратно на родину, в США, и основал там фонд имени себя самого, чтобы финансировать исследования вакцин и способов полного излечения от ВИЧ.
Разумеется, метод лечения, использованный для Тимоти Брауна, не подходит обычным больным: процесс замены костного мозга несопоставимо более опасен, чем ВИЧ-инфекция. Просто этот пример иллюстрирует, что у некоторых людей есть биологические особенности, которые делают их менее восприимчивыми к развитию заболевания. Мутация в гене CCR5 – только одна из таких особенностей, а вообще врачи выделяют целую группу “нон-прогрессоров” – людей, которые после заражения ВИЧ годами сохраняют нормальную концентрацию CD4+ лимфоцитов без антиретровирусной терапии. В зависимости от критериев того, что такое “годами” и что такое “нормальная концентрация”, оценка численности этих счастливчиков в разных публикациях варьирует в очень широких пределах; автор наиболее внятного из найденных мной обзоров [34] предлагает считать, что таких людей 2–5 % среди всех ВИЧ-инфицированных. Причины такой устойчивости могут быть разными. Кому-то просто повезло заразиться ослабленным, неудачно мутировавшим вариантом ВИЧ. У кого-то особенно хорошо работают цитотоксические CD8+ лимфоциты – быстро и беспощадно находят и уничтожают каждую новую заразившуюся клетку. У кого-то вырабатывается особенно много противовирусного фермента APOBEC3G, который препятствует встраиванию ДНК вируса в геном хозяина. У кого-то удачная комбинация MHC-генов, позволяющая привлечь к новому вирусу особенно пристальное внимание иммунной системы. У кого-то сформировались особенно удачные антитела. И так далее, и тому подобное – там масса хитрой и красивой молекулярной биологии. Важно то, что эти механизмы нужно изучать, потому что это ключ к новым лекарствам против ВИЧ. Пока что единственное такое новое лекарство, вошедшее в клиническую практику, – это маравирок, который связывается с корецептором CCR5, мешая вирусу делать то же самое и, соответственно, проникать в клетку.
Но вообще перспективных подходов очень много. Исследуются новые схемы антиретровирусной терапии, ориентированные на интенсивное лечение заболевания вскоре после заражения, – есть отрывочные данные о том, что, возможно, в некоторых случаях это позволяет успеть подавить инфекцию до того, как она захватила организм [35]. Ведется поиск препаратов, которые могли бы стимулировать (!) синтез новых вирусных частиц: когда ДНК вируса встроена в геном и при этом неактивна, этот резервуар инфекции практически невозможно обнаружить, а вот с клетками, интенсивно производящими вирус, иммунная система борется [36]. Уже проведены первые испытания генной терапии – нескольким людям ввели их собственные CD4+ лимфоциты с измененным корецептором CCR5 (принцип такой же, как у берлинского пациента, только без пересадки костного мозга), и результаты получились довольно обнадеживающие; по крайней мере, такие клетки нормально выживают в кровяном русле и не подвержены заражению ВИЧ [37]. Еще один возможный подход – поиск хороших, удачных вариантов антител против вируса с их последующим введением пациентам [38]. А самая интересная история, хотя и далекая пока от клинической практики, – это применение нового метода редактирования генов, CRISPR/Сas9 (я о нем еще буду рассказывать в главе про ГМО), для того чтобы вот просто взять и вырезать вирусную ДНК из человеческого генома. Уже показано, что это действительно удается сделать в культуре клеток [39]. Осталось только понять, как сделать то же самое с настоящим пациентом.
Последняя модная тема, о которой принято говорить в связи с ВИЧ, – это перспективы создания вакцины. Прямо скажем, перспективы туманные. Универсальный принцип вакцинации – “ввести ослабленного возбудителя или его фрагменты” – здесь работает плохо. Возбудителя вводить вообще нельзя, слишком опасно. К его фрагментам организм, может быть, и выработает антитела (да и то не все вакцины позволяют достичь такого результата) – но это будут антитела только к той конкретной разновидности вируса, которая использовалась для создания вакцины. Как только человек сталкивается с каким-нибудь другим штаммом, он снова уязвим. Похожая история с гриппом, против которого поэтому приходится создавать новую вакцину каждый год. Но ВИЧ еще более разнообразен, чем грипп, да и встречается, к счастью, все же не настолько часто, чтобы попытка разработать (и вколоть каждому человеку!) вакцины от всех существующих штаммов оказалась рентабельной.
Приходится придумывать более хитрые подходы. Например, в России сейчас разрабатываются три вакцины. В московском Институте иммунологии сделали “Вичрепол”, содержащий самые консервативные, редко изменяющиеся белки ВИЧ (полученные генно-инженерными методами). В петербургском Биомедицинском центре есть вакцина “ДНК-4” – четыре гена ВИЧ в одной плазмиде. По генам в клетках человека строятся белки, к белкам формируются антитела, получается иммунный ответ. Вакцина, созданная в новосибирском ГНЦ вирусологии и иммунологии “Вектор”, называется “КомбиВИЧвак”. Она содержит сложный и красивый искусственный белок TBI, в который включены фрагменты антигенов ВИЧ, пространственно ориентированные таким образом, чтобы B-лимфоцитам и T-лимфоцитам было удобно с ними знакомиться. Но ни один из этих препаратов еще не прошел клинических испытаний второй и третьей стадии, которые позволили бы оценить эффективность. А именно в этот момент обычно разрушаются все надежды. Иногда вообще выясняется, что новая вакцина, разработчики которой грозились спасти человечество, не то что не снижает, а повышает риск заражения [40].
Испытание эффективности вакцины от ВИЧ – это отдельная проблема. Надо набрать очень большую группу здоровых людей, половине ввести вакцину, половине ввести плацебо, а потом несколько лет ждать, кто из них заразится ВИЧ, а кто нет. Люди, в общем, существа довольно легкомысленные, презервативами пользоваться не любят, и в любой достаточно большой группе, за которой наблюдают достаточно длительное время, обязательно будут зараженные. Останется только сравнить, сколько зараженных в группе, которая получила вакцину, а сколько – в группе, получившей плацебо.
Самая успешная на сегодняшний день вакцина против ВИЧ снижает вероятность заражения на треть. Это лучше, чем ничего, но, увы, все-таки маловато для запуска массовой вакцинации. Она основана на многократном введении двух препаратов. Один из них представляет собой вирусный вектор, доставляющий в клетки три гена ВИЧ. Второй – созданный при помощи генной инженерии вирусный гликопротеин gp120 (шляпку от гриба, если вы еще помните мои попытки описать жизненный цикл вируса с привлечением художественных образов). В испытаниях [41] приняли участие 16 тысяч человек. Половина из них получила уколы настоящего препарата, половина – плацебо. За три с половиной года наблюдений заразились ВИЧ 56 человек в группе, получившей настоящую вакцину, и 76 человек в группе, которой вводили плацебо. Разницы в количестве вирусных частиц в крови у тех, кто все-таки заразился, в группах с настоящей вакциной и с плацебо зарегистрировано не было.
Совершенно не следует делать из этого вывод, что разработка вакцины против ВИЧ – дело безнадежное. Исследователи активно работают, механизмы иммунного ответа становятся все более понятны, развивается много параллельных направлений, все они вносят вклад в копилку знаний. Возможно, в разработке вакцины против ВИЧ в ближайшие годы и не будет резкого прорыва, но эффективность препаратов будет становиться все выше и рано или поздно достигнет уровня, на котором вакцинация уже становится осмысленной. Только что, в тот момент, когда я уже закончила главу про ВИЧ (на довольно пессимистической ноте) и описывала в четвертой главе влияние акупунктуры на мою трудовую биографию, научный журналист Алексей Торгашев обратил мое внимание (и внимание общественности) на три свежие статьи [42], [43], [44], посвященные обсуждению вопроса о том, как бы так вакцинировать людей (точнее, пока животных), чтобы они вырабатывали антитела широкого спектра действия, способные нейтрализовать большое количество разных штаммов вируса.
Тут нужно опять вспомнить, как вырабатываются антитела, – я писала об этом в главе про прививки. Сначала B-лимфоцит связывается с антигеном случайно, просто потому, что его рецептор более или менее подошел. Потом, после получения разрешающего сигнала от T-лимфоцита, B-лимфоцит начинает размножаться и при этом мутировать, чтобы получались разные варианты антител, среди которых можно будет выбрать наиболее подходящие. И вот для того, чтобы получились не просто вообще какие-нибудь антитела к ВИЧ, а антитела определенной структуры, направленные на конкретный фрагмент вируса, должно произойти много-много специфических мутаций, и все в определенном, заданном направлении. То есть надо сначала ввести первый антиген, чтобы в принципе спровоцировать серию мутаций в B-лимфоцитах, которые его распознали. Потом ввести второй антиген, чтобы среди этой новой популяции B-лимфоцитов нашелся кто-нибудь, кто связывается именно с ним, – и тоже начал мутировать с целью еще более качественного связывания. Потом ввести еще один антиген для выбора подходящих B-лимфоцитов для селекции именно среди этих мутантов третьего поколения. И так до тех пор, пока не появятся именно такие антитела, которые смогут эффективно защищать пациента от ВИЧ.
При обычной вакцинации антитела у разных людей получаются разные. Одни ловят вирус, условно, за пятку, другие за фалды сюртука, третьи за безымянный палец. А тут нужно, чтобы антитела у всех пациентов формировались такие, чтобы ловить вирус конкретно за третью пуговицу рубашки. При этом если ввести сразу только пуговицы от рубашки, то иммунная система их с высокой долей вероятности проигнорирует, они не очень похожи на большого опасного преступника. Надо сначала вводить рубашку, а потом поощрять тех, кто в ней связался именно с пуговицами, а потом тех, кто именно с третьей пуговицей. Звучит по-дурацки, зато возникает иллюзия понимания (ну, по крайней мере у меня). Становится ясно, что в борьбе с ВИЧ используются ужасно сложные и красивые подходы, так что, скорее всего, мы дождемся окончательной победы человечества над вирусом. А пока что надо не бояться ВИЧ-инфицированных, не думать, что они немедленно умрут или не смогут работать, спокойно с ними дружить. Когда дружба дойдет до секса – использовать презервативы. Как, собственно, и с любым новым партнером.

